低强度超声辐照联合氢醌乳膏对SD大鼠黄褐斑模型的疗效观察
2017-09-26何施逸邓志博王乾力李韫韬杜永洪
何施逸 邓志博 王乾力 李韫韬 杜永洪
低强度超声辐照联合氢醌乳膏对SD大鼠黄褐斑模型的疗效观察
何施逸 邓志博 王乾力 李韫韬 杜永洪
目的 探讨低频低强度超声辐照联合氢醌乳膏治疗SD大鼠黄褐斑病灶的疗效,有望为临床治疗黄褐斑提供新的思路。方法 将建模成功的18只SD大鼠黄褐斑模型随机分对照组、氢醌组及低强度超声辐照联合氢醌组(以下简称联合组),每组各6只。氢醌组脱毛后均匀涂上氢醌乳膏轻揉至吸收;联合组在氢醌组治疗基础上,同时采用声强0.32 W/cm2、频率为42 kHz的超声辐照12 min;对照组则保持皮肤暴露,不做任何处理。连续治疗14 d后,观察各组SD大鼠治疗前及治疗期间各生理指标及斑块变化趋势;比较各组治疗后血清、肝脏、皮肤超氧化物歧化酶(SOD)活力及丙二醛(MDA)含量。光镜下观察各组治疗后黑素颗粒的变化。结果 18只SD大鼠黄褐斑模型均成功建模,各组实验大鼠治疗前及治疗期间各项生理指标无明显变化。联合组斑块面积减少,颜色变浅;氢醌组变化略小。联合组及氢醌组治疗后SOD活力均较对照组上升,MDA含量均较对照组下降;且联合组变化更为显著,与氢醌组比较差异有统计学意义(P<0.05)。联合组和氢醌组治疗后皮肤组织病理图均可见黑色颗粒减少,其中联合组黑色素颗粒呈散在分布;氢醌组黑色素颗粒呈线性分布。结论 低频低强度超声辐照联合氢醌乳膏对SD大鼠黄褐斑病灶的治疗效果显著优于单用氢醌乳膏的治疗效果。
超声辐照,低强度;氢醌;黄褐斑;协同作用;大鼠
关于黄褐斑发病机制目前尚不明确,其组织学特点主要表现为表皮中黑素和黑素小体增加,黑素细胞活性增强[1]。现代医学研究[2]表明,在一些不利因素的影响下,正常皮肤的平衡遭到破坏,表皮基底层黑色素细胞分裂增加,活性增强,黑素形成增加、易行。有学者[3]认为,黄褐斑是皮肤衰老的表现之一,原因是皮肤组织中自由基含量增加,细胞功能遭到破坏。而超氧化物歧化酶(SOD)作为机体内的一种自由基清除酶,其活性降低,清除氧自由基的能力下降,使脂质过氧化物产生过多。丙二醛(MDA)是脂质过氧化反应的最终产物。故通过测定SOD和MDA含量可间接反映氧自由基在体内生成和清除情况,进一步反映黄褐斑生成及恢复情况。随着超声医学的迅速发展,超声作为一种促进皮肤药物渗透的安全治疗手段,已受到行业关注。研究[4]发现,低频超声具有显著的空化作用,能破坏角质层的脂质双分子层结构,增加皮肤黏膜通透性,即具有显著的增透效应。江浩波等[5]也证实超声波导入氨甲环酸治疗黄褐斑的疗效好,安全性高,依从性好,值得临床推广。氢醌乳膏是治疗皮肤黄褐斑的最有效药物之一。因此,本实验通过构建SD大鼠黄褐斑模型,检测肝脏和皮肤组织匀浆,以及血清中的SOD活力及MDA含量,推测借助超声导入氢醌乳膏对于治疗黄褐斑是否有协同增强效果,同时为低频低强度超声辐照联合外用药膏应用于临床黄褐斑的局部治疗提供实验依据。
材料与方法
一、实验大鼠黄褐斑模型建立及分组
健康清洁级、SD大鼠18只,雌性,体质量(289.5± 3.2)g,由重庆医科大学动物实验中心提供。适应性饲养1周后,经改良蒲春霞等[6]制备黄褐斑大鼠模型方法,于实验大鼠后腿根部按25 mg/kg肌肉注射黄体酮注射液,1次/d,左右腿交替,连续注射30 d。待确定建成黄褐斑大鼠模型后,将其随机分为低频低强度超声辐照联合氢醌组(以下简称联合组)、氢醌组及对照组,每组各6只。本实验经我院动物实验伦理委员会同意。
二、材料与仪器
全自动样品快速研磨仪[上海净信科技(Tissuelyser-24),型号:7i8s-24];黄体酮注射液(天津金耀药业有限公司,20 mg/1 ml,国药准字:H120233);0.9%氯化钠溶液;1 ml带针注射器;SOD测定试剂盒(WST-1法,96T,南京建成生物工程研究所,生产批号:20160810);MDA测定试剂盒(TBA法,96 T,南京建成生物工程研究所,生产批号:20161009);氢醌乳膏(广东人人康药业有限公司,0.2 g/10 g,国药准字:H20040088,规格:10 g×1支/盒);低频低强度超声设备(苏州工业园区海纳科技有限公司),频率42 kHz,输出功率0.13~1.27 W/cm2,连续可调节,探头直径45 mm。
三、实验方法
1.各组处理方法:对照组正常饲养,保持皮肤暴露,不做任何处理。氢醌组在背部固定区域待皮肤剃毛后,均匀涂上氢醌轻揉至大概吸收,1次/d。联合组先用0.8 ml的1%戊巴比妥钠溶液麻醉后,在背部固定区域皮肤(脱毛后)均匀涂抹氢醌乳膏轻揉至大概吸收后,剂量同氢醌组;同时将预热好的低频超声探头放于涂抹氢醌区域12 min,声强为0.32 W/cm2,每次累积辐照8 min后用冷水冷却探头后继续辐照。均连续治疗14 d。每日治疗前,观察各组SD大鼠精神状态、体质量、进食及皮肤黄褐斑病变情况,测量SD大鼠黄褐斑病灶面积大小变化情况。
2.血清及皮肤肝脏组织匀浆的制备:第14天,将所有实验大鼠腹腔麻醉后,迅速剪开皮肤,在心脏部位抽取血液5 ml,离心10 min(3500 r/min)取血清进行检测;后取肝脏和背部皮肤样本,用预冷4℃的0.9%氯化钠溶液漂洗,除去血液,滤纸拭干后称质量,将组织剪碎,置于匀浆器中加入0.9%氯化钠溶液,将其研磨成10%的组织匀浆,随后将匀浆液离心10 min(3500 r/min),取上清液进行检测。
3.皮肤病理切片标本的制备:在实验大鼠背部病变部位取1.0 cm×1.0 cm大小皮肤,95%乙醇溶液固定24 h后,10%福尔马林溶液再固定,然后常规石蜡包埋切片,HE染色,光学显微镜下观察。
4.实验大鼠血清及皮肤和肝脏组织中SOD、MDA含量的检测:按检测试剂盒说明,采用分光光度法测定样品管的吸光度值,计算血清和组织中SOD、MDA的含量。
四、统计学处理
应用SPSS 10.0统计软件,计量资料以x±s表示,组间比较行t检验。P<0.05为差异有统计学意义。
结果
随着每日黄体酮注射液的使用,实验大鼠的毛色逐渐泛黄、粗糙;且30 d后实验大鼠血清MDA明显增高,SOD显著下降,与建模前比较差异均有统计学意义(均P<0.05),见表1。本实验所入选大鼠黄褐斑模型均成功建立。

表1 实验大鼠建模前后血清SOD及MDA比较(x±s)
一、治疗前及治疗期间各组实验大鼠生理指标情况
建模期间大鼠精神状态良好,进食规律;治疗期间,联合组大鼠进食量减少,体质量略有下降。见图1,2。联合组超声辐照大鼠时均未见烫伤皮肤。
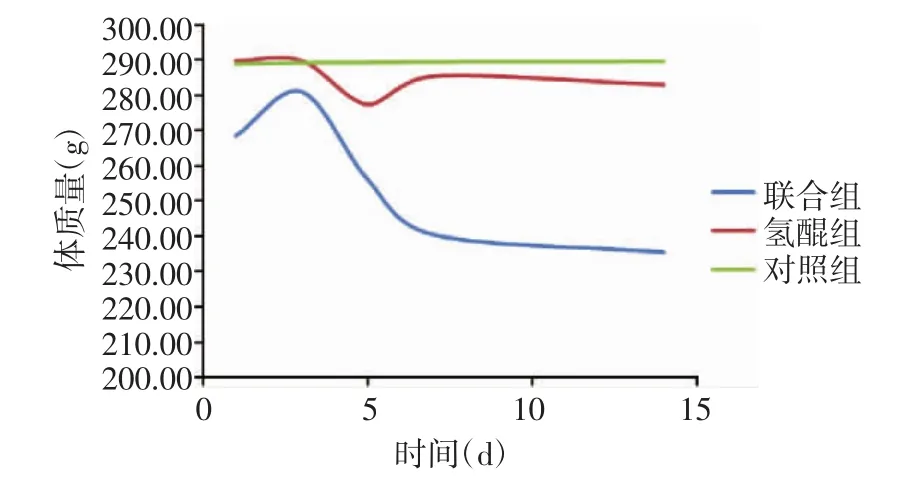
图1 治疗期间各组实验大鼠体质量变化

图2 治疗期间各组实验大鼠进食量变化情况
二、各组实验大鼠黄褐斑皮肤病灶变化情况
与治疗前对比,治疗第14天,联合组的大鼠背部皮肤斑块面积明显变小,颜色变浅,氢醌治疗组斑块面积也有变小,但不及联合组变化明显。经测量见表2和图3~6。

表2 治疗前及治疗期各组实验大鼠皮肤斑块面积变化情况(x±s) cm2

图3 治疗期间各组实验大鼠皮肤斑块面积变化趋势

图4 建模后大鼠背部皮肤斑块(箭头示)

图5 联合组治疗第14天大鼠背部皮肤斑块(箭头示)
三、各组实验大鼠血清及皮肤和肝脏组织中SOD、MDA含量的比较
治疗后,联合组和氢醌组血清及肝脏和皮肤组织中的SOD活力均较对照组升高,MDA含量均较对照组下降,差异均有统计学意义(均P<0.05)。联合组与氢醌组血清及肝脏和皮肤组织中的SOD活力比较差异均有统计学意义(均P<0.05)。见表3。
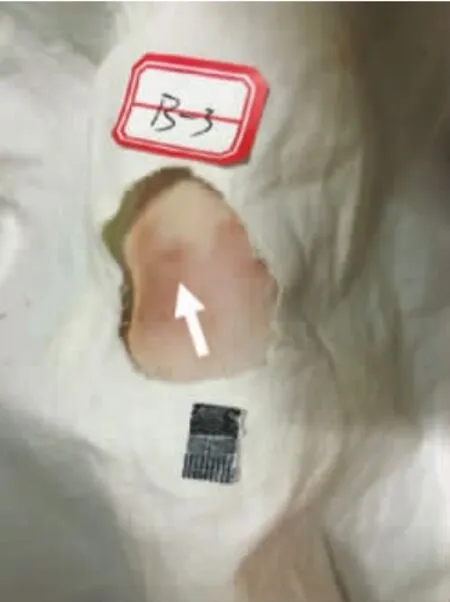
图6 氢醌组治疗第14天大鼠背部皮肤斑块(箭头示)
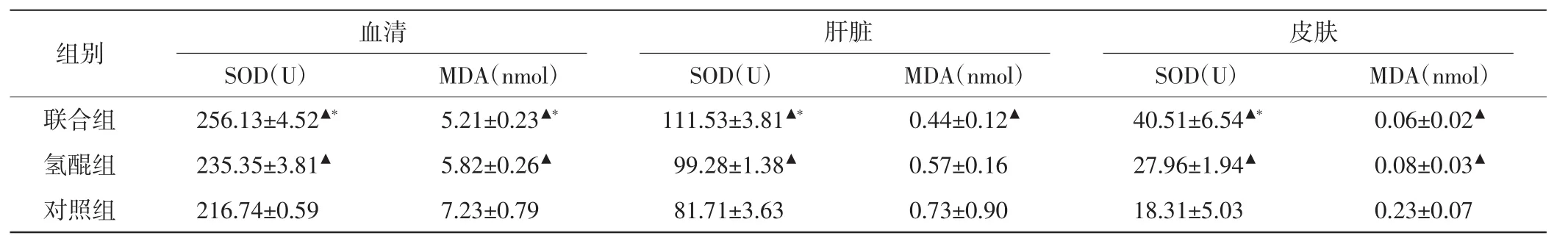
表3 各组治疗后血清及肝脏和皮肤组织中SOD及MDA的含量比较(x±s)
四、各组治疗后皮肤病理学变化情况
光学显微镜下,联合组和氢醌组大鼠皮肤组织基底层和棘层的黑色素颗粒数量均较对照组减少,其中联合组的黑色素颗粒大多呈线性散在分布,氢醌组呈线型密集分布,而对照组的黑色素颗粒较多且呈层状分布。见图7~9。
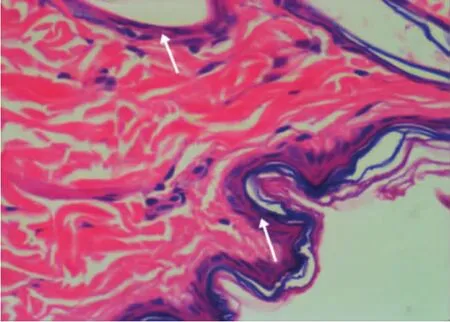
图7 联合组大鼠皮肤病理图示棘层和基底层黑色素颗粒(箭头示)散在分布(HE染色,×100)
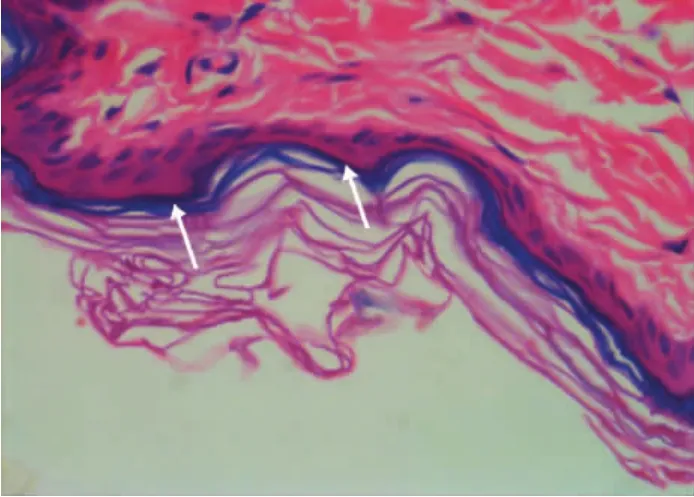
图8 氢醌组大鼠皮肤病理图示棘层和基底层黑色素颗粒(箭头示)呈单线型分布(HE染色,×100)
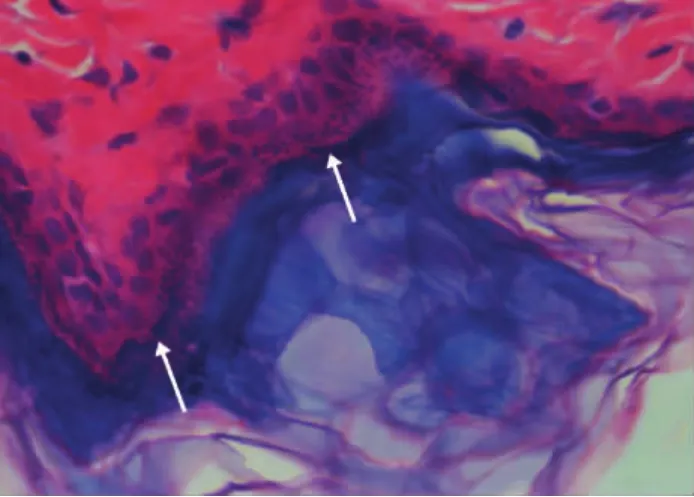
图9 对照组大鼠皮肤病理图示棘层和基底层黑色素颗粒(箭头示)呈层状密集分布(HE染色,×100)
讨论
黄褐斑是一种临床常见的获得性色素代谢异常性皮肤病。在亚洲地区的中青年女性中发病率较高,表现为在面部的眼周、额部、颧颊部及口周对称性出现黄褐色至深褐色的斑片,界限清楚,该病虽无明显自觉症状,但严重影响患者的容貌和心理。近年来,随着社会环境的变化,生活压力的增大,黄褐斑的发病率呈逐年增加的趋势[7]。氢醌是目前公认治疗黄褐斑最有效的药物之一。氢醌与酪氨酸酶的底物酪氨酸结构相似,可竞争性抑制酪氨酸酶的活性,影响黑色素的形成,还可抑制DNA和RNA复合体,剥蚀黑素小体,破坏黑素细胞[8]。本实验结果表明,氢醌组治疗14 d后血清及肝脏和皮肤组织中的SOD活力显著高于对照组,MDA含量显著低于对照组,差异均有统计学意义(均P<0.05);且观察黄褐斑皮肤组织病理图发现,氢醌组皮肤黑色素有所减少,确证氢醌有一定疗效。但其存在用药时间长、剂量较大、有刺激性且不稳定的缺点[9]。
超声的空化机械效应在一定强度和辐照时间范围内能提高细胞膜通透性,细胞膜短时间内开放使细胞内外发生物质交换(即声孔效应),且其作用过程可逆。通过低频超声对皮肤产生的空化效应、热效应、空化的声微流作用和辐射压等,能提供10倍于常规给药方法的持续稳定的渗透率,且低频超声经皮给药相比静脉给药是一种无创、无痛、感染风险低的给药途径,与口服给药相比具有无胃肠道降解、无首关消除,并能提供长达7 d的药物持续释放等优势[10]。由于皮肤角质细胞及细胞间质含水量和气核均较多,故角质细胞内易产生空泡,从而形成水性通道。药物及大分子化合物易于通过这些水性通道。因此,低频超声促渗可更有效地提高皮肤特别是角质层的通透性,使药物被动扩散更为迅速,也使大分子药物经皮促渗成为可能。低频超声透皮给药已被广泛应用于离体实验和动物活体实验,到目前为止,无论是小分子透皮传输还是大分子透皮传输均有很多成功的例子,如刘雯等[11]采用丝白祛斑软膏联合超声波导入治疗黄褐斑,研究结果表明超声波导入药物能有效促进药物的渗透吸收,提高治疗黄褐斑的有效率。本实验结果也表明,连续治疗14 d后联合组SOD活力较对照组及氢醌组均显著增强,MDA含量均显著降低,差异均有统计学意义(均P<0.05),且联合组与氢醌组血清及肝脏和皮肤组织中的SOD、MDA比较差异均有统计学意义(均P<0.05)。同时观察病理图发现,对照组大鼠表皮基底层及棘层内黑素颗粒含量较高,且呈层状扩散分布;氢醌组治疗后黑素颗粒减少,靠近角化层成条分布,无扩散现象;联合组治疗效果最显著,仅见少量渐断分布、颜色较浅的黑素颗粒残留。
临床上低频超声强度的选择应以产生最大的促渗效果,而又不至于烫伤皮肤,产生皮肤损伤为准。本实验采用的超声强度为0.32 W/cm2,约8 min后探头开始发烫,采用冷水循环降温,未见实验大鼠皮肤烫伤。此外,在治疗前后实验大鼠进食量及体质量均略有下降,由此可见0.32 W/cm2对大鼠黄褐斑的治疗是安全可行的。但是,大鼠和人的皮肤略有不同,在临床上使用超声促进药物导入皮肤的超声辐照强度及时间尚需要进一步的讨论。张国良和徐礼鲜[12]从组织学的角度证明,0.5 W/cm2的低频超声在临床应用安全可靠。
综上所述,低强度超声辐照联合氢醌乳膏治疗黄褐斑的疗效在实验室检查、病理方面均显著优于单纯使用氢醌乳膏治疗的效果,且安全可行,可为临床治疗黄褐斑提供参考。
[1] 汤楠,吴艳华,李其林,等.黄褐斑病因及发病机制研究现状[J].皮肤性病诊疗学杂志,2013,20(4):302-304.
[2] 杨婷婷,杨国红,王曙光,等.黄褐斑发病机制及治疗药物的研究进展[J].中华中医药学刊,2013,32(3):604-606.
[3] Choi YK,Rho YK,Yoo KH,et al.Effects of vitamin C vs.multivitamin on melanogenesis:comparative study in vitro and in vivo[J].Int J Dermatol,2010,49(2):218-226.
[4] Becker B M,Helfrich S,Baker E,et al.Ultrasound with topical anesthetic rapidly decreases pain of intravenous cannulation[J].Acad Emerg Med,2005,12(4):289-295.
[5] 江浩波,孙志平,张淑芳,等.超声导入氨甲环酸治疗黄褐斑疗效观察[J].长江大学学报(自科版),2015,12(6):49-50.
[6] 蒲春霞,何海蓉.大鼠黄褐斑动物模型的建立[J].河北科技师范学院学报,2013,27(2):66-69.
[7] 田常丽,汪斌.黄褐斑病因探赜[J].中医临床研究,2014,6(2):62-63.
[8] 刘艳综,肖生祥,王永贤,等.黄褐斑治疗现状[J].中国皮肤性病学杂志,2004,18(9):59-61.
[9] 王丹丹,杨蓉娅,宋克敏.千白氢醌乳膏治疗黄褐斑疗效观察[J].中国美容医学杂志,2007,16(9):1254-1255.
[10]张国良,史宗道.低频超声透皮给药的研究进展[J].华西药学杂志,2001,16(5):367-368.
[11]刘雯,王毅侠,江丽.丝白祛斑软膏联合超声波导入治疗黄褐斑疗效观察[J].中国美容医学杂志,2008,17(3):429-430.
[12]张国良,徐礼鲜.低频超声波透皮给药的强度对皮肤组织的影响[J].华西药学杂志,2003,18(1):20-22.
Effect of low intensity ultrasound irradiation combined with hydroquinone ointment on chloasma in SD rats
HE Shiyi,DENG Zhibo,WANG Qianli,LI Yuntao,DU Yonghong
College of Biomedical Engineering,Chongqing Medical University,Chongqing 400016,China
Objective To investigate the effect of using low intensity ultrasound combined with hydroquinone ointment on the treatment of chloasma in SD rats,which is expected to provide a new idea for clinical treatment of chloasma. Methods Eighteen chloasma SD rats were randomly divided into control group,hydroquinone group and low intensity ultrasound combined with hydroquinone group,6 rats in each group.The combined group was irradiated with ultrasound at the intensity of 0.32 W/cm2and frequency of 42 kHz for 12 min,the hydroquinone group was evenly coated with hydroquinone to absorb after the hair removal,while the control group was only exposed the skin without any treatment.The changes of physiological indexes in SD rats were observed before and during the experiment.Plaque images were collected and the change trend was observed.Serum,liver,and skin were removed,and their SOD activity and MDA content were measured.After 14 d continuous treatment,the changes of melanin granules were observed under optical microscope.Results Eighteen SD rats with chloasma were all successfully built. There were no significant changes in physiological indexes before and after treatment among three groups.Plaque area in combined group reduced and became pale,while hydroquinone group did not show obvious changes.After treatment,the activity of SOD was increased,while the content of MDA was decreased in the combined group and hydroquinone group compared with the control group,with the changes being more obvious in the combined group,there was difference(P<0.05).Pathological observation showed that the number of melanin granules was reduced after treatment,and the distribution of melanin granules was discrete in the combined group and linear in hydroquinone group.Conclusion The effect of using low intensity ultrasound combined with hydroquinone is significantly superior to single hydroquinone on the treatment of SD rats with chloasma.
Ultrasound irradiation,low intensity;Hydroquinone;Chloasma;Synergies;Rat
R-332;R445.1
A
2017-05-31)
国家自然科学基金项目(81127901);重庆市基础科学与前沿技术研究专项(csct2016jcyjA0098)
400016 重庆市,重庆医科大学生物医学工程学院省部共建国家重点实验室培育基地——重庆市超声医学工程重点实验室重庆市生物医学工程学重点实验室(何施逸、李韫韬、杜永洪);重庆医科大学第二临床学院(邓志博、王乾力)
杜永洪,Email:duyonghong@yeah.net
