木瓜蛋白酶水解鸡骨泥制备短肽工艺优化
2017-09-25赵改名柳艳霞赵莉君
朱 瀛,赵改名,柳艳霞,赵莉君,田 玮
(1.河南农业大学食品科学技术学院,河南省肉制品加工与质量安全控制重点实验室,河南 郑州 450002; 2.河南农业大学牧医工程学院,河南 郑州 450002)
木瓜蛋白酶水解鸡骨泥制备短肽工艺优化
朱 瀛1,赵改名1,柳艳霞1,赵莉君1,田 玮2
(1.河南农业大学食品科学技术学院,河南省肉制品加工与质量安全控制重点实验室,河南 郑州 450002; 2.河南农业大学牧医工程学院,河南 郑州 450002)
为了探究酶解鸡骨泥制备抗氧化肽的最佳工艺,研究了以木瓜蛋白酶酶解鸡骨泥时各因素对短肽得率的影响,以及制备的抗氧化肽对羟自由基、超氧阴离子自由基和1,1-二苯基-2-三硝基苯肼(DPPH)自由基的清除能力。试验探究了酶解过程中不同底物质量分数、加酶量、反应温度和反应时间对短肽得率的影响。采用响应曲面优化得到了以短肽得率为目标的木瓜蛋白酶酶解鸡骨泥的最优工艺,反应条件为:底物质量分数11.44%,加酶量211.11 mg·g-1,反应温度57 ℃,反应时间3 h,在该条件下酶解液短肽得率预期为59.20%,实测为58.87%±0.51%。采用优化工艺制备的抗氧化肽,在达到32 g·L-1时与维生素C清除羟自由基、超氧阴离子自由基和DPPH自由基的能力相近,说明鸡骨泥肽具有一定的抗氧化活性。
鸡骨泥;木瓜蛋白酶;短肽得率;抗氧化活性
中国是鸡肉生产大国[1],但目前对包括鸡骨在内的动物骨的加工利用还比较落后,每年都有大量的动物骨被浪费或加工成附加值较低的产品[2]。动物骨的开发与利用主要集中于猪骨、牛骨、鹅骨和鸡骨等,这其中由于鸡骨的产量大,有很大的开发应用价值[3-4]。鸡骨含有人体必需的多种微量元素,是一种名副其实的营养宝库。鸡骨干燥产品中蛋白质约占12.0%~35.0%,其中含量最高的是胶原蛋白,骨粉中含有17种氨基酸, 其中包括人体所必需的8种氨基酸,相比于其他食品中氨基酸含量,鸡骨粉中的蛋白质属于优质蛋白质。鸡骨内钙磷的比例适中,约为2∶1[5]。目前,鸡骨泥的开发和利用主要集中在明胶和骨素上[6],主要工艺是将鸡骨泥中的一些营养物质提取出来,再经浓缩后制备成食品调味料或添加剂,但鸡骨泥中的大分子蛋白人体难以吸收。采用酶解法处理鸡骨泥,不仅能够将大分子蛋白水解成利于人体吸收的小分子肽,还能使产品具有独特的功能特性,有效的提高了鸡骨泥的价值,是有较大发展潜力的研究课题。功能性短肽近年来成为研究的热门,主要是由于:1)短肽具有独特的吸收机制:短肽的抗原性要比其原型蛋白质低的多,产生的渗透压也远低于游离氨基酸,还可避免氨基酸之间的吸收竞争。这都使得一些肽能以完整的形式被机体吸收进入血液循环系统,并被组织利用。2)短肽具有一些独特的功能特性,例如抗氧化性,抗高血压,乳化性等,这些特性是大分子蛋白和游离氨基酸所不具备的。本研究采用木瓜蛋白酶酶解鸡骨泥,考察不同底物质量分数、加酶量、反应温度和反应时间对产物短肽得率的影响,并通过羟自由基、超氧阴离子自由基和DPPH自由基清除率来评价产物的抗氧化活性,以期为酶法制备鸡骨肽提供参考。
1 材料与方法
1.1原料
鸡骨泥采购于河南大用集团,质量为20 kg,保存于-40 ℃冰柜中进行后续试验。木瓜蛋白酶购于北京Solarbio公司,为固体,酶活性为600×104U·g-1。
1.2仪器
AL104型分析天平(梅特勒-托利多仪器有限公司);THZ-82型恒温水浴振荡器(金坛市杰瑞尔电器有限公司);UV-2600型紫外分光光度计(岛津企业管理有限公司);ALLEGR A-64A型高速离心机(Beckman Coulter);BPJ-9156A型精密鼓风干燥箱(上海一恒仪器有限公司);ALPHAI-4LD-plus型台式真空冷冻干燥机(德国 CHRIST公司)。
1.3工艺流程

图1 工艺流程 Fig.1 Production process
本试验酶解过程如下:向250 mL锥形瓶中加入100 mL蒸馏水。加入一定量的底物(以质量分数%表示),之后加入一定量的酶(加酶量以mg·g-1表示)。底物和酶添加完毕后放入恒温水浴振荡器中反应。
单因素试验固定的试验条件为:底物质量分数11%,加酶量200 mg·g-1,反应温度55 ℃,反应时间3 h。
1.4指标测定方法
1.4.1 可溶性蛋白质的测定 采用考马斯亮蓝G-250测定蛋白质含量。该染料在游离状态下呈红色,在稀酸溶液中当它与蛋白质的疏水区结合后变为青色,前者最大光吸收在465 nm,后者在一定蛋白质浓度范围内蛋白质与色素结合物在595 nm波长下的吸光度与蛋白质含量成正比,故可用于蛋白质的定量测定[8]。
1.4.2 短肽得率测定 短肽得率测定采用JANG等[9]的方法:将体积分数为5%三氯乙酸与蛋白酶水解液以1∶1体积比混合,离心(4 985 r·min-1,12 min),取上清液,采用考马斯亮蓝法测其可溶性蛋白,短肽得率计算公式如下
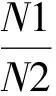
式中:TCA-NSI为三氯乙酸可溶性氮得率,%;N1为在5%TCA 中可溶性蛋白,mg;N2为酶解液中可溶性蛋白,mg。
1.4.3 羟自由基清除率测定 分别配制1、2、4、8、16、32 g·L-1的鸡骨泥肽和维生素C的无水乙醇溶液。采用GOHIL等[10]方法:配制0.75 mmol·L-1邻二氮菲无水乙醇溶液,取1 mL于试管中,依次加入0.2 mmol·L-1(pH值7.4)的磷酸缓冲液2 mL和蒸馏水1 mL,充分混匀,加0.75 mmol·L-1的FeSO4溶液1 mL,混匀,加入1 mL 0.01% H2O2,于37 ℃水浴60 min,测定536 nm处的吸光值AP。
其他操作同上,用1 mL蒸馏水代替1 mLH2O2测定吸光值AB。
其他操作同上,用1 mL酶解液代替1 mL蒸馏水,测定吸光值AS。
清除率按以下公式计算:

1.4.4 超氧阴离子清除能力测定 采用HALLIWELL等[11]的邻苯三酚自氧化法测定超氧阴离子自由基清除率:分别配制1、2、4、8、16、32 g·L-1的鸡骨泥肽和维生素C溶液。取50 mmol·L-1(pH值8.2)的Tris-HCl缓冲液4.5 mL于试管中,加入2 mL蒸馏水,30 mmol·L-1的邻苯三酚溶液0.5 mL,充分混匀,添加按照上法配制的不同浓度鸡骨泥液及维生素C溶液1 mL,空白组添加1 mL蒸馏水,在25 ℃恒温反应20 min,于320 nm波长处测吸光度,在4 min内,每隔30 s读数1次,计算4 min内的平均增值A样。清除率按以下公式计算

1.4.5 DPPH自由基清除能力测定 采用MARFAK等[12]方法:分别配制1、2、4、8、16、32 g·L-1的鸡骨泥肽和维生素C的无水乙醇溶液。试管中加入2 mL 0.2 mmol·L-1的DPPH无水乙醇溶液,加入2 mL各个梯度的鸡骨泥肽液或维生素C的无水乙醇溶液,混匀后在室温(25 ℃)避光条件下放置30 min,测定517 nm处吸光值A1,再测定2 mL 0.2 mmol·L-1的DPPH无水乙醇溶液和2 mL无水乙醇混合后的吸光值A2。清除率按以下公式计算:

1.5数据分析
本试验采用 Microsoft Excel 2007 软件处理数据 (样本平均值±标准偏差),利用 IBM SPSS Statistics 13.0统计分析软件进行单因素方差分析(One-way ANOVA),采用Design expert 8.0软件做响应曲面分析。
2 结果与分析
2.1单因素试验结果及分析
2.1.1 底物质量分数的单因素试验结果 由表1可以看出,当底物的质量分数由5%到11%时,短肽得率的上升趋势明显(P<0.05),说明当底物质量分数较低时,随着底物的增加,酶与底物的结合几率也在增加,从而使溶液中的活性物质质量分数上升。当底物由11%到15%时,短肽得率开始下降,说明当底物质量分数较高时,随着底物的增加,有效水分降低,使得酶与底物的运动受阻,难以有效结合,从而使得溶液中的活性物质质量分数下降[13]。
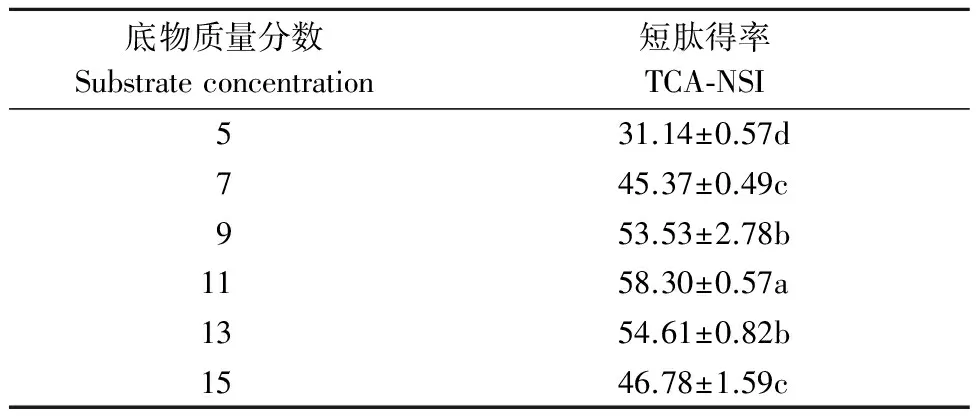
表1 不同底物质量分数对短肽得率的影响 Table 1 The influence of different substrate concentration on the TCA-NSI %
注:表中数据为平均值±标准差,同一列中不同字母表示不同处理间存在显著差异(P<0.05),下同。加酶量200 mg·g-1,反应温度55 ℃,反应时间3 h。
Note: The data in the table and figure are the average value±the standard deviation, different letters in the same column, indicates that there are significant differences between different treatment groups (P<0.05), the same as below. Enzyme concentration 200 mg·g-1, temperature 45 ℃, reaction time 3 h.
2.1.2 加酶量的单因素试验结果 由表2可以看出,当加酶量在50~200 mg·g-1时,随着加酶量的增加,短肽得率呈明显的(P<0.05)上升趋势。这是由于加酶量由低至高的过程中,酶分子同底物结合的几率逐渐增大,从而使大分子的蛋白被水解为小分子肽的几率增大,进而溶液中的活性物质的浓度增大[14]。当加酶量在200~300 mg·g-1时,随着加酶量的增加,短肽得率呈平缓甚至有下降的趋势。这是由于加酶量较高时,酶分子已经结合了大部分底物的酶切位点,使得溶液中的活性物质浓度达到了最高,同时一部分短肽与酶反应生成了没有活性的游离氨基酸。

表2 不同加酶量对短肽得率的影响Table 2 The influence of different enzyme concentration on the TCA-NSI
注:底物质量分数11%,反应温度55 ℃,反应时间3 h。
Note: Substrate concentration 11%, temperature 45 ℃, reaction time 3 h.
2.1.3 反应温度的单因素试验结果 由表3可以看出,当温度在40~55 ℃时,随着温度的上升,短肽得率有明显的(P<0.05)上升趋势。这是由于在酶的最适温度以下时,随着温度的上升,酶分子的运动能力不断增强,与底物分子结合概率增大,溶液中活性物质浓度不断上升。当温度在55~70 ℃时,随着温度的上升,短肽得率逐渐下降。这是由于,当温度超过酶的最适温度后,随着温度的上升,溶液中酶分子的结构逐渐被破坏,使得能够有效参与反应的酶分子数量下降,从而导致溶液中产生的活性物质数量下降。
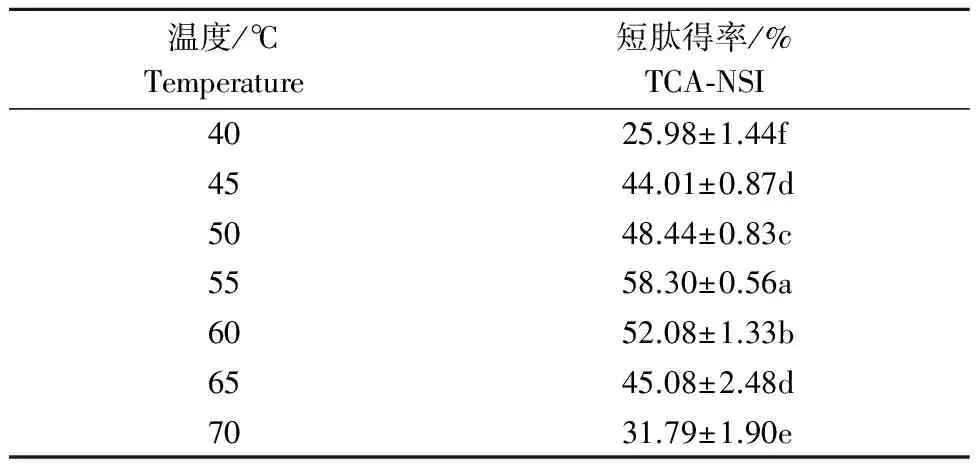
表3 不同温度对短肽得率的影响 Table 3 The influence of different temperature on the TCA-NSI
注:底物质量分数11%,加酶量200 mg·g-1,反应时间3 h。
Note: Substrate concentration 11%, enzyme concentration 200 mg·g-1, reaction time 3 h.
2.1.4 反应时间的单因素试验结果 由表4可以看出,反应时间在0.5~2.5 h时,随着时间的增加,
短肽得率有明显(P<0.05)的上升。这是由于酶与底物的结合、反应需要一个过程,在充分反应之前,随着反应时间的增加,越来越多的酶和底物结合并反应,产物的数量会不断增加[15]。当反应时间在2.5~3 h时,随着时间的增加,短肽得率数量上下波动。这是由于在大部分酶分子与底物分子充分结合并反应后,随着反应时间的增加会使一部分活性小肽被水解为游离氨基酸而失去生物活性,与此同时,一部分还未反应的大分子蛋白被水解为小分子肽又会使活性物质数量上升,故出现上下波动的现象。
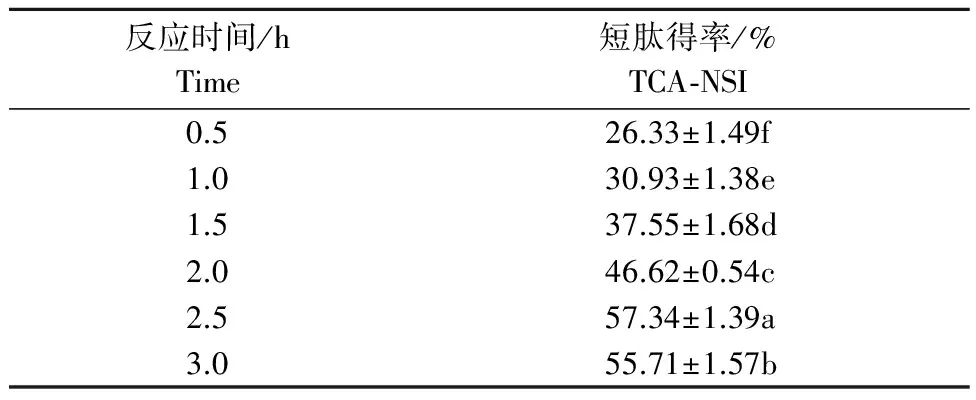
表4 不同反应时间对短肽得率的影响 Table 4 The influence of different reaction time on the TCA-NSI
注:底物质量分数11%,加酶量200 mg·g-1,反应温度55 ℃。
Note: Substrate concentration 11%, enzyme concentration 200 mg·g-1, temperature 45 ℃
2.2响应曲面设计
由于短肽得率是影响最终酶解液抗氧化活性的重要指标,根据单因素试验情况,固定反应时间3 h。以底物质量分数、加酶量和温度作为影响因素,短肽得率作为响应值设计试验(表5),得到结果如表6所示。

表5 响应面试验设计及结果Table 5 Experiment design and result of the response surface

表6 短肽得率回归模型方差分析结果Table 6 ANOVA analysis of regression model of TCA-NSI
采用逐步回归法得出底物质量分数、加酶量和温度对短肽得率的优化方程,方程如下:
TCA-NSI=-2624.08+19.32A+1.95B+82.95C-0.01BC-0.84A2-2.90×10-3B2-0.71C2。
Design Expert软件给出了以最大短肽得率为目标的优化结果:底物质量分数11.44%,加酶量211.11 mg·g-1,反应温度57 ℃,此时预期短肽得率为59.20%。在该反应条件下,验证试验短肽得率为58.87%±0.51%,与预期结果基本一致。
2.3抗氧化能力测定
目前对于活性物质的抗氧化能力的评价方法有很多,单一的指标难以说明一种物质的抗氧化活性[16]。目前已知的抗氧化剂通常通过以下5种途径来达到抗氧化目的:抑制脂质过氧化反应;直接清除活性氧自由基;清除氧;螯合金属离子;激活机体本身内在的抗氧化防御系统[17-19]。
本试验选取了羟自由基、超氧阴离子自由基以及DPPH自由基测定鸡骨泥肽和维生素C对它们的清除能力,从而在一定程度上评价鸡骨泥肽的抗氧化活性。图2、图3和图4分别显示出了鸡骨泥肽和维生素C在不同质量浓度下对不同自由基的清除率,可以看出:1)在较低的质量浓度(1~8 g·L-1)时,维生素C对于羟自由基的清除能力明显高于鸡骨泥肽,而在较高的质量浓度(16~32 g·L-1)时,二者的清除能力相近。2)随着维生素C和鸡骨泥肽质量浓度增加,对超氧阴离子自由基的清除率相似,维生素C(最高清除率在90%左右)清除能力略高于鸡骨泥肽(最高清除率在80%左右)。3)在较低的质量浓度(1~8 g·L-1)时,维生素C对于DPPH自由基的清除能力高于鸡骨泥肽,在较高的质量浓度(16~32 g·L-1)时,二者清除能力相近。综上可以看出,在抗氧化肽质量浓度达到16~32 g·L-1时与维生素C清除自由基的能力相近,清除效果较好。
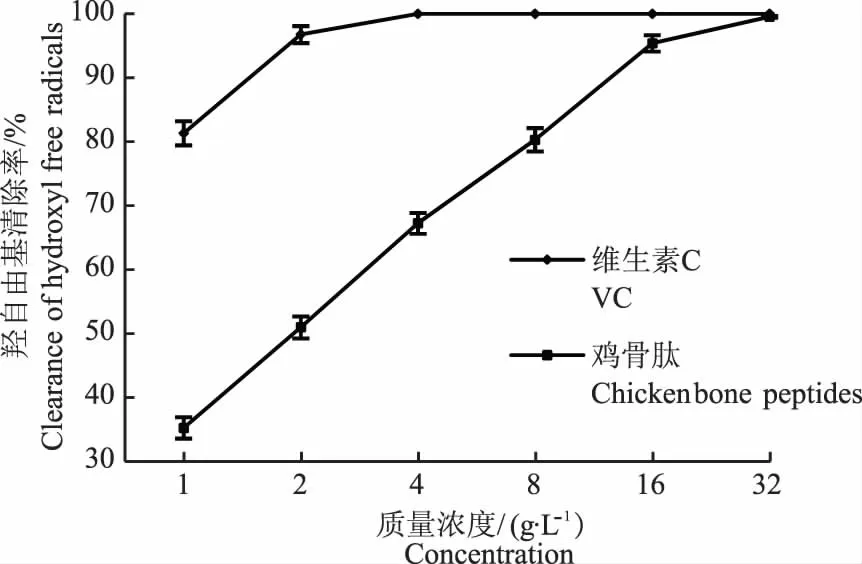
图2 羟自由基清除率比较Fig.2 Comparison of the clearance of hydroxyl free radicals
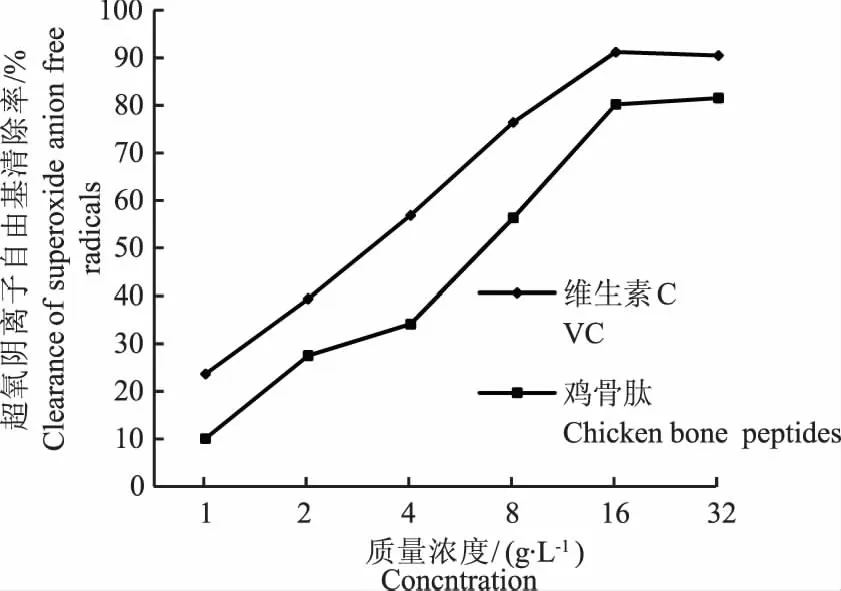
图3 超氧阴离子自由基清除率比较Fig.3 Comparison of the clearance of superoxide anion free radicals

图4 DPPH自由基清除率比较Fig.4 Comparison of the clearance of DPPH free radicals
3 结论
1)短肽得率随着底物质量分数和温度的增加,先增加后下降;随着加酶量和时间的增加,先增长后趋于平缓,羟自由基清除率与短肽得率增减趋势相近。
2)通过响应面试验得到以短肽得率为目标的最优酶解条件为:底物质量分数11.44%,加酶量211.11 mg·g-1,反应温度57 ℃,此时预期短肽得率为59.20%,该反应条件下试验短肽得率为58.87%±0.51%。
3)通过测定最优酶解条件下产物的抗氧化活性指标,得出鸡骨泥肽对羟自由基、超氧阴离子自由基以及DPPH自由基都有一定清除能力,其质量浓度达到32 g·L-1时与维生素C的清除能力相近。
[1] 李睿,王海燕,尚永彪. 鸡骨的综合利用研究进展[J].肉类工业,2010(11):9-11.
[2] 卢进峰,张小弓,王雅静. 鸡骨深加工及综合利用[J]. 肉类工业,2010(9):54-56.
[3] 李娇娇,李诚. 酶解鹅骨蛋白制备抗氧化肽的工艺优化[J]. 食品工业科技,2013(20):194-198.
[4] 邹利. 猪骨粉酶解液制备MRPs的抗氧化性及肉味香精的工艺研究[D]. 合肥:合肥工业大学,2010.
[5] 夏秀芳. 畜禽骨的综合开发利用[J]. 肉类工业,2010(11):9-11.
[6] 许雄. 鸡骨渣的酶解及其应用研究[D]. 郑州:河南农业大学,2009.
[7] 赵电波. 木瓜蛋白酶的提取及应用进展[J]. 肉类研究,2010(11):19-23.
[8] 郝建军,康宗利,于洋. 植物生理学实验技术[M]. 北京:化学工业出版社,2006.
[9] JANG A, LEE M. Purification and identification of angiotensin converting enzyme inhibitory peptides from beef hydrolysates[J]. Meat Sci, 2005, 69(4): 653-661.
[10] GOHIL K, MOYR K, FARZIN S, et al. mRNA expression profile of a human cancer cell line in response toGinkgobilobaextract: induction of antioxidant response and the Golgi system[J]. Free Radic Re, 2000, 33(6): 831-849.
[11] HALLIWELL B, GUTTERRIDGE J M C. Antioxidant activity of burdock its scavenging effect on free radical and active of 50% ethaolic red axtract[J]. Journal of Food Science, 2003, 68(1): 21-25.
[12] MARFAK A, TROUILLAS P,ALLAIS D P, et al. Reactivity of flaronoids with 1-hydroxyethl radical: ar-radiolysis study[J]. Biochim Biophys Acta, 2004, 1670: 28-29.
[13] 张宇昊. 花生短肽制备及其功能活研究[D]. 北京:中国农业科学院,2007.
[14] 王玉霞. 鸡骨肽制备及其ACE抑制活性研究[D]. 北京:中国农业科学院,2011.
[15] 赵钟兴. 蚕蛹蛋白酶解制备抗氧化和降血压活性产物及其动力学研究[D]. 南宁:广西大学,2012.
[16] 马小媛,钱卫平. 抗氧化能力评价方法[J]. 化学进展,2011(8):1738-1746.
[17] 包斌,得力格尔桑,许勤. 抗氧化肽的研究进展[J]. 内蒙古农业大学学报,2004,25(1):121-124.
[18] 陈炳卿. 营养与食品卫生学[M].第4版.北京:人民卫生出版社,2002.
[19] 陈君石,闻之梅. 食物、营养与癌症预防[M]. 上海:上海医科大学出版社,1999.
(责任编辑:朱秀英)
OptimizationofenzymatichydrolysisofchickenboneproteinforproductionofantioxidantpeptidesbyusingPapain
ZHU Ying1, ZHAO Gaiming1, LIU Yanxia1, ZHAO Lijun1, TIAN Wei2
(1.Henan Key Lab of Meat Quality and Safety Control, College of Food Science and Technology, Henan Agricultural University,Zhengzhou 450002, China;2.College of Animal Husbandry and Veterinary Medicine, Henan Agricultural University, Zhengzhou 450002, China)
In order to explore the optimal process of making antioxidant peptides by hydrolyzing the chicken bone, Papain was used to hydrolyze chicken bone residue, and to investigate the effect of different substrate concentration, enzyme concentration, reaction temperature and reaction time on the yield of oligopeptide of product, and the antioxidant peptides’ ability to clear the hydroxyl free radicals, superoxide anion free radicals and DPPH free radicals. Aiming at higher oligopeptide yield, using response surface optimization, the best process of Papain to hydrolyze chicken bone residue has been obtained: The substrate concentration is 11.44%, the enzyme concentration is 211.11 mg·g-1, the reaction temperature is 57 ℃, and the reaction time is 3 h. Under these conditions, the predicted TCA-NSI is 59.20%, and the experiment result is 58.87%±0.51%. The antioxidant peptides, which is made with the optimized process, have similar ability to the VC to clear the hydroxyl free radicals, superoxide anion free radicals and DPPH free radicals at the concentration of 32 g·L-1, indicating that chicken bone peptieles have certain antioxidant activity.
chicken bone residue; Papain; TCA-NSI; antioxidant activity
S879
:A
2016-08-30
河南省重大科技专项基金项目(161100110800)
朱 瀛(1989-),男,河南郑州人,硕士研究生,主要从事畜禽副产品利用方面的研究。
赵改名(1962-),男,河南洛阳人,教授,博士。
1000-2340(2017)03-0390-06
