利用析因设计法优化神经干细胞分化为多巴胺能神经元的诱导方案
2017-09-25宋振涛陈恒王帅田振辉刘小盾曲廷瑜
宋振涛 陈恒 王帅 田振辉 刘小盾 曲廷瑜
利用析因设计法优化神经干细胞分化为多巴胺能神经元的诱导方案
宋振涛 陈恒 王帅 田振辉 刘小盾 曲廷瑜
目的优化实验设计将人神经干细胞(hNSCs)高比例诱导分化为多巴胺能神经元。方法从aFGF、dbcAMP、普拉克索(PRX)、TPA和forskolin共计5种诱导因子中,使用单因素方法筛选出对hNSCs诱导为多巴胺能神经元有显著作用的诱导因子,显著性检验使用student'st检验。之后使用析因设计方法对选出的显著因子的诱导作用进行定量评估,找出每个因子对hNSCs诱导为多巴胺能神经元的诱导规律,统计学显著性使用方差分析。最后使用最快上升法找到每个显著因子的最佳浓度。结果根据初步的单因素筛选实验,aFGF、dbcAMP、TPA被认为是对hNSCs诱导为多巴胺能神经元起诱导作用的因子。使用析因设计对aFGF、dbcAMP和TPA的因子效应进行建模,得出在初始的浓度下,aFGF和dbcAMP为阳性诱导因子,TPA为阴性诱导因子,并得出三者的浓度变化比例为0.29:0.90:-0.39。选取三者的步长分别为11 ng/ml、35 μmol/L和 -15 nmol/L,使用最快上升法优化出三者最佳的浓度分别为166 ng/ml、310 μmol/L和10 nmol/L。最终多巴胺能神经元诱导比例可以达到(6.56±0.07)﹪,相比较对照提高了23.8﹪。结论析因设计法可以有效的优化hNSCs诱导分化为多巴胺能神经元。
神经干细胞; 多巴胺; 神经元
作者单位:250012 济南,山东省齐鲁干细胞工程有限公司
帕金森病(Parkinson's disease,PD)是一种常发生于中老年人的神经退行性疾病,病理为中脑黑质多巴胺能神经元死亡,造成中脑多巴胺大量缺乏[1]。使用细胞治疗的思路,将中脑多巴胺能神经元进行体外移植以恢复中脑多巴胺能神经元的含量和多巴胺含量是最有前景的治疗方式,目前诱导多能干细胞和胚胎干细胞已经在体外诱导分化为多巴胺能神经元[2-3]。但是诱导多能干细胞和胚胎干细胞有形成畸胎瘤的风险,因此临床应用具有局限性。人神经干细胞(human neural stem cells,hNSCs)已经从胎儿前脑成功分离扩增,同时不丢失他们分化为神经元和胶质细胞的多向分化能力[4]。但是hNSCs在体外较难以分化为多巴胺能神经元,限制着他们在临床上的应用。
β-tubulinⅢ是一种微管蛋白,作为早期神经元的标志物被广泛应用于多种生物细胞的分化实验之中[5]。酪氨酸羟化酶(tyrosine hydroxylase,TH)是多巴胺合成的限速酶,被广泛认定为多巴胺能神经元检测的金标准[6]。Moreno等[7]人使用dbcAMP、TPA及BDNF和GDNF多个因子将神经上皮细胞诱导分化为功能性的多巴胺能神经元。Chen等[8]使用转基因小鼠的方法对人aFGF基因在大脑发育中的诱导情况进行评价,实验表明人aFGF基因可以在脑室膜细胞、神经元细胞中激活,尤其是其中的一部分多巴胺能神经元,因而表征出aFGF在多巴胺能神经元的发育过程中具有重要作用。在aFGF、dbcAMP、TPA(phorbol-12-myristae-13-acetate)和forskolin联合诱导下,hNSCs可以分化为TH阳性神经元[4]。普拉克索(pramipexole,PRX)是一种非麦角碱多巴胺受体兴奋剂,体外实验表明,它可以促进多巴胺能神经元的再生[9]。最新的研究表明人多巴胺能神经元受体的激活可以促进神经祖细胞的增殖、保护多巴胺能神经元受损[10]。
本研究以 aFGF、dbcAMP、PRX、TPA 和forskolin五种诱导因子为起始条件,使用析因设计法对最终的最佳诱导方案进行探索,得出最佳诱导方案。
材料与方法
一、hNSCs的培养扩增
hNSCs购买自美国Lonza公司。培养扩增方法参考Yang等[9]的方法,简述如下,hNSCs培养于T75培养瓶,每瓶内加入15 ml配制的完全培养基。完全培养基配制方法为,基础培养基使用DMEM/F12培养基(美国Invitrogen公司),加入无血清替代物 B27(1:50,美国 Invitrogen公司),肝素(5 μg/ml,美国 Sigma公司),2 mmol/L 谷氨酰胺(美国Sigma公司),抗生素(antibiotic-antimycotic mixture,1:100,美 国 Invitrogen 公 司),20 ng/ml重组人表皮生长因子(human recombinant epidermal growth factor,EGF),20 ng/ml基本成纤维细胞生长因子(basic fi broblast growth factor,bFGF),生长因子均采购自R&D。于37 ℃、5﹪CO2恒温恒湿培养箱中培养,每3天更换7.5 ml新鲜培养基,每1~2周,Accutase(Milipore)酶解为单个细胞进行传代。
二、显著因子筛选
取生长旺盛的hNSCs神经球,Accutase酶解为单个细胞,并以每孔0.5×105的细胞量置于已经放入了包被poly-D-lysine细胞爬片的24孔板(Corning)中。每孔1 ml完全培养基,加入1﹪FBS帮助细胞贴壁。然后加入100 ng/ml aFGF、100 μmol/L dbcAMP、10 μmol/L PRX、100 nmol/L TPA和25 μmol/L forskolin作为诱导因子,作为对照。此外,分别去除上述的一种诱导因子进行诱导实验,以观察各个因子的诱导作用如何。
隔天全换液1次,每孔1 ml诱导液,共诱导6 d,每个实验2次重复。
三、析因设计
在选出显著因子之后,对显著因子使用析因设计进行规律探索,实验设计及结果分析使用design expert 8.0。析因设计因子水平表如表1所示。
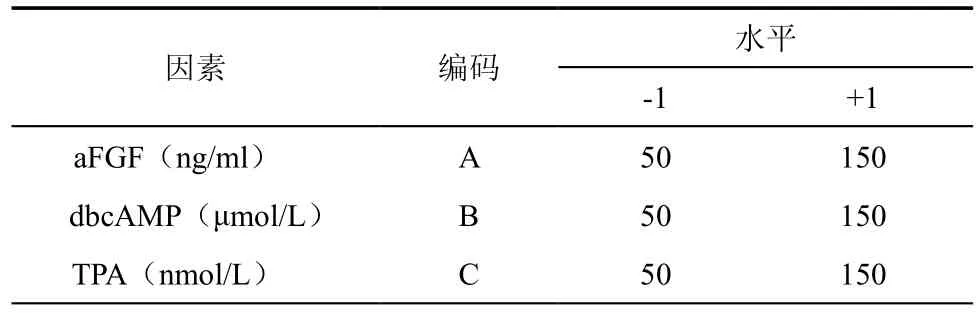
表1 析因设计因子水平表
析因设计[11]使用2次重复的23完全析因设计,析因设计的因子包含“-1”和“+1”两个水平,分别代表因子的“低”与“高”。参考“1.2显著因子筛选”实验中aFGF、dbcAMP和TPA的浓度来设定“1.3析因设计”的“-1”和“+1”水平,如表1所示。
将以上信息输入到design expert 8.0中,得出相应的实验设计表(表2),根据表格中的因子配比分别进行诱导实验。其诱导方法类同“1.2显著因子筛选”,简言之,除了aFGF、dbcAMP和TPA 3个诱导因子按照实验设计表中数据外,其他的操作均相同。使用加入1﹪FBS的完全培养基作为基础液,配制相应浓度的aFGF、dbcAMP和TPA因子。于24孔板中,每孔0.5×105个细胞,加入1 ml诱导液,隔天全换液1次,诱导6 d。
四、最快上升法
使用析因设计找出3个显著因子对诱导效果的影响规律之后,使用最快上升法对最佳因子浓度进行优化。根据析因设计的拟合方程式,得出aFGF、dbcAMP和TPA的步长比例为0.29:0.90:-0.39,最后选取最终的步长分别为11 ng/ml、35 μmol/L和 -15 nmol/L。此外,100 ng/ml aFGF、100 μmol/L dbcAMP、10 μmol/L PRX、100 nmol/L TPA 和25 μmol/L forskolin的因子组合作为对照。
五、免疫细胞化学
hNSCs经诱导6 d之后,将细胞爬片取出,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤1次,4﹪多聚甲醛室温固定20 min。PBS洗涤3次后,一抗4 ℃孵育过夜。一抗使用5﹪的驴血清(Jackson Immunoresearch Laboratories)稀释(稀释液使用PBS),内含有0.1﹪ Triton X-100。第2天,PBS洗涤3次后,于暗处,二抗37 ℃孵育1 h,二抗使用5﹪驴血清稀释。二抗孵育完成后,PBS洗涤3次,再使用 DAPI(Vector Labs)染核 10 min。之后于荧光显微镜下观察荧光(Olympus,日本)。
一抗为小鼠抗β-tubulinIII(Sigma,1:400)和兔抗TH(PelFreez,1:400)。二抗使用驴抗小鼠TRITC和驴抗兔FITC,二抗均购买自Jackson Immunoresearch Laboratories。
六、参数测定及结果分析
400倍放大倍数下,每个细胞爬片随机选取3个区域,分别计数各自的细胞核和TH阳性细胞数目,计算TH阳性率,取平均值。最后每个实验组的两个细胞爬片的TH阳性率取平均作为最终的TH阳性率。
七、统计学分析方法
析因设计的实验设计和结果分析使用design expert 8.0统计分析软件。最佳的诱导方案的TH阳性率和对照的TH阳性率的对比使用Minitab 16.0统 计分析软件,使用进行假设检验的单样本student'st检验,TH阳性率数据表示为,以P< 0.05 为差异有统计学意义。
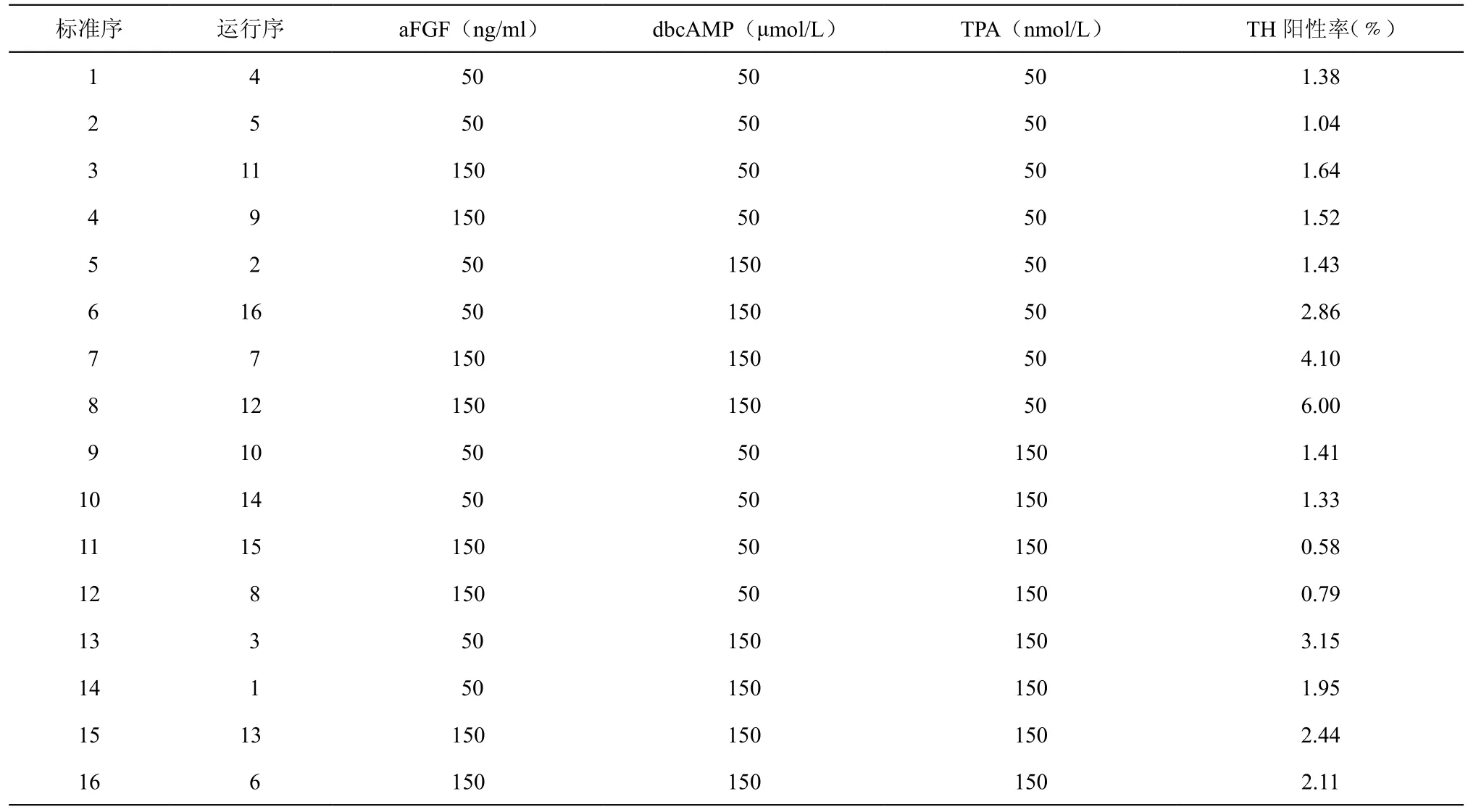
表2 析因设计及结果
结 果
一、多巴胺能神经元的免疫学标记
使用 100 ng/ml aFGF、100 μmol/L dbcAMP、10 μmol/L PRX、100 nmol/L TPA 和 25 μmol/L forskolin 5种混合因子进行诱导hNSCs实验,以确认初步选择出来的诱导方案能否将hNSCs诱导为多巴胺能神经元,完全培养基诱导作为对照,经过6 d诱导分化后的hNSC的免疫学荧光图如图1所示,可以看出此时的hNSCs已经转变成神经元的形态,细胞体上伸出长长的轴突。从β-tubulin Ⅲ和TH的叠加图可以看出,两者的神经元图可以很好地重叠,表明此神经元为多巴胺能神经元。对照为未经过诱导的hNSCs的TH和β-tubulin Ⅲ双染图,可以看出,hNSCs没有TH阳性标记,也不存在有β-tubulin Ⅲ标记。
二、显著因子筛选
使 用 100 ng/ml aFGF、100 μmol/L dbcAMP、10 μmol/L PRX、100 nmol/L TPA 和 25 μmol/L forskolin 5种混合因子进行诱导hNSCs为多巴胺能神经元作为对照,分别去除其中的一种因子,看此时的TH阳性率与对照的差异,差异越大表明此因子越显著。如图2所示,去除forskolin和PRX之后,其TH阳性率和对照没有明显差异(显著性水平0.05),TPA是对TH阳性率有显著影响的因子(P=0.02)。因此TPA有必要进一步讨论其在诱导多巴胺能神经元的最佳因子浓度。dbcAMP和aFGF尚未达到显著性水平,但是其与对照的差异已达到了对照的35﹪以上,考虑到计数阳性细胞时存在的误差,因此aFGF和dbcAMP也有进一步研究的必要。综合考虑,选取aFGF、dbcAMP和TPA为显著因子,以作进一步的优化。

图 1 光学显微镜下观察诱导因子诱导出来的β-tubulin Ⅲ和TH阳性细胞(免疫荧光染色,×400)
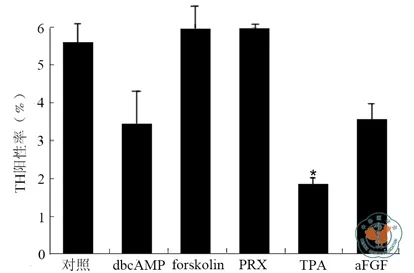
图2 显著因子筛选
三、析因设计
在使用“显著因子筛选”实验后,选出了aFGF、dbcAMP和TPA 3个显著因子,那么这3个显著因子的浓度变化会如何影响最终的多巴胺能神经元分化比例就需要析因设计来完成。如表2所示,析因设计使用2次重复的23完全析因设计。
使用design expert 8.0计算后,可以得出TH阳性率和3个因子aFGF、dbcAMP和TPA的拟合方程式。其中TH positive ratio为TH阳性率表征多巴胺能神经元比例,A为aFGF,B为dbcAMP,C为TPA。经过单因素方差分析后,模型的P值可以达到0.0049,表明模型极显著,具备统计学效应。模型的R2为0.8716,拟合度良好。
根据Box等人撰述的析因设计的特点[11],A和B的系数为正数,因此TH阳性率会随着A和B的增加而增加,C的系数为负数,因此TH阳性率会随着C的减小而增加。最佳的变化比例是三者的系数比,也就是A:B:C = 0.29:0.90:-0.39,亦即每当 A 增加 0.29 ng/ml、B 增加 0.90 μmol/L、C 减少0.39 nmol/L时,TH阳性率增加的最快。(注意:这里的0.29:0.90:-0.39是编码值,对应到3个因子的实际浓度为真实值,他们之间是有换算比例的,本文的A、B、C的编码值和真实值换算比例恰好是1:1:1的,因为三者的“-1”和“+1”水平的差值都是100(表1),所以此处可以直接将编码值认定为真实值的。)
四、最快上升法
最快上升法是和析因设计联合使用的一种实验设计方法,每变化一次显著因子的浓度值,查看此时的TH阳性率值如何,多次变化后找到最佳因子点,每一次因子变化称为“步”(表3)。根据析因设计的结果,3个因子的浓度变化比例为A:B:C = 0.29:0.90:-0.39,最后综合考虑,选择最终A、B和C的步长分别为166 ng/ml、310 μmol/L 和 10 nmol/L。
从表3可以看出,随着最快上升法的因子浓度逐渐步进,TH阳性率也逐渐增加,在第7步时,TH阳性率达到达到最高点,为(6.56±0.07)﹪。若是继续进行下一步,那么TPA的值将会是负值,因此选取第7步为优化终点,也就是最佳因子浓度aFGF、dbcAMP 和 TPA 分别为 166 ng/ml、310 μmol/L和10 nmol/L,最佳TH阳性率为(6.56±0.07)﹪。使用 100 ng/ml aFGF、100 μmol/LdbcAMP、10 μmol/L PRX、100 nmol/L TPA 和 25 μmol/L forskolin 5 种混合因子诱导hNSCs为多巴胺能神经元作为对照,而此时的对照为(5.30±1.33)﹪,最佳优化结果相比较对照提升了23.8﹪。如图3所示,细胞免疫化学结果也表明最快上升法的最佳诱导方案的TH诱导比例明显多于对照诱导因子。使用进行假设检验的单样本t检验得出此时P值为0.026,表明两者差异具有统计学意义。
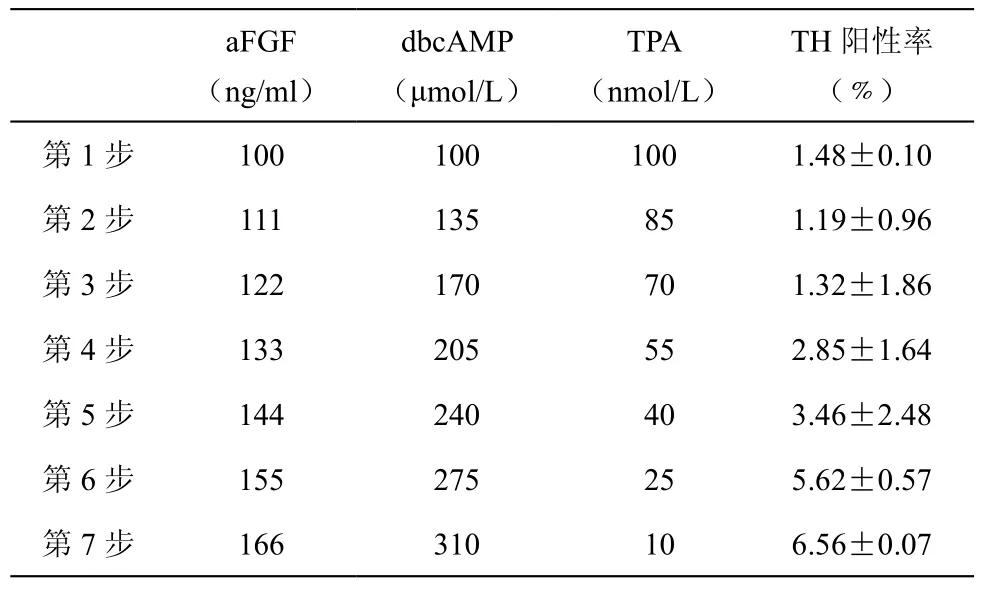
表3 最快上升法结果

图3 光学显微镜下观察最快上升法最佳诱导方案的β-tubulin Ⅲ和TH阳性细胞(免疫荧光染色,×400)
讨 论
hNSCs可以在体外扩增、培养,并在合适的体外条件下分化为神经元、星形胶质细胞和少突胶质细胞等神经细胞[9],因此在体外经过合适诱导分化的hNSCs,将具有很大的治疗用途潜力,但是目前hNSCs的分化效率很低,因此选择合适的诱导方案进行高效率的分化就很关键。
Iacovitti等[12]使用胚胎癌干细胞NT2细胞系进行诱导实验,TPA、forskolin、多巴胺和aFGF联合诱导具有将其诱导为多巴胺能神经元的作用。Scintu等[13]使用TPA、forskolin、IBMX和aFGF作为诱导因子可以使得人骨髓间充质干细胞向神经细胞方向分化。而Christophersen等[4]认为forskolin、dbcAMP、aFGF和TPA是神经祖细胞向多巴胺能神经元方向分化的关键因子,而BDNF,IGF-I,GDNF和IL-1就不太重要。由此可以看出,为了使得不同细胞定向分化,就需要不同的因子相互配合。上述3个文献的共有因子是TPA、forskolin、aFGF三种因子,本研究在对混合因子的诱导效应进行研究发现,TPA、dbcAMP、aFGF 3个因子是对hNSCs的定向诱导分化有重要作用的。TPA是蛋白激酶C(PKC)激活剂[12],PKC对神经元分化中的突触发生和分支发生等形态学发育有重要作用[14]。从本研究来看TPA的诱导效果是最显著的,这个结论和Christophersen等[4]的结果是一致的。dbcAMP可以提高胞内cAMP的水平,进而激活蛋白激酶A(PKA),PKA是神经元和胶质细胞分化的关键调控之一[13],对神经元突起的形成和发育也有作用[14]。同dbcAMP一样,forskolin也是PKA的激活剂,两者的作用机制上有相似之处,本研究发现在选择的初始浓度上,forskolin不如dbcAMP的效果好,因此最终选择的显著因子没有forskolin。aFGF是纤维生长因子家族的一员,别名FGF1[15],可以促进神经祖细胞[4]和小鼠的纹状体神经元[16]表达TH标记。同前述研究类似,本研究同样发现aFGF具有促进hNSCs表达TH的作用。PRX是一种非麦角碱多巴胺受体兴奋剂,Pan等[17]研究了PRX对SH-SY5Y细胞(神经母细胞瘤细胞株),发现它可以促使SH-SY5Y细胞的TH基因高含量表达,同时也可以促使多巴胺能神经元的其他标记物DAT和VMAT2的基因表达,不过本研究在做显著因子筛选时,没有看到PRX在hNSCs的诱导分化上的作用。
目前的体外诱导分化实验,都是以对因子类别的诱导评价为主,对每个因子的浓度变化对诱导结果的规律不甚重视[4,12-13],而本研究正是从优化的角度入手,找到显著因子之后,使用析因设计的方法确定各因子的最佳浓度。析因设计是实验设计的一种,其他的实验设计还有正交试验、混料试验、均匀设计、Plackett-Burman设计和响应面优化法等[18-19]。实验设计常常使用在发酵领域的培养基优化和产物优化中,它具有试验次数少、衡量的因素多的优点。目前用在细胞学方面的实验设计还不太多,Liu等[20]使用析因设计诱导脐带间充质干细胞的无血清培养体系,得出最佳的培养体系为bFGF为17.91 ng/ml、人类白蛋白为2.80 mg/ml、皮质醇为27.65 μmol/L 和 SITE 为 1.18﹪时,此时脐带间充质干细胞状态最好、传代最快,1个月后较初始细胞数量扩增了1 000倍。Chang等[21]使用多步析因设计方法优化胚胎干细胞分化为内胚层细胞的作用因子,发现RA会抑制分化、低浓度葡萄糖会促进分化,此外作者还大量衡量了多个因子之间的交互作用,这是单因素实验难以做到的。本研究使用析因设计和最快上升法相配合,得出hNSCs诱导分化为多巴胺能神经元的最佳因子浓度aFGF、dbcAMP和 TPA 分别为 166 ng/ml、310 μmol/L 和 10 nmol/L。最后的验证实验,得出最佳TH阳性率为(6.56±0.07)﹪,而此时的对照为(5.30±1.33)﹪,优化结果相比较对照提升了23.8﹪,证明析因设计在优化hNSCs诱导分化方面的有效性。
1 Suzuki S, Kawamata J, Iwahara N, et al. Intravenous mesenchymal stem cell administration exhibits therapeutic effects against 6-hydroxydopamine-induced dopaminergic neurodegeneration and glial activation in rats[J]. Neurosci Lett, 2015, 584:276-281.
2 Peng SP, Copray S. Comparison of Human Primary with Human iPS Cell-Derived Dopaminergic Neuron Grafts in the Rat Model for Parkinson's Disease[J]. Stem Cell Rev, 2016,12(1):105-120.
3 Tian LP, Zhang S, Zhang YJ, et al. Lmx1b can promote the differentiation of embryonic stem cells to dopaminergic neurons associated with Parkinson's disease[J]. Biotechnol Lett, 2012,34(7):1167-1174.
4 Christophersen NS, Meijer X, Jørgensen JR, et al. Induction of dopaminergic neurons from growth factor expanded neural stem/progenitor cell cultures derived from human fi rst trimester forebrain[J].Brain Research Bulletin, 2006, 70(4-6):457-466.
5 Mariani M, Karki R, Spennato M, et al. Class III β-tubulin in normal and cancer tissues[J]. Gene, 2015, 563(2):109-114.
6 White RB, Thomas MG. Moving beyond tyrosine hydroxylase to de fi ne dopaminergic neurons for use in cell replacement therapies for Parkinson's disease[J]. CNS & neurological disorders drug targets,2012, 11(4):340.
7 Moreno EL, Hachi S, Hemmer K, et al. Differentiation of neuroepithelial stem cells into functional dopaminergic neurons in 3D micro fl uidic cell culture[J]. Lab on a Chip, 2015, 15(11):2419-2428.
8 Chen MS, Lin HK, Chiu H, et al. Human FGF1 promoter is active in ependymal cells and dopaminergic neurons in the brains of F1B-GFP transgenic mice[J]. Dev Neurobiol, 2015, 75(3): 232-248.
9 Yang H, Wang J, Wang F, et al. Dopaminergic neuronal differentiation from the forebrain-derived human neural stem cells induced in cultures by using a combination of BMP-7 and pramipexole with growth factors[J]. Front Neural Circuits, 2016, 10:29.
10 Bono F, Savoia P, Guglielmi A, et al. Role of dopamine D2/D3 receptors in development, plasticity, and neuroprotection in human iPSC-Derived midbrain dopaminergic neurons[J]. Mol Neurobiol,2017.
11 Box GE, Hunter JS, Hunter WG. Statistics for experimenters:design,innovation, and discovery[M]. Vol. 2. New York: Wiley-Interscience,2005.
12 Iacovitti L, Stull ND, Jin H. Differentiation of human dopamine neurons from an embryonic carcinomal stem cell line[J]. Brain Research, 2001, 912(1):99-104.
13 Scintu F, Reali C, Pillai R, et al. Differentiation of human bone marrow stem cells into cells with a neural phenotype:diverse effects of two speci fi c treatments[J]. BMC Neuroscience, 2006, 7:14.
14 Cabell L, Audesirk G. Effects of selective inhibition of protein kinase C, cyclic AMP-dependent protein kinase, and Ca(2+)-calmodulindependent protein kinase on neurite development in cultured rat hippocampal neurons[J]. Int J Dev Neurosci, 1993, 11(3):357-368.
15 Sakaguchi DS, Janick LM, Reh TA. Basic fibroblast growth factor(FGF-2) induced transdifferentiation of retinal pigment epithelium:generation of retinal neurons and glia[J]. Dev Dyn, 1997, 209(4):387-398.
16 Du X, Stull N, Iacovitti L. Novel expression of the tyrosine hydroxylase gene requires both acidic fi broblast growth factor and an activator[J]. J Neurosci, 1994, 14(12):7688-7694.
17 Pan T, Xie W, Jankovic J, et al. Biological effects of pramipexole on dopaminergic neuron-associated genes: relevance to neuroprotection[J].Neuroscience Letters, 2005, 377(2):106-109.
18 黄立, 宋振涛, 朱明军. 联合试验设计法优化辣蓼饲料添加剂生产工艺[J]. 江苏农业科学, 2016, 44(11):272-276.
19 Song ZT, Zhu MJ. Feed additive production by fermentation of herb Polygonum hydropiper L. and cassava pulp with simultaneous fl avonoid dissolution[J]. Biotechnol Appl Biochem, 2017, 64(2):290-300.
20 Liu C, Wu M, Hwang S. Optimization of serum free medium for cord blood mesenchymal stem cells[J]. Biochemical Engineering Journal,2007, 33(1):1-9.
21 Chang KH, Zandstra PW. Quantitative screening of embryonic stem cell differentiation:Endoderm formation as a model[J]. Biotechnol Bioeng, 2004 , 88(3):287-298.
Optimization of induced differentiation of human neural stem cells into dopaminergic neurons by factorial design
Song Zhentao, Chen Heng, Wang Shuai, Tian Zhenhui, Liu Xiaodun, Qu Tingyu.Shandong Province Qilu Stem Cells Engineering Company Limited, Jinan 250012, China
ObjectiveTo induce the differentiation of human neural stem cells(hNSCs)into dopaminergic neurons.Methods From a total of 5 kinds of inducing factors including aFGF,dbcAMP, pramipexole(PRX), TPA(phorbol-12-myristae-13-acetate), forskolin, single factor experiments were used to screen significant factors which play an important role in inducing hNSCs into dopaminergic neurons, and significance tests were tested by student'st. Factorial design was used to evaluate the inducing effect of the selected significant factors and to find out how these factors affect the induced dopaminergic neuron positive ratio. Statistical significance was tested by analysis of variance. Finally, the optimal concentration of each significant factor was determined by using the steepest-ascent method.ResultsAccording to single factor experiments, aFGF, dbcAMP and TPA were considered to be important factors in inducing differentiation of dopaminergic neurons form hNSCs. Inducing effect of aFGF, dbcAMP and TPA was modeled by factorial design. These results showed that aFGF and dbcAMP were positive factors and TPA was negative factor at the initial concentrations. The ratio of concentration changes in aFGF, dbcAMP and TPA should be 0.29:0.90:-0.39. The stepwise of aFGF, dbcAMP and TPA used in the steepest-ascent method was selected as 11 ng/ml, 35 μmol/L and -15 nmol/L, respectively. Then, the optimal concentration of aFGF, dbcAMP and TPA was achieved at 166 ng/ml, 310 μmol/L and 10 nmol/L. The optimal dopaminergic neuron positive ratio was(6.56±0.07)﹪, which increased by 23.8﹪ comparing to control group.ConclusionFactorial design can effectively optimize the differentiation of hNSCs into dopaminergic neurons.
Neural stem cells; Dopamine; Neurons
Qu Tingyu, Email: tqu2010@hotmail.com
2017-02-14)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2017.04.002
山东省2016年重点研发计划(创新型产业集群)项目(2016ZDJQ0104);泰山学者建设工程专项经费(tshw201502002)
曲廷瑜,Email:tqu2010@hotmail.com
宋振涛,陈恒,王帅,等.利用析因设计法优化神经干细胞分化为多巴胺能神经元的诱导方案[J/CD].中华细胞与干细胞杂志(电子版),2017,7(4):195-201.
