基于髓过氧化物酶的分子探针成像研究进展
2017-09-23李安宁吴越姚振威冯晓源
李安宁, 吴越, 姚振威, 冯晓源
基于髓过氧化物酶的分子探针成像研究进展
李安宁, 吴越, 姚振威, 冯晓源
髓过氧化物酶(MPO)是许多炎症相关疾病的重要标志物,包括动脉粥样硬化、血管炎、中风、肿瘤、帕金森病、阿尔茨海默病、多发性硬化等。MPO可以作为一个成像靶点,通过在体情况下监测MPO的活性,协助炎症相关疾病的诊断。利用MPO酶学激活的原理将MPO可催化的底物同能产生影像学信号的物质以特定方法结合便可构成MPO特异性分子探针。本文将以MPO为靶点的各种成像探针及其在体应用情况进行综述。
髓过氧化物酶; 炎症; 分子探针; 分子影象学
炎症已被证实参与许多疾病的进程,包括动脉粥样硬化[1]、血管炎[2]、中风[3]、肿瘤[4]、帕金森病[5]、阿尔茨海默病[6]、多发性硬化[7,8]等 。髓过氧化物酶(Myeloperoxidase,MPO)是炎症过程中最重要的酶之一[9],逐渐成为诊断及治疗的靶点[10]。正常情况下, MPO以中性粒细胞产生的过氧化氢和氯离子为底物,催化产生次氯酸和多种自由基,参与机体天然免疫应答。当机体处于炎症、氧化应激状态时,不能有效清除多余的自由基和氧化剂,便会进一步激活细胞的炎性信号通路[11],产生组织损伤而导致多种疾病。因此,激活的MPO即代表疾病进程中的活动性炎症。
通过MPO可激活的特异性分子探针可以在在体情况下监测MPO的活性,有助于评估炎性相关疾病的活动进程,进而指导临床以炎症为靶点的相关治疗并评估疗效,具有良好的应用前景。利用MPO酶学激活的原理将MPO可催化的底物同能产生影像学信号的物质以特定方法结合便可构成MPO特异性分子探针,该类探针可以为顺磁性粒子标记的MR成像探针、放射活性原子标记的PET或SPECT成像探针、荧光标记的光学成像探针等。
MPO特异性磁共振探针及应用
1.MPO-Gd分子探针
Querol等[12,13]于2006年首次报道了一种髓过氧化物酶(Myeloperoxidase,MPO)特异性的磁共振探针MPO-Gd[bis-5-hydroxytryptamide-diethylenetriaminepentaacetic acid(Gd),bis-5HT-DTPA(Gd)],该探针以具有两个酸酐衍生物的DTPA为螯合底物,以5-羟色胺(5-hydroxytryptamide,5-HT)为基质,通过酚基基团的氧化完成Gd3+络合物的接合而生成(化学结构式及作用机制见图1a)。5-HT由于具有非常强的还原能力,超出了MPO主要反应底物氯离子的还原能力[14],含有5-HT的探针到达炎性反应的部位,可以同炎性反应过程中产生的氯离子竞争同MPO反应而被激活显像,间接对炎性反应部位产生的MPO进行成像[14-17]。不同于常规的MR对比剂(如DTPA-Gd),这种MPO特异性对比剂在每一个酸酐分别链接了容易寡聚化的基团[17,18],通过聚合反应可以寡聚化,并可通过结合或交联到周围蛋白质上形成环圈结构而短暂局部聚集[19,20],从而诱导弛豫扩大,表现为延迟期增强信号[13]。组织内MPO活性高于0.005 U/mg时均可激活此探针。且此探针不能被嗜酸性粒细胞过氧化物酶(eosinophil peroxidase,EPO)等其他过氧化物酶所激活,具有很好的特异性。小鼠周围静脉注射6 h后,90%的对比剂会被清除掉,具有很好的临床转化潜力。
2.在不同疾病中的应用
多发性硬化:MPO已被证实参与多发性硬化斑块的形成,可作为多发性硬化活动性病灶的标志物[21,22]。在实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠尾静脉注入MPO-Gd和DTPA-Gd各0.3 mmol/kg后,Chen等[23]对比了两种对比剂对活动性炎性病灶的显示能力,在增强早期,两者均可见到弥漫的血脑屏障破坏导致的增强灶;在增强晚期,DTPA-Gd增强程度快速下降,而MPO-Gd因被病灶部位的MPO激活,强化时间明显延长(达60 min),强化程度也高于DTPA-Gd。统计发现,MPO-Gd延迟期图像上显示病灶的体积与临床症状严重程度及病理上组织脱髓鞘程度呈正相关。Pulli等[24]在同样小鼠模型的尾静脉注射同样剂量的对比剂,发现MPO-Gd较DTPA-Gd可以发现更早期的亚临床病灶及慢性期的活动性病灶,证实此对比剂反映的是病灶的炎性活动程度而不仅是血脑屏障的破坏。Forghani等[25]进一步通过MPO-Gd增强成像(0.3 mmol/kg,尾静脉注射)对EAE小鼠ABAH(一种活性MPO特异性抑制剂)治疗的疗效进行了评估,相对于对照组,ABAH治疗组病灶的体积和数目都明显减少,病灶的强化程度也减轻,同临床症状的缓解及病理上炎症的减轻均相符。因此,MPO-Gd增强成像可以非侵入性地检测多发性硬化内活动性斑块,可检测亚临床病灶并可评估多发性硬化的疗效,相对于常规对比剂更准确。
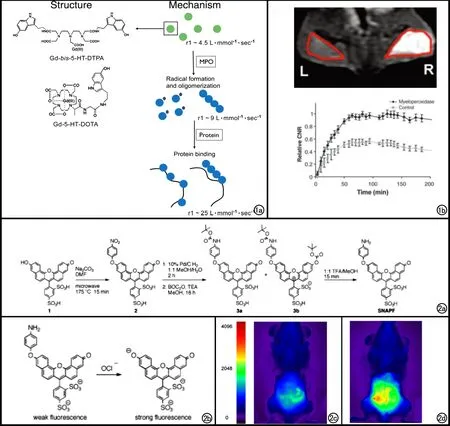
图1 a) MPO特异性磁共振对比剂的化学结构式(左)及作用机制(右)。经MPO激活后,对比剂形成寡聚体并可结合到周围的蛋白质上形成圈环结构; b) 小鼠右侧(R)包埋含人MPO的基底膜凝胶,左侧(L)包埋基底膜凝胶,尾静脉注入Gd-bis-5-HT-DTPA后,基底膜凝胶部位冠状面1.5T抑脂MR图像(上)及相应的CNR曲线(下)显示包埋含人MPO基底膜凝胶的部位信号明显增强[13]。 图2 a)SNAPF的化学合成过程图解; b) SNAPF为MPO激活过程图解; c) 静脉注射SNAPF之前h-MPOtg小鼠FRI成像; d) 静脉注射SNAPF 1小时之后同一只h-MPOtg小鼠FRI成像,腹膜部位的荧光强度增加了1.4倍[33]。
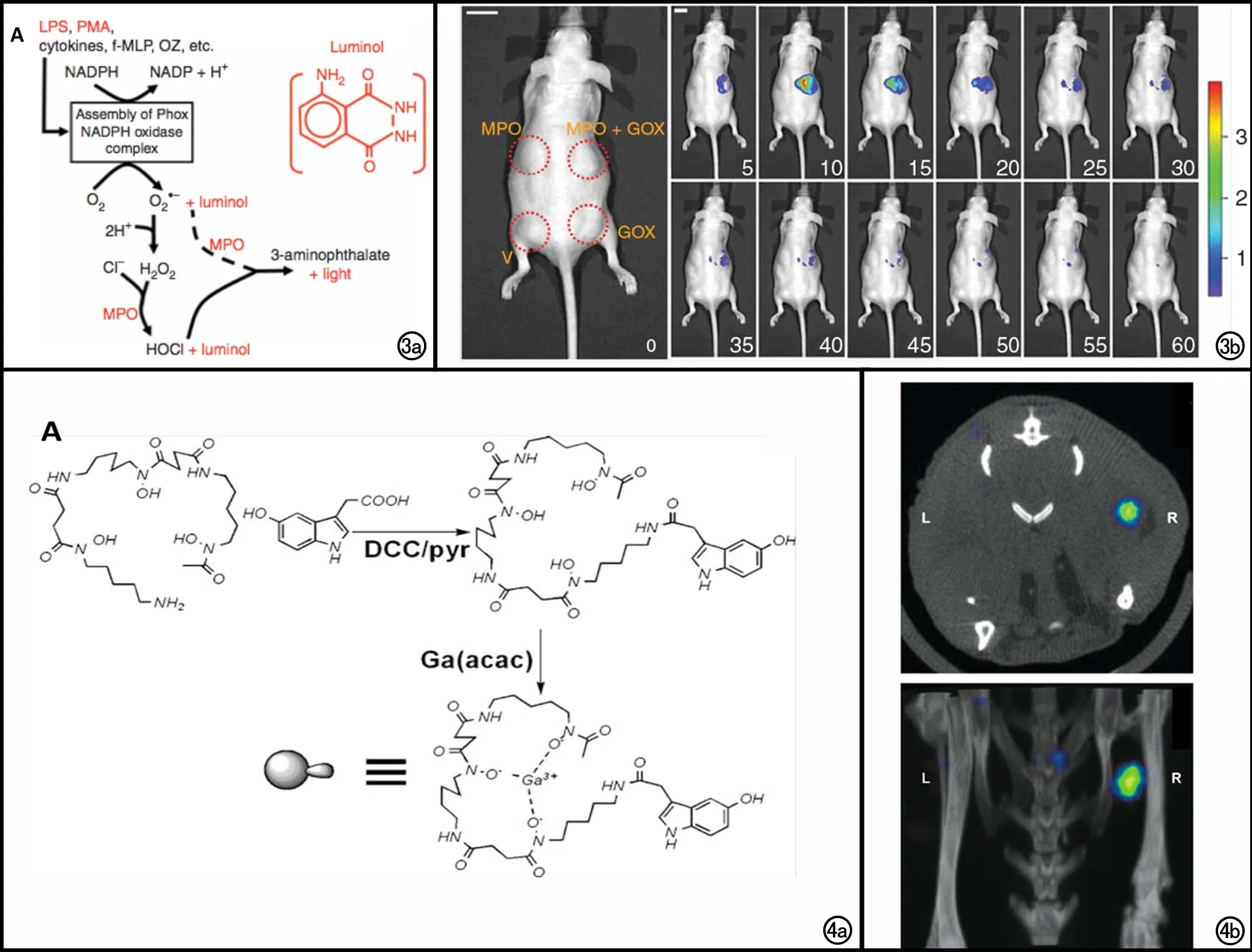
图3 a) 图解发光氨生物发光成像的生物化学基础;MPO氧化过程产生的HOCl可以直接或间接氧化发光氨而发光;或者MPO也可以利用超氧阴离子(虚线)或者其他ROS作为底物催化发光氨; b) V(PBS )、GOX(葡萄糖氧化酶)、MPO或MPO+GOX分别包埋于人工基底膜内,种植于裸鼠的皮下,在t=0(发光氨注射之前,比例尺1 cm)及在发光氨腹腔注射后5~60 min(每隔5 min成像一次,比例尺1 cm)的生物发光成像可见仅有MPO+GOX组小鼠发出生物荧光,且荧光强度在10 min时达到高峰,在65~90 min之间降至基线水平[34]。 图4 a) MPO特异性67Ga探针合成图解; b) 小鼠MPO/人工基底膜移植物(R)及对照移植物(L)的SPECT/CT成像断层图像(上)及3D重建图像(下)显示含有MPO的移植物有明显的MPO特异性67Ga探针的聚集[38]。
血管壁炎症:最常见于血管炎,主要表现为炎性细胞向血管壁的浸润,伴MPO表达的升高。目前影像诊断血管炎主要依赖于血管管径的改变,偶尔可见血管壁的强化,准确性不高。Su等[26]观察了以MPO为靶点的分子增强成像对于川崎病小鼠血管炎模型中血管壁炎性病灶的显示,尾静脉注射对比剂后[0.3 mmol/kg于磷酸盐缓冲液(phosphate buffered solution,PBS)中],在30 min时可见血管炎组主动脉根部管壁增厚且信号明显增强,而对照组血管壁仅呈中等增强;比较60 min时主动脉根部大血管的MPO-Gd及DTPA-Gd成像,可见MPO-Gd图像上病灶的增强程度较DTPA-Gd高6.9倍,可持续强化达90 min;而DTPA-Gd增强在60 min时即迅速降低,90 min时降至基线水平。Deleo等[27,28]基于Chen的方法,制作了MPO特异性磁共振对比剂di-5-hydroxytryptamide(0.1 mmol/kg,尾静脉注射),此对比剂应用在兔颈总动脉动脉瘤模型中,伴有活动性炎症的动脉瘤管壁的强化程度较不伴有活动性炎症的动脉瘤管壁强,且对比剂廓清慢。综上,MPO特异性对比剂增强成像可以敏感地发现血管壁中的炎性病灶,较常规对比剂敏感,有助于血管壁活动性炎症的准确诊断。
心肌梗死:心肌的缺血会伴随缺血组织内炎性细胞同步浸润,MPO大量聚集,造成心肌组织损伤。Nahrendorf等[29]阐述了MPO-Gd增强成像在心肌损伤评估及疗效示踪中的应用,连续MPO-Gd成像(0.3 mmol/kg,尾静脉注射)表明,损伤心肌内MPO的活性在冠脉结扎后第2天达到峰值,第8天降至基线水平。立普妥治疗心肌的缺血再灌注损伤,成像发现在再灌注开始后4 h,对照组同治疗组可见相同程度的信号增强;至24 h,对照组信号强度不变,而治疗组信号明显减低。因此,MPO-Gd增强成像可以非侵入性评估心肌的缺血损伤,并可实现心肌保护药物的疗效示踪。
脑中风:MPO是脑中风脑组织损伤中炎症的主要参与者,在缺血的脑组织中广泛存在,目前缺少合适的方法来准确评估此炎症。Breckwoldt等[30]比较了MPO-Gd(0.3 mmol/kg,尾静脉注射)及DTPA-Gd(0.3 mmol/kg,尾静脉注射)成像对于脑中风中炎症的显示效果,DTPA-Gd增强在45 min时开始减少,而MPO-Gd增强可持续至60 min,且DTPA-Gd强化程度只有MPO-Gd的87%;连续MPO-Gd增强图像对比噪声比(contrast to noise ratio,CNR)分析发现增强程度在梗死后3天达到峰值,至梗死后21 d,依然可以检测到增强灶,说明梗死之后组织的炎性破坏长期存在。脑梗死体积同MPO-Gd增强的CNR有很好的相关性,说明梗死体积越大,MPO含量越高,MPO-Gd增强程度也越强。因此,MPO-Gd增强成像可在分子水平阐述脑中风患者脑内病灶的炎性情况。
动脉粥样硬化斑块:MPO参与炎性动脉粥样硬化斑块的形成,降低斑块的稳定性,成为动脉粥样硬化新的治疗靶点。Ronald等[31]通过MPO-Gd(0.2 mmol/kg,尾静脉注射)增强成像显示了兔动脉粥样硬化斑块中的活动性炎症,MPO-Gd增强成像可见病变血管壁的局灶性增强,正常血管壁未见强化灶。MPO-Gd与DTPA-Gd对于病变血管壁的连续成像发现,在最初的20 min,两者增强水平相同;从30 min开始,MPO-Gd增强程度增高,并持续至增强后4 h。在MPO-Gd增强晚期,炎性病灶表现为病变血管壁内不规则的增强灶,但DTPA-Gd增强晚期未出现此强化灶。对比增强前和增强后2 h的图像,病变组MPO-Gd增强的CNR变化值(ΔCNR)较DTPA-Gd高出2倍;正常组两者之间的ΔCNR没有明显差异。因此,MPO-Gd成像为粥样硬化斑块中活动炎症的诊断提供了一种新思路。
肿瘤治疗:肿瘤干预中的炎性改变对肿瘤治疗的疗效具有重要意义,评估炎症对于肿瘤治疗的利弊一直是影像领域的难题。Kleijn等[32]利用MPO-Gd 成像(0.1 mmol/kg,尾静脉注射)对大鼠脑肿瘤病毒治疗模型中肿瘤组织与炎症区域的区分及两者的相互关系进行了探讨,在开始病毒治疗前,MPO-Gd成像肿瘤强化程度很低;在治疗后第1天,肿瘤的周边区域开始出现强化,一直持续至治疗后第7天;而DTPA-Gd增强表现为对比剂从肿瘤区域向正常脑组织的快速渗漏;长期追踪发现,MPO-Gd增强早期测得的肿瘤体积变化趋势与延迟期测得的MPO活性趋势相反。因此,MPO-Gd成像可以区分肿瘤及其周边炎性水肿,反映宿主对于病毒治疗的反应,推进了胶质瘤治疗的疗效评估。
MPO特异性光学探针及应用
1.光学探针
信号产生物质在活性MPO部位聚集并发出光学信号,借助光学成像设备实现荧光成像或生物发光成像便可评估MPO在体内的分布及活性情况。荧光成像主要依赖MPO特异性荧光探针在活性MPO部位聚集。生物发光成像主要借助可以同活性MPO反应的底物(如发光氨,luminol)而发光。底物在原始注射状态无信号,一旦为酶激活可在作用位点产生强烈的信号改变。
三是开展预算考评工作。预算体系是否能够起到作用还应该以具体的评价和考核为依据,根据绩效进行预算考评可以找出在预算体系建设中存在的不足,指导其进一步的改进工作。在考核中应该以业务完成的效率、达到的效果为主要指标,以达到进行财务内部控制的目的。
2.荧光探针的应用
MPO在参与炎症的过程中可以产生氧化性次氯酸(HOCL/OCL-)。Shepherd等[33]合成了一种可以同次氯酸选择性发生反应,进而反映MPO活性状态的荧光探针(sulfo naphtha amino-phenyl fluorescein,SNAPF)。在体外实验中,SNAPF分别同HOCL或PBS共培养,HOCL组荧光强度较PBS组高出7倍。在小鼠腹膜炎模型中(50 nmol,腹腔注射),腹膜炎组荧光信号增高了1.4倍,而对照组及对照对比剂组均未发现荧光信号增高。体外人动脉粥样硬化斑块病理标本中应用该探针可以检测到表达MPO的细胞产生的HOCL。因此,MPO为靶点的SNAPF荧光成像是一种非常有价值的、可以敏感显示组织中活动性炎症的分子成像方法。
3.生物荧光素酶探针的应用
在体急、慢性炎症:为了检测在体炎症状态下产生的MPO,Gross等[34]将MPO特异性发光氨注入皮炎小鼠体内(200 mg/kg,腹腔注射),发现皮炎组较对照组生物发光升高了13倍。另在小鼠急性关节炎模型中,关节炎组相对于PBS组和MPO-/-组,生物发光信号增加了25~30倍,48 h后达峰值,持续至注射后第5天。Zhang等[35]利用化学发光共振能量转移体系(chemiluminescence resonance energy transfer system,CRET)法,通过将发光氨产生的蓝光转化为穿透力更强的近红外光,在深部肺炎症模型中,检测到探针(发光氨40 mg/ml,125 ul;QD800,12.5 ul)发光强度较单独使用发光氨提高了37倍。Tseng等[36,37]进一步通过发光氨(100 mg/kg,腹腔注射)和光泽精(25 mg/kg,腹腔注射)生物发光成像对急、慢性炎症进行鉴别,在丙二醇甲醚醋酸酯(phorbol 12-myristate 13-acetate,PMA)诱导的皮炎模型中,在感染后3 h的急性期,发光氨检测的信号强度明显高于光泽精;第3~4天进入慢性期后,光泽精检测到的生物发光量逐渐上升;4个月后,光泽精检测到的发光强度远高于发光氨。因此,发光氨可用于急性炎症的显像,而光泽精适用于慢性炎症的显像。
肿瘤相关炎症:利用光学成像区分肿瘤与炎症得到了越来越广泛的应用。Gross等[34]在自发性大颗粒淋巴细胞白血病模型中,观察到MPO阳性显像区域与组织学中的炎症部位相一致,说明MPO特异性光学成像可以监测新生肿瘤。Zhang等[35]通过CRET探针有效检测到深度在1.2~6.8 mm的转移灶形成过程中的MPO活性,提示炎性细胞的浸润参与了肿瘤的发展过程。Tseng等[36]通过发光氨和光泽精成像进一步区分了抗肿瘤过继免疫治疗中的急慢性炎症反应,实现了免疫杀伤过程的光学成像监测。
MPO特异性核医学探针及应用
1.探针介绍
以MPO特异性的bis-5HT-DTPA为底物,链接以放射性核素,可合成MPO特异性核医学探针。分子核医学可以应用放射性核素示踪技术,直视活体内MPO的分布、密度与功能,进而从分子水平上认识炎症相关疾病,为疾病的准确诊断、有效治疗与基础研究提供有价值的信息。
Querol等[38]将MPO特异性的bis-5HT-DTPA链接以67Ga制成放射性对比剂(80~100 uCi,尾静脉注射),并示踪了炎症中的MPO,将含有MPO的基质胶包埋入小鼠体内,SPECT/CT成像发现基质胶较周围肌肉信号增强了2.7倍,6 h后生物分布实验证实大部分对比剂已被清除。Zhang等[39]同样利用MPO特异性的bis-5HT-DTPA标记以111In制成MPO特异性的核医学探针[13],通过SPECT/CT成像(100 uCi)显示了癫痫过程中脑内的炎性改变,且主要位于海马部位。
未来展望
发展分子影像技术的目的就是在分子水平实现生物有机体生理和病理变化的在体、实时、动态、无创三维成像,融合不同影像的双、多模态技术, 可实现不同影像设备的优势互补, 同时亦可减少假阳性和假阴性, 从而使获取的结果更为精确可靠。对以上探针的双、多模态融合将在疾病的治疗、诊断及监测等方面发挥更加重要的作用。
[1] Sager HB,Nahrendorf M.Inflammation:a trigger for acute coronary syndrome[J].Q J Nucl Med Mol Imaging,2016,60(3):185-193.
[2] Monach PA.Biomarkers in vasculitis[J].Curr Opin Rheumatol,2014,26(1):24-30.
[3] Jin R,Liu L,Zhang S,et al.Role of inflammation and its mediators in acute ischemic stroke[J].J Cardiovasc Transl Res,2013,6(5):834-851.
[4] Shalapour S,Karin M.Immunity,inflammation,and cancer:an eternal fight between good and evil[J].J Clin Invest,2015,125(9):3347-3355.
[5] Schapira AH.Recent developments in biomarkers in Parkinson disease[J].Curr Opin Neurol,2013,26(4):395-400.
[6] Cavedo E,Lista S,Khachaturian Z,et al.The road ahead to cure Alzheimer's disease:development of biological markers and neuroimaging methods for prevention trials across all stages and target populations[J].J Prev Alzheimers Dis,2014,1(3):181-202.
[7] Nagra RM,Becher B,Tourtellotte WW,et al.Immunohistochemical and genetic evidence of myeloperoxidase involvement in multiple sclerosis[J].J Neuroimmunol,1997,78(1):97-107.
[8] Mallucci G,Peruzzotti-Jametti L,Bernstock JD,et al.The role of immune cells,glia and neurons in white and gray matter pathology in multiple sclerosis[J].Prog Neurobiol,2015,127(5):1-22.
[9] Kato Y.Neutrophil myeloperoxidase and its substrates:formation of specific markers and reactive compounds during inflammation[J].J Clin Biochem Nutr,2016,58(2):99-104.
[10] Soubhye J,Aldib I,Delporte C,et al.Myeloperoxidase as a target for treatment of inflammatory syndromes:mechanisms and structure activity relationships of inhibitors[J].Curr Med Chem,2016,23(35):3975-4008.
[11] Heinecke JW.Pathways for oxidation of low density lipoprotein by myeloperoxidase:tyrosyl radical,reactive aldehydes,hypochlorous acid and molecular chlorine[J].Biofactors,1997,6(2):145-155.
[12] Querol M,Chen JW,Bogdanov AA.A paramagnetic contrast agent with myeloperoxidase-sensing properties[J].Org Biomol Chem,2006,4(10):1887-1895.
[13] Chen JW,Querol Sans M,Bogdanov A,et al.Imaging of myeloperoxidase in mice by using novel amplifiable paramagnetic substrates[J].Radiology,2006,240(2):473-481.
[14] Bogdanov A Jr,Matuszewski L,Bremer C,et al.Oligomerization of paramagnetic substrates result in signal amplification and can be used for MR imaging of molecular targets[J].Mol Imaging,2002,1(1):16-23.
[15] Michon T,Chenu M,Kellershon N,et al.Horseradish peroxidase oxidation of tyrosine-containing peptides and their subsequent polymerization:a kinetic study[J].Biochemistry,1997,36(28):8504-8513.
[16] Tien M.Myeloperoxidase-catalyzed oxidation of tyrosine[J].Arch Biochem Biophys,1999,367(1):61-66.
[17] Chen JW,Pham W,Weissleder R,et al.Human myeloperoxidase:a potential target for molecular MR imaging in atherosclerosis[J].Magn Reson Med,2004,52(5):1021-1028.
[18] Querol M,Chen JW,Weissleder R,et al.DTPA-bisamide-based MR sensor agents for peroxidase imaging[J].Org Lett,2005,7(9):1719-1722.
[19] Heuther G,Reimer A,Schmidt F,et al.Oxidation of the indole nucleus of 5-hydroxytryptamine and formation of dimers in the presence of peroxidase and H2O2[J].J Neural Transm Suppl,1990,32(3):249-257.
[20] Heinecke JW,Li W,Francis GA,et al.Tyrosyl radical generated by myeloperoxidase catalyzes the oxidative cross-linking of proteins[J].J Clin Invest,1993,91(6):2866-2872.
[21] Gray E,Thomas TL,Betmouni S,et al.Elevated myeloperoxidase activity in white matter in multiple sclerosis[J].Neurosci Lett,2008,444(2):195-198.
[22] Gray E,Thomas TL,Betmouni S,et al.Elevated activity and microglial expression of myeloperoxidase in demyelinated cerebral cortex in multiple sclerosis[J].Brain Pathol,2008,18(1):86-95.
[23] Chen JW,Breckwoldt MO,Aikawa E,et al.Myeloperoxidase-targeted imaging of active inflammatory lesions in murine experimental autoimmune encephalomyelitis[J].Brain,2008,131(4):1123-1133.
[24] Pulli B,Bure L,Wojtkiewicz GR,et al.Multiple sclerosis:myeloperoxidase immunoradiology improves detection of acute and chronic disease in experimental model[J].Radiology,2015,275(2):480-489.
[25] Forghani R,Wojtkiewicz GR,Zhang Y,et al.Demyelinating diseases:myeloperoxidase as an imaging biomarker and therapeutic target[J].Radiology,2012,263(2):451-460.
[26] Su HS,Nahrendorf M,Panizzi P,et al.Vasculitis:molecular imaging by targeting the inflammatory enzyme myeloperoxidase[J].Radiology,2012,262(1):181-190.
[27] Deleo MJ,Gounis MJ,Hong B,et al.Carotid artery brain aneurysm model:in vivo molecular enzyme-specific MR imaging of active inflammation in a pilot study[J].Radiology,2009,252(3):696-703.
[28] Gounis MJ,Van Der Bom IM,Wakhloo AK,et al.MR imaging of myeloperoxidase activity in a model of the inflamed aneurysm wall[J].AJNR,2015,36(1):146-152.
[29] Nahrendorf M,Sosnovik D,Chen JW,et al.Activatable magnetic resonance imaging agent reports myeloperoxidase activity in healing infarcts and noninvasively detects the antiinflammatory effects of atorvastatin on ischemia-reperfusion injury[J].Circulation,2008,117(9):1153-1160.
[30] Breckwoldt MO,Chen JW,Stangenberg L,et al.Tracking the inflammatory response in stroke in vivo by sensing the enzyme myeloperoxidase[J].Proc Natl Acad Sci USA,2008,105(47):18584-18589.
[31] Ronald JA,Chen JW,Chen Y,et al.Enzyme-sensitive magnetic resonance imaging targeting myeloperoxidase identifies active inflammation in experimental rabbit atherosclerotic plaques[J].Circulation,2009,120(7):592-599.
[32] Kleijn A,Chen JW,Buhrman JS,et al.Distinguishing inflammation from tumor and peritumoral edema by myeloperoxidase magnetic resonance imaging[J].Clin Cancer Res,2011,17(13):4484-4493.
[33] Shepherd J,Hilderbrand SA,Waterman P,et al.A fluorescent probe for the detection of myeloperoxidase activity in atherosclerosis-associated macrophages[J].Chem Biol,2007,14(11):1221-1231.
[34] Gross S,Gammon ST,Moss BL,et al.Bioluminescence imaging of myeloperoxidase activity in vivo[J].Nat Med,2009,15(4):455-461.
[35] Zhang N,Francis KP,Prakash A,et al.Enhanced detection of myeloperoxidase activity in deep tissues through luminescent excitation of near-infrared nanoparticles[J].Nat Med,2013,19(4):500-505.
[36] Tseng JC,Kung AL.In vivo imaging of inflammatory phagocytes[J].Chem Biol,2012,19(9):1199-1209.
[37] Tseng JC,Kung AL.In vivo imaging method to distinguish acute and chronic inflammation[J].J Vis Exp,2013,16(78).DOI:10.3791/50690.
[38] Querol Sans M,Chen JW,Weissleder R,et al.Myeloperoxidase activity imaging using67Ga labeled substrate[J].Mol Imaging Biol,2005,7(6):403-410.
[39] Zhang Y,Seeburg DP,Pulli B,et al.Myeloperoxidase nuclear imaging for epileptogenesis[J].Radiology,2016,278(3):822-830.
R811.1
A
1000-0313(2017)09-0984-06
2016-05-03
2016-06-29)
250012 济南,山东大学齐鲁医院放射科(李安宁);200040 上海,复旦大学附属华山医院放射科(吴越、姚振威、冯晓源)
李安宁(1984-),女,山东招远人,博士,主治医师,主要从事中枢神经系统影像诊断工作。
姚振威,E-mail:aocnhnr@126.com
国家自然科学基金资助项目(81271633);山东大学齐鲁医院科研基金资助项目(2016QLQN26)
10.13609/j.cnki.1000-0313.2017.09.020