腹部影像助力从“基于人群”到更“个性化”的肿瘤诊疗决策
——对美国癌症联合委员会第8版癌症分期系统的影像学更新内容解读
2017-09-23黄子星张彤胡富碧魏毅宋彬
黄子星, 张彤, 胡富碧, 魏毅, 宋彬
·专稿·
腹部影像助力从“基于人群”到更“个性化”的肿瘤诊疗决策
——对美国癌症联合委员会第8版癌症分期系统的影像学更新内容解读
黄子星, 张彤, 胡富碧, 魏毅, 宋彬
AJCC; 肿瘤分期; 体层摄影术,X线计算机; 磁共振成像
1976年美国癌症联合委员会(American Joint Committee on Cancer,AJCC)发布了第1版的癌症分期系统,目的在于为肿瘤诊治和预后评估提供规范化的分期依据。40年来由AJCC所组成的不同专业背景专家审议团队通过对相关学术研究材料的评议,按6~8年的间期定期发布新版癌症分期系统,使之不断更新和完善。正如第7版癌症分期系统(2010年发布)在其序言中首句所述,癌症分期在与癌症抗争中扮演着关键角色。目前,AJCC癌症分期系统已成为临床医生和研究人员制定肿瘤诊疗规范及对患者预后评估最重要的参考标准。
随着人们对肿瘤的发病机制、分子病理特征、生物学行为、预后等方面的广泛研究以及各类新型抗癌治疗方法的深入探讨,AJCC第7版逐渐显露出其不足和缺陷,特别是如何在癌症分期系统中体现循证医学证据的质量等级和临床实践中临床医生对推荐意见正确、全面理解存在较大问题。因此,AJCC于2013年成立第8版癌症分期系统的循证医学与统计学核心专家组,首次建立AJCC证据等级量化标准。循证证据质量按照Ⅰ~Ⅳ级递减,且只有证据等级为Ⅰ~Ⅲ级的内容被纳入第8版癌症分期系统。目前,AJCC第8版癌症分期系统已经出版发行[1],并将于2018月1月1日正式在全球展开临床应用。
本文旨在通过归纳总结AJCC第8版癌症分期系统中腹部常见恶性肿瘤影像学评价方面所更新的内容,解读更新内容背后的科学理论与临床实践逻辑,探讨未来影像学在精准癌症分期方面的应用价值。
腹部常见恶性肿瘤分期系统更新解读
1.肝癌分期系统更新
第8版主要针对肝细胞癌(hepatocellular carcinoma,HCC)的T分期进行修订(表1),未对区域淋巴结(N)和远处转移(M)进行更新。T分期的修订使得肿瘤分期也有相应修订(表2),Ⅰ期分出了Ⅰa和Ⅰb;Ⅲ期取消了Ⅲc期。
影像学检查:增强CT 和增强MRI是肝癌最重要的影像学检查方法,扫描应包含平扫、动脉期、静脉期和延迟期。
影像学报告格式:①肝脏形态:是否有肝硬化;②门静脉高压:脾脏大小、腹水和静脉曲张情况;③肿瘤情况:原发肿瘤、数目、大小、部位(肝段)、肿瘤特征(强化、假包膜、T1同反相位、无钙化)、卫星灶数目等;④有无局部血管侵犯;⑤区域淋巴结:异常或可疑淋巴结(特别是肝门部、腹腔干周围及门静脉旁淋巴结);⑥远处转移。

表1 AJCC 第8版肝癌分期更新要点

表2 AJCC第8版肝癌预后分期
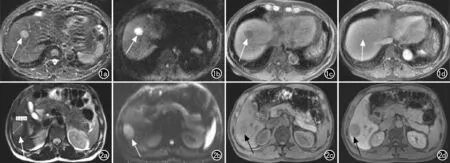
图1 T1a期HCC患者,肿瘤最长径1.5 cm,高分化,无血管侵犯。a) 脂肪抑制T2WI图像示肝右前叶上段结节状较高信号病灶(箭); b) DWI(b=800 s/mm2)示病灶呈高信号(箭); c) 脂肪抑制T1WI示病灶呈低信号(箭); d) 增强T1WI门静脉期示病灶廓清,周围见环状强化的假包膜(箭)。 图2 T1b期HCC患者,肿瘤最长径3.4 cm,镜下病理未见血管侵犯。a) 脂肪抑制T2WI示肝右后叶下段类圆形稍高信号病灶(箭); b) DWI(b=800 s/mm2)示病灶呈高信号(箭); c) 脂肪抑制T1WI示病灶呈较低信号(箭); d) 增强T1WI肝胆期病灶未见肝胆特异性对比剂摄取,病灶呈低信号(箭)。

图3 T2期HCC患者,肿瘤最长径6.0 cm,镜下病理见邻近血管侵犯。a) 脂肪抑制T2WI示肝右后叶下段类圆形不均匀高信号病灶(箭),与邻近血管分界不清; b) DWI(b=800 s/mm2)示病灶呈高信号(箭); c) 脂肪抑制T1WI示病灶呈较低信号(箭); d) 增强T1WI肝胆期病灶未见明显肝胆特异性对比剂摄取,病灶呈低信号(箭)。 图4 T3期HCC患者,肝内多发肿瘤,最大病灶最长径>5.0 cm。a) 脂肪抑制T2WI示多发病灶呈稍高信号(箭); b) DWI(b=800 s/mm2)示病灶呈高信号(箭); c) 脂肪抑制T1WI示病灶呈稍低信号(箭);d) 增强T1WI门静脉期示病灶呈低信号(箭)。 图5 T4期巨块型HCC患者。a) 脂肪抑制T2WI示病灶呈不均匀混杂信号(箭); b) 增强T1WI门静脉期示病灶呈低信号(箭),肿块侵犯门静脉主干和左右支,可见癌栓形成(箭头)。
2.胆道恶性肿瘤分期系统更新
AJCC第8版癌症分期系统继续沿用第7版胆道恶性肿瘤的分类,包括肝内胆管癌、胆囊癌、肝门部胆管癌、远端胆管癌和Vater壶腹癌。第8版更新主要是对T分期的细化以及N分期的重新定义,未对M分期进行修订。
肝内胆管癌:修订了T1、T2及T4期的定义(表3)。N分期和M分期标准不变。肿瘤分期方面也做了相应修订(表4)。
影像学检查:对于直径大于2 cm的肝内胆管癌及血管侵犯评估,增强CT 和增强MRI价值相当,但是MRI的MRCP检查可提供额外信息。
影像学报告格式:①肿瘤情况:大小(二维)、部位、形态、数目、相关的肝萎缩;②局部侵犯、邻近结构侵犯、血管侵犯;③区域淋巴结:异常或可疑淋巴结(特别有关的淋巴结组);④远处转移。
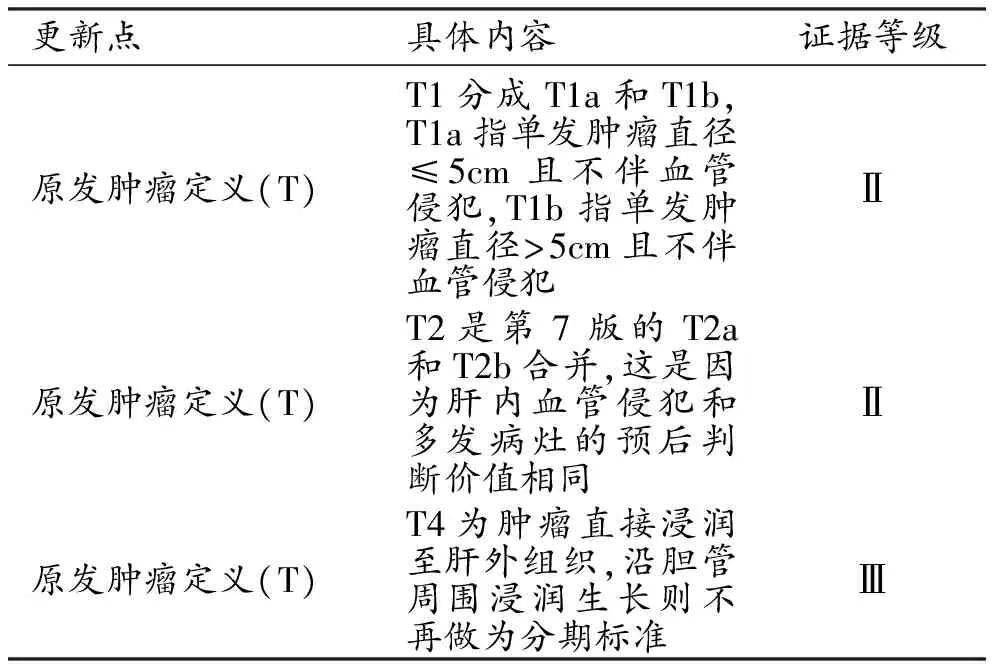
表3 AJCC 第8 版肝内胆管癌分期系统更新要点
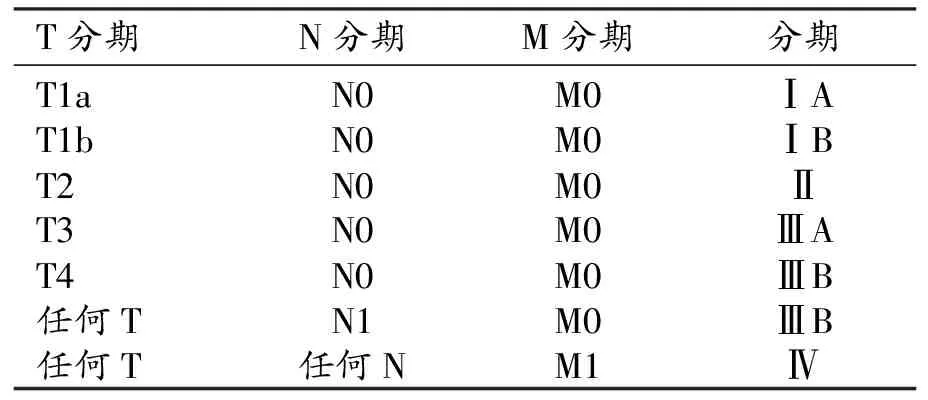
表4 AJCC第8版肝内胆管癌预后分期
肝门胆管癌:修订了Tis及T4期的定义(表5);全新定义了N分期,按淋巴结数目进行分期;M分期不变;肿瘤分期方面也做了相应修订(表5)。

表5 AJCC第8版肝门胆管癌分期更新要点
影像学检查:多普勒超声、CT和MRI都是常用检查,超声可以作为黄疸患者的首选检查。高质量的多排CT图像可提供胆管梗阻程度、血管侵犯、肝脏萎缩、淋巴结和远处转移信息。肝叶萎缩提示血管和/或胆管受累,也说明预期标准肝体积(standard liver volume,SLV)的显著减少,对术前评估有重要意义。
影像学报告格式:①肿瘤情况:大小(二维)、部位(近端肝总管、左右肝管汇合处、左肝管或右肝管)、形态(生长类型);②局部侵犯:肝段胆管受累、胆管变异、肝叶萎缩、血管侵犯;③区域淋巴结:异常或可疑淋巴结(肝门、胆囊管、肝外胆管、胰头、十二指肠近端、肝动脉、门静脉);④远处转移情况:肝内、腹膜、肺、脑、骨骼及其他区域;异常或可疑淋巴结(腹主动脉周围、腔静脉周围、肠系膜上血管、腹腔动脉)。
胆囊癌:T分期主要是对T2进行了细化(表6),其余T分期不变。N分期也是改为按转移淋巴结数目划分(表6)。肿瘤分期方面,将Ⅱ期分为ⅡA期和ⅡB期,T2a为ⅡA期,T2b为ⅡB期,因为肿瘤位于肝脏侧较位于腹腔侧预后更差,其余分期未变。
影像学检查:超声是初诊胆囊癌最常用的检查方法,但是对于早期胆囊癌常常不能检出。对于进展期胆囊癌,超声可以提供胆管树和血管受侵的相关信息。多期增强CT和MRI是主要的分期检查方法。
影像学报告格式:①肿瘤情况:大小(二维)、形态、局部侵犯、邻近结构侵犯、血管侵犯;②区域淋巴结:异常或可疑淋巴结(胆囊管、胆总管、肝动脉、门静脉);③远处转移情况:转移灶以及异常或可疑淋巴结(腹主动脉周围、腔静脉周围、肠系膜上动脉、腹腔动脉)。

表6 AJCC第8版胆囊癌分期系统更新要点
远端胆管癌:AJCC第8版远端胆管癌分期修订较为彻底,基本上重新定义了全部T、N 分期标准(表7)。肿瘤分期也作出较大修订(表8)。
远端胆管癌、Vater壶腹癌及胰腺癌的影像学建议。
远端胆管癌、Vater壶腹癌及胰腺癌(胰头)病灶在同一区域,因此影像检查选择相同。多期增强薄层CT或MRI是首选检查方法,检查应在未进行任何干预(例如活组织检查、支架置入)前完成,以避免操作后继发胰腺炎干扰分期评估。至于选择CT还是MRI,根据当地医疗机构的设备情况、放射医师的专业知识(更擅长CT还是MRI)以及患者情况(对比剂过敏、肾功能不全)决定。
动态增强扫描应包括胰腺强化峰值期(胰腺实质期或动脉晚期)和肝脏强化峰值期(门静脉期),胰腺实质期提高了肿瘤相对于背景胰腺的显著性(无论起源是壶腹部、胰腺或是远端胆管),门静脉期可判断肿瘤的胰外侵犯程度、血管受累以及肝转移的可能性。薄层图像(2~3mm)对于判断血管受累和评估潜在的小的转移性病灶尤为重要。术前和术后复查都应该采用薄层扫描。

表7 AJCC第8版远端胆管癌分期更新要点
注:N/A代表没有证据等级

表8 AJCC第8版远端胆管癌预后分期
影像的TNM分期分类:应报告肿瘤与相关血管的关系,特别是肿瘤与动脉的关系,如肠系膜上动脉、腹腔动脉、脾动脉和肝动脉,如肿瘤向后延伸到腹膜后,则还应包括主动脉。此外,记录肿瘤与相关静脉的关系,包括门静脉、脾静脉、脾静脉汇合和肠系膜上静脉以及分支血管,如胃结肠干、第一空肠静脉和回肠分支。
肿瘤与血管的关系应使用公认的术语进行描述,如圆周受累程度,邻接为肿瘤与血管接触面≤180°,包围为肿瘤与血管接触面>180°。CT的多平面重组和MR多平面成像特别有助于显示肿瘤与相关血管的圆周关系。描述肿瘤与相邻结构如胃、脾、结肠、小肠和肾上腺的关系也很重要。淋巴结的评估存在困难,因为术前影像检查价值有限且不能检测微转移性病灶,不过对可疑淋巴结的定位具有意义。如果淋巴结短径>1 cm或形态异常(圆形,低密度或不均匀密度,不规则边缘,侵犯相邻的血管或结构),应怀疑转移。通常手术区域外淋巴结,如腹膜后、盆腔、空结肠系膜和回结肠系膜淋巴结也应进行评估和报告;转移最常见部位包括肝、腹膜和肺。增强CT或增强MRI对潜在转移的评估具有一定价值。
影像学报告格式:①原发性肿瘤:位置、大小、特征和对管道(胆总管和主胰管)的影响。注意是否存在疑似/重叠急性胰腺炎,可能会影响分期。慢性胰腺炎/自身免疫性胰腺炎可能表现出类似胰腺癌的改变。②局部范围:使用公认的术语(例如邻接和包围)描述相邻动脉结构(腹腔干、肠系膜上动脉、肝动脉、脾动脉以及主动脉)和静脉结构(门静脉、脾和肠系膜上静脉、下腔静脉)。还需观察肿瘤及肿瘤条索灶累及血管数量、血管是否直接被肿瘤累及或分开、血管变窄、血管栓塞、血管潜在的肿瘤累及长度、侧枝扩张、静脉曲张、分支血管的受累情况等。③相关的动脉变异:肝动脉变异特别重要,例如肝动脉起自肠系膜上动脉、副右肝动脉,弓形韧带综合征引起的腹腔干狭窄,腹腔干和肠系膜上动脉的动脉粥样硬化等,这些因素对于治疗计划亦具有重要意义。④淋巴结受累:淋巴结短径>1cm或形态异常(圆形,低密度或不均匀密度,不规则边缘,相邻的血管或结构受侵),应该怀疑有转移。通常手术区域外的淋巴结,如腹膜后、盆腔、空结肠系膜和回结肠系膜淋巴结也应进行评估和报告。⑤远处转移:肝、腹膜(有无腹水,腹水提示可能有腹膜转移)、肺和骨骼转移。
Vater壶腹癌:T、N 分期标准全部重新定义,T分期上进一步细化(表9)。T和N分期的全新定义使得肿瘤分期也做出相应修订(表10),ⅠA期为T1aN0M0,ⅠB期为T1b-2N0M0,ⅡA期为T3aN0M0,ⅡB期为T3bN0M0,出现N1为ⅢA期, T4或者N2为ⅢB期,出现M1为Ⅳ期。
3.胰腺癌分期系统更新
T分期方面不再以肿瘤是否局限于胰腺内进行分期,而以肿瘤的直径大小来划分,因为在临床实践中判断肿瘤是否累及胰腺外器官或组织非常困难,导致第7版的T2和T3的界定非常困难。肿瘤分期主要是在Ⅲ期的修改,N分期达到N2或T分期达到T4就是Ⅲ期。
4.胃癌分期系统更新

表9 AJCC第8版Vater 壶腹癌分期更新要点
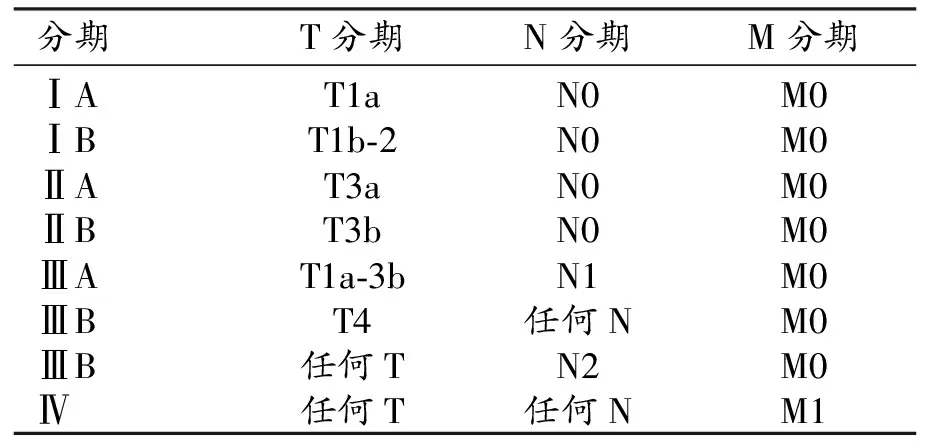
表10 AJCC第8版Vater壶腹癌预后分期
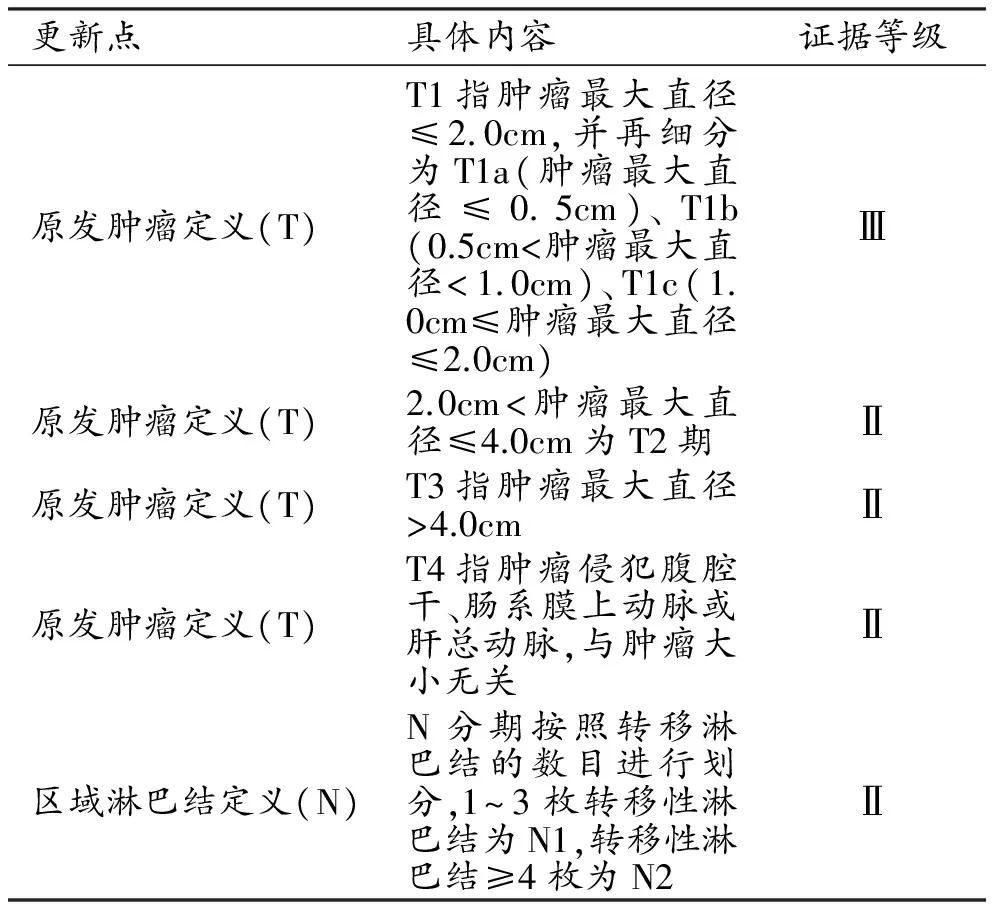
表11 AJCC第8版胰腺癌分期更新要点
第8版明显的变化就是首次提出了临床分期(cTNM)与新辅助治疗后病理分期(ypTNM)的概念,将过去单一分期系统改为临床分期、病理分期及新辅助治疗后病理分期相结合的综合分期系统,和影像密切相关的是临床分期。临床分期(表12)是基于治疗前疾病所呈现的严重程度的依据而来,包括体格检查、实验室检查、影像学、内镜(包括超声内镜和细针穿刺)及活检,还可能包括诊断性腹腔镜检查伴随腹腔灌洗液的细胞/组织学评估。临床分期不同于病理学分期,更适用于治疗前评价与初始治疗决策。
影像检查:超声内镜和口服对比剂的胸腹盆增强CT是确定临床分期(cT、cN、cM)的初始检查方法。18氟脱氧葡萄糖(18F-FDG) PET/CT和MRI可用于进一步明确局部进展期疾病的cN和cM分期。
临床T分期(cT):基于原发肿瘤的浸润深度,T1分为T1a(侵犯固有层或黏膜肌层)和T1b(侵犯粘膜下层)。T2为侵犯固有肌层,T3为侵犯浆膜下层结缔组织,但未累及相邻结构和浆膜(脏层腹膜)。T4分为T4a(肿瘤穿透浆膜层)和T4b(侵犯邻近结构/器官)。
临床N分期(cN):影像报告应记录肿大淋巴结(伴恶性特征)数目,而且在多学科讨论时重新阅片,以记录显现的恶性淋巴结的数目。由于同行评议文献中并没严格定义cN分期标准,所以目前需要综合评估异常淋巴结的大小、形态和数目以确定cN分期。
临床M分期(cM):影像学发现器官转移(包括腹膜)即为临床转移(cM1)。CT及MRI在判断腹膜小转移灶上存在局限,所以采用诊断性腹腔镜手术或腹腔灌洗液检查确定的腹膜转移也被判定为转移。
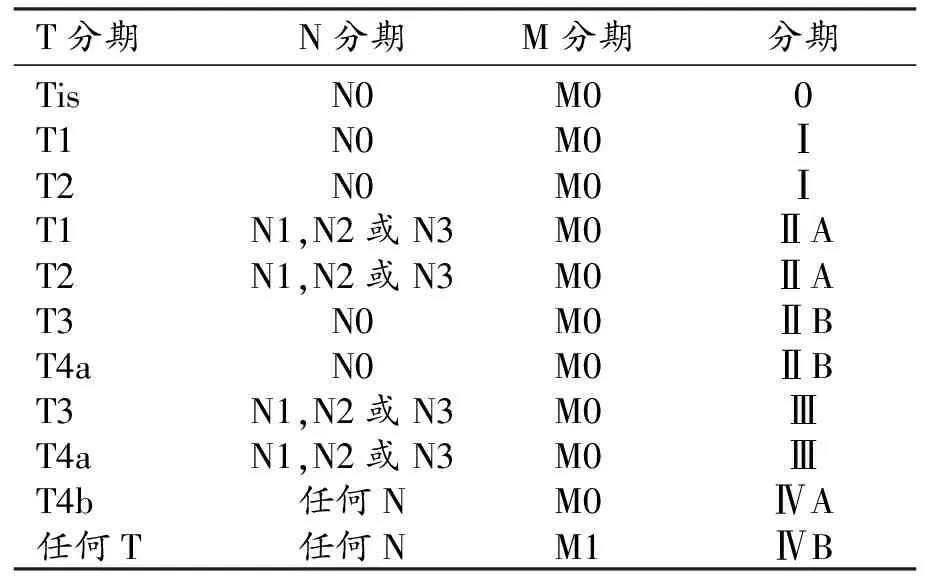
表12 AJCC第8版胃癌临床预后分期(cTNM)
针对胃食管结合部癌,第8版对胃癌分期系统的适用范围作了明确的定义,如果肿瘤侵及胃食管交界线且中心位于胃食管交界线以下2 cm的范围内,采用食管癌分期;如果肿瘤中心位于胃食管交界线以下2 cm以外的范围,采用胃癌分期;未侵及胃食管交界线的贲门癌采用胃癌分期。
5.结直肠癌系统更新
第8版针对区域淋巴结(N)和远处转移(M)的部分细节进行了修订,对于T分期并无更新。
N分期中,再次强调了肿瘤沉积(tumor deposit,TD),TD特指存在于原发肿瘤淋巴引流区域内(结肠系膜和直肠系膜的脂肪组织内)的孤立肿瘤结节,其内没有可辨认的淋巴结、血管、神经结构,多数TD源于血管淋巴管浸润。TD是一个较差的预后风险指标,即便是没有淋巴结转移的情况。TD不会改变原发肿瘤T分期,但如果不伴有区域淋巴结转移,就会导致N分期从N0变为N1c,如果合并有区域淋巴结转移,TD结节的数目无需计算到阳性淋巴结数目中。TD存在也意味着患者需要接受术后辅助化疗。
第8版进一步细化了M分期,M1a为转移灶局限在一个器官或部位,如果肺、卵巢这样分为左右两侧的器官内存在多发转移,也为M1a;M1b为超出一个器官或部位,但没有腹膜转移;M1c为存在腹膜转移,无论是否合并其他器官部位的转移。新增M1c分期的原因为伴有腹膜转移的结直肠癌患者的预后较M1a和M1b患者差。
新增M1c分期也使得TNM分期新增了ⅣC期,无论T和N,出现M1c即为ⅣC期。
6.肾癌
第8版除了T3a部分标准更新外其余内容较第7版没有变化,描述肾静脉侵犯方面删除了“肉眼上”用语,并且将“含肌层静脉”更改为“肾段静脉”。此外,T3a标准中增加了“或侵犯肾盂肾盏系统”内容。肿瘤侵犯肾静脉并不少见,但是在大体标本检查时肾静脉分支不能被肉眼识别,这种情况在部分肾切除标本中更加明显,显微镜下评价通常不会造成这种失误,因此,“肉眼上”在目前的pT3a分期标准中被删除。此外,肾周和肾窦脂肪受侵犯应该在显微镜下明确。肿瘤细胞侵犯至脂肪,有或无促结缔组织增生反应,以及肾周或肾窦软组织血管侵犯都是肾周/肾窦受侵犯的依据。
7.前列腺癌
第7版首次将血清前列腺特异抗原(prostate-specific antigen,PSA)水平和肿瘤分级(格里森评分)纳入前列腺癌TNM分期当中。为了更加符合临床的诊疗原则,第8版在延续此分期方法的基础上将格里森4+5、5+4或者5+5(格里森评分9~10分,组织分级为5级)和/或PSA>20 ng/mL的患者纳入到Ⅲ期(即使肿瘤局限于前列腺内)。第8版推荐将格里森评分与组织分级同时报告,并且均用于对前列腺癌的TNM分期中。此外,第7版根据病变的范围及单双侧采用了三层系统对前列腺癌病理分期的pT2期进行亚分类,即pT2a、pT2b和pT2c。然而,最新研究表明当肿瘤局限于前列腺内时,对肿瘤的预后均未形成明显的价值。因此,第8版将所有病理学上局限于器官内的前列腺癌均纳入pT2期,对于临床T2分期,仍保留了三层亚分类的形式。
8.膀胱癌
第8版在膀胱癌T分期上未做修订,而在第7版的基础上将膀胱周围淋巴结转移纳入到N1期。目前大量研究证实,对于仅发生膀胱癌淋巴结累及的转移性患者,其预后明显好于内脏或骨转移者。因此,将仅发生膀胱癌淋巴结累及的转移性患者(超过髂总淋巴结)归为M1a,而将所有其它转移者归为M1b。对于膀胱癌预后分期,将Ⅲ期再分为ⅢA和ⅢB,将Ⅳ期分为ⅣA和ⅣB。
展望
自AJCC第7版2010年问世以来,有关肿瘤生物学和分子肿瘤学的研究十分迅猛,新知识、新技术、新方法和新发现层出不穷,日新月异。一方面,人们对肿瘤的发病机制、分子病理特征、生物学行为、预后等方面的认识不断深入,另一方面,肿瘤治疗的理念和方法手段不断丰富,因此,尽管部分恶性肿瘤在部分地区和国家的发病率在增高,但是癌症总体病死率的下降是一个全球性的事件。
这种变化趋势,除了归功于肿瘤预防、高危人群筛查和肿瘤早期诊断之外,还和两大因素密切相关,一是AJCC所展示的基于解剖结构改变范围的癌症TNM精准分期的广泛临床应用,二是各类肿瘤分子标记物的发现与利用[2];前者可以更好地预测肿瘤的临床结局和评价在人群水平上某类肿瘤的分层治疗效果,而后者使得对同类肿瘤的分子特征分型成为可能,并由此预测该型肿瘤对某种治疗措施的反应,从而实现在患者个体水平的针对性治疗。正如AJCC第8版癌症分期系统序言中的首句所言,继续构建从“基于人群”到更“个性化”的桥梁[1],这将是未来癌症分期系统所追求的目标。
在从“基于人群”到更“个性化”的这一发展过程中,影像学发挥着举足轻重的桥梁作用。医学影像技术与设备的进步,使得我们可以获得更高分辨力和更高清晰度的形态学影像数据,对癌症局部解剖、侵犯深度和广度、淋巴结形态结构特点以及远处转移病灶的判断更加精准,是实现无创、活体和精准TNM分期的关键技术。更为重要的是,随着各种功能与代谢成像、分子影像和定量影像技术的蓬勃发展,采用纹理分析、影像组学、深度学习等技术手段,通过对影像大数据的深入挖掘,我们可以对肿瘤的发病机理、组织病理分级、分子病理特征(包括基因特性)、肿瘤异质性、生物学行为、临床预后等方面进行评估,包括对靶向治疗有效患者的筛选和疗效评价,极大拓宽了影像医学的广度和深度,为癌症精准分期奠定了重要基础[3,4]。影像学对肿瘤的综合检查,既可以获得实用的精准TNM分期,又可以揭示肿瘤的分子病理特征,寻找出那些具有预后价值、影响生存的分子生物标记物,进而划分分子亚型,实现对某类肿瘤的分层治疗[5]。因此,在肿瘤的精准TNM解剖分期基础上联合肿瘤的分子生物学信息,有望推动肿瘤分期向更加精准和更加个性化的方向发展。
个性化的诊疗是精准临床医学新模式的重要标志,而影像学是实现个性化诊疗的关键基础。影像学不但可提供解剖形态学信息,还能反映肿瘤的生物学信息和分子特征,并进行深度挖掘和分层分析,为肿瘤“个性化”诊疗提供重要依据,真正助力从“基于人群”到更“个性化”的肿瘤诊疗决策。精准医学,影像先行;影像医学,大有可为。
[1] Mahul BA,Stephen E,Frederick LG,et al.AJCC cancer staging manual[M].(8th ed)New York:Springer,2016.
[2] O'Connor JP,Aboagye EO,Adams JE,et al.Imaging biomarker roadmap for cancer studies[J].Nat Rev Clin Oncol,2017,14(3):169-186.
[3] O'Neill AC,Jagannathan JP,Ramaiya NH.Evolving cancer classification in the era of personalized medicine:a primer for radiologists[J].Korean J Radiol,2017,18(1):6-17.
[4] Mankoff DA,Farwell MD,Clark AS,et al.Making molecular imaging a clinical tool for precision oncology:a review[J].JAMA Oncol,2017,3(5):695-701.
[5] Aerts HJ.The potential of radiomic-based phenotyping in precision medicine:a review[J].JAMA Oncol,2016,2(12):1636-1642.
R445; R730.4; R730.7
A
1000-0313(2017)09-0890-07
2017-08-22)
610041 成都,四川大学华西医院放射科
黄子星(1982-),男,四川乐山人,硕士,主治医师,主要从事腹部影像诊断工作。
宋彬,E-mail:anicesong@vip.sina.com
10.13609/j.cnki.1000-0313.2017.09.001