树突状细胞联合细胞因子诱导杀伤细胞治疗术后恶性黑色素瘤的疗效分析
2017-09-22刘施佳谢云青龚福生陈路川魏晟宏应敏刚郑秋红
刘施佳, 谢云青, 龚福生, 陈路川, 魏晟宏, 应敏刚, 郑秋红
树突状细胞联合细胞因子诱导杀伤细胞治疗术后恶性黑色素瘤的疗效分析
刘施佳, 谢云青, 龚福生, 陈路川, 魏晟宏, 应敏刚, 郑秋红
目的探讨树突状细胞联合细胞因子诱导杀伤细胞(DC-CIK)在治疗术后恶性黑色素瘤(MM)的疗效以及安全性分析。方法收集经病理确诊的MM患者77例,分为治疗组37例和对照组40例。对照组进行单纯手术治疗,治疗组于手术后进行DC-CIK治疗。对2组患者进行生存随访,比较2组患者的生存期、免疫功能和生活质量改善情况,观察不良反应,并进行预后相关因素的单因素和多因素分析。结果治疗组和对照组的中位生存期分别为45和29月,治疗组的总生存期显著高于对照组(P=0.018);2组的无进展生存期差别无统计学意义(P=0.245)。治疗组患者的免疫功能和生活质量均得到显著改善,仅2例发生不良反应,且未达3/4级。是否有淋巴结转移(P=0.008)、是否进行DC-CIK治疗(P=0.02)以及治疗疗程数(P=0.031)是影响MM预后的独立预后因子。结论DC-CIK细胞免疫治疗可延长MM患者的生存期,提高其免疫功能,改善其生活质量,治疗过程安全性高,无明显副作用;治疗疗程多于4次时,疗效更好。
黑色素瘤; 树突细胞; 细胞因子类; 杀伤细胞
恶性黑色素瘤(malignant melanoma, MM)是一种来源于黑色素细胞的肿瘤,恶性度高,主要见于皮肤,发病率约占所有恶性肿瘤的1%~3%[1]。我国的MM发病率虽低于欧美国家,但近年有明显增长的趋势,年增长率为3%~5%,每年约有20 000新增病例[2]。MM早期(Ⅰ及Ⅱ期)或局部病变,手术切除可治愈,一旦发展至晚期(Ⅲ及Ⅳ期)且发生远处转移,则很难治愈,其中位生存期仅8~9月,3年生存率仅10%~15%,5年生存率不足10%[3-4]。临床上发现,MM细胞对放疗和化疗均不敏感,这也是MM致死率高、预后差的主要原因。多项研究表明,MM细胞具有较强的免疫原性,对免疫治疗较为敏感,尤其是国内外关于PD-1及PD-L1的研究成果及临床试验已充分证明,免疫治疗是提高MM治疗疗效最有希望的方式[5-7]。
随着肿瘤免疫学及细胞生物学等学科的发展,树突状细胞(dendritic cells, DC)与细胞因子诱导的杀伤细胞(cytokine-induced killer, CIK)联合介导的过继免疫细胞治疗可清除循环肿瘤细胞及微小转移灶,降低肿瘤的转移复发率,延长患者的生存时间,并提高其生活质量,同时具有安全性高、无明显毒副反应等特点[8],正逐渐成为继手术、放疗和化疗后的第4种重要辅助疗法。2004年5月-2013年5月,笔者医院收治的手术联合DC-CIK细胞免疫治疗的MM患者共37例,现回顾性分析其临床资料,并探讨手术联合DC-CIK细胞免疫治疗MM的有效性及安全性,报道如下。
1 对象与方法
1.1 对象 MM患者37例(治疗组),男性25例,女性12例,年龄中位数57岁(48~74岁);黏膜MM 14例,皮肤MM 23例;区域淋巴结转移17例,远处转移7例;37例均于术后接受DC-CIK细胞回输治疗。对照组为同期收治的单纯行手术治疗的MM患者40例,男性27例,女性13例,年龄中位数56岁(46~73岁);黏膜MM 15例,皮肤MM 25例;区域淋巴结转移19例,远处转移6例。2组严格按照病情、年龄进行1∶1匹配,不同病情的患者所占比例差别无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核同意,患者或家属均知情并签署同意书。
纳入标准:(1)经病理组织学或细胞学确诊;(2)Kamofsky评分≥70分;(3)预计能完成DC-CIK治疗2个疗程以上或生存期至少>8周,未接受其他抗肿瘤方法治疗;(4)心、肝、肾等脏器功能无明显异常。
1.2 方法
1.2.1 主要试剂及仪器 淋巴细胞分离液(Ficoll-PagueTMPremium,美国GE Healthcare公司);抗人CD3单克隆抗体及GT-T551培养基(北京宝日医生物技术有限公司);γ-干扰素(interferon-γ, IFN-γ)和肿瘤坏死因子α(tumor necrosis factors α, TNF-α)(上海Novoprotein公司);重组人白细胞介素2(recombinant human interleukin-2, rhIL-2)(北京四环生物制药有限公司);注射用重组人粒细胞巨噬细胞集落刺激因子(recombinant human granulocyte/macrophage colonystimulating factor for injection,rhGM-CSF)及rhIL-4(厦门特宝生物工程有限公司);流式细胞仪(FC500)及流式细胞术所用抗体CD45-PC7,CD3-FITC/CD(16+56)-PE,CD86-PE,CD83-PE,HLA-DR-ECD,CD80-FITC,CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5(美国Beckman公司)。
1.2.2 治疗方法 治疗组接受手术治疗后15 d进行DC-CIK细胞回输,连续4次为1个疗程,共2~13个疗程。对照组按照《中国黑色素瘤诊疗指南》规定的治疗原则行手术治疗。
1.2.3 DC-CIK细胞的制备 参照文献[9]的方法,抽取患者新鲜外周全血100 mL,用肝素抗凝后,经淋巴分离液梯度离心,取单个核细胞,用RPMI 1640培养液悬浮细胞,离心洗涤细胞3次后,将细胞接种于培养瓶中,置37 ℃、体积分数为0.05的CO2培养箱孵育120 min,贴壁细胞中加入含75 ng/mL的GM-CSF和50 ng/mL的rhIL-4的GT-T551培养基,每3天换液1次,第4天按40 μg/mL加入自体肿瘤组织冻融抗原,第5天加入50 ng/mL的TNF-α,第7天将抗原负载成熟后的DC,计数细胞,取部分细胞进行流式细胞表型分析,其他细胞用生理盐水制备成1 mL的DC悬液(细胞数≥107)(DC+0.5%人血白蛋白),给患者腹股沟淋巴结周围区皮下注射。收集非贴壁细胞,移入经50 μg/mL的CD3单抗包被过的75 cm2培养瓶中,用GT-T551培养基调整细胞密度为1×106mL-1,加入1 000 U/mL的IFN-γ及rhIL-2,每3天补液1次(GT-T551培养基),同时补加500 U/mL的rhIL-2。分别于培养的第10及12天收集CIK细胞,计数细胞,取部分细胞进行流式细胞表型分析,其他细胞置于200 mL含0.5%人血白蛋白的生理盐水中,回输给患者。针对每次回输的DC及CIK细胞,回输前对细胞培养液取样进行细菌、真菌、支原体及内毒素检测,均为阴性。每个疗程CIK细胞数不低于1.0×1010。
1.2.4 DC-CIK细胞流式细胞仪表型检测及患者外周血免疫功能评价 (1)DC细胞表型检测:CD86+,HLA-DR+,CD80+,CD83+检测DC成熟度。(2)CIK细胞表型检测:CD3+CD4+,CD3+CD8+检测T细胞亚群比例;CD3-CD(16+56)+检测NK细胞比例;CD3+CD(16+56)+检测NKT细胞比例。(3)患者外周血免疫功能评价:通过检测外周血单核细胞的T淋巴细胞亚群来评价免疫功能,包括CD3+,CD3+CD4+,CD3+CD8+,CD4+/CD8+和CD3-CD(16+56)+的变化,细胞回输前及治疗结束后10 d,用流式细胞仪检测患者外周血中上述指标。
1.2.5 疗效观察 疗效观察指标:(1)治疗组接受细胞免疫治疗前后外周血免疫功能指标的变化。(2)治疗期间详细观察患者症状、体征变化,于治疗前、后分别检测患者外周血白细胞、肝功能及肾功能。(3)每隔3月复查胸部CT、腹部B超和CT,了解有无复发转移,密切观察是否出现各种不良反应,并记录发生时间、表现及转归。不良反应按照美国国立癌症研究所制定的毒性评价标准NCI(急性和亚急性毒性反应的表现和分度标准)进行评估分级。
生活质量改善评定标准:显效为KPS评分提高≥20分;有效为KPS评分提高≥10分;无效为KPS评分提高<10分或不变甚至减低。治疗结束后1月评价有效率,同时密切观察2组患者治疗前后的食欲、睡眠及精神状况。
有效率(%)=[(显效病例+有效病例)/全部病例]×100%
1.2.6 随访 全部病例均进行随访观察,采用复查、信件或电话等方法进行随访,内容包括生存情况及不良反应等。随访截止日期2016年5月,随访时间为9~112月。以无进展生存期(progression free survival, PFS)和总生存期(overall survival, OS)作为观察指标。PFS指从开始手术治疗到肿瘤进展或死亡的时间;OS指从开始手术治疗到死亡的时间或随访截止时间。
1.3 统计学处理 采用SPSS 22.0软件进行统计学分析,生存分析采用Kaplan-Meier 法并行Log-rank检验,率检验采用χ2检验,2组均数的比较采用t检验。将单因素分析有意义的因素引入COX比例风险模型进行多因素分析。P<0.05为差别有统计学意义。
2 结 果
2.1 抗原负载前后DC形态及培养后DC-CIK细胞表型流式检测结果 DC培养至第3天,DC表面可见触角样突起(图1A);培养至第5天,加入自体MM抗原后,可见DC因捕获吞噬抗原颜色加深体积增大,触角样突起增多(图1B)。将培养3 d的DC进行流式检测成熟度指标,CD86,HLA-DR,CD83及CD80表达量低(图1C);培养7 d后,CD86,HLA-DR,CD83及CD80表达量>90%(图1D)。DC-CIK细胞混合培养第10天对CIK细胞进行流式检测,较外周血单核细胞中CD3+CD4+细胞减少,CD3+CD8+及CD3+CD(16+56)+效应细胞大量增加(图1E,表1)。

表1 DC-CIK细胞表型分析结果
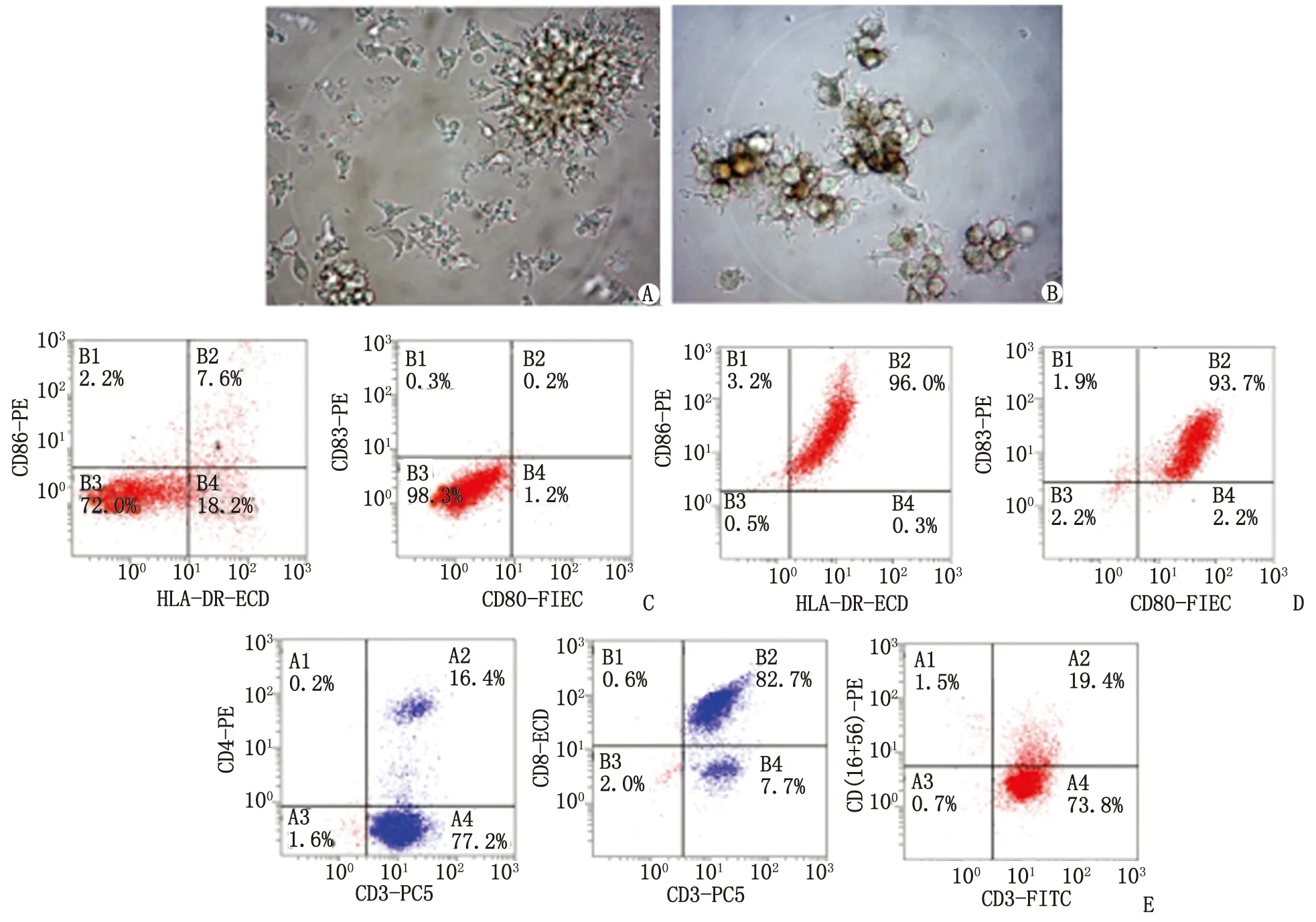
A:显微镜下未成熟DC形态( ×400);B:负载抗原后DC捕获抗原( ×400);C:未成熟DC流式检测结果;D:成熟DC流式检测结果;E:培养后CIK细胞流式检测结果.图1 抗原负载前后DC形态及培养后DC-CIK细胞表型流式检测结果Fig 1 DC morphology and the flow cytometry result of DC-CIK cell phenotype
2.2 治疗组和对照组的OS和PFS比较 治疗组死亡19例;对照组死亡34例。治疗组的中位生存时间为45月,优于对照组的29月。Kaplan-Meier生存曲线和Log-rank test检验结果表明,2组患者的OS比较,差别有统计学意义(χ2=5.639,P=0.018,图2A)。治疗组和对照组的中位PFS分别为18及16月。Kaplan-Meier生存曲线和Log-rank test检验结果表明,2组差别无统计学意义(χ2=1.351,P=0.245,图2B)。
2.3 治疗组治疗后免疫功能变化 经DC-CIK细胞免疫治疗后,治疗组患者外周血单核细胞中CD3+CD4+双阳性细胞比例及CD4+/CD8+比值较治疗前提高,CD3+细胞和CD3+CD8+双阳性细胞比例较治疗前显著提高(表2)。
2.4 MM的独立预后因素 将可能影响预后的各因素进行单因素分析,结果显示:是否进行DC-CIK治疗(χ2=5.639,P=0.018)、DC-CIK治疗疗程数(χ2=5.397,P=0.02)以及是否有淋巴结转移(χ2=7.445,P=0.006)是MM的预后影响因素;性别、年龄及原发部位对预后无影响(P>0.05,表3)。将单因素分析中对预后有影响的因素,是否进行DC-CIK治疗、DC-CIK治疗疗程数以及是否有淋巴结转移纳入COX比例风险模型进行多因素分析,结果表明:是否进行DC-CIK治疗、DC-CIK治疗疗程数以及有无淋巴结转移是影响MM预后的独立因素(P<0.05,表4)。
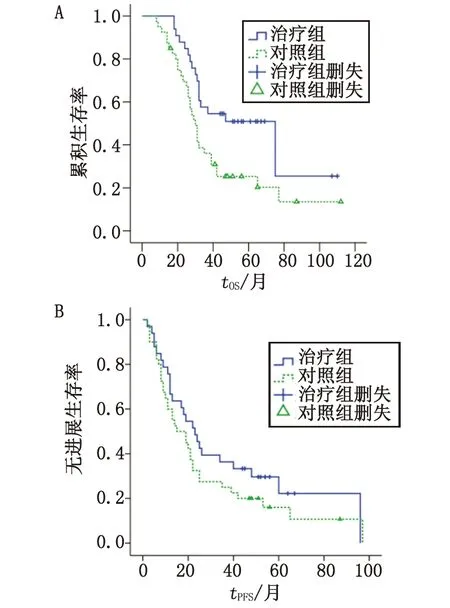
OS:总生存期; PFS:无进展生存期.图2 治疗组与对照组总生存期及无进展生存期曲线Fig 2 The survival or progression free survival curves of the treatment group and the control group
表2DC-CIK细胞免疫治疗前后患者T细胞亚群变化
Tab2Changes of T cell subsets before and after the treatment with DC-CIK cells
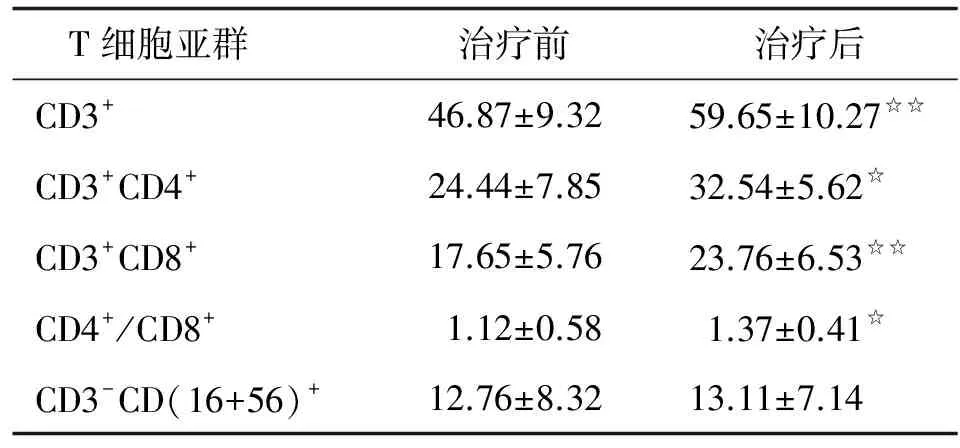
T细胞亚群治疗前治疗后CD3+46.87±9.3259.65±10.27☆☆CD3+CD4+24.44±7.8532.54±5.62☆CD3+CD8+17.65±5.7623.76±6.53☆☆CD4+/CD8+1.12±0.581.37±0.41☆CD3-CD(16+56)+12.76±8.3213.11±7.14
表中数据除CD4+/CD8+为比值外其余均为%. 与治疗前比较,☆:P<0.05,☆☆:P<0.01.
表3恶性黑色素瘤患者临床预后因素的单因素分析
Tab3Univariate analysis of clinical prognostic factors in patients with malignant
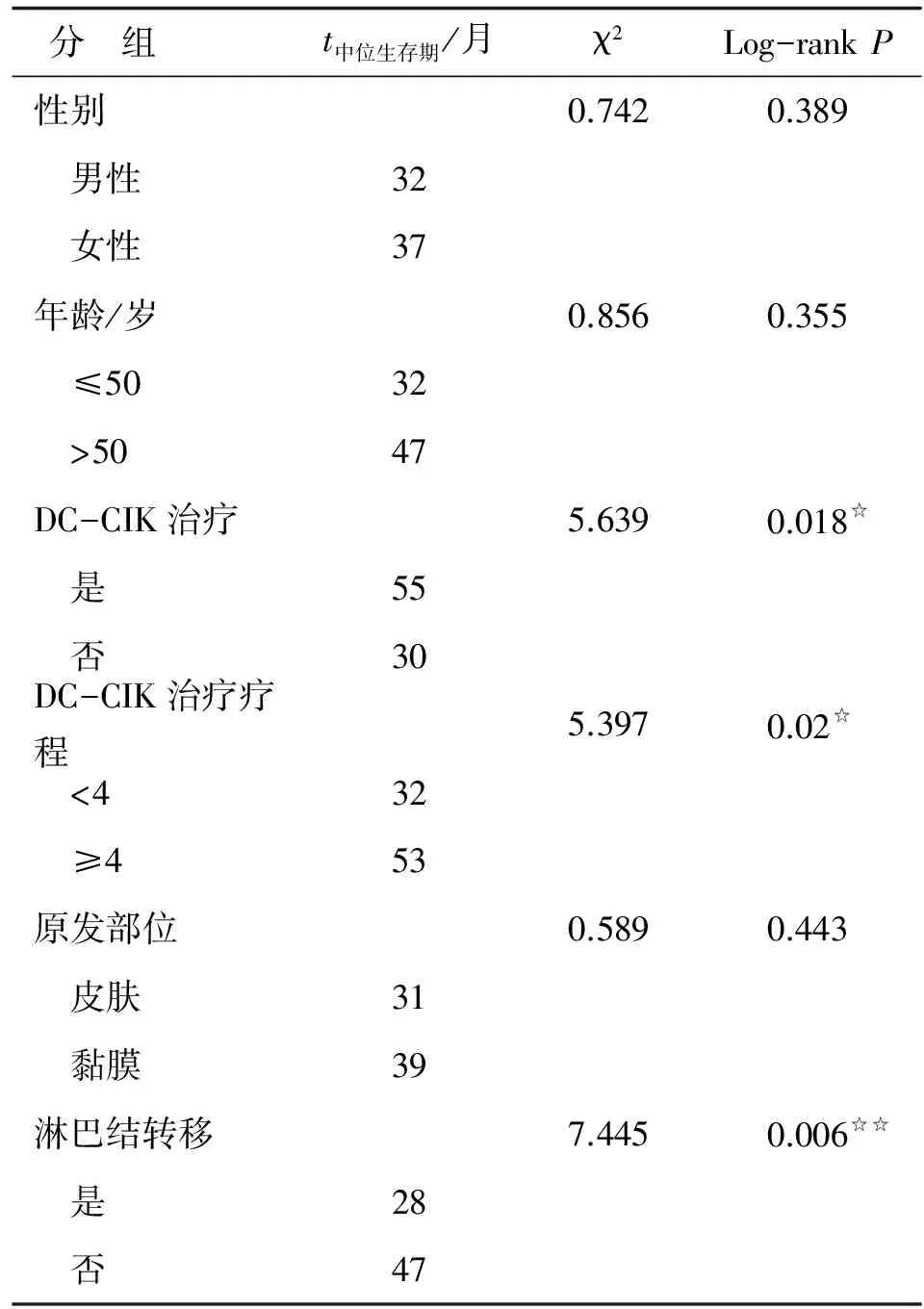
分 组t中位生存期/月χ2Log-rankP性别0.7420.389 男性32 女性37年龄/岁0.8560.355 ≤5032 >5047DC-CIK治疗5.6390.018☆ 是55 否30DC-CIK治疗疗程5.3970.02☆ <432 ≥453原发部位0.5890.443 皮肤31 黏膜39淋巴结转移7.4450.006☆☆ 是28 否47
☆:P<0.05,☆☆:P<0.01.
2.5 治疗后生活质量改善情况 对照组及治疗组治疗后生活质量的改善有效率分别为57.5%及78.4%,2组比较差别有统计学意义(P<0.01,表5),且治疗组治疗后自我感觉良好,体力增强,睡眠质量和食欲均有显著改善。
2.6 DC-CIK治疗的不良反应 接受DC-CIK治疗的患者中,仅2例在细胞回输后出现发热和畏寒,24 h内自行或经对症处理后恢复正常,不良反应未达3/4级。

表4 恶性黑色素瘤患者临床预后因素的多因素分析
表52组患者治疗前后生活质量改善情况
Tab5Comparison of quality of life before and after the treatment
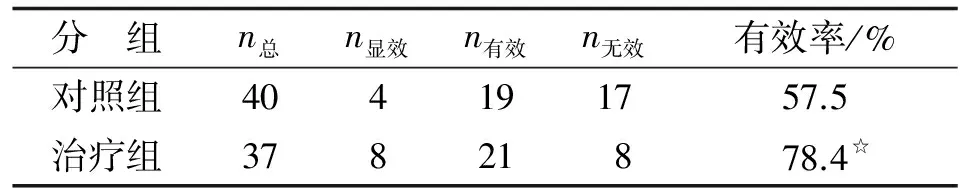
分 组n总n显效n有效n无效有效率/%对照组404191757.5治疗组37821878.4☆
与对照组比较,☆:P<0.01.
3 讨 论
MM是一种恶性程度较高的肿瘤,常发生广泛转移。对于早期还未发生淋巴结转移的患者,手术切除原发灶或行原发灶扩大切除术可治愈部分患者。而对于已发生淋巴结转移的早期患者或已发生远处转移的中晚期患者,治疗上应以手术为主,辅以其他相关治疗,但临床数据显示,因MM对放疗及化疗的敏感性差,临床治疗难度大,有效率低[10-11]。由于MM发生转移早,真正早期发现无转移或微转移的患者较少。因此,寻求各种治疗方法以延长MM患者的生存期是治疗的关键。
DC是目前已知的人体内抗原加工和提呈功能最强的细胞,能够在机体内激发T细胞应答,在肿瘤特异性免疫中发挥主导作用,处于免疫应答的中心环节[12]。CIK细胞是人外周血单个核细胞在体外经过多种细胞因子共同刺激后,诱导培养获得的一群异质细胞,其中CD3+CD8+及CD3+CD56+双阳性细胞是CIK细胞中的主要效应细胞,兼有T淋巴细胞强大的抗瘤活性与NK细胞的非MHC的限制性杀瘤优点。肿瘤组织裂解总蛋白中包含丰富的MHC抗原表位成分,经过DC细胞的摄取、加工和提呈后,可诱导产生针对该抗原的特异性细胞毒性T淋巴细胞,从而发挥特异性的抗肿瘤作用。抗原负载后的DC在体外制成DC疫苗,经皮内、皮下或静脉输入机体,目前已被试用于MM及前列腺癌等多种肿瘤的临床治疗[13-14]。王忠成等认为,抗原负载的DC-CIK和DC有明显的抗肿瘤作用[15]。
本研究使用MM组织裂解总蛋白负载DC制备瘤苗,通过皮下注射和共培养DC-CIK以保证CIK细胞的特异性杀伤作用。在治疗时机上,选择在手术切除原发灶后进行DC-CIK细胞回输,减小肿瘤负荷后,最大限度地发挥DC-CIK细胞清除术后体内残存的肿瘤细胞和微小病灶,延长生存期,降低肿瘤转移和复发的作用。结果显示,对照组和治疗组的3年生存率分别为35%及57.6%,5年生存率分别为12.5%及27.3%,中位OS分别为29及45月。虽治疗组的PFS未见明显改善,但其OS较对照组显著延长,免疫功能和生活质量显著提高,且仅2例患者在回输后出现发热和畏寒,不良反应未达到3/4级,证明DC-CIK细胞治疗可显著延长MM患者的生存时间,且治疗过程安全性高,无明显副作用。
单因素分析结果显示,是否有淋巴结转移、是否进行DC-CIK治疗以及治疗的疗程数是影响细胞治疗疗效和患者预后的影响因素。多因素COX回归分析提示,是否有淋巴结转移、是否进行DC-CIK治疗以及治疗疗程数是独立预后因子。说明进行DC-CIK治疗不仅可以延长MM患者的生存期,随着治疗疗程的增加,还可以获得更加良好的预后。文献报道,影响患者预后的因素还包括肿瘤大小、浸润深度及肿瘤分期等[16]。但由于本研究中,不同发病部位的MM无明确统一的分期标准,所以对MM的预后因素分析还不够全面,笔者将在今后的研究中进一步扩大样本量,以期得到更全面的数据分析。
目前,美国FDA已批准上市阻断PD-1细胞通路的的药物Keytruda(药品名:Pembrolizumab,德国默克公司),用于治疗晚期MM,被誉为治疗MM的“超级对症药”,该药可将约15%的晚期MM患者的5年生存率提高到35.3%。在一项大型随机临床试验KEYNOTE-001(NCT01295827)中,Pembrolizumab在655位晚期MM患者中,客观反应率达33%,2年生存率达49%,14%的患者发生了治疗相关的3/4级不良事件,9%的患者发生了严重不良反应事件[17]。由于PD-1抗体药物在提高客观有效率以及延长患者的总生存时间上的优异表现,已被纳入治疗晚期MM的一线药物名单。然而,PD-1抗体药物的副作用和高昂的费用也不容忽视。目前我国大陆地区还未引进此类PD-1抗体药物,而DC-CIK细胞治疗在长达十几年的临床使用中,在延长患者的生存期、提高患者生活质量、治疗安全无明显副作用以及治疗费用等方面均表现突出,不失为一种安全成熟、可操作性较高、患者愿意接受的有效辅助治疗手段。
[1] 杨 华, 郑 勤. 恶性黑色素瘤的免疫治疗现状与进展[J]. 现代肿瘤医学, 2011,19(11):2341-2345.
[2] CSCO Melanoma Committee.MelanomadiagnosisandtreatmentguidelinesofChina[M]. Version 2013. Beijing: People’s Medical Publishing House, 2013:17-18.
[3] Balch C M, Gershenwald J E, Soong S J,etal. Final version of 2009 AJCC melanoma staging and classification[J].JClinOncol, 2009,27(36):6199-6206.
[4] Jang S, Atkins M B. Treatment of BRAF-mutant melanoma: the role of vemurafenib and other therapies[J].ClinPharmacolTher, 2014,95(1):24-31.
[5] Hodi F S, Hwu W J, Kefford R,etal. Evaluation of immune-related response criteria and RECISTv1.1 in patients with advanced melanoma treated with pembrolizumab[J].JClinOncol, 2016,34(13):1510-1517.
[6] Jacquelot N, Roberti M P, Enot D P,etal. Immunophenotyping of stage Ⅲ melanoma reveals parameters associated with patient prognosis[J].JInvestDermatol, 2016,36(5):994-1001.
[7] Hamid O, Robert C, Daud A,etal. Safetyandtumorresponseswithlambrolizumab(anti-PD-1) inmelanoma[J].NEnglJMed, 2013,369(2):134-144.
[8] 刘艳华, 孙三元, 孙 丽, 等. DC-CIK治疗晚期恶性肿瘤的研究[J]. 医药信息, 2014,12(5):225.
[9] 应敏刚, 魏植强, 杨建伟, 等. 结直肠癌术后放化疗联合DC-CIK的疗效分析[J]. 实用癌症杂志, 2010,3(25):274-277.
[10] 王园园, 王义善, 王 鑫, 等. PI3K/Akt信号通路与恶性黑色素瘤浸润转移的研究进展[J]. 实用医学杂志, 2012,26(2):322-323.
[11] 李 海, 郑晓娟. 恶性黑色素瘤21例临床病理分析[J]. 现代中西医结合杂志, 2012,21(3):272-273.
[12] Anguille S, Smits E L, Lion E,etal. Clinical use of dendritic cells for cancer therapy[J].LancetOncol, 2014,15(7):257-267.
[13] Bloy N, Pol J, Aranda F,etal. Trial watch: dendritic cell-based anticancer therapy[J].Oncoimmunology, 2014,3(11):e963424.
[14] Makkouk A, Weiner G J. Cancer immunotherapy and breaking immune tolerance: new approaches to an old challenge[J].CancerRes, 2015,75(1):5-10.
[15] 王忠成, 王 钰. 抗原负载的DC与DC-CIK 抗肿瘤作用的比较分析[J]. 解剖科学进展, 2011,17(4):335-338.
[16] Scheri R P, Essner R, Turner R R,etal. Isolated tumor cells in the sentinel node affect long-term prognosis of patients with melanoma[J].AnnSurgOncol, 2007,14(10):2861-2866.
[17] Ribas A, Hamid O, Daud A,etal. Association of pembrolizumab with tumor response and survival among patients with advanced melanoma[J].JAMA, 2016,315(15):1600-1609.
(编辑:何佳凤)
Efficacy of Dendritic and Cytokine-Induced Killer Cells on Postoperative Patients with Malignant Melanoma
LIU Shijia, XIE Yunqing, GONG Fusheng, CHEN Luchuan, WEI Shenhong, YING Mingang, ZHENG Qiuhong
Fujian Provincial Key Laboratory of Tumor Biotherapy, Fujian Provincial Tumor Hospital, Teaching Hospital of Fujian Medical University, Fuzhou350014, China
Objective To observe the efficacy and safety of the application of dendritic and cytokine-induced killer (DC-CIK) cells on postoperative patients with malignant melanoma. Methods A total of 77 patients with malignant melanoma were recruited from May 2004 to May 2013. DC-CIK therapy was given to 37 patients after surgery in the treatment group, whereas the other 40 patients in the control group only
surgical treatment. Follow-up was conducted for the patients in the two groups. Overall survival (OS), progression free survival (PFS), immunologic function, Karnofsky performance status (KPS), and adverse reactions were compared. Univariate and multivariate analysis of survival were also carried out. Results The median OS was 45 months in the DC-CIK group and 29 months in the control group. The OS in the DC-CIK group was higher than that in the control group (P=0.018), while there was no significant difference in PFS between the two groups (P=0.245). However the immune function and quality of life were significantly improved for the DC-CIK group (P<0.05) and only two patients in DC-CIK group had adverse reactions, which were less than grade 3/4. Multivariate analysis showed that lymph node metastasis (P=0.008), DC-CIK therapy (P=0.02), and DC-CIK therapy cycle (P=0.031) were independent prognostic parameters. Conclusion DC-CIK cell immunotherapy may prolong the survival of malignant melanoma patients and is safe and with tolerable adverse reactions. It can improve immune function and the quality of life of patients with malignant melanoma. If a patient received more than 4 DC-CIK cycles, it might produce greater clinical benefits.
melanoma; dendritic cells; cytokines; killer cells
福建省医学创新课题(2015-CXB-4);福建省自然科学基金(2016J01514)
福建医科大学教学医院,福建省肿瘤医院,福建省肿瘤生物治疗重点实验室,福州 350014
刘施佳,女,技师,医学硕士
郑秋红. Email:zqh2858@foxmail.com
R329.24; R457.2; R739.5
: A
: 1672-4194(2017)04-0217-06
