不同道地产区蒙古黄芪抗疲劳作用比较研究△
2017-09-21闫暾任凯白小荣张春红李旻辉
闫暾,任凯,白小荣,张春红*,李旻辉,2,3,4*
(1.包头医学院,内蒙古 包头 014060;2.内蒙古自治区中医药研究所,内蒙古 呼和浩特 010110;3.内蒙古自治区特色道地药材资源保护与利用重点实验室,内蒙古 包头 014060;4.内蒙古自治区中医药研究所,内蒙古 呼和浩特 010110)
不同道地产区蒙古黄芪抗疲劳作用比较研究△
闫暾1,任凯1,白小荣1,张春红1*,李旻辉1,2,3,4*
(1.包头医学院,内蒙古 包头 014060;2.内蒙古自治区中医药研究所,内蒙古 呼和浩特 010110;3.内蒙古自治区特色道地药材资源保护与利用重点实验室,内蒙古 包头 014060;4.内蒙古自治区中医药研究所,内蒙古 呼和浩特 010110)
目的:本研究对浑源仿野生栽培蒙古黄芪、武川栽培蒙古黄芪、土默特右旗栽培蒙古黄芪及野生蒙古黄芪的抗疲劳作用进行比较研究。方法:采用18~22 g KM小鼠,随机分组后连续灌胃给予黄芪提取液(低剂量为5 g·kg-1,高剂量为10 g·kg-1)4周,进行负重力竭游泳实验,记录小鼠力竭游泳时间;同时测定给药4周后小鼠运动90 min后全血乳酸(LA)含量、血浆乳酸脱氢酶(LDH)活性,血浆尿素氮(BUN)含量,肝糖原(LG)含量。结果:与空白对照组比较四种不同产地的蒙古黄芪均可显著延长小鼠力竭游泳时间(P< 0.05),各低剂量组力竭游泳时间分别为:浑源组522.0±81.5 s、武川组613.4±55.7 s、土右野生组508.2±61.0 s、土右栽培组484.5±40.7 s,高剂量组力竭游泳时间分别为:浑源组599.7±48.6 s、武川组790.3±57.1 s、土右野生组575.7±73.7 s、土右栽培组544.1±74.9 s,相同剂量进行比较发现武川组游泳时间较其他组显著延长(P< 0.05),其余各组间无统计学差异;四组黄芪均可增加小鼠运动后肝糖原含量,各低剂量组肝糖原含量分别为:浑源组26.81±1.04 mg·g-1、武川组31.67±2.87 mg·g-1、土右野生组22.31±2.38 mg·g-1、土右栽培组22.96±1.95 mg·g-1,各高剂量组肝糖原含量分别为:浑源组30.89±3.35 mg·g-1、武川组39.56±3.44 mg·g-1、土右野生组29.52±1.43 mg·g-1、土右栽培组28.41±2.06 mg·g-1;同时四个产地黄芪均可显著降低运动后小鼠血液乳酸、尿素氮含量,增加乳酸脱氢酶活性(P<0.05)。结论:四种产地蒙古黄芪均具有显著的抗疲劳作用,其中以内蒙古武川产黄芪药效最好,浑源和土右黄芪作用次之。
蒙古黄芪;道地产地;抗疲劳;力竭游泳;肝糖原
中药黄芪为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.) Beg.var.mongholicus(Beg.) Hsiao或膜荚黄芪Astragalusmembranaceus(Fisch) Bge.的干燥根[1],《神农本草经》中列为上品,具有补气升阳、固表止汗、托毒排脓、利水消肿、敛疮生肌之功效,现代药理研究表明其具有显著的抗疲劳[2]、提高免疫力、降糖降脂等作用[3]。由于各栽培区的生长环境和栽培方式有较大区别,对药材的外形产生了一定的影响,膜荚黄芪栽培后多为鸡爪芪,传统观念认为鸡爪芪质量较差,影响了膜荚黄芪的市场占有率,使得目前药材市场上以栽培的蒙古黄芪为主[4]。我国古人很早就发现,产地迥同的同种药材其质量优劣不同,临床疗效差别巨大,讲求道地的重要性。蒙古黄芪主产于山西恒山地区、甘肃陇南地区、内蒙古南部。山西和内蒙古是历史较为悠久的道地产区,甘肃的栽培历史较短。目前甘肃、内蒙古均为育苗移栽2~3年,山西也有部分地区选择育苗移栽方式栽培,但恒山地区仍以山地直播6~8年为主,称为“恒山黄芪”主供海外市场[5]。不同产地蒙古黄芪的主要成分已经有学者展开系统研究,但其药理作用是否具有差异,研究较少。本次研究选择了山西浑源黄芪,内蒙古武川黄芪、以及土默特右旗野生和栽培黄芪4种道地产的蒙古黄芪,以抗疲劳作用为切入点展开研究,初步探讨山西和内蒙古两个道地产区栽培品间、内蒙古2个产地栽培品间以及栽培品和野生品间的药效差异,为后续20余种不同产地蒙古黄芪在抗疲劳、免疫增强作用及降血糖作用方面的研究奠定基础。
1 实验材料
1.1 仪器
FLBP-200万能高速粉碎机(上海菲力博食品机械有限公司),20目标准筛(浙江上虞市道墟张兴纱筛厂),KDM调温电热套(山东鄄城华鲁电热仪器有限公司),SHZ-Ⅲ循环水真空泵(上海亚荣生化仪器厂),RE-52A旋转蒸发器(上海亚荣生化仪器厂),JA5001电子天平(上海浦春计量仪器有限公司)。
1.2 药材
蒙古黄芪药材,由本课题组自行采集(见表1),经包头医学院生药研究室李旻辉教授鉴定为蒙古黄芪Astragalusmembranaceus(Fisch.) Beg.var.mongholicus(Beg.) Hsiao的干燥根。
1.3 动物
18~22g雄性KM小鼠,由中国人民解放军军事医学科学院实验动物中心提供,合格证号SCXK-(军)2012-0004。
1.4 试剂盒
肝/肌糖原测定试剂盒(南京建成生物工程研究所,批号:20160321),尿素氮 (BUN) 测试盒 (脲酶法)(南京建成生物工程研究所,批号:20160318),全血乳酸(Lactic Acid)测定试剂盒(比色法)(南京建成生物工程研究所,批号:20160322),乳酸脱氢酶(LDH)试剂盒(微板法)南京建成生物工程研究所,批号:20160322。

表1 4个道地产地蒙古黄芪的来源和采集情况
2 实验方法
2.1 蒙古黄芪供试品溶液的制备
取蒙古黄芪药材供试品适量,粉碎,过20目筛,称取300 g至5000 mL圆底烧瓶中加10倍量水浸泡过夜,加热回流提取1.5 h,抽滤,滤渣加8倍量水加热回流提取1 h,抽滤,合并2次滤液,减压浓缩至300 mL(生药量为1 g·mL-1),备用。
2.2 不同产地蒙古黄芪抗疲劳作用研究
2.2.1 不同产地蒙古黄芪对小鼠力竭游泳时间的影响 实验动物适应一周后,按体重随机分组,供试品以产地进行命名(详见表1),各组分别为:空白对照组,浑源组,武川组,土右野生组,土右栽培组,各给药组分为高低两个剂量,低剂量为5 g·kg-1,高剂量为10 g·kg-1。空白对照组按0.1 mL/10 g体重以蒸馏水灌胃,其余各组按剂量给药,连续给药4周,记录小鼠体重。给药期间对小鼠进行2次习惯性游泳训练,每次游泳10 min。末次给药后1 h,将小鼠尾根部负10%体重的铁丝,置于水深20 cm,水温(25±1)℃的玻璃水缸中,记录小鼠力竭游泳时间。判定力竭标准:小鼠沉入水中10 s 不能浮出水面,结果见表2。
2.2.2 不同产地蒙古黄芪对小鼠运动后血液乳酸含量(LA)、血液尿素氮含量(BUN)、乳酸脱氢酶活性(LDH)及肝糖原(LG)含量的影响 动物分组及给药方式同2.2.1,另加一组游泳对照组,此组按0.1 mL/10 g体重以蒸馏水灌胃。末次给药1 h后,除空白对照组外,其余各组动物不负重游泳90 min,乙醚麻醉,心脏取血,肝素抗凝。留取100 μL全血进行全血乳酸含量测定,其余血样3500 r·min-1离心10 min,取上清,按尿素氮测试盒及乳酸脱氢酶试剂盒方法测定血浆尿素氮含量及乳酸脱氢酶活性,结果见表3。取新鲜肝脏样本用生理盐水漂洗后,滤纸吸干,称重,按样品重量(mg):30% KOH体积(μL)=1∶3,置于10 mL试管中保鲜膜封口,沸水浴煮20 min,流水冷却后离心。按肝/肌糖原测定试剂盒方法进行测定,结果见表3。
2.3 结果统计
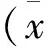
3 结果
3.1 不同产地的蒙古黄芪对小鼠体重及力竭游泳时间的影响
结果如表2所示,与正常对照组比较,各产地黄芪均能延长小鼠负重力竭游泳时间(P< 0.05),其中武川黄芪效果最佳(P< 0.01),与同剂量的浑源黄芪和土右黄芪比较,力竭游泳时间显著延长。
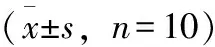
表2 不同产地蒙古黄芪对小鼠体重及力竭游泳时间的影响
注:*与空白组比较,P< 0.05;**与空白组比较,P< 0.01;△与同剂量武川组比较,P< 0.05
3.2 不同产地蒙古黄芪对运动后小鼠LG、LA、LDH、BUN含量的影响
结果见表3,游泳后小鼠肝糖原的含量与不游泳小鼠相比显著减少(P< 0.05),同时乳酸和尿素氮的含量增加(P< 0.05),血浆中LDH活性也显著增加(P< 0.05)。与游泳对照组比较,各产地蒙古黄芪均可增加小鼠肝糖原储备(P< 0.05),与同剂量组比较武川组肝糖原平均含量最高;各产地蒙古黄芪均可降低游泳引起的小鼠血液乳酸含量和尿素氮含量(P<0.05),同时显著增加血浆乳酸脱氢酶活性(P<0.01)。
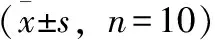
表3 不同产地蒙古黄芪对小鼠肝糖原(LG)、血液乳酸(LA)、血浆尿素氮(BUN)、血液乳酸脱氢酶(LDH) 活力的影响
注:#与空白对照组比较P< 0.05;*与游泳对照组比较P< 0.05;**与游泳对照组比较P< 0.01
4 讨论
黄芪被誉为补气第一药,其抗疲劳作用为主要功效,而且其抗疲劳作用已经被现代药理学研究证实[6]。本研究首次探讨了不同道地产地蒙古黄芪的抗疲劳作用。疲劳产生的原因主要为能源物质的耗竭和代谢产物的蓄积,糖原是运动时能量的重要来源,它的多少直接影响运动能力,提高糖原的储备可维持运动时血糖水平,延缓疲劳的发生。随运动负荷的增加,血中尿素含量也随之增加,同时,乳酸是糖无氧酵解的产物,剧烈运动时间长,会使机体乳酸堆积,尿素和乳酸过多是引起运动性疲劳的一个重要因素。已有研究表明食用黄芪能使体内肝糖原储备量的提高,从而为机体提供更多的能量来源,且可增强乳酸脱氢酶活力,有效地降低运动后血乳酸水平,从而延缓疲劳的产生,以达到抗疲劳的目的,本研究结果与报道相符。总体上看各产地蒙古黄芪都能显著增加小鼠的肝糖原含量,增强血浆乳酸脱氢酶的活性,加快乳酸的分解,同时可减少血浆尿素氮含量,延长小鼠力竭游泳时间。通过比较不同产地黄芪的药效可以发现,武川产蒙古黄芪的抗疲劳作用比浑源蒙古黄芪和土右蒙古黄芪作用好,浑源黄芪和土右黄芪抗疲劳药效未见显著性差异。而通过比较土右野生黄芪和栽培黄芪发现,黄芪野生品和栽培品在抗疲劳作用方面并无显著的药效学差异。
对于导致不同产地蒙古黄芪抗疲劳作用的差异的原因,可能是药材中主要成分含量存在差异所致。黄芪中主要含有皂苷、黄酮、多糖等多种化学成分[7]。李珊珊、吴铭等[8-9]人的研究表明黄芪多糖在小鼠负重游泳实验中能显著延长小鼠游泳时间,发挥抗疲劳作用。黄芪总皂苷的药理作用目前报道较多的是在免疫调节、抗肿瘤、心血管方面的作用[10],抗疲劳作用研究报道较少,但也有学者研究了黄芪总皂苷对运动性疲劳大鼠的海马功能和形态的影响,在运动疲劳状态下海马是较易受损的神经部位,实验结果表明黄芪皂苷可以维持海马正常组织形态降低海马部位的MDA水平,发挥一定的抗疲劳作用[11]。黄芪总黄酮的药理作用报道较多的是在抗氧化、免疫调节、抗肿瘤、心血管作用等方面[12]。本研究参考辛博、刘凤波等人方法[10,13],采用紫外分光光度法测定了四个产地蒙古黄芪中总黄酮、总多糖、总皂苷的含量。篇幅所限,简要列出测定结果供讨论参考。通过测定山西浑源黄芪所含总黄酮、总多糖和总皂苷的含量分别为9.30、92.60、18.75 mg·g-1;内蒙古武川黄芪为4.27、136.90、26.62 mg·g-1;土右栽培组为3.96、115.32、20.18 mg·g-1;土右野生黄芪组为4.17、119.40、23.40 mg·g-1。比较后发现,武川黄芪的总多糖和总皂苷含量均为最高,而山西浑源黄芪中的总黄酮的含量是最高,总多糖和总皂苷含量却最低。土右栽培黄芪和野生黄芪中总黄酮、总多糖、总皂苷的含量略低于武川黄芪,土右栽培黄芪的总皂苷含量比野生黄芪低。此外我们在对这四种蒙古黄芪进行体外抗氧化研究时也发现,山西浑源黄芪的抗氧化能力显著高于其他三种黄芪。因此推测多糖含量的差异可能是导致不同产地黄芪抗疲劳作用不同的主要因素,黄芪总皂苷起到辅助作用,总黄酮的作用尚待进一步研究。
造成黄芪药材主要成分含量差异的主要原因可能有种苗来源、水分、阳光、采收的年限和季节等[13]。因此在栽培过程中土地的灌溉、海拔、土质等都会造成药材中有效成分差异,进而造成不同地区药材作用的差异,因此,土默特右旗和武川虽然在地理位置上相距较近,但产出的药材还是存在一定差别。随着生长年限的增加,黄芪不断生长,初生代谢产物为其生长及次生代谢产物的积累提供能量,会导致出生代谢产物含量降低[14]。黄芪中的总多糖及总黄酮分别为初生代谢产物和次生代谢产物,因此2~3年生蒙古黄芪与6年生以上的蒙古黄芪在这两种成分的含量上差异较大,产生的药理作用也相应有差异。这提示我们,蒙古黄芪的抗疲劳作用可能受生长环境和采收年限影响较大,受到栽培和野生因素的影响较小,通过栽培可以在保证药效的同时解决蒙古黄芪资源不足的问题。
黄芪为大宗药材,每年的需求量在2万t以上,至19世纪50年代,野生黄芪药材几近枯竭,目前野生黄芪已列入国家保护药材名录,禁止采挖,中药黄芪全部以栽培品入药,且基原植物以蒙古黄芪为主。面对药材产销量的增加,对药材的真伪辨别及等级评价也在不断的向高水平发展。当前对药材的评价模式从以传统鉴别方式发展到把传统经验的辨状论质与化学评价、生物效应评价相结合的模式上来,这样既能体现中药材的整体特性,又能用以区分道地与非道地药材,同时能够保证药材的安全有效。因此对不同来源的蒙古黄芪药材的评价研究中药效学研究必不可少。在进一步的研究中将继续对不同产地黄芪对免疫及降血糖等方面的作用进行研究,通过更多样品总结蒙古黄芪药效学与产地之间的关系,指导蒙古黄芪药材的培育种植,同时为药材的质量评价提供科学可靠的依据,促进蒙古黄芪的科学开发与利用。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:519.
[2] 李大勇,贺永贵,刘丽萍,等.黄芪水提取液对小鼠抗疲劳作用及ANP分泌的影响[J].吉林体育学院学报,2011,27(2):77-78.
[3] 陈国辉,黄文凤.黄芪的化学成分及药理作用研究进展[J].中国新药杂志,2008,17(17):1482-1485.
[4] 余坤子,刘靖,洪浩,等.黄芪种植产地与生态环境及饮片规格的调查研究[J].中国中药杂志,2010,35(9):1112-1115.
[5] 张贺廷,王健,程铭恩,等.蒙古黄芪主产区栽培及商品规格等级调查[J].中药材,2015,38(12):2487-2492.
[6] 李凤文,刘荣珍,赵鹏,等.黄芪对小鼠抗疲劳作用实验研究[J].中国医药指南,2005,3(7):780-781.
[7] 张蔷,高文远,满淑丽.黄芪中有效成分药理活性的研究进展[J].中国中药杂志,2012,37(21):3203-3207.
[8] 李珊珊,袁婧,吴剑平,等.黄芪多糖抗小鼠疲劳的作用机制研究[J].现代生物医学进展,2014,14(36):7052-7055.
[9] 吴铭,周桃英,陈年友,等.黄芪多糖抗疲劳作用研究[J].湖北农业科学,2014,53(1):175-177.
[10]刘凤波,侯俊玲,王文全,等.不同来源黄芪中黄芪总皂苷含量比较研究[J].中国现代中药,2013,15(8):650-654.
[11]冯毅翀,许金叶,赵自明,等.黄芪总皂苷对运动性疲劳大鼠海马功能和形态的影响[J].中医杂志,2014,55(5):420-423.
[12]张冬青,汪德清.黄芪总黄酮生物学活性作用研究进展[J].中国中药杂志,2010,35(2):253-256.
[13]张庆芝,吴晓俊,刘涤,等.影响黄芪有效成分含量的因子的研究[J].中草药,2002,33(4):314-315.
[14]辛博,谢景,王文全.不同生长年限黄芪药材中总多糖和总黄酮含量的测定[J].中医药信息,2015,32(5):31-34.
Anti-fatigueEffectsofAstragalusmembranaceus(Fisch.)Beg.var.mongholicus(Beg.)HsiaofromDifferentGenuineHabitatsonMice
YAN Tun1,RENKai1,BAIXiaorong1,ZHANGChunhong1*,LIMinhui1,2*
(1.CollegeofPharmacy,BaoTouMedicalCollege,BaoTou014060,China;2.InnerMongoliaAutonomousRegionAcademyofTraditionalMedicine,Hohhot010110,China;3.InnerMongoliaKeyLaboratoryofCharacteristicTraditionalChineseMedicinalResourcesProtectionandutilize,Baotou014060,China;4.InnerMongoliaAutonomousRegionAcademyofChineseMedicine,Hohhot010110,China)
Objective: The anti-fatigue effects ofAstragalusmembranaceus(Fisch.) Beg.var.mongholicusfrom different habitats were studied in this research.The samples of wild and cultivatedA.membranaceusvar.mongholicuswere collected from Shanxi Hunyuan,Inner Mongolia Wuchuan and Inner Mongolia Tumoteyouqi.Methods:Exhaustive swimming exercise:18~22 g KM mice were used and administered orally by dose of 5 g·kg-1and 10 g·kg-1for 4 weeks.One hour after the last administration,put mice into water (16 cm×16 cm×20 cm,(25±1) ℃) with 10% bodyweight iron wire on the tail,recording the swimming time until the mice sank for 10 s.90 min swimming exercise:Mice were treated as described above.One hour after the last administration,put mice into water (16 cm×16 cm×20 cm,(25±1) ℃) and let them swim for 90 min,then lactic dehydrogenase,blood urea nitrogen,lactic acid,and hepatic glycogen were tested.Results:The results indicated thatA.membranaceusvar.mongholicusfrom all these habitats could significantly extend mice exhaustive swimming time,increase the liver glycogen and blood lactate dehydrogenase after swimming,decrease the blood lactic and blood urea nitrogen level after swimming.The swimming time of each low dose group was:Hunyuan (522.0±81.5) s,Wuchuan (613.4±55.7) s,Tumoteyouqi wild (508.2±61.0) s,Tumoteyouqi cultivated (484.5±40.7) s;the swimming time of each high dose group is:Hunyuan (599.7±48.6) s,Wuchuan (790.3±57.1) s,Tumoteyouqi wild (575.7±73.7) s,Tumoteyouqi cultivated (544.1±74.9) s,and Wuchuan group is significantly longer than the other three groups.The liver glycogen of each low dose group was:Hunyuan (26.81±1.04) mg·g-1,Wuchuan (31.67±2.87) mg·g-1、Tumoteyouqi Wild (22.31±2.38) mg·g-1,Tumoteyouqi Cultivated (22.96±1.95) mg·g-1,the liver glycogen of each high dose group was:Hunyuan (30.89±3.35) mg·g-1,Wuchuan (39.56±3.44) mg·g-1,Tumoteyouqi wild (29.52±1.43) mg·g-1,Tumoteyouqi cultivated (28.41±2.06) mg·g-1.Conclusion:The swimming time of all the four groups was prolonged remarkably,and WuchuanA.membranaceusvar.mongholicusshowed best anti-fatigue effects.There was no significant difference between cultivated and wildA.membranaceusvar.mongholicusfrom Tumoteyouqi.
Astragalusmembranaceus(Fisch.) Beg.var.mongholicus(Beg.) Hsiao;genuine habitats;anti-fatigue effects;exhaustive swimming exercise;hepatic glycogen
名贵中药资源可持续利用能力建设项目(2060302);公益性行业科研专项(201507002);内蒙古自治区科技创新引导项目(内蒙古地区5种道地药材种质资源保护、特色栽培加工技术规范的制定及推广应用);内蒙古自治区科技计划项目(蒙药资源保护与开发利用科研创新平台)
] 张春红,教授,研究方向:蒙药资源保护与利用;Tel:(0471)7167890,E-mail:zchlhh@126.com; 李旻辉,教授,研究方向:中蒙药资源保护与开发利用、分子生药学;Tel:(0471)6262232,E-mail:li_minhui@aliyun.com
10.13313/j.issn.1673-4890.2017.7.005
2016-12-19)
*[
