钙卫蛋白在肿瘤坏死因子抑制剂治疗幼年特发性关节炎临床应答中的预测作用
2017-09-21李晖蔡玮陈开澜
李晖,蔡玮,陈开澜
(武汉市妇女儿童医疗保健中心血液肿瘤科,武汉 430016)
钙卫蛋白在肿瘤坏死因子抑制剂治疗幼年特发性关节炎临床应答中的预测作用
李晖,蔡玮,陈开澜
(武汉市妇女儿童医疗保健中心血液肿瘤科,武汉 430016)
目的评估血清钙卫蛋白(MRP8/14)水平在肿瘤坏死因子(TNF)抑制剂治疗中国人群幼年特发性关节炎(JIA)患者临床应答中的预测作用。方法纳入 72 例接受依那西普治疗 24 周的JIA 患者和 30例健康志愿者(HCs),采用免疫酶吸附法检测JIA 患者基线期和 HCs血清 MRP8/14 水平。临床应答定义为实现 ACR 儿科临床应答标准 ACRpedi 50。结果JIA 患者中血清MRP8/14 水平显著高于 HCs(P < 0.001)。基线期应答组患者血清 MRP8/14 水平显著高于不应答组(P < 0.001)。受试者工作特征曲线显示,MRP8/14 水平预测临床应答曲线下面积为 0.823(95%CI:0.706~0.939)。进一步行单因素、多因素 logistic 回归分析发现,血清 MRP8/14 高水平是临床应答的独立预测因素(P=0.003)。结论血清 MRP8/14 水平可作为可靠的、新颖的预测 TNF抑制剂治疗JIA患者临床应答的生物标志物。
幼年特发性关节炎;钙卫蛋白;肿瘤坏死因子抑制剂;临床应答
肿瘤坏死因子(tumor necrosis factor,TNF)抑制剂作为幼年特发性关节炎(juvenile idiopathic arthritis,JIA)最有效的治疗方式,可快速缓解患者的疾病活动度,在一定程度上抑制放射学进展[1],但依然有20% ~30% 的 患 者 治 疗 疗 效 不 佳[2]。 钙 卫 蛋 白(MRP8/14)是中性粒细胞的衍生蛋白,其在 JIA、类风湿关节炎(rheumatoid arthritis,RA)、炎症性肠病(inflammatory bowel disease,IBD)等多种免疫性疾病中都表现出促炎作用[3-5]。HOLZINGER 等[6]发现,血清 MRP8/14 在 JIA 患者中高表达,且与疾病活动度相关;ANINK 等[3]的研究显示,血清 MRP8/14 基线期水平高可以预测阿达木单抗与依那西普治疗JIA患者的6个月治疗应答。然而目前针对中国人群,血清 MRP8/14 水平在 TNF 抑制剂治疗 JIA 患者中的疗效预测作用尚未有研究,因此本研究旨在评估血清MRP8/14 水平在 TNF 抑制剂治疗中国人群 JIA 患者临床疗效应答中的预测作用。
1 材料与方法
1.1 研究对象
收集2010年9月1日至2015年8月30日于武汉市妇女儿童医疗保健中心门诊或病房接受TNF抑制剂(依那西普)治疗的 JIA 患者 72 例。入组标准:家属签署知情同意书;符合2001年国际风湿病联 盟(international league of associations for rheumatology,ILAR)的 JIA 分类标准;准备使用依那西普进行治疗。排除标准:3个月内接受过依那西普或者其他生物制剂治疗;3个月内采用激素关节腔注射治疗;关节严重畸形患者;有严重心脏、肝脏、肾脏等重要脏器和血液、内分泌系统病变及病史者(严重程度的评价标准为肝功能≥2倍正常值上限,血肌酐>正常值上限;白细胞计数<4×109/L,血红蛋白<85 g/L;血小板计数< 80×109/L);正处于急、慢性感染期间,或既往有活动性结核史者;恶性肿瘤患者;乙肝表面抗原阳性,或丙肝抗体阳性者;对依那西普成分过敏者;中重度心力衰竭(纽约心脏学会3~4级);研究者认为的不适合使用依那西普的其他情况。同时纳入30例年龄、性别匹配的健康志愿者作为对照组,以评估MRP8/14在JIA患者中表达水平的差异。
本研究获得武汉市妇女儿童医疗保健中心伦理委员会批准,所有受试者家属均签署书面知情同意书。
1.2 研究方法
1.2.1 临床疗效应答评估:所有 JIA 患者均采用依那西普进行治疗(0.4 mg/kg 皮下注射,2 次/周),持续24周。在24周后对患者疗效进行评估,按照ACR儿科临床应答标准 ACRpedi 50 将患者划分为应答组与不应答组[7]。ACRpedi 50 应答标准为以下 6 项核心指标中至少3项改善≥50%,且不超过1项恶化≥30% :红 细胞沉降率(erythrocyte sedimentation rate,ESR)、儿 童 健 康 评 估 问 卷(childhood health assessment questionnaire,CHAQ)、活动性炎性关节计数、活动受限关节计数、医师对疾病的总体评估、患儿或患儿父母对病情的总体评估[7]。
1.2.2 样本采集及血清 MRP8/14 的检测:采集使用依那西普治疗前基线期JIA 患者及健康志愿者外周血 4 mL,置于不含乙二胺四乙酸(ethylene diaminete traacetic acid,EDTA)的 试 管 中 ,室 温 静 置 1 h 后 ,4 ℃ 1 000g离心 10 min,取上清液后于 4 ℃ 16 000g离心 10 min,取上清液置于-80 ℃冰箱中保存备用。
采 用 免 疫 酶 联 吸 附 法(enzyme-linked immuno sorbent assay,ELISA),按照 MRP8/14 ELISA 试剂盒(Immunodiagnostik 公司,德国)说明书操作,对患者血清中MRP8/14的水平进行检测。
1.3 统计学分析
采用 SPSS 21.0 软件进行统计学分析。定量资料的组间差异比较采用 Mann-Whitney 检验(偏态),定性资料组间的差异比较采用χ2检验进行分析。应用受试者工作特征(receiver operating characteristic,ROC)曲线进行血清 MRP8/14 对依那西普治疗JIA 患者临床应答的预测作用分析,并进一步采用单因素、多因素 logistic逻辑回归模型分析影响依那西普治疗 JIA 患者临床应答的因素。P < 0.05 为差异有统计学意义。
2 结果
2.1 MRP8/14 在 JIA 患者血清中高表达
JIA 患 者 中 血 清 MRP8/14 水 平 为 1 464(798~2 947)ng/mL,显著高于年龄、性别匹配的健康对照组[202(112~368)ng/mL,P< 0.001]。
2.2 纳入临床疗效应答分析 JIA 患者的基线期临床特征
72 例 JIA 患者中,9 例未持续用药至第 24 周(4例感染和3例失访,未纳入最后临床应答分析;2例疗效不佳,纳入不应答组进行分析),因此纳入最终分析的24周临床疗效应答患者为65例,患者年龄中位值为 11.5(8.3~14.2)岁、女 42 例(65%)、病程 42(24~67)个月,其他临床特征、合并用药和 JIA 类型见表1。
2.3 应答组与不应答组血清 MRP8/14 水平
纳入最终 24 周临床疗效应答分析的 65 例 JIA患者中,46 例达到 ACRpedi 50,为应答组;19 例未达到 ACRpedi 50,为不应答组。对于 19 例无应答患者,6例置换为其他TNF抑制剂(英夫利昔单抗)治疗,9 例置换为白细胞介素 6(interleukin 6,IL-6)抑制剂治疗,4例置换为3联疗法治疗。应答组基线期C 反应蛋白(C-reactive protein,CRP)水平数值上高于 不 应 答 组[34.9(23.3~42.6)mg/L vs 24.4(17.1~35.2)mg/L,P=0.076];应答组 JIA 亚型中全身型患者 比 例 显 著 低 于 不 应 答 组(7%vs 26% ,P= 0.027)。2组间其他人口学信息、临床特征、合并用药、JIA亚型差异均无统计学意义,见表1。
基 线 期 应 答 组 患 者 血 清 MRP8/14 为 2 189(995~3 588)ng/mL,显著高于不应答组[748(284~1 130)ng/mL,P < 0.001]。 采 用 ROC 曲 线 进 行 分析,显示 MRP8/14 水平预测依那西普治疗 JIA 患者临 床 应 答 曲 线 下 面 积(area under curve,AUC)为0.823,95%CI:0.706~0.939(图 1)。采用整体 65 例JIA 患者中 MRP8/14 血清水平中位值 1 426 ng/mL 作为切割点,预测敏感度 65.2%,特异度 84.2%。
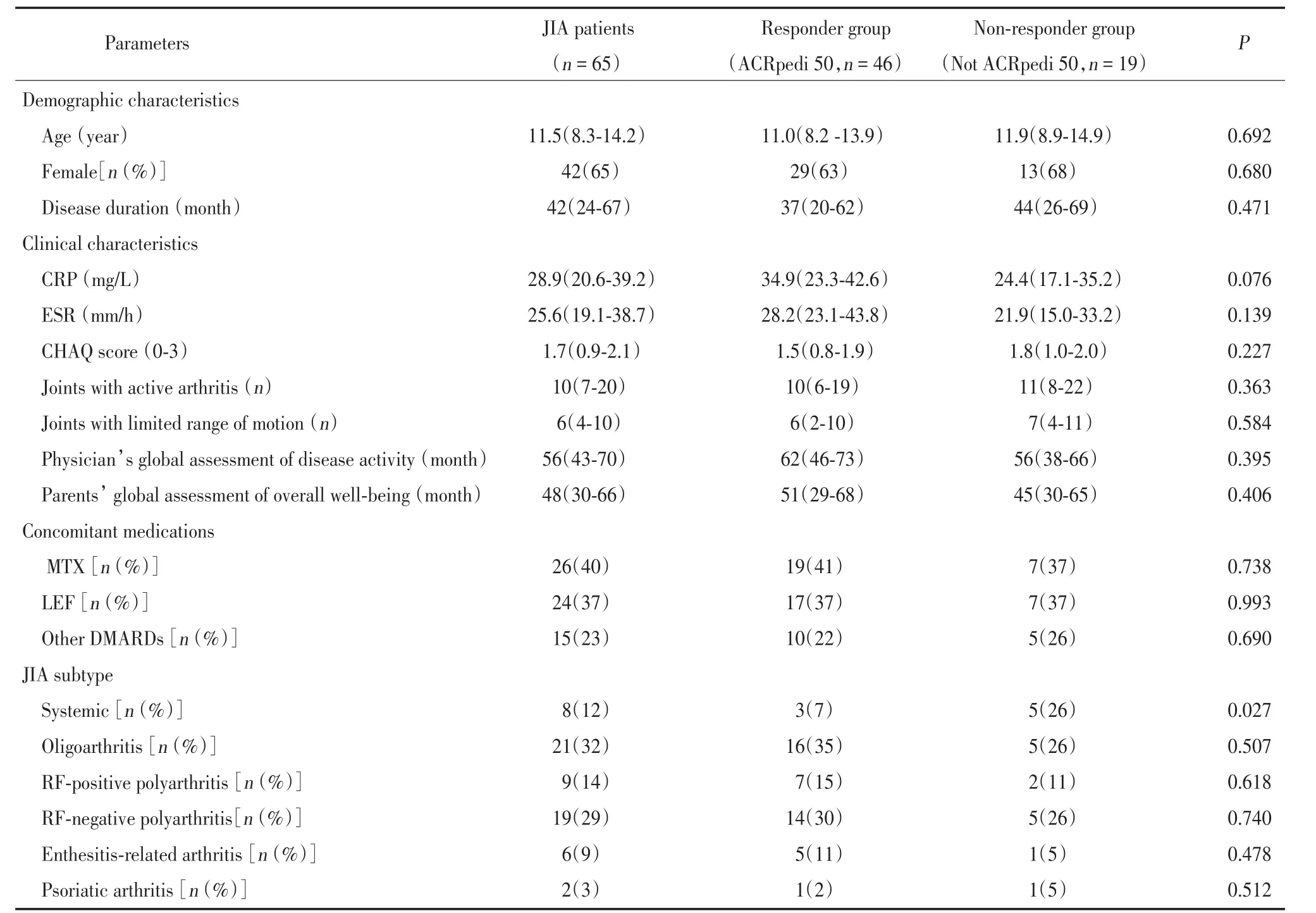
表1 纳入最终疗效应答分析的JIA患者基线期临床特征Tab.1 Baseline characteristics of JIA patients who were included in final response analysis
2.4 影响 JIA 患者临床应答基线期因素的 logistic回归分析
为进一步证实血清 MRP8/14 水平在依那西普治疗JIA 中的预测作用,本研究按照纳入分析 65例JIA 患 者 血 清 MRP8/14 中位 值 1 426 ng/mL 为 切 割点,将患者分为 MRP8/14 高水平组(>1 426 ng/mL)和 MRP8/14 低水平组(≤ 1 426 ng/mL),并将表 1 中应答组与不应答组差异分析中P< 0.1 的因素一起纳入单因素 logistic 回归分析,单因素回归分析中P < 0.1 的因素再进一步纳入多因素 logistic 回归分析。CRP 也按照 65 例 JIA 中位值 28.9 mg/L 为切割点,分为高 CRP 组(>28.9 mg/L)和低 CRP 组(≤ 28.9 mg/L);按照是否全身型 JIA 分为非全身型 JIA 组和全身型JIA组。
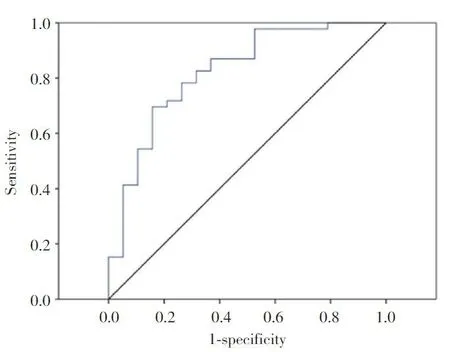
图1 基线期血清MRP8/14水平预测临床应答ROC曲线分析Fig.1 ROC curve analysis of baseline serum MRP8/14 levels for prediction of clinical response
单因素 logistic回归显示,基线期血清 MRP8/14高水平可以显著预测临床应答(OR=9.098,95%CI:2.310~35.832,P=0.002),此外非全身型 JIA 也是临床 应 答 的 预 测 因 素(OR=5.199,95%CI:1.083~ 24.196,P=0.039 )。多因素 logistic回归分析显示,基线期血清 MRP8/14 高水平可以提高 JIA 患者约 8倍的临床应答概率,是唯一的临床应答独立预测因素(OR=8.926,95%CI:2.085~38.218,P=0.003),见表2。
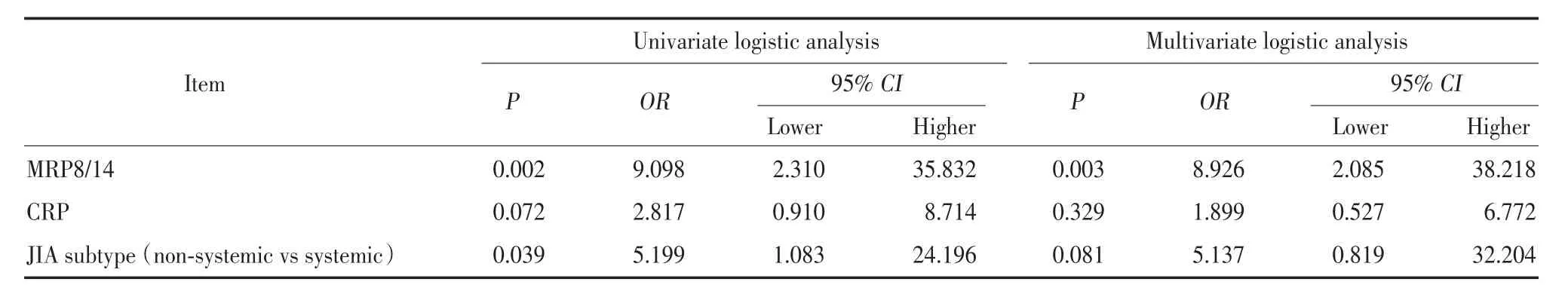
表2 预测 ACR pedi 50 临床应答因素分析Tab.2 Predictive factor analysis for ACR Pedi 50 clinical response
3 讨论
MRP8/14,又 称 S100A8/A9,隶 属 于 S100 类 蛋白,其亚基包含2个钙结合EF手型结构蛋白,是中性粒细胞中比例最高的蛋白[8-9]。MRP8/14 表达具有组织或细胞特异性,可作为急性炎症细胞活化的标志物[10],同时它也是一种宿主防御蛋白,进入细胞微环境后可结合微生物生长繁殖所必须的锌锰离子,进而抑制其增殖,从而发挥抑制病原微生物生长的作用[11]。
MRP8/14 通过调节 Toll样受体 4 信号传导,可以诱导自体反应的CD8+T细胞产生,并且促进氧化平衡和 IL-17 表达水平的上调[12]。在抗原诱导的小鼠关节炎模型中,S100A8-/A9-(MRP8-/14-)小鼠关节肿胀数显著低于对照组,软骨层细胞团数量和蛋白聚糖损耗也均显著低于对照组,此外MRP8-/14-组未显示软骨损伤,而对照组有显著软骨损伤,提示MRP8/14可以促进关节的炎症产生,并破坏关节软骨[13]。本研究发现,JIA 患者血清 MRP8/14 水平显著高于健康对照组,与 HOLZINGER 等[6]的研究结果类似,表明了MRP8/14在JIA患者中的促炎作用。
MONCRIEFFE 等[14]研究发现,血清 MRP8/14 水平可以预测接受甲氨蝶呤治疗的 JIA 患者的治疗应答。ANINK 等[3]的研究显示,使用 TNF 抑制剂治疗6 个月的 JIA 患者中,基线期高血清MRP8/14水平可以预测临床应答和长期持续缓解。与此结果类似,本研究表明,在中国人群接受TNF抑制剂治疗的患者中,24周治疗应答组基线期血清MRP8/14水平显著高于不应答组,并且基线期血清MRP8/14 高表达水平是 TNF抑制剂治疗JIA 患者疗效应答的独立预测因素,其可以增加8倍疗效应答概率。
此外,在其他免疫性疾病中,外周血或者粪便MRP8/14水平也可以作为TNF抑制剂治疗的疗效预测因子。CHOI等[5]对使用不同 TNF 抑制剂治疗的RA患者进行疗效应答分析,结果显示16周时临床应答组在基线期血清 MRP8/14 水平显著高于不应答组,进一步多因素回归分析发现,MRP8/14水平高是患者临床应答的独立预测因素;BOSCHETTI等[15]纳入使用TNF抑制诱导治疗的IBD患者,持续随访1 年,发现粪便 MRP8/14 水平与诱导治疗应答显著相关。
此研究尚有一些不足之处,样本量可以进一步扩大,除依那西普外其他 TNF 抑制剂治疗 JIA 的评估未纳入。因此进一步研究方向为纳入更大样本量的JIA患者,使用不同类型TNF 抑制剂进行治疗,检测其治疗前基线期MRP8/14血清水平,深入评估MRP8/14 在不同 TNF 抑制剂治疗 JIA 患者中的临床应答预测作用。
综上所述,本研究表明,经TNF抑制剂依那西普治疗的 JIA 患者,达到临床应答组基线期血清MRP8/14 表 达 水 平 显 著 高 于 不 应 答 组 ;相 对 于MRP8/14 低水平患者,基线期 MRP8/14 高水平患者临床应答概率提高了8倍,是TNF抑制剂治疗JIA患者临床应答的独立预测因素。
参考文献:
[1]KLOTSCHE J,NIEWERTH M,HAAS JP,et al.Long-term safety of etanercept and adalimumab compared to methotrexate in patients with juvenile idiopathic arthritis(JIA)[J].Ann Rheum Dis,2016,75(5):855-861.DOI:10.1136/annrheumdis-annrheumdis-2014-206747.
[2]OTTEN MH,PRINCE FH,ARMBRUST W,et al.Factors associated with treatment response to etanercept in juvenile idiopathic arthritis[J].JAMA,2011,306(21):2340-2347.DOI:10.1001/jama.2011. 1671.
[3]ANINK J,VAN SUIJLEKOM-SMIT LW,OTTEN MH,et al.MRP8/14 serum levels as a predictor of response to starting and stopping anti-TNF treatment in juvenile idiopathic arthritis [J].Arthritis Res Ther,2015,17:200.DOI:10.1186/s13075-015-0723-1.
[4]MOSLI MH,ZOU G,GARG SK,et al.C-reactive protein,fecal calprotectin,and stool lactoferrin for detection of endoscopic activity in symptomatic inflammatory bowel disease patients:a systematic review and meta-analysis[J].Am J Gastroenterol,2015,110(6):802-819,820.DOI:10.1038/ajg.2015.120.
[5]CHOI IY,GERLAG DM,HERENIUS MJ,et al.MRP8/14 serum levels as a strong predictor of response to biological treatments in patients with rheumatoid arthritis[J].Ann Rheum Dis,2015,74(3):499-505.DOI:10.1136/annrheumdis-2013-203923.
[6]HOLZINGER D,FROSCH M,KASTRUP A,et al.The Toll-like receptor 4 agonist MRP8/14 protein complex is a sensitive indicator for disease activity and predicts relapses in systemic-onset juvenile idiopathic arthritis[J].Ann Rheum Dis,2012,71(6):974-980. DOI:10.1136/annrheumdis-2011-200598.
[7]GIANNINI EH,RUPERTO N,RAVELLI A,et al.Preliminary definition of improvement in juvenile arthritis[J].Arthritis Rheum,1997,40(7):1202-1209.
[8]HEIZMANN CW,FRITZ G,SCHAFER BW.S100 proteins:structure,functions and pathology[J].Front Biosci,2002,7:d1356-d1368.
[9]LEUKERT N,VOGL T,STRUPAT K,et al.Calcium-dependent tetramer formation of S100A8 and S100A9 is essential for biological activity[J].J Mol Biol,2006,359(4):961-972.DOI:10.1016/j. jmb.2006.04.009.
[10]UCHIDA T,FUKAWA A,UCHIDA M,et al.Application of a novel protein biochip technology for detection and identification of rheumatoid arthritis biomarkers in synovial fluid[J].J Proteome Res,2002,1(6):495-499.
[11]BROPHY MB,HAYDEN JA,NOLAN EM.Calcium ion gradients modulate the zinc affinity and antibacterial activity of human calprotectin[J].J Am Chem Soc,2012,134(43):18089-18100. DOI:10.1021/ja307974e.
[12]VOGL T,TENBROCK K,LUDWIG S,et al.Mrp8 and Mrp14 are endogenous activators of Toll-like receptor 4,promoting lethal,endotoxin-induced shock[J].Nat Med,2007,13(9):1042-1049. DOI:10.1038/nm1638.
[13]VAN LENT PL,GREVERS L,BLOM AB,et al.Myeloid-related proteins S100A8/S100A9 regulate joint inflammation and cartilage destruction during antigen-induced arthritis[J].Ann Rheum Dis,2008,67(12):1750-1758.DOI:10.1136/ard.2007.077800.
[14]MONCRIEFFE H,URSU S,HOLZINGER D,et al.A subgroup of juvenile idiopathic arthritis patients who respond well to methotrexate are identified by the serum biomarker MRP8/14 protein[J]. Rheumatology(Oxford),2013,52(8):1467-1476.DOI:10.1093/ rheumatology/ket152.
[15]BOSCHETTI G,GARNERO P,MOUSSATA D,et al.Accuracies of serum and fecal S100 proteins(calprotectin and calgranulin C)to predict the response to TNF antagonists in patients with Crohn’s disease[J].Inflamm Bowel Dis,2015,21(2):331-336.DOI:10.1097/MIB.0000000000000273.
(编辑 于 溪)
Correlation of Serum Calprotectin Expression with Clinical Response in Juvenile Idiopathic Arthritis Patients Treated with a Tumor Necrosis Factor Inhibitor
LI Hui,CAI Wei,CHEN Kailan
(Department of Hematology and Oncology,Wuhan Medical and Health Center for Women and Children,Wuhan 430016,China)
ObjectiveTo investigate the correlation of serum calprotectin(MRP8/14)expression with clinical response in Chinese juvenile idiopathic arthritis(JIA)patients treated with a tumor necrosis factor(TNF)inhibitor.MethodsSeventy-two JIA patients and 30 health volunteers(HCs)were enrolled in this prospective study.All JIA patients
etanercept for 24 weeks.Serum was collected from JIA patients at baseline before treatment and from HCs.Clinical response was defined according to the American College of Rheumatology(ACR)Pedi 50 criteria.ResultsSerum MRP8/14 expression was greater in JIA patients than in HCs(P < 0.001).Serum MRP8/14 level was greater in responders than in non-responders(area under the receiver operating characteristic curve,0.823;95%CI:0.706-0.939).Univariate and multivariate logistic analysis showedthathighserumMRP8/14expressionwasanindependentpredictivefactorforclinicalresponse(P=0.003).ConclusionSerumMRP8/14 level can be used as a convincing and novel biomarker for clinical response in JIA patients treated with a TNF inhibitor.
juvenile idiopathic arthritis;calprotectin;tumor necrosis factor inhibitor;clinical response
R593.22
A
0258-4646(2017)09-0825-05
http://kns.cnki.net/kcms/detail/21.1227.R.20170906.1318.026.html
10.12007/j.issn.0258-4646.2017.09.013
李晖(1970-),女,副主任医师,硕士.
蔡玮,E-mail:caiweii918@163.com
2016-10-25
网络出版时间:2017-09-06 13:18
