精料补充料能量水平对肉牛瘤胃发酵特性及微生物菌群的影响
2017-09-20张海波王之盛
张海波,王之盛
(1.宜春学院生命科学与资源环境学院,江西宜春 336000;2.四川农业大学动物营养研究所,四川雅安 750001)
精料补充料能量水平对肉牛瘤胃发酵特性及微生物菌群的影响
张海波1*,王之盛2
(1.宜春学院生命科学与资源环境学院,江西宜春 336000;2.四川农业大学动物营养研究所,四川雅安 750001)
本试验旨在研究精料补充料(精补料)能量水平对肉牛瘤胃发酵特性及瘤胃微生物菌群的影响。选用3头安装永久性瘤胃瘘管的宣汉黄牛,采用3×3拉丁方设计,试验牛分别饲喂综合净能为7.49 MJ/kg(低能组)、8.85 MJ/kg(中能组)、10.19 MJ/kg(高能组)的精补料,测定饲喂后0、3、6、9、12 h瘤胃液pH、氨氮(NH3-N)、挥发性脂肪酸、微生物蛋白及微生物相对含量。结果表明:高能组丙酸(3、9、12 h和平均)、微生物蛋白(9、12 h和平均)、原虫(3、6、9、12 h和平均)和牛链球菌(9、12 h和平均)显著高于低能组(P<0.05),乙酸/丙酸(3、12 h和平均)、NH3-N浓度(3、6、9 h和平均)和溶纤维丁酸弧菌(6、9、12 h和平均)显著低于低能组(P<0.05)。综上所述,提高精补料的能量水平,肉牛瘤胃中原虫和牛链球菌增多,溶纤维丁酸弧菌减少,从而引起丙酸升高,降低乙酸/丙酸和NH3-N浓度,使微生物蛋白增加。
肉牛;能量水平;瘤胃发酵特性;微生物菌群
牛肉素以高蛋白、低脂肪、低胆固醇含量等优良品质深受消费者喜爱,但与庞大的市场需求相比,我国的肉牛养殖并不能满足需要。大力发展标准化和规模化养殖、施行精准饲养、提高饲料利用效率是解决供需矛盾的有效手段。
肉牛有超过一半的蛋白质需要来自从瘤胃进入十二指肠的微生物蛋白[1],故精准饲养、提高饲料利用效率的关键点就是要提高瘤胃微生物蛋白的合成。饲料中的能量和蛋白质是瘤胃微生物蛋白合成的主要营养物质。当蛋白质含量一定时,能量则成为微生物蛋白合的主要限制因素[2-3],且瘤胃内饲料主要是通过瘤胃微生物进行降解。溶纤维丁酸弧菌是瘤胃内重要的纤维降解菌之一,能降解日粮中的纤维[4]。牛链球菌是反刍动物瘤胃中主要的淀粉降解菌之一,其主要生理作用是降解和利用淀粉来维持自身生长[5]。此外,与传统的体外发酵技术相比,运用瘤胃瘘管技术可以控制瘤胃内环境,更真实地反映瘤胃发酵情况。
以前的研究多集中在利用体外发酵技术研究能量水平对反刍动物瘤胃发酵参数的影响[6-7],而运用瘤胃瘘管技术研究精料补充料(以下简称精补料)能量水平对肉牛瘤胃微生物菌群的影响较少。本试验旨在研究精补料能量水平对肉牛瘤胃发酵参数及微生物菌群的影响,为合理配制肉牛精补料能量水平提供理论依据和基本参数。
1 材料与方法
1.1 试验动物与饲养管理 选取3头年龄相近,体况良好,体重为(312.5±23.85)kg,安装永久性瘤胃、十二指肠近端和回肠末端瘘管的去势宣汉黄牛。宣汉黄牛的饲养管理按照肉牛的常规饲养管理进行,每天定时(08:00和16:00)饲喂2次,自由饮水。
1.2 试验设计及日粮 参照中国肉牛饲养标准[8],设计3种精补料能量水平。3种精补料综合净能分别为 7.49(低能量水平)、8.85(中能量水平)、10.19 MJ/kg(高能量水平),精补料配方及营养成分见表1。精料粗料比为4:6,粗料为稻草,饲喂时先粗料后精补料,每头牛每天饲喂2.15 kg的精补料和3 kg的稻草。稻草饲喂时加工成4 cm左右的短节。稻草的营养成分:干物质90.88 %,综合净能为1.92 MJ/kg,粗蛋白5.55 %,粗纤维24.10 %,酸性洗涤纤维67.96 %,中性洗涤纤维45.71 %,钙0.07 %,磷0.05 %。采用3×3拉丁方试验设计,进行3期动物试验,每期20 d,其中15 d为预试期,5 d为采样期。
1.3 样品的采集 每期的第16天,在饲喂后0、3、6、9、12 h分别采集瘤胃液100 mL,经4层纱布过滤后,取10 mL立即测定瘤胃pH,剩下的瘤胃液分成2部分保存,一部分放入-20℃用于瘤胃发酵参数的测定,另一部分立即放入液氮用于微生物菌群的测定。
1.4 饲料常规营养成分测定 参照张丽英[9]的方法分别测定3种料补料的粗蛋白、粗纤维、钙、磷、中性洗涤纤维和酸性洗涤纤维含量。

表1 精补料组成和营养成分
1.5 瘤胃发酵参数的测定 瘤胃pH采用pH计(上海雷磁,pHS-3D型)测定。瘤胃液挥发性脂肪酸(VFA)采用CP-3800气相色谱测定。瘤胃液氨氮(NH3-N)浓度参照冯宗慈等[10]的方法测定。采用Makkar等[11]的方法测定瘤胃微生物蛋白。
1.6 微生物菌群的测定 参照细菌基因组DNA提取试剂盒(天根生化科技有限公司,DP302-02)的说明方法抽提瘤胃液总DNA。实时荧光定量PCR引物见表2。采用Denman等[12]的方法,用总菌做内参,计算目标微生物的相对丰度。
1.7 统计分析 用SPSS 17.0统计软件进行单因素方差分析。差异显著时采用Duncan's方法对各组间平均数进行多重比较,结果表示为平均值±标准差。P<0.05为差异显著。
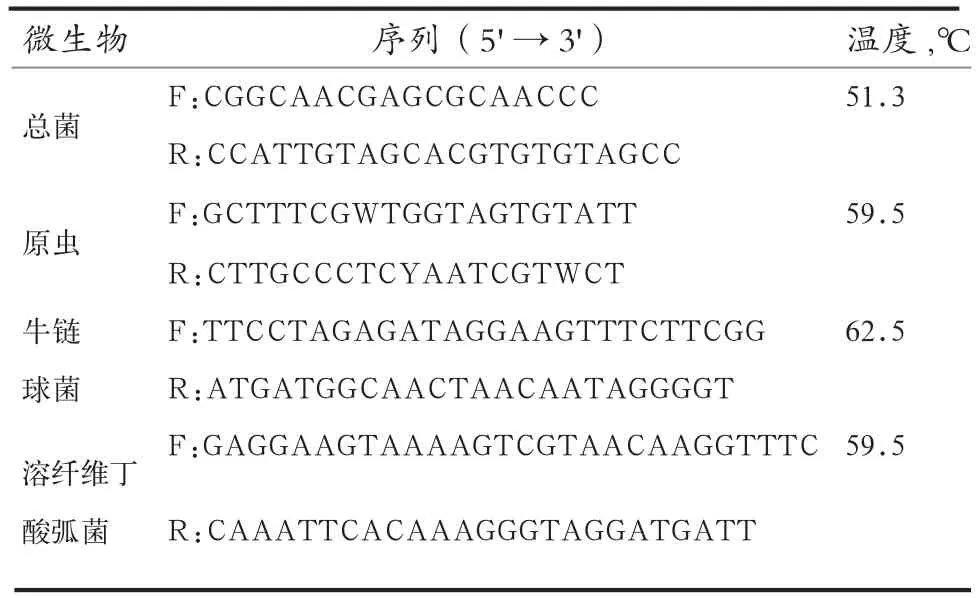
表2 实时荧光定量PCR引物
2 结 果
2.1 精补料能量水平对瘤胃pH的影响 由表3可知,各处理组瘤胃pH在各个时间点的差异不显著(P>0.05),但平均以低能组最高,高能组最低。2.2 精补料能量水平对瘤胃VFA的影响 由表4可知,高能组丙酸(3、9、12 h和平均)显著高于低能组(P<0.05);高能组丙酸(3 h和平均)显著高于中能组(P<0.05)。高能组乙酸/丙酸(3、12 h和平均)显著低于低能组(P<0.05)。

表3 精补料能量水平对瘤胃pH的影响

表4 精补料能量水平对瘤胃VFA的影响
2.3 精补料能量水平对瘤胃NH3-N的影响 由表5可知,低能组NH3-N浓度(3、6、9 h和平均)显著高于高能组(P<0.05),显著高于中能组(平均)(P<0.05)。中能组和高能组与低能组相比NH3-N浓度(平均)分别降低了23.65%和43.14%(P<0.05)。

表5 精补料能量水平对瘤胃NH3-N的影响 mg/100mL
2.4 精补料能量水平对瘤胃微生物蛋白的影响 由表6可知,高能组微生物蛋白含量(9、12 h和平均)显著高于低能组(P<0.05),显著高于中能组(9 h和12 h)(P<0.05)。中能组和高能组与低能组相比微生物蛋白含量(平均)分别提高了10.61%和25.92%。

表6 精补料能量水平对瘤胃微生物蛋白的影响 mg/mL
2.5 精补料能量水平对瘤胃微生物菌群的影响 由表7可知,高能组瘤胃中原虫(3、6、9、12 h和平均)和牛链球菌(9、12 h和平均)显著高于低能组(P<0.05);高能组瘤胃中原虫(3、6、9 h和平均)和牛链球菌(9、12 h和平均)显著高于中能组(P<0.05)。高能组瘤胃中溶纤维丁酸弧菌(6、9、12 h和平均)显著低于低能组(P<0.05),显著低于中能组(6、9 h和平均)(P<0.05)。
3 讨 论
3.1 精补料能量水平对瘤胃pH的影响 瘤胃液pH是综合反映瘤胃发酵过程的指标之一,对日粮营养物质的消化代谢有重要影响。在本试验中,各处理组瘤胃液pH在各个时间点的差异不显著,但高能量组的pH最低,低能量组的pH最高。较高能量水平的精补料中,非结构性碳水化合物含量较高,结构性碳水化合物含量降低,从而在短时间内即可产生大量VFA,导致瘤胃液pH下降[6],而由于瘤胃液具有缓冲能力,最终使瘤胃液pH下降不明显,但还是有随着精补料能量升高而瘤胃液pH下降的趋势。

表7 精补料能量水平对瘤胃微生物菌群的影响
3.2 精补料能量水平对瘤胃VFA的影响 碳水化合物在瘤胃微生物的作用下生成VFA(包括乙酸、丙酸、丁酸等),是瘤胃微生物生长的主要能量来源。在本试验中,随着精补料能量升高,丙酸浓度升高,乙酸/丙酸降低。可能是在较高能量水平的精补料中,瘤胃发酵程度增加,丙酸量随之增加[13],形成丙酸发酵模式,最终表现为乙酸/丙酸降低。增加非结构性碳水化合物(可降解淀粉)的含量,可以增加瘤胃丙酸的含量,降低乙酸/丙酸[13]。
3.3 精补料能量水平对瘤胃NH3-N的影响 本研究中,随着精补料能量增加,瘤胃NH3-N浓度降低。提高日粮能量水平,为微生物繁殖提供充足的能量,有利于微生物数量增加,促进微生物对NH3-N利用增多,从而降低NH3-N浓度。Lee等[14]研究也表明,随着底物碳水化合物的增加,培养液中NH3-N浓度降低。
3.4 精补料能量水平对瘤胃微生物蛋白的影响 本试验中,随着精补料能量增加瘤胃微生物蛋白升高,与Zhang等[7]研究结果一致。这可能是提高了日粮能量水平,有利于微生物数量增加,从而使微生物蛋白升高。
3.3 精补料能量水平对瘤胃微生物菌群的影响 本试验中,随着精补料能量增加,瘤胃原虫数量增多,与Zhang等[7]的结果一致。这可能是随着精补料能量增加,为原虫的繁殖提供了充足的能量,有利于原虫的繁殖。但Faciola等[15]研究表明,原虫具有吞噬细菌的功能,能够减少从瘤胃进入十二指肠的细菌蛋白。瘤胃微生物蛋白主要由原虫蛋白和细菌蛋白组成,原虫能够吞噬细菌,让细菌蛋白变成原虫蛋白的一部分,故原虫数量的增加促进微生物蛋白的合成。
溶纤维丁酸弧菌是反刍动物瘤胃中主要纤维降解菌之一,其主要生理作用是对饲料中的纤维和蛋白进行降解[4]。本试验结果表明,随着精补料能量增加溶纤维丁酸弧菌数量减少,与张海波[6]体外发酵研究结果一致。其原因可能是较高能量水平的精补料中,日粮中酸性洗涤纤维和酸性洗涤纤维含量降低,而发酵底物(中酸性洗涤纤维和酸性洗涤纤维)的减少导致溶纤维丁酸弧菌数量减少。
牛链球菌是反刍动物瘤胃中主要淀粉降解菌之一,其主要生理作用是降解和利用淀粉来维持自身生长[5]。本试验中,随着精补料能量增加,瘤胃中牛链球菌数量增多。其原因可能是较高能量水平的精补料中,提高了日粮淀粉比例,有利于瘤胃牛链球菌繁殖,导致牛链球菌增加。Tajima等[16]利用实时荧光定量PCR技术研究表明,日粮从干草型转换到谷物型可以显著增加荷斯坦奶牛瘤胃牛链球菌的数量。
4 结 论
随着精补料能量水平增加,肉牛瘤胃中原虫和牛链球菌增加,溶纤维丁酸弧菌减少,从而引起丙酸升高,降低乙酸/丙酸和NH3-N浓度,使微生物蛋白增加。综合考虑,效果最佳的精补料能量水平为高能组(10.19 MJ/kg)。
[1] Tas B M, Susenbeth A. Urinary purine derivates excretion as an indicator of in vivo microbial N flow in cattle: A review[J]. Livest Sci, 2007, 111(3): 181‐192.
[2] Tazzoli M, Trocino A, Birolo M, et al. Optimizing feedefficiency and nitrogen excretion in growing rabbits by increasing dietary energy with high‐starch, high‐soluble fibre, low‐insoluble fibre supply at low protein levels[J]. Livest Sci, 2015, 172: 59‐68.
[3] Belanche A, Doreau M, Edwards J E, et al. Shifts in the rumen microbiota due to the type of carbohydrate and level of protein ingested by dairy cattle are associated with changes in rumen fermentation[J]. J Nutr, 2012, 142(9): 1684‐1692.
[4] Sirohi S K, Dagar S S, Singh N, et al. Dif f erential rumen microbial dynamics and fermentation parameters in cattle fed on high fi bre and high concentrate diets[J]. Int J Anim Nutr, 2013, 30(1): 60‐66.
[5] Wang H, Pan X, Wang C, et al. Ef f ects of dif f erent dietary concentrate to forage ratio and thiamine supplementation on the rumen fermentation and ruminal bacterial community in dairy cows[J]. Anim Prod Sci, 2015, 55(2): 189‐193.
[6] 张海波. 能量水平对瘤胃发酵特性及微生物菌群的影响[D]. 雅安: 四川农业大学, 2012.
[7] Zhang X F, Zhang H B, Wang Z S, et al. Ef f ects of dietary carbohydrate composition on rumen fermentation characteristics and microbial population in vitro[J]. Italian J Anim Sci, 2015, 14: 524‐531.
[8] 中华人民共和国农业部. 中华人民共和国农业行业标准NY/T 815‐2004: 转基因大豆环境安全检测技术规范[S].北京:中国标准出版社, 2004: 4‐21.
[9] 张丽英. 饲料分析及饲料质量检测技术[M]. 北京: 中国农业大学出版社, 2003.
[10] 冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 内蒙古畜牧科学, 1993, (4):40‐41.
[11] Makkar H P S, Becker K. Purine quantif i cation in digesta from ruminants by spectrophotometric and HPLC methods[J]. Brit J Nutr, 1999, 81(2): 107‐112.
[12] Denman S E, Tomk ins N W, McSweeney C S. Quantitation and diversity analysis of ruminal methanogenic populations inresponse to the antimethanogenic compound bromochloromethane[J]. Fmes Mierobiol Eeol, 2007, 62: 313‐322.
[13] DePeters E J, Getachew G, Fadel J G. In vitro gas production as a method to compare fermentation characteristics of steam‐flaked corn[J]. Anim Feed Sci Tech, 2003, 4(105): 109‐122.
[14] Lee M R F, Merry R J, Davies D R, et al. Ef f ect on increasing availability of water‐soluble carbohydrates on in vitro rumen fermentation[J]. Anim Feed Sci Tech, 2003, 104(4): 59‐70.
[15] Faciola A P, Broderick G A. Ef f ects of feeding lauric acid or coconut oil on ruminal protozoa numbers, fermentation pattern, digestion, omasal nutrient fl ow, and milk production in dairy cows[J]. J Dairy Sci, 2014, 97(8): 5088‐5100.
[16] Tajima K, Aminov R I, Nagamine T, et al. Diet‐dependent shifts in the bacterial population of the rumen revealed with real‐time PCR[J]. Appl Environ Microbiol, 2001, 67(6): 2766‐2774.
Rumen Fermentation and Rumen Microbes in Beef Cattle Receiving Diets with Dif f erent Dietary Energy Level of Concentrate Supplement
ZHANG Hai‐bo1*, WANG Zhi‐sheng2
(1. College of Life Science and Environmetal Resource, Yichun University, Jiangxi Yichun 336000, China; 2. Animal Nutrition Institute of Sichuan Agricultural University, Sichuan Ya’an 625014, China)
The objective of the experiment was to evaluate the ef f ects of energy level of concentrate supplement on rumen fermentation characteristics and microbial population in beef cattle. The three concentrate supplement energy levels were low dietary density (7.49 MJ/kg), medium dietary density (8.85 MJ/kg) and high dietary density (10.19 MJ/kg). Rumen fl uid were used to pH, ammonia (NH3‐N), volatile fatty acid (VFA), microbial protein and microbial relative content after 0, 3, 6, 9, and 12 h feeding. Groups were assigned as 3×3 Latin squares design. Results show that the propionic acid (3 , 9 , 12 h and average), microbial protein (9, 12 h and average), protozoa (9, 3, 6, 12 h and average) and Streptococcus bovis (9, 12 h and average) in high energy group were signif i cantly higher than in low energy group (P<0.05), while acetate to propionate ratio (3, 12 h and average) and NH3‐N (3, 6, 9 h and average) and butyrivibrio fi brisolvens (9, 6, 12 h and average) was signif i cantly lower (P<0.05). These results indicated that protozoa and Streptococcus bovis were growth with concentrate supplement of energy increasing, while inhibit butyrivibrio fi brisolvens growth; which increase the propionic acid, decrease acetate to propionate ratio and NH3‐N, so as to make the microbial protein concentration increasing.
Cattle; Energy level; Ruminal fermentation characteristics; Microbial community structure
S823.5
A
10.19556/j.0258-7033.2017-09-097
2017-02-14;
2017-04-18
国家肉牛牦牛产业体系资助项目(CARS-38)和宜春学院博士科研启动基金(3350100050)
张海波(1985-),男,重庆开州人,博士,讲师,主要从事反刍动物营养研究,E-mail: zhanghaiboainide@163. com
* 通讯作者
