杜洛克和长白公猪精子活力与畸形率动态变化的研究
2017-09-20高圣玥黄宣凯王佳辉
高圣玥,黄宣凯,王佳辉
(黑龙江省畜牧研究所,黑龙江齐齐哈尔 161005)
杜洛克和长白公猪精子活力与畸形率动态变化的研究
高圣玥*,黄宣凯,王佳辉
(黑龙江省畜牧研究所,黑龙江齐齐哈尔 161005)
本文旨在研究杜洛克和长白公猪精液稀释后精子活力和畸形率的动态变化。实验选取杜洛克和长白公猪各20头,采集新鲜精液并使用BTS稀释液进行常规稀释,检测稀释后0~96 h 9个时间点精液精子活力和畸形率。结果表明:猪精液稀释0 h精子活力最高,随后逐渐降低,2个品种猪精液稀释72 h后,精子活力出现快速下降,精子畸形率显著升高(P <0.05),杜洛克公猪精液稀释后72 h畸形率(11.1%)、84 h畸形率(13.1%)显著高于长白猪(10.6%、11.8%)(P<0.05),这可能暗示长白猪精液的适宜保存时间要长于杜洛克,但考虑繁殖性能方面,两品种猪精液稀释后保存时间不应超过72 h为宜。
杜洛克;长白猪;精子活力;精子畸形率;动态变化
随着猪精液液态保存技术的发展,猪人工授精技术在养猪生产中广泛应用[1]。常温液态精液保存(17~25℃)与低温(0~5℃)和冷冻(-79~-190℃)保存方式相比,可以提高母猪受胎率和窝产仔数,有利于良种公猪遗传资源的利用[2],具有费用低和操作程序简单等优点[3]。猪精液常温保存的国家标准(GB23238-2009)要求精液在稀释保存3 d后的精子活力不低于0.6、精子畸形率不高于0.1。但常温保存精液的保存时间不稳定,受公猪品种、精液品质、稀释液[4-5]及采精技术等多因素影响,使得人工授精技术在一定区域内较难实现大范围推广。因此,猪精液常温保存时间越来越受到重视。
杜洛克和长白猪在国内外三元杂交中常作第一父本和杂交终端父本,且在筛选猪最优杂交组合中被广泛地应用,因此杜洛克和长白公猪精液稀释与适宜保存时间的研究显得尤为重要。目前,关于常温保存下杜洛克与长白公猪精液活力和畸形率动态变化的研究报道较少。因此,本实验旨在研究杜洛克与长白公猪精液稀释后精子活力和畸形率的动态变化及其差异,探讨两品种公猪精液常温保存的适宜时间,为养猪生产实践中杜洛克和长白猪精液合理保存与利用提供理论依据。
1 材料与方法
1.1 实验猪群与饲养管理 实验猪为黑龙江省畜牧研究所种猪场提供,选取2~4岁、采精时间在6个月以上、精液品质没有不良记录的杜洛克、长白种公猪各20头。种公猪单圈饲养在阳光充足,通风良好的圈舍内,并配有专门取暖用的设备。保持圈舍清洁干燥、冬暖夏凉。猪舍内湿度一般控制在65%左右,温度在18~22℃,不超过26℃。种公猪每天运动0.5~1.0 h,增加体质,强壮四肢,防止蹄病的发生。
1.2 数据采集
1.2.1 精液的采集与稀释 每日早上饲喂1 h后采用手握法采精。选择色泽和气味正常、精子活力在0.8以上,密度为3×108~5×108个/mL的精液[6]。采用商品化的丹麦亚卫Beltsville-TS(BTS)猪精液稀释粉作为常温保存的稀释液,将采集的2个品种种公猪精液按照2∶1的比例,缓慢地将等温稀释液加入精液中,轻轻摇晃混匀。用10层纱布包裹缓慢降温5~10 min,使精液的温度降至17℃,并置于17℃精液保存箱中保存。每隔12 h摇动精液1次,从0 h开始每隔12 h检测精子活力和畸形率,直至稀释后96 h停止。
1.2.2 精子活力的检测 精子活力的测定采用目测法。从恒温箱中取出常温保存精液,用移液枪吸取30μL置于载玻片上,盖上盖玻片后立即在200~400倍光学显微镜下观察。每个样品随机观察3个视野,检测视野中直线前进运动的精子数占总精子数的比例,求其平均值作为精子活力。
1.2.3 精子畸形率检测 精子畸形率检测采用Giemsa染色法。吸取10 μL的原精均匀涂抹在载玻片上,自然晾干,然后用95%酒精固定30 min,自然晾干;再用Giemsa溶液染色2 h,冲洗干净并自然晾干。然后在显微镜(400×)下观察精子形态,计数200个精子,同时记录畸形精子和正常精子,计算畸形精子占总精子数的百分率。
1.3 统计分析 用Excel软件绘制不同时间点精子活力和畸形率的动态变化曲线,对检测指标进行回归分析,采用曲线估计法建立二次回归模型;应用SAS 9.0 软件对上述数据进行单因素方差分析,采用Duncan's法进行多重比较,结果表示为平均值±标准差,数据差异显著用P<0.05表示。
2 结果与分析
2.1 杜洛克和长白公猪原精液品质 如表1所示,杜洛克和长白公猪原精液精子密度、活力、畸形率符合国家标准。其中,长白公猪射精量显著高于杜洛克公猪(P<0.05),而长白公猪精子密度显著低于杜洛克公猪(P<0.05),2个品种精子活力与畸形率无显著差异(P<0.05)。
2.2 两品种猪精液精子活力与畸形率动态变化 如表2所示,两品种猪精子活力都随着稀释时间的增加逐渐降低,精液稀释后0~72 h试验期内各时间点杜洛克猪精子活力均高于长白猪,其中,精液稀释后12 h杜洛克猪精子活力显著高于长白猪(P<0.05),其他各时间点间两品种无显著性差异(P>0.05);两品种猪精子畸形率都随着稀释时间的增加逐渐升高,精液稀释后12 h杜洛克猪精子畸形率显著低于长白猪(P<0.05),而精液稀释后84 h杜洛克猪精子畸形率显著高于长白猪(P<0.05)。

表1 杜洛克和长白猪原精液品质分析(n=20)

表2 杜洛克和长白猪精子活力和畸形率比较 %
2.3 品种内猪精液精子活力和畸形率动态变化
2.3.1 杜洛克猪精子活力与畸形率动态变化 如图1所示,杜洛克猪精子活力整体下降趋势平稳,在72~96 h出现快速下滑,精子畸形率在48 h后出现较大波动,48~72、72~96 h 2个时段出现快速升高,而从整体变化趋势来看,杜洛克猪精子活力和畸形率在精液稀释后72 h分别出现快速下降与升高。杜洛克猪精液稀释后0~96 h,精子活力与精子畸形率拟合二次曲线,拟合度R2分别为0.98和0.99。
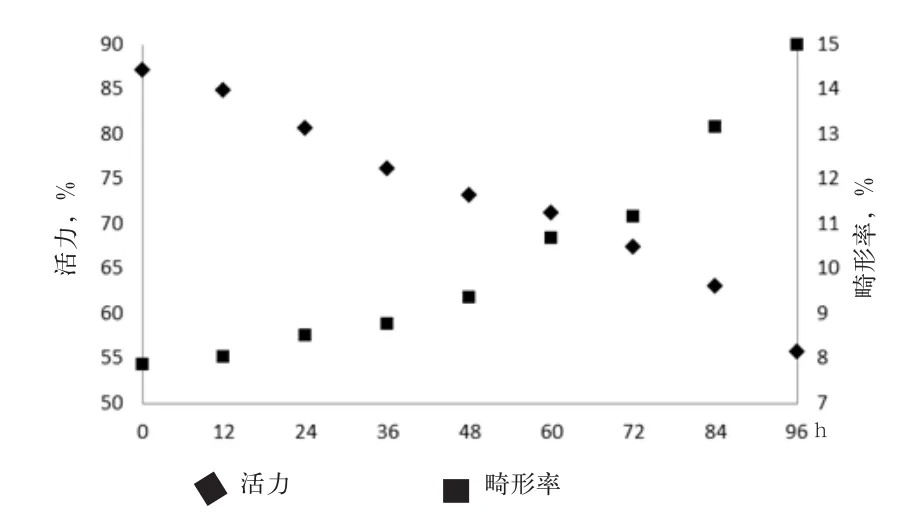
图1 杜洛克猪精子活力和畸形率
2.3.2 长白猪精子活力与畸形率动态变化 如图2所示,长白猪精子活力在36~48 h与72~96 h出现2次快速降低,精子畸形率出现在72~96 h,而从整体变化趋势来看,长白猪精子活力和畸形率在精液稀释后72 h分别出现快速下降与升高。长白猪精液稀释后0~96 h,精子活力与精子畸形拟合二次曲线,拟合度R2分别为0.98和0.97。
2.3.3 品种内猪精液稀释48 h后精子活力和畸形率比较 如表3所示,随着稀释时间的增加,两品种猪精子活力各时间段的下降速率逐渐增加,各时间段畸形率的上升速率逐渐增加。杜洛克精子活力84~96 h的下降速率极显著高于48~60 h(P<0.01),长白猪各时间段精子活力下降速率均差异极显著(P<0.01)。杜洛克精子畸形率在72~84、84~96 h上升速率显著高于60~72 h(P<0.05),长白猪精子畸形率在72~84、84~96 h上升速率极显著高于60~72 h(P<0.01)。
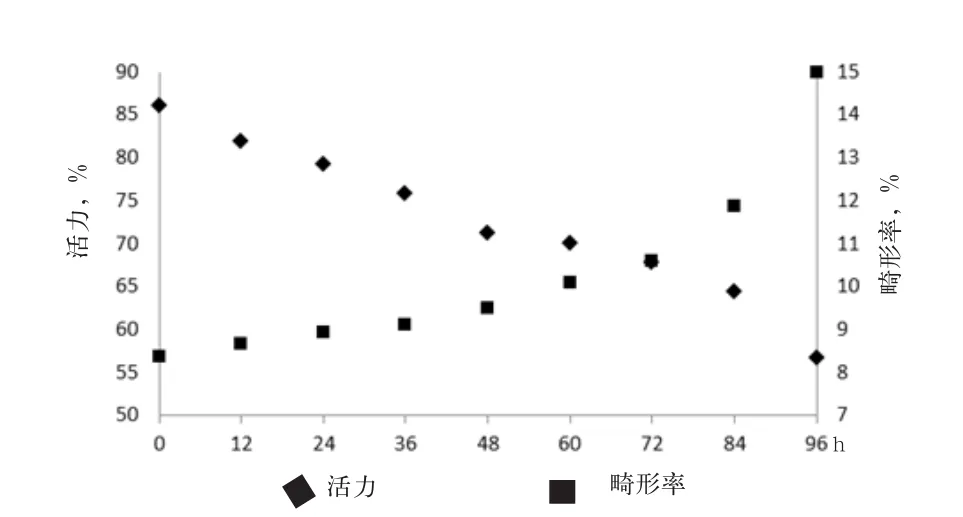
图2 长白猪精子活力和畸形率
3 讨 论
精液在长期保存的过程中,常规的精液参数会发生变化,包括精子活力、精子畸形率、pH以及能量的代谢等[6]。Johnson等[7]报道,在精液长期保存过程中,精子结构和功能发生改变,这种自然老化的过程与稀释条件和长期保存时间有关。本研究结果显示,两品种猪精液稀释后精子活力和畸形率分别随着稀释时间的增加而逐渐降低与升高。这可能是由于猪精液稀释后保存在17℃下,在这种温度下,精子的运动虽然明显减弱或消失,但精子的代谢过程却没有停止,精子需要通过糖酵解途径产生能量来维持细胞代谢[8],导致稀释液中营养成分的降低,从而使精子活力和畸形率发生改变。

表3 精液稀释48 h后精子活力和畸形率比较 %
不同品种公猪精液在体外保存过程中,精子功能的维持能力不同。这种维持能力的不同可以通过精子相关参数体现,如精子质膜完整性、精子活力[9]和精子畸形率。猪精子活力和畸形率的高低与精子能否通过雌性生殖道和卵子进行受精有关,液态猪精液在18~22℃温度下保存3~5 d[7]。本研究结果显示,两品种猪精液稀释72 h后,精子活力出现快速下降,精子畸形率显著升高,杜洛克公猪精液稀释后72、84 h畸形率显著高于长白猪,这可能暗示长白猪精液的适宜保存时间要长于杜洛克,但保存时间超过48~72 h时,精子活力下降会对分娩率和产仔数产生影响[10],因此,考虑繁殖性能方面,两品种猪精液稀释后保存时间不应超过72 h为宜。
本研究拟合了两品种猪精液稀释后0~96 h精子活力和畸形率二次曲线,用于估测各时间点精子活力。结果显示,拟合度均达到95% 以上,其中杜洛克猪精子活力、畸形率拟合度达到98%以上,这表明用多项式曲线方程用以估测不同品种猪精子活力与畸形率是可行的,但猪精子活力与畸形率受品种[11-12]、季节[13]、采精频率[14]、稀释液[5]等多因素的影响,估测准确度还需进一步建模来验证,寻找一种简便、经济且准确的估测方法,从而在养猪生产实践中为不同品种猪精液品质检测提供依据。
4 结 论
猪精液保存时间影响精子活力和畸形率,品种间不同时间点精子活力与畸形率也存在差异。长白猪精液采用BTS稀释液稀释后保存时间可能要长于杜洛克猪,但两品种猪在精液稀释72 h后品质显著降低,这也表明在保证精液品质与受精能力的前提下,两品种猪精液都应在稀释72 h前尽早使用,以免影响后续人工授精效果与繁殖性能。
[1] Boe‐Hansen G B, Christensen P, Vibjerg D et al. Sperm chromatin structure integrity in liquid stored boar semen and its relationships with fi eld fertility[J]. Theriogenology, 2008, 69 (6):728‐36.
[2] 郭年藩. 猪精液常温保存液[J]. 国外畜牧科技, 1990, 6: 21‐22.
[3] 高建明, 虞桂平, 邵世义, 等. 不同稀释液对猪精液常温保存效果的影响[J]. 中国畜牧杂志, 2007, 43(13): 17‐19.
[4] 安秀云. 猪常温精液保存过程中应注意的问题[J]. 黑龙江动物繁殖, 2010, 18(6): 43‐44.
[5] 侯丽鹏. 不同稀释液对猪精液常温保存效果的影响[D]. 杨凌: 西北农林科技大学, 2012: 5‐6.
[6] Vyt P, Maes D, Dejonvkheere E, et al. Comparative study on five different commercial extenders forboar semen[J]. Reprod Domest Anim, 2004, 39:8‐12.
[7] Johnson L A, Weitze K F, Fiser P, et al. Storage of boar semen[J]. Anim Reprod Sci, 2000, 62:143‐72.
[8] Christensen P, Knudsen D P, Wachman H, et al. Quality control in boar semen production by use of the FACSCount AF system[J].Theriogenology, 2004, 62:1218‐28.
[9] Waberski D, Schapmann E, Henning H, et al. Sperm chromatin structural integrity in normospermic boars is not related to semen storage and fertility after routine AI[J]. Theriogenology, 2011, 75(2):337‐45.
[10] 李光轩. 公猪精液品质与母猪繁殖力相关性研究[D]. 杨凌: 西北农林科技大学, 2014: 32‐34.
[11] 孙德林, 吕小燕. 不同品种不同月龄公猪精液的比较研究[J]. 动物科学与动物医学, 2005, 12(2): 58‐59.
[12] 梅军四, 江中良, 袁勤科. 不同品种的种公猪精液品质差异的研究[J]. 畜牧与兽医, 2016, 48(9): 86‐89.
[13] 周春宝, 汪劲能, 陶勇, 等. 不同季节对杜洛克公猪精液品质的影响[J]. 黑龙江动物繁殖, 2006, 14(4) :5‐6.
[14] 梅四军. 采精频率对杜洛克种公猪精液品质的影响[D].杨凌: 西北农林科技大学, 2016: 6‐7.
S828.3
A
10.19556/j.0258-7033.2017-09-065
2017-03-14;
2017-06-15
齐齐哈尔市科技局项目(NYGG-201526)
高圣玥(1978-),男,黑龙江人,副研究员,硕士,研究方向为动物遗传育种与繁殖,E-mail: 1750210645@qq.com
* 通讯作者
