白眉长臂猿感染戊型肝炎病毒的病理学观察
2017-09-18安俊卿戴榕全佘锐萍田纪景石蕊寒常玲玲张成林
安俊卿 戴榕全 汤 金 卢 岩 佘锐萍*田纪景 石蕊寒 常玲玲 张成林*
(1.中国农业大学动物医学院,北京,100193;2.北京动物园,北京,100044)
白眉长臂猿感染戊型肝炎病毒的病理学观察
安俊卿1戴榕全1汤 金1卢 岩2佘锐萍1*田纪景1石蕊寒1常玲玲1张成林2*
(1.中国农业大学动物医学院,北京,100193;2.北京动物园,北京,100044)
稿件运行过程
白眉长臂猿; 戊型肝炎病毒; 肝炎; 肺炎; 肾炎
2010年3月8日,北京动物园1只白眉长臂猿突发死亡,通过组织病理学和免疫组织化学等方法对该病死白眉长臂猿死因进行分析。大体剖检观察显示心脏表面可见灰白色病灶,肝脏表面散在大小不一黄白色病灶,肾脏成土黄色,肺脏大面积出血,胃黏膜有散在出血点,肠道水肿,肠系膜淋巴结肿大。病理组织学观察结果显示心肌坏死严重,肺脏严重出血并含有大量炎性细胞浸润,肝脏肝细胞变性坏死并有大量的炎性细胞浸润,肾脏肾小管上皮细胞变性坏死,肾小管管腔中含有黄绿色的小结晶体,肠黏膜水肿。免疫组织化学检测肝脏、肾脏戊型肝炎病毒ORF 2阳性。综合诊断该白眉长臂猿因感染戊型肝炎病毒而导致抵抗力减弱,从而导致肾脏肾小管蛋白凝集发生结晶,引发尿毒症,而后导致心肌坏死,从而导致死亡。
白眉长臂猿(Hoolockleuconedys)为国家Ⅰ级重点保护动物,世界自然保护联盟(IUCN)中规定为濒危级保护动物[1]。白眉长臂猿分布区域狭窄,数量稀少,现已濒于灭绝。在白眉长臂猿栖息的高黎贡山,国家已建立了自然保护区。
戊型肝炎(HE)是由戊型肝炎病毒(HEV)引起的一种以粪-口途径传播为主的慢性传染性疾病[2]。戊型肝炎是一种人畜共患传染病,常通过污染食物和饮水进行传播,孕妇感染后死亡率可达20%,对人类的健康产生了极大的危害[3]。目前,戊型肝炎在发达及发展中国家均被看作为是一种主要的疾病[4],在我国戊型肝炎的感染率呈逐年递增的趋势。
自从Meng等2003年首次从猪血清分离到猪源戊型肝炎病毒后[5],相继有学者报道牛、犬、兔子和啮齿类动物均可以感染戊型肝炎病毒,戊型肝炎病毒在动物中已广泛存在[6-9]。但对于圈养野生动物戊型肝炎病毒感染的报道相对较少,对于戊型肝炎病毒感染白眉长臂猿的病例还未见有报道。白眉长臂猿和其他长臂猿一样,是灵长类学家、心理学家的重要研究动物。
本研究通过组织病理学和免疫组织化学等方法对白眉长臂猿感染戊型肝炎病毒而引起心力衰竭的死亡病例进行了报道,为进一步防止此类疾病的发生,保护白眉长臂猿的健康提供借鉴与参考。
1 材料与方法
1.1 材料
白眉长臂猿,编号y 09-2,雌性,2009年到北京动物园做繁殖交换,年龄10岁,死前2个月第一次发生腹泻,而后1周化验鞭毛虫阳性,潜血可疑;4 d后稀便化验脓球阳性,鞭毛虫包囊阳性;4 d后又在稀便中发现黏液,但无虫卵。死前1个月粪便中发现大量鞭毛虫滋养体,其他阴性。而后稀便化验鞭毛虫阳性,死前2周稀便,眼观明显黏液,便检黏液阳性,潜血阳性,脓球大量,虫卵阴性。死前10 d出现呕吐水样清亮黏液现象,呕吐物中含有白细胞少量,扁平上皮细胞阳性,水泻潜血阳性,脓球阳性,黏液虫卵阴性,拍片右盆腔有高亮不规则阴影。死前1周,稀便中有疑似胆汁的橘黄色液体,潜血阳性,内有草酸钙结晶。死亡当天血液生化出重度缺钾,15:30见腹部胀,呼吸困难,16:00吐鲜血,16:15抢救无效死亡,死前生化检验,谷丙转氨酶是正常值的3倍。
1.2 方法
取病死金丝猴内脏器官于25mL/L戊二醛-多聚甲醛混合液充分固定后,常规方法成石蜡切片,进行HE染色,Mallory三色染色和HEV免疫组织化学染色(HEV ORF 2抗体,1∶200稀释,购于中杉金桥),重点观察心脏,肝脏,肺脏,肾脏,脾脏和胃肠道的病理变化。
2 结果
2.1 大体剖检观察结果
剖检:尸重8.5 kg。剖检可见全身脂肪黄染。
主要病变:肺脏眼观大面积出血,实变(图1),支气管内含泡沫状血性物;肝脏表面凸凹不平,散在大小不一黄白色的病灶(图2)。肾脏表面色淡褐黄色,切面皮髓界限不明显,实质呈土黄色(图3);心脏外观色淡,表面可见灰白色病灶(图4);淋巴结中央髓质部呈黑色;胃肠道黏膜面苍白,胃黏膜面小面积弥散出血点,肠道全段水肿,肠壁增厚,肠系膜淋巴结均肿大,最大约1 cm×1.5 cm(疑似触诊肿物)。
2.2 组织病理学观察结果
2.2.1 心脏:心肌纤维多见波浪状变化,断裂,肌纤维普遍肿胀、颗粒变性,局部心肌纤维呈条索状溶解性坏死,在血管周围溶解性坏死更明显。间质明显水肿(图5,图6)。
2.2.2 肺脏:肺主要是小叶性化脓性肺炎的变化。镜下可见,有的小叶出现大面积出血和局灶性嗜中性白细胞浸润,嗜中性白细胞大多呈破碎状态。有的肺小叶呈现代偿性支气管高度代偿性扩张。细支气管和肺泡管内常见有炎性细胞浸润(图7,图8,图9)。
2.2.3 肾脏:皮质区:肾小球内系膜细胞增生,基底膜增厚、显现,发生膜性肾小球肾炎,有的肾小球明显萎缩。肾球囊内常见有粉红色蛋白颗粒聚集;肾小管上皮发生玻璃滴样变,或坏死,很多小管内可见黄绿色细小结晶。髓质肾小管普遍显著扩张(图10,图11,图12)。
2.2.4 肝脏:肝小叶界限分明,肝细胞中度脂肪变性,胞浆中充满了空泡,肝小叶周围的肝细胞有大量含铁血黄素沉着。肝呈现在脂肪性变性的基础上局灶性坏死,有可能由于长时间出血形成。汇管区淋巴细胞大量浸润,局部大片纤维组织增生,迪氏隙显现水肿(图13,图14)。
2.2.5 肠道:肠普遍出血,水肿,血液中嗜酸性粒细胞增多。结肠中,黏膜上皮完整,固有层含有大量淋巴细胞浸润并有含铁血黄素,肠道中肥大细胞减少,固有层中可观察到大量原虫滋养体状结构(图15,图16)。
2.2.6 淋巴结:肠系膜淋巴结髓质淋巴窦极度扩张常可见吞噬有橙色结晶的巨噬细胞(图17),肺门淋巴结有碳末(图18)。
2.3 Mallory 三色染色结果
Mallory三色染色结果显示心肌纤维大片溶解性坏死,纤维组织增生,肝脏肝小叶汇管区大量纤维组织增生(图19,图20)。
2.4 肝脏和肾脏HEV免疫组织化学观察结果
HEV免疫组织化学染色显示在肝脏有阳性信号弥散分布于肝细胞的胞浆(图21,图22)。在肾脏中,肾小管上皮细胞的胞浆有阳性信号分布,肾小球呈阴性(图23,图24)。
3 讨论
在本病例的病史中阐述,白眉长臂猿死前有两月腹泻的现象,并检验有鞭毛虫感染。经推测,有可能为贾第鞭毛虫病。贾第鞭毛虫经食物感染在十二指肠内脱囊变成滋养体,在十二指肠壁和胆囊中寄生并繁殖,引起肠炎。贾第虫高发于热带,对于健康动物感染不明显[10]。由于此只白眉长臂猿感染戊型肝炎病毒,从而使自身抵抗力下降,给予了贾第鞭毛虫生存环境,所以出现了腹泻的现象。在肠道的固有层也看到了大量寄生虫样物质。长期的腹泻现象导致了白眉长臂猿全身代谢紊乱,脱水而导致了肾结石。
HE染色镜下观察心脏心肌纤维严重坏死,Mallory三色结果显示心肌纤维大片溶解坏死,大量纤维组织增生,心肌坏死是该白眉长臂猿的致死原因。肾脏有明显的蛋白管型和大量的结晶,根据病史推断,这种结晶可能为草酸钙结晶。大量的远曲小管结石堵塞,使肾远曲小管极度扩张,从而产生尿毒症,引起心肌发生严重的变性坏死。肺组织大面积坏死,肺出血严重,有急性化脓性炎症。肺中组织大量坏死,有出血,大量嗜中性粒细胞浸润,并有浓汁形成。肺炎及肺的大面积出血坏死导致缺氧也是心肌坏死的原因之一。心肌坏死是引起白眉长臂猿死亡的直接因素。
HEV 作为一种人畜共患传染病病原,已受到国内外学者的广泛关注。现已证实猪、牛、禽类和啮齿类动物等动物均可感染戊型肝炎病毒,戊型肝炎在动物中已广泛存在[11-14]。作为一种食源性传染病病原,HEV感染食物的情况也受到了广泛的关注[15-16]。由于HEV 在人畜之间的极大危害性,目前对HEV的致病机理及其感染后对全身各器官的损伤的研究也已有相应的报道[17-19]。
随着HEV宿主的不断扩大,其对圈养野生动物的影响开始受到学者的重视。通过对动物园圈养野生动物HEV流行病学调查,发现在哺乳动物和禽类中均可检测到HEVPCR阳性[20]。Li Heng等曾报道过HEV和真菌混合感染圈养高山兀鹫(Gypshimalayensis)的病例,说明HEV在动物园中的流行状况已受到了学者的广泛关注[21]。本课题组丁叶等曾对戊型肝炎病毒感染大熊猫(Ailuropodamelanoleuca)后其肝脏和肾脏的组织病理学变化做了相应报道[22]。石蕊寒等曾用免疫组化对北京动物园5例灵长类动物戊型肝炎进行过调查,结果表明5例病例的肝脏和肾脏免疫组化染色均呈现不同程度的阳性反应,从而表明在一定程度上北京动物园灵长类动物存在HEV感染[23]。而白眉长臂猿感染HEV的病例还未见有报道。
本研究中病死白眉长臂猿大体剖检显示肝脏表面凹凸不一,肝脏表面有大小不一的黄白色病灶,病理组织学观察结果显示肝外周颜色明显变浅,肝中含铁血黄素沉着明显,汇管区纤维化增生,肝细胞呈现不同程度变性、坏死,汇管区炎性细胞浸润,间质中有少量的淋巴细胞浸润,Mallory三色染色结果显示肝小叶汇管区纤维增生,呈现慢性肝炎症状。
大体剖检图片

图1 肺脏大面积出血Fig.1 Large area of lung hemorrhage

图2 肝脏表面凸凹不平,散在大小不一黄白色病灶Fig.2 The surface of the liver was uneven and scattered with different sizes of yellow white lesions

图3 肾脏切面皮髓界限不明显,实质呈土黄色Fig.3 The boundary of renal cortex and medulla was not obvious, and the color of parenchyma was khaki

图4 心脏外观色淡,表面可见灰白色病灶Fig.4 The color of the heart was light and there are white lesions on the surface

图5 心肌纤维肿胀,呈波浪状(HE,20×)Fig.5 Myocardial fibers were swollen and waved(HE,20×)

图6 心肌纤维大片溶解性坏死(HE,20×)Fig.6 Most of the myocardial fibers were dissolved necrosis(HE,20×)

图7 肺实质大面积出血,嗜中性白细胞浸润(HE,20×)Fig.7 Massive areas of the lung parenchyma were hemorrhage and infiltration of neutrophils(HE,20×)

图8 高倍镜观察,肺出血和嗜中性白细胞浸润(HE,40×)Fig.8 In the high magnification microscopy,the lung was hemorrhage and neutrophil infiltration(HE,40×)

图9 支气管高度代偿性扩张,局部肺泡代偿性扩张(HE,20×)Fig.9 The bronchus were highly compensatory expansion and local alveolars were compensatory expansion(HE,20×)

图10 肾脏肾小管普遍发生玻璃性样变,肾小管管腔中有蛋白管型(HE,20×)Fig.10 Hyaline degeneration was commonly occurred in the renal tubular and protein cast could be observed in the renal tubules(HE,20×)

图11 肾小管中常可见黄绿色细小结晶,有的结晶呈圆形或扇形(HE,40×)Fig.11 Small yellow green crystals could be seen in the tubules,some of which are round or shaped(HE,40×)

图12 肾脏肾球囊明显扩张,囊腔中有粉红色蛋白渗出物,肾小球严重萎缩(HE,40×)Fig.12 The Kimmelstiel was significantly expanded,and there was a pink protein exduation in the glomerular cavity.The glomerular was atrophy severely(HE,40×)

图13 肝小叶界限分明,肝小叶周围的肝细胞有大量含铁血黄素沉着(HE,10×)Fig.13 The boundary of the acini hepatitis is clear and there is a large number of hemosiderosis around the hepatic cells(HE,10×)

图14 汇管普遍淋巴细胞浸润(HE,40×)Fig.14 Lymphocyte cells infiltration in the portal area(HE,40×)

图15 肠黏膜固有层及黏膜下明显水肿红色为潘氏细胞(↑)(HE,40×)Fig.15 Intestinal lamina and submucosal layer was edema.The red was Paneth Cells(↑)(HE,40×)
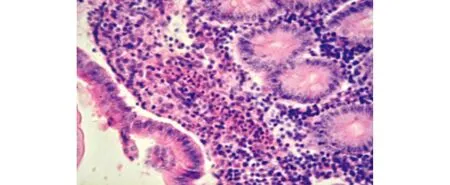
图16 肠黏膜固有层中有炎性细胞浸润(HE,40×)Fig.16 Inflammatory cell infiltration in the lamina of the intestine(HE,40×)

图17 肠系膜淋巴结髓质淋巴窦极度扩张有吞噬橘红色结晶的巨噬细胞(HE,20×)Fig.17 Medullary lymph sinus of the mesenteric lymph nodes were enlargement severely.Macrophages with orange red crystals could be observed(HE,20×)

图18 肺门淋巴结有大量碳末沉着(HE,40×)Fig.18 A large number of carbon can be observed in Hilar lymph node(HE,40×)

图19 心肌纤维大片溶解坏死,纤维组织增生(蓝色)(Mallory 三色染色,20×)Fig.19 Most of myocardial fibers were necrosis and fibrous tissue were proliferation(blue)(Mallory three color stain,20×)

图20 肝小叶汇管区大量纤维组织增生(蓝色)(Mallory三色染色,20×)Fig.20 Proliferation of fibrous tissue in the portal area (blue)(Mallory three color stain,20×)

图21 肝脏中HEV阳性信号广泛分布(HEV免疫组化,10×)Fig.21 Positive HEV signals distribute widely in the liver (HEV immunohistochemistry,10×)

图22 肝细胞胞浆呈强阳性反应(HEV免疫组化,20×)Fig.22 Strong positive signals in the hepatic cell cytoplasm (HEV immunohistochemistry,20×)

图23 肾小管上皮普遍呈HEV阳性反应(HEV免疫组化,20×)Fig.23 HEV positive signals widely distribute in renal tubular epithelium(HEV immunohistochemistry,20×)

图24 HEV阳性信号分布于肾小管上皮细胞胞浆及管腔渗出物中(HEV免疫组化,40×)Fig.24 HEV positive signals distribute in renal tubular epithelial cell cytoplasm and luminal exudates(HEV immunohistochemistry,40×)
由于取材时未能及时冻存新鲜组织,很遗憾没有PCR诊断结果,但有报道显示免疫组织化学染色同样是诊断HEV感染的重要方法之一[24]。HEV免疫组织化学染色显示在其肝脏、肾脏中有阳性信号弥散分布于肝细胞的胞浆及肾小管上皮细胞的胞浆中。这表明病死白眉长臂猿感染了HEV,上述肝脏的病理变化与HEV感染有关。而其死前的生化检查中,谷丙转氨酶是正常值的三倍,进一步验证了此病例白眉长臂猿患有严重的肝炎。
目前,人畜共患传染性疾病感染圈养珍稀野生动物的情况越来越受到人们的重视。圈养动物生活环境被污染,饲养管理方式不当,都会造成机体抵抗力下降、传染性疾病的传播,从而产生巨大的经济损失。因此,对我们应当重视对HEV等一系列食源性传播的病原,保持动物园环境卫生,做好相关生物安全防护工作,严格卫生管理制度,以保障白眉长臂猿等圈养珍稀野生动物的安全。
4 结论
从此病例的发病经过及其大体剖检病变来看,此例白眉长臂猿因感染HEV,导致其抵抗力下降,引起贾第虫感染,以至长期腹泻,使全身代谢平衡紊乱。尤其是肾小管广泛的结石的存在,导致体内代谢产物排泄受阻,引起尿毒症,继而造成大片心肌坏死,是引起此例长臂猿死亡的主要原因。而其肺部的化脓性炎,是导致其死亡的诱发因素。
[1] 魏明.珍贵濒危动物白眉长臂猿[J].科学大观园,2011(1):6.
[2] Meng X J,Halbur P G,Shapiro M S,et al.Genetic and experimental evidence for cross-species infection by swine hepatitis E virus[J].Journal of Virology,1998,72(12):9714-9721.
[3] Emerson S U,Purcell R H.Hepatitis E vrus[J].Reviews in Medical Virology,2003,13(13):145-154.
[4] Aggarwal R,Jameel S.Hepatitis E[J].Hepatology,2011,54(6):2218-2226.
[5] Meng X J.Swine hepatitis E virus:cross-species infection and risk in xenotransplantation[M].Springer Berlin Heidelberg,2003:185-216.
[6] 于品,佘锐萍,夏抗抗,等.免疫组化法检测大鼠肝脏组织中的乙型肝炎病毒和戊型肝炎病毒[J].中国动物检疫,2010,27(9):42-45.
[7] 李睿文,周寅,佘锐萍,等.犬肝脏中戊型肝炎病毒抗原的检测及组织病理学观察[J].动物医学进展,2010,31(S):58-62.
[8] 尹君,佘锐萍,李睿文,等.免疫组织化学法检测北京地区牛肝脏中戊型肝炎病毒抗原[J].动物医学进展,2010,31(S):55-57.
[9] 郭兆杰,佘锐萍,毛晶晶,等.兔肝脏和肠道中戊型肝炎病毒抗原的检测及组织病理学观察[J].中国兽医杂志,2014,50(11):19-20,23.
[10] 齐萌,冯超,吕超超,等.人畜贾第虫病流行概况[J].黑龙江畜牧兽医,2009(10):83-85.
[11] Li W G,She R P,Wei H T,et al.Prevalence of hepatitis E virus in swine under different breeding environment and abattoir in Beijing,China[J].Veterinary Microbiology,2009,133(1/2):75-83.
[12] Yu P,She R P,Xia K K,et al.The immunohistochemical detection of hepatitis B virus and hepatitis E virus on the liver of the rat[J].Chinese Journal of Animal Health Inspection,2010.
[13] Huang F,Li Y,Yu W,et al.Excretion of infectious hepatitis E virus into milk in cows imposes high risks of zoonosis[J].Hepatology,2016,64(2):350-359.
[14] 赵月,佘锐萍,潘辰,等.北京地区屠宰鸡肝脏和肠道戊型肝炎免疫组化检测及组织病理学观察[C].兽医病理学会议论文集,2012.
[15] Peng X,Li R,She R,et al.Prevalence of hepatitis E virus in swine fed on kitchen residue[J].PloS One,2012,7(3):e33480.
[16] Li W G,She R P,Li R W,et al.Investigation of hepatitis E virus infection in the slaughtered swine in Kunming of Yunnan Province[J].Chinese Veterinary Science,2010,40(6):636-641.
[17] Yang Y,Shi R,She R,et al.Effect of swine hepatitis E virus on the livers of experimentally infected mongolian gerbils by swine hepatitis E virus[J].Virus Research,2015,208:171-179.
[18] Mao J,Zhao Y,She R,et al.Detection and localization of rabbit hepatitis E virus and antigen in systemic tissues from experimentally intraperitoneally infected rabbits[J].PLoS One,2014,9(3):e88607.
[19] Soomro M H,Shi R,She R,et al.Antigen detection and apoptosis in Mongolian gerbil’s kidney experimentally intraperitoneally infected by swine hepatitis E virus[J].Virus Research,2016,213(3):343-352.
[20] Zhang W,Shen Q,Mou J,et al.Cross-species infection of hepatitis E virus in a zoo-like location,including birds[J].Epidemiology & Infection,2008,136(8):1020-1026.
[21] Li H,Zhu R,She R,et al.Case report associated with aspergillosis and hepatitis E virus coinfection in himalayan griffons[J].BioMed Research International,2015,2015(10):1-9.
[22] 丁叶,普天春,佘锐萍,等.9例大熊猫肝脏和肾脏的器官病理学观察[J].科技导报,2010,28(4):21-27.
[23] 石蕊寒,佘锐萍,闫鹤.北京动物园5例灵长类动物戊型肝炎疾病调查报告[C]//2012年中国畜牧兽医学会兽医病理学分会暨中国病理生理学会动物病理生理专业委员会学术研讨会论文集,2012.
[24] Ha S K,Chae C.Immunohistochemistry for the detection of swine hepatitis E virus in the liver[J].Journal of Viral Hepatitis,2004,11(3):263-267.
Hylobates hoolock; Hepatitis E virus; Hepatitis; Pneumonia; Nephritis
Observation of the Pathology of Hepatitis E VirusInfection inHoolockleuconedys
An Junqing1Dai Rongquan1Tang Jin1Lu Yan2She Ruiping1*Tian Jijing1Shi Ruihan1Chang Lingling1Zhang Chenglin2*
(1.College of Veterinary Medicine,China Agricultural University,Beijing,100193,China;2.Beijing Zoo,Beijing,100044,China)
On 8 March 2010,aHoolockleuconedysdied suddenly at Beijing Zoo.We conducted histopathology and immunohistochemistry to analyze the cause of death.Gross autopsy showed white lesions on the surface of the heart and different sizes of yellow-white lesions on the surface of the liver.The kidney became soil yellow and severe hemorrhage was found in the lung.There were scattered bleeding spots in the stomach mucous membrane.The intestine showed edema and the mesenteric lymph node was dilated.Per the results of histopathology,the myocardium showed severe necrosis.Many inflammatory cell infiltrations were discovered together with severe pulmonary hemorrhage in the lung.Examination of the liver revealed degeneration,necrosis and inflammatory cell infiltration.Large numbers of tubular epithelial cells were degenerative and obvious yellow green crystals were found in the renal tubes.The intestinal mucosal showed edema.Immunohistochemistry results revealed that HEV ORF 2 antigen was positive in the liver and kidney.Per these results,we established that infection of hepatitis E virus in the Hylobates hoolock caused weakened resistance resulting from protein agglutination in renal tubes which induced crystallization uremia.Finally,myocardial necrosis was severe and led to the death of the gibbon.
Figures of gross lesions
安俊卿,男,24岁,硕士研究生;中国农业大学动物医学院病理与公共卫生研究室。E-mail:904345922@qq.com
*通讯作者:佘锐萍,E-mail:sheruiping@126.com;张成林,E-mail:zhch6465@263.net
2016-09-28
S859.8
A
修回日期:2016-10-18
发表日期:2017-02-10
2310-1490(2017)01-115-07
