持续性心房颤动导管消融术后复发二尖瓣峡部心房扑动不同消融策略的比较
2017-09-18郭雪原董建增龙德勇喻荣辉汤日波白融刘念桑才华蒋晨曦李松南马长生
郭雪原 董建增 龙德勇 喻荣辉 汤日波 白融 刘念 桑才华 蒋晨曦 李松南马长生
持续性心房颤动导管消融术后复发二尖瓣峡部心房扑动不同消融策略的比较
郭雪原 董建增 龙德勇 喻荣辉 汤日波 白融 刘念 桑才华 蒋晨曦 李松南马长生
目的 比较持续性心房颤动(房颤)导管消融术后复发二尖瓣峡部心房扑动(房扑)患者不同消融策略,探讨复发二尖瓣峡部相关房扑的优化消融方案。方法 回顾性分析2010年1月至2012年12月北京安贞医院持续性房颤导管消融后复发,术中电生理检查明确为二尖瓣峡部相关房扑的患者74例。根据再次消融时不同消融策略分为两组:心动过速下消融组(A组,43例)和复律后窦性心律下消融组(B组,31例)。消融终点均为双侧肺静脉电隔离以及左心房顶部线、二尖瓣峡部线、三尖瓣峡部线的双向传导阻滞。术后随访比较两组患者未服用抗心律失常药物情况下窦性心律的维持率。结果 两组患者年龄、性别、体重指数、高血压病、糖尿病、冠心病等比较,差异均无统计学意义(均P>0.05)。两组患者二尖瓣峡部阻断、肺静脉、左心房顶部线及三尖瓣峡部消融线比较,差异均无统计学意义(均P>0.05) ;B组患者手术时间[(132.5±29.6)min比(150.2±41.1)min,P=0.044]、透视时间[(23.1±8.6)min比(27.9±7.2)min,P=0.011]和消融时间[(14.0±4.1)min比(16.3±4.7)min,P=0.027]显著低于A组,差异均有统计学意义。平均随访(16.9±6.3)个月,两组患者窦性心律维持率比较,差异无统计学意义(P=0.771)。结论 持续性房颤初次导管消融术后复发二尖瓣峡部相关房扑的患者,复律后窦性心律下消融与心动过速下消融相比更为简化,长期随访窦性心律维持率无显著差异。
心房颤动;导管消融术;心房扑动
持续性心房颤动(房颤)导管消融术后复发心律失常可有多种类型,这些心律失常通常呈持续发作,多伴快速心室率,症状可能比房颤本身更为明显。房颤再次导管消融时发现绝大多数的房性心动过速(90%)为折返机制,消融终止部位在顶部线、二尖瓣峡部或间隔[1]。大折返房性心动过速中二尖瓣峡部相关的心房扑动(房扑)发生率最高[2-3]。但由于二尖瓣峡部解剖复杂,所以导管消融实现峡部双向传导阻滞较为困难。如何提高持续性房颤患者二尖瓣峡部导管消融的成功率,简化消融过程,提高消融效率,避免过度消融和消融并发症的发生是当前研究的热点。本研究旨在比较持续性房颤导管消融术后复发二尖瓣峡部房扑的不同消融策略,评价对长期预后的影响。
1 对象与方法
1.1 研究对象
回顾性分析2010年1月至2012年12月于北京安贞医院接受房颤再次导管消融,经电生理检查明确诊断为二尖瓣峡部相关房扑的患者74例,其中男49例(66.2%),平均年龄(56.3±6.8)岁。根据再次导管消融时不同消融策略分为两组:心动过速下消融组(A组,43例)和复律后窦性心律下消融组(B组,31例)。所有患者均完成随访。入选标准:既往诊断为持续性房颤(持续时间>1年),初次导管消融时已经消融二尖瓣峡部,本次导管消融经心内电生理检查明确为二尖瓣峡部相关房扑。排除标准:(1)左心室射血分数(left ventricular eject fraction,LVEF)<35%;(2)存在抗凝禁忌证;(3)经食管超声心动图证实左心房血栓、严重瓣膜病和(或)人工瓣膜置换病史。
1.2 电生理检查和导管消融治疗
术中采用芬太尼和咪达唑仑镇静,常规穿刺双侧股静脉,经左侧股静脉放置冠状窦电极,经右侧股静脉成功穿刺房间隔后行左心房及肺静脉造影。采用3.5 mm盐水灌注消融导管,在三维电解剖标测系统(CARTO XP或CARTO 3, Biosense-Webster)指导下进行标测和导管消融。本次术中二尖瓣峡部相关房扑诊断标准[4]如下:(1)Carto激动顺序标测显示心动过速围绕二尖瓣峡部折返;(2)沿二尖瓣环至少两个不同部位拖带标测显示起搏后间期(PPI)与心动过速周长差值小于20 ms。A组患者在心动过速下标测消融二尖瓣峡部传导缝隙,B组患者在窦性心律下起搏冠状静脉窦电极,标测消融线上传导最早部位,消融实现二尖瓣峡部阻滞(图1)。
术后常规应用抗心律失常药物2~3个月,应用华法林抗凝治疗3个月,定期监测凝血功能,维持国际标准化比值(INR)在2.0~3.0。术后定期复查12导联心电图和24 h动态心电图。术后复发定义为3个月空白期之后心电图记录到>30 s的房颤、房扑或房性心动过速发作。
1.3 统计学分析
所有数据采用SPSS 17.0进行统计学处理。正态分布计量资料以(x-±s)表示,组间比较采用独立样本t检验;计数资料以例数和百分比表示,组间比较采用卡方检验或Fisher确切概率法。导管消融术后成功率采用Kaplan-Meier分析和log-rank检验。以双侧检验P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基线资料情况比较(表1)
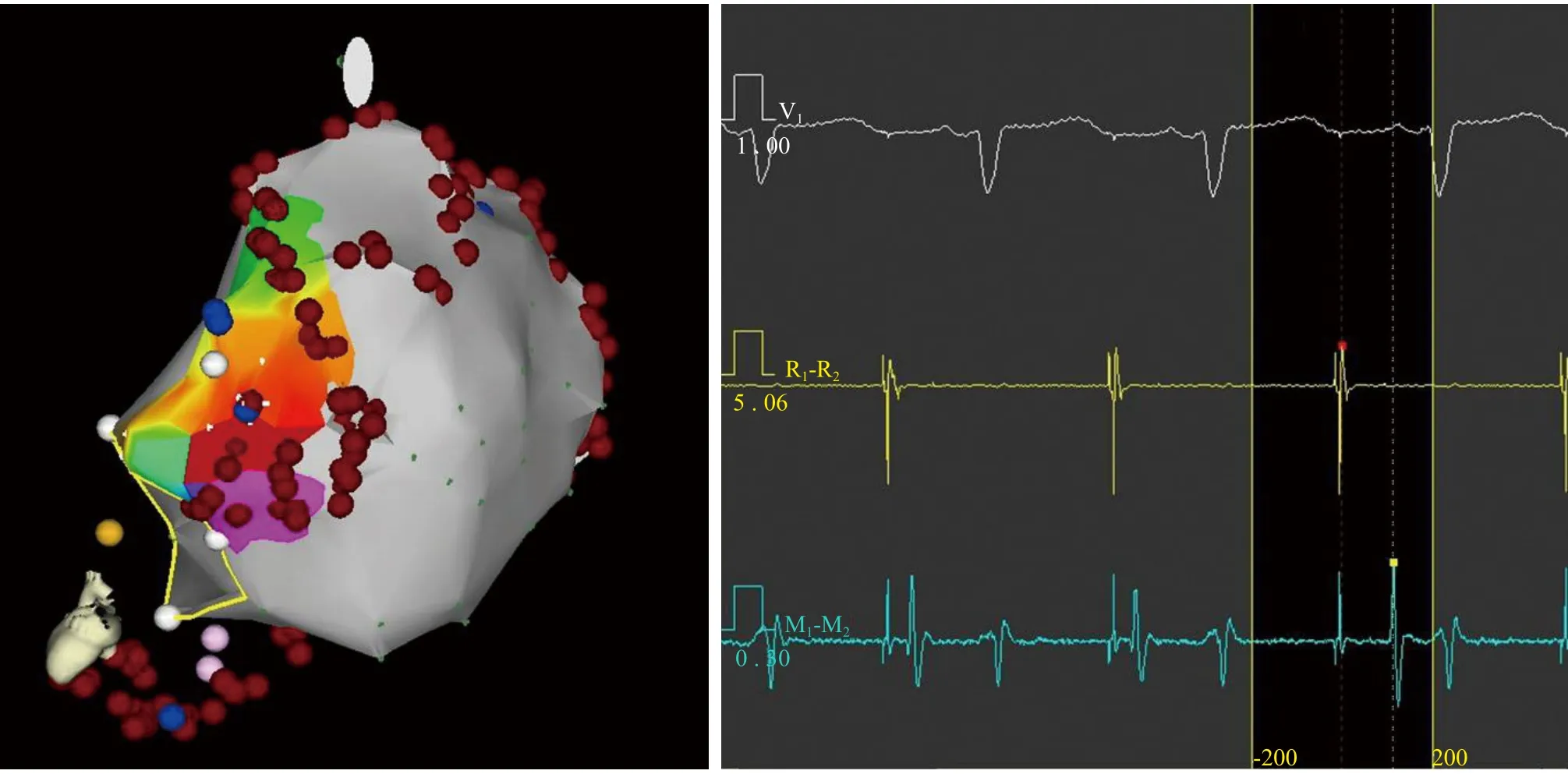
图1 窦性心律下标测消融二尖瓣峡部传导缝隙 窦性心律下冠状窦远端起搏,沿消融线标测起搏信号到局部A波最早间距(SA间期),传导缝隙位于最短SA间期部位,图中蓝点部位导管消融可见SA间期明显延长
两组患者年龄、性别、体重指数、高血压病、糖尿病、冠心病等比较,差异均无统计学意义(均P>0.05)。

表1 基线资料
2.2 电生理检查及导管消融结果(表2)
两组患者二尖瓣峡部阻断、肺静脉、左心房顶部线及三尖瓣峡部消融线比较,差异均无统计学意义(均P>0.05);B组患者手术时间[(132.5±29.6)min比(150.2±41.1)min,P=0.044]、透视时间[(23.1±8.6) min比(27.9±7.2) min,P=0.011]和消融时间[(14.0±4.1) min比(16.3±4.7)min,P=0.027]显著低于A组,差异均有统计学意义。
2.3 随访结果
所有患者平均随访(16.9±6.3)个月,52例(70.3%,52/74)患者未见心律失常发作。两组患者在未服用抗心律失常药物的情况下,A组共31例(72.1%)患者成功维持窦性心律,B组共21例(67.7%)患者成功维持窦性心律。两组患者导管消融成功率比较,差异无统计学意义(P=0.771,图2)。
3 讨论
本研究表明,对于持续性房颤初次导管消融术后复发的二尖瓣峡部房扑,复律后窦性心律下导管消融与心动过速下导管消融成功率比较,差异无统计学意义,而复律后导管消融效率更高。
二尖瓣峡部消融对房颤成功率起着关键作用。Jaïs等[5]报道,阵发性房颤实现肺静脉电隔离后,联合二尖瓣峡部导管消融可将消融成功率从69%提高到87%。Gaita等[6]研究显示,房颤初次或再次导管消融中实现二尖瓣峡部阻滞可以获得较高的长期成功率,而对复发二尖瓣峡部房扑的患者,消融二尖瓣峡部并实现双向传导阻滞可以终止心动过速并获得良好的远期效果。由于二尖瓣峡部解剖结构复杂,实现双向传导阻滞有较大困难。峡部中段心房肌厚难以透壁消融,临近组织如左下肺静脉肌袖、左回旋支分支、Marshall韧带、左心耳嵴部等结构均可影响二尖瓣峡部的完全阻滞。虽然有文献报道二尖瓣峡部阻滞率达到90%以上[7]。但真实情况可能并非如此,而过度消融可能会导致冠状动脉损伤、血栓栓塞和心脏压塞等并发症。

表2 两组患者导管消融手术特征
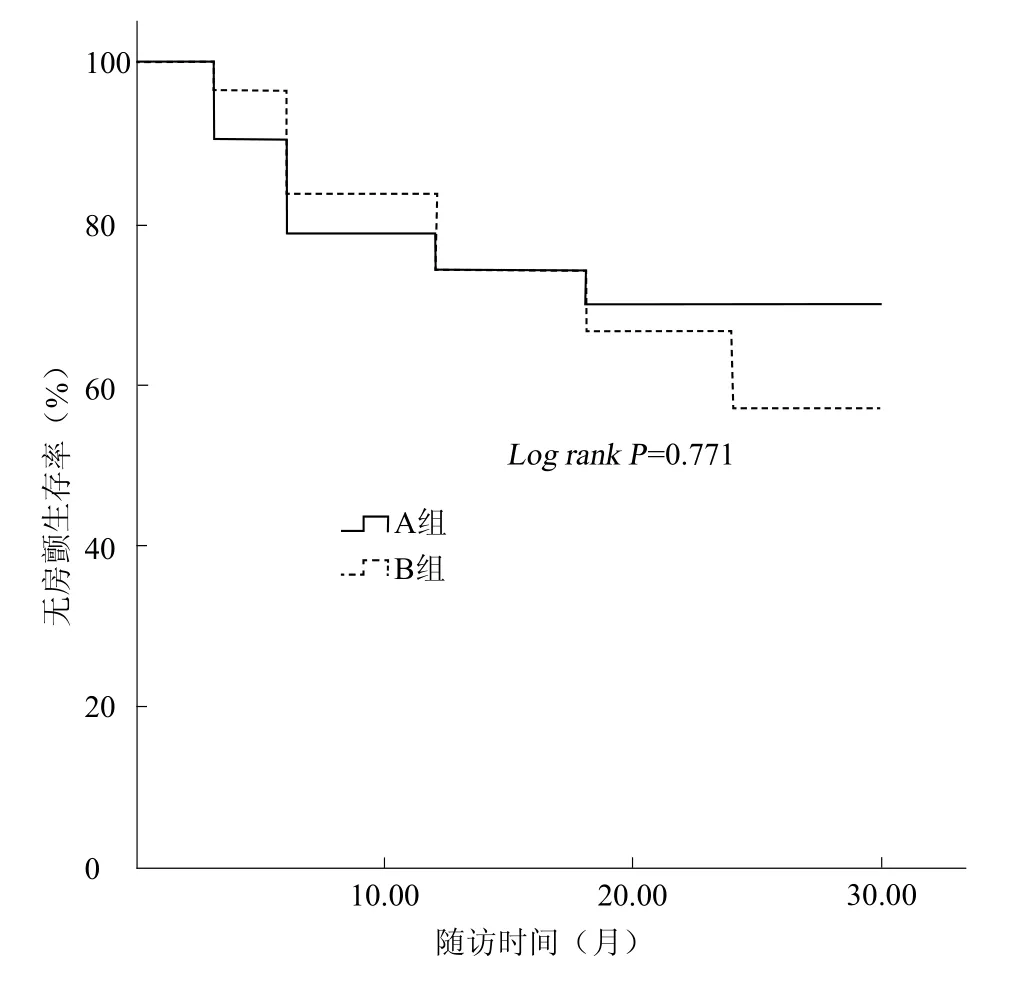
图2 两组患者导管消融术后无房颤复发的Kaplan-Meier生存曲线
由于二尖瓣峡部解剖结构的复杂性,在导管消融过程中保证消融导管与峡部的良好贴靠并保证足够的消融时间是峡部实现阻滞的关键。本中心通常在长鞘的配合下采用倒“U”字法消融二尖瓣峡部,消融开始后适当调整导管的弯度使其在不同部位与心内膜紧密贴靠。在二尖瓣峡部线难以阻滞的情况下,如果盲目大幅度提高输出功率和预设温度,会增加局部心肌内蒸汽爆裂导致心房穿孔的风险。可以在起搏下,在消融线上仔细标测发现消融线上的传导缝隙,对于确实难以阻滞的患者可行影像学检查明确有无解剖结构的异常。
二尖瓣峡部残余传导缝隙可能位于心内膜、心外膜或者左心耳与左上肺静脉间的嵴部。心动过速下难以判断传导恢复的部位,导管消融未能终止心动过速可能会影响术者的判断。此外,盲目过度消融可能会导致组织水肿,使消融更为困难。本中心对60例二尖瓣峡部阻滞的患者进行分析,发现7例(11.7%)在嵴部存在传导缝隙,且可能会导致嵴部相关心动过速;在起搏标测下,在嵴部测量局部的SA间期,可以明确判断并消融成功[8]。PROPOSE研究[9]将房颤导管消融术后二尖瓣峡部依赖房扑患者随机分成仅二尖瓣峡部消融组(32例)和重复肺静脉隔离+非肺静脉触发灶消融组(33例)。术后随访18个月,二尖瓣峡部消融组仅有16%患者无房性心律失常复发,而重复肺静脉隔离+非肺静脉触发灶消融组则有85%患者无复发。这提示对于复发二尖瓣峡部依赖房扑的患者消融非肺静脉触发灶可能更为重要。尽管这一研究有着诸多的局限性,但提示术后复发二尖瓣峡部折返机制可能更为复杂。
一些研究探讨了提高二尖瓣峡部阻滞率的方法。Wong等[10]报道了二尖瓣峡部导管消融过程中使用Agilis可调弯鞘,并使用较高功率(瓣环侧最高可使用50 W/48℃)对二尖瓣峡部消融可以达到较高的阻滞率。Reddy等[11]应用球囊暂时封堵冠状窦口以减少局部冠状动脉的血流散热效应,作为提高导管消融效率和峡部阻滞率的一种方法。而一项随机对照研究显示,球囊暂时封堵冠状窦口的方法可以缩短心内膜消融时间,减少冠状窦内消融,但阻滞率并未提高[12]。对于常规导管消融方法无法实现二尖瓣峡部阻滞的患者可经胸心外膜消融。Berruezo等[13]报道了4例经心外膜导管消融的二尖瓣峡部房扑患者(3例心动过速心肌病),该组患者平均接受了2次以上心内膜和冠状窦内消融均告失败,结果4例均经心外膜消融成功,术后随访18 个月,未见心律失常发作,并且所有患者心功能均恢复正常。上述研究结论尚存争议,有待更多的随机对照研究予以证实,并在临床实践中进一步验证和评价。
本研究的局限性主要为以下几方面:(1) 本研究为回顾性分析,患者样本量较小,抽样误差可能会影响研究结果;(2)缺乏导管消融相关可能并发症,如冠状动脉损伤、左心耳延迟等的数据,可能会影响两组患者的安全性比较结果;(3)本研究对术后复发的识别主要通过患者的症状、心电图和24 h动态心电图检查,可能会低估术后的复发率;(4)随访时间相对较短,两种策略的效果尚需要长期随访评价。
[ 1 ] Chae S, Oral H, Good E, et al. Atrial tachycardia after circumferential pulmonary vein ablation of atrial fibrillation: mechanistic insights, results of catheter ablation, and risk factors for recurrence. J Am Coll Cardiol, 2007,50(18): 1781-1787.
[ 2 ] Cosio FG. Macroreentrant tachycardia after circumferential pulmonary vein ablation. Heart Rhythm, 2005, 2(5): 472-473.
[ 3 ] Sawhney N, Anand K, Robertson CE, et al. Recovery of mitral isthmus conduction leads to the development of macroreentrant tachycardia after left atrial linear ablation for atrial fibrillation. Circ Arrhythm Electrophysiol, 2011,4(6): 832-837.
[ 4 ] Matsuo S, Wright M, Knecht S, et al. Peri-mitral atrial flutter in patients with atrial fibrillation ablation. Heart Rhythm, 2010, 7(1): 2-8.
[ 5 ] Jaïs P, Hocini M, Hsu LF, et al. Technique and results of linear ablation at the mitral isthmus. Circulation, 2004, 110(19): 2996-3002.
[ 6 ] Gaita F, Caponi D, Scaglione M, et al. Long-term clinical results of 2 different ablation strategies in patients with paroxysmal and persistent atrial fibrillation. Circ Arrhythm Electrophysiol, 2008, 1(4): 269-275.
[ 7 ] Shah AJ, Pascale P, Miyazaki S, et al. Prevalence and types of pitfall in the assessment of mitral isthmus linear conduction block. Circ Arrhythm Electrophysiol, 2012, 5(5): 957-967.
[ 8 ] Jiang CX, Dong JZ, Long DY, et al.Ridge-related reentry despite apparent bidirectional mitral isthmus block. Heart Rhythm,2016,13(9):1845–1851
[ 9 ] Bai R, Di Biase L, Mohanty P, et al. Ablation of perimitral flutter following catheter ablation of atrial fibrillation: impact on outcomes from a randomized study (PROPOSE). J Cardiovasc Electrophysiol, 2012, 23(2): 137-144.
[10] Wong KC, Qureshi N, Jones M, et al. Mitral isthmus ablation using steerable sheath and high ablation power: a single center experience. J Cardiovasc Electrophysiol, 2012. 23(11): 1193-1200.
[11] Reddy VY, Ruskin JN, D'Avila A. Balloon occlusion of the coronary sinus to facilitate mitral isthmus ablation. J Cardiovasc Electrophysiol, 2008,19(6): 651.
[12] Wong KC, Jones M, Qureshi N, et al. Balloon occlusion of the distal coronary sinus facilitates mitral isthmus ablation. Heart Rhythm, 2011,8(6): 833-839.
[13] Berruezo A, Bisbal F, Fernández-Armenta J, et al. Transthoracic epicardial ablation of mitral isthmus for treatment of recurrent perimitral flutter. Heart Rhythm, 2014,11(1): 26-33.
Different strategies for the ablation of atrial tachycardia in the redo ablation of persistent atrial fibrillation
GUO Xue-yuan, DONG Jian-zeng, LONG De-yong, YU Rong-hui, TANG Ri-bo, BAI Rong, LIU Nian, SANG Cai-hua, JIANG Chen-xi, LI Song-nan, MA Chang-sheng.
Department of Cardiology, Beijing Anzhen Hospital, Capital Medical University, Beijing 100029, China
Correspoding author: MA Chang-sheng, Email: chshma@vip.sina.com
Objective The recurrence of perimitral atrial tachycardia is common after initial ablation of persistent atrial fibrillation (AF). The aim of the study is to explore a preferable ablation approach for perimitral atrial tachycardia in the redo ablation of persistent AF. Methods Seventy-four patients with perimitral atrial tachycardia after initial ablation for persistent AF were included in our study. Patients were distinguished into either the group of having ablation during tachycardia (Group A) or the group having ablation after cardioversion to sinus rhythm (Group B) according to the differentablation strategies. The procedural endpoints were pulmonary vein isolation and bidirectional conduction block of all the ablated lines. The primary endpoint of the study was freedom from atrial tachyarrhythmia recurrence during the follow-up period. Results There were statistical differences in baseline clinical data between the 2 groups. During the redo procedure, conduction recovery rate across the mitral isthmus (MI), cavotricuspid isthmus and left atial roofline were 100%, 40.5% and 48.6% respectively. The procedural time, fluoroscopy time, mapping time were longer in the patients of group A. During a mean follow-up of (16.9±6.3) months, 31 (72.1%) patients in group A and 21(67.7%) patients in group B maintained in sinus rhythm in the absence of antiarrhythmic durgs (P=0.771) . Conclusion In patients with perimitral atrial tachycardia after initial ablation for persistent AF,ablation in sinus rhythm is a more simplified method and as effective as ablation during tachycardia.
Atrial fibrillation; Catheter ablation;Atrial tachycardia
R541.75
2017-05-09)
10. 3969/j. issn. 1004-8812. 2017. 08. 005
国家自然科学基金项目(81530016,81500270)
100029 北京,首都医科大学附属北京安贞医院心内科
马长生,Email:chshma@vip.sina.com
