人参多糖对冬毛期雄性水貂生产性能、血清生化指标和肠道形态结构的影响
2017-09-16孙伟丽杨雅涵樊燕燕杜东升谷海军李光玉
孙伟丽 张 婷 杨雅涵 王 卓 樊燕燕 李 斌 杜东升 谷海军 李光玉*
(1.中国农业科学院特产研究所,吉林省特种经济动物分子生物学国家重点实验室,长春130112;2.博阳双良饲料有限责任公司,辽中110201;3.吉林特研生物技术有限公司,长春130112)
人参多糖对冬毛期雄性水貂生产性能、血清生化指标和肠道形态结构的影响
孙伟丽1张 婷1杨雅涵1王 卓1樊燕燕1李 斌2杜东升2谷海军3李光玉1*
(1.中国农业科学院特产研究所,吉林省特种经济动物分子生物学国家重点实验室,长春130112;2.博阳双良饲料有限责任公司,辽中110201;3.吉林特研生物技术有限公司,长春130112)
本试验旨在研究饲粮中添加人参多糖对冬毛期雄性水貂生产性能、血清生化指标和肠道形态结构的影响。选择120日龄、健康的当年生短毛黑水貂(雄性)40只,随机分成4组,每组10个重复,每个重复1只。Ⅰ组(对照组)饲喂基础饲粮,Ⅱ、Ⅲ、Ⅳ组分别饲喂在基础饲粮中添加10、50和100 mg/kg(干物质基础)人参多糖的试验饲粮。试验期77 d,其中预试期7 d,正试期70 d。结果表明:饲粮中添加不同水平人参多糖对冬毛期雄性水貂平均日增重、平均日采食量和料重比无显著影响(P>0.05)。皮长随着人参多糖添加水平的提高而增大,Ⅳ组显著高于Ⅰ组(P<0.05);针毛长度在Ⅳ组达到最大值,显著高于Ⅰ组(P<0.05);绒毛高度表现为Ⅲ和Ⅳ组差异不显著(P>0.05),但二者均显著高于Ⅰ和Ⅱ组(P<0.05)。饲粮中添加不同水平的人参多糖对冬毛期雄性水貂血清中蛋白质(如总蛋白、白蛋白、球蛋白和尿素含量)和脂肪代谢相关指标(如总胆固醇和甘油三酯含量)的影响不显著(P>0.05),但总蛋白含量随着人参多糖添加水平的提高有升高的趋势。Ⅲ组血清中丙氨酸氨基转氨酶活性显著高于Ⅰ和Ⅱ组(P<0.05),与Ⅳ组差异不显著(P>0.05);Ⅳ组血清中天门冬氨酸氨基转移酶活性显著高于Ⅰ和Ⅱ组(P<0.05),与Ⅲ组差异不显著(P>0.05);血清中碱性磷酸酶活性在各组间均差异不显著(P>0.05)。Ⅱ、Ⅲ、Ⅳ组血清白细胞介素-6和肿瘤坏死因子-α含量均显著高于Ⅰ组(P<0.05),Ⅱ、Ⅲ、Ⅳ组间差异不显著(P>0.05)。饲粮中添加人参多糖极显著增加了冬毛期雄性水貂空肠的绒毛高度以及绒毛高度/隐窝深度(P<0.01)。综上所述,饲粮中添加50~100 mg/kg人参多糖可改善冬毛期雄性水貂的肠道形态结构,有利于提高营养物质的消化吸收,同时可提高血清中白细胞介素-6和肿瘤坏死因子-α含量,有利于增强机体免疫能力。
水貂;人参多糖;冬毛期;血清生化指标;肠道形态结构
人参多糖(ginseng polysaccharide,GPS)是人参中的重要成分,有研究证明其具有增强免疫力等作用[1]。相比于灵芝多糖、黄芪多糖、香菇多糖等,人参多糖提高免疫力效果更为显著[2]。在南美白对虾[3]及异育银鲫[4]等水产动物的研究中发现人参多糖能通过提高消化酶活性而提高消化功能,能通过调节肝脏中超氧化物歧化酶(SOD)的活性而增强机体免疫力[3-4]。在毛皮动物生产领域,王卓等[5]报道了在育成期水貂饲粮中添加0.9%的果寡糖(FOS)具有替代150 mg/kg土霉素的效果。水貂属于珍贵毛皮动物,其肠道较短,食物消化周期短,肠道排空时间短[6],小肠绒毛结构的改变有利于营养物质的消化吸收。目前还没有人参多糖应用于毛皮动物饲粮的研究,鉴于人参多糖在其他动物生产中的效果,为探索人参多糖对水貂的作用效果及其机制,本试验设置了3个人参多糖梯度,通过对比冬毛期雄性水貂生产性能、血清生化指标以及肠道形态结构的变化,为人参多糖在水貂生产中的应用提供理论支持,为毛皮动物功能性饲料添加剂研发开拓新的思路。
1 材料与方法
1.1试验设计
选择当年出生的120日龄、健康的短毛黑水貂(雄性)40只,随机分成4组,每组10个重复,每个重复1只。Ⅰ组(对照组)饲喂基础饲粮,Ⅱ、Ⅲ、Ⅳ组分别饲喂在基础饲粮中添加10、50和100 mg/kg(干物质基础)人参多糖的试验饲粮。试验期77 d,预试期7 d,正试期70 d。试验期间每天07:00和14:00各饲喂1次,自由饮水,试验期从2015年9月23日至2015年12月8日。
1.2基础饲粮配制及饲养管理
根据NRC(1982)中水貂饲养标准结合课题组多年来取得的水貂冬毛期营养需求量设计基础饲粮。基础饲粮由鸡骨架、鱼等鲜饲料原料组成,其组成及营养水平见表1。人参多糖由中国农业科学院特产研究所药用植物资源创新团队提供,制作方法为:将干燥人参根浸泡、热水煮提、2次乙醇沉淀后得到人参多糖,产率为10%;以葡萄糖为标准品,采用苯酚硫酸法[7]测得总糖含量为90%。
1.3测定指标与方法
1.3.1 饲粮常规养分含量
饲粮中水分、粗蛋白质、粗脂肪、粗灰分、钙、磷含量测定参考文献[8]的方法。
代谢能(设定蛋白质消化率为85%,粗脂肪消化率为90%,碳水化合物消化率为60%)和碳水化合物含量通过计算得出,计算公式如下:
代谢能(MJ/kg)=[粗蛋白质含量(%)×0.85×18.82(MJ/kg)+粗脂肪含量(%)×0.90×39.73(MJ/kg)+碳水化合物含量(%)×0.60×17.56(MJ/kg)]/100;碳水化合物含量(%)=干物质含量(%)-粗蛋白质含量(%)-粗脂肪含量(%)-粗灰分含量(%)。
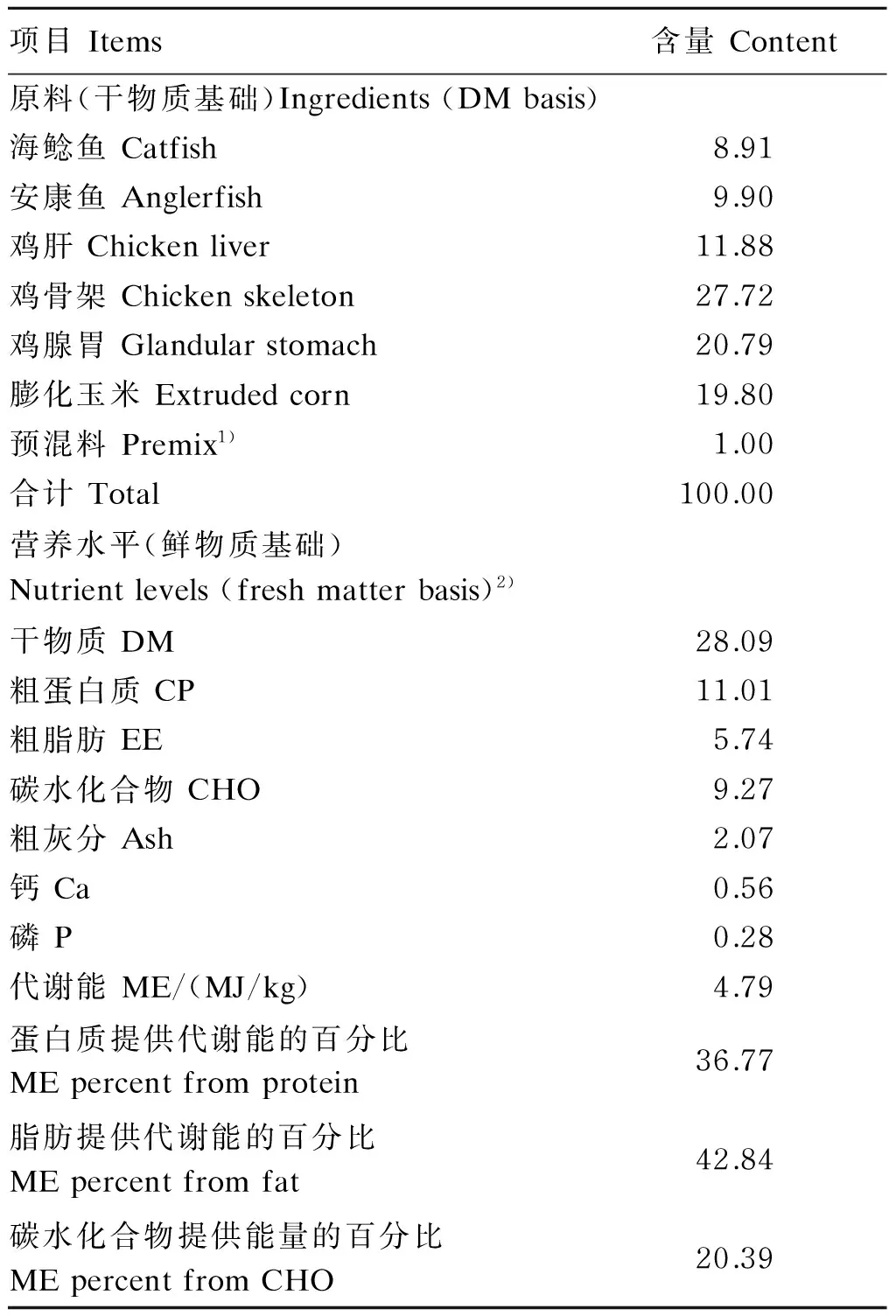
表1 基础饲粮组成及营养水平
1)预混料为每千克饲粮提供The premix provided the following per kg of the diet:VA 10 000 IU,VD32 000 IU,VE 100 IU,VB16 mg,VB210 mg,VB66 mg,VB120.1 mg,VK31 mg,VC 400 mg,烟酸 nicotinic acid 30 mg,D-泛酸D-pantothenic acid 40 mg,生物素 biotin 0.2 mg,叶酸 folic acid 1 mg,胆碱 choline 400 mg,Fe 82 mg,Cu 20 mg,Mn 120 mg,Zn 50 mg,I 0.5 mg,Se 0.2 mg,Co 0.3 mg。
2)代谢能和碳水化合物为计算值,其余为实测值。ME and CHO were calculated values, while and others were measured values.
1.3.2 生长性能
正式试验开始后,每隔2周早上空腹称量体重,计算平均日增重;每天记录采食量,计算平均日采食量;根据平均日增重和平均日采食量计算料重比。
1.3.3 血清生化指标
饲养试验结束后,每组分别选取8只水貂,每只心脏采血10 mL,置于促凝固管中,静置待血清析出后3 500 r/min 4 ℃离心10 min,将分离出的血清分装在1.5 mL的Eppendorf管中,置于-80 ℃中保存,备用。血清生化指标中,天门冬酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)活性及白蛋白(ALB)、总蛋白(TP)、球蛋白(GLO)、尿素(UREA)、总胆固醇(TC)、甘油三酯(TG)含量采用全自动生化分析仪(Selectra E,荷兰)测定,试剂盒购自中生北控生物科技有限公司,严格按照说明书操作;白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)采用酶联免疫吸附试验(ELISA)试剂盒测定,试剂盒购自南京建成生物工程研究所。
1.3.4 毛皮品质
饲养试验结束后,每组10只水貂全部屠宰,获取皮张,皮张烘干后测定皮长及针毛和绒毛高度。
1.3.5 肠道形态结构
10只水貂全部屠宰后,将每只水貂的空肠肠管纵向剖开,取上表面为1 cm×1 cm的空肠组织1块,生理盐水冲洗后,放入10%甲醛溶液中固定,接着将固定的标本经脱水→透明→浸蜡→包埋→修块→切片→展片→常规苏木精-伊红(HE)染色等处理后,制成4~6 μm厚的石蜡切片[9]。挑选制作合格的切片,用显微镜(Leica DM1000,德国)在100倍下随机选择多个非连续性视野观察切片,并挑选典型视野拍摄成图片,使用软件Toupview测定肠绒毛长度、隐窝深度,并计算绒毛高度/隐窝深度(V/C)。每只动物取不相邻的6张切片,每个切片读取5个数据。
1.4数据处理与统计分析
试验结果以“平均值±标准差”表示,数据采用Excel 2007整理后,用SAS V8软件的单因素方差分析(one-way ANOVA)程序进行方差分析,并采用Duncan氏法进行组间差异显著性的多重比较,P<0.01为差异极显著,P<0.05为差异显著。
2 结 果
2.1人参多糖对冬毛期雄性水貂生产性能的影响
2.1.1 生长性能
由表2可知,饲粮中添加不同水平的人参多糖对冬毛期雄性水貂平均日增重、平均日采食量和料重比均无显著影响(P>0.05)。
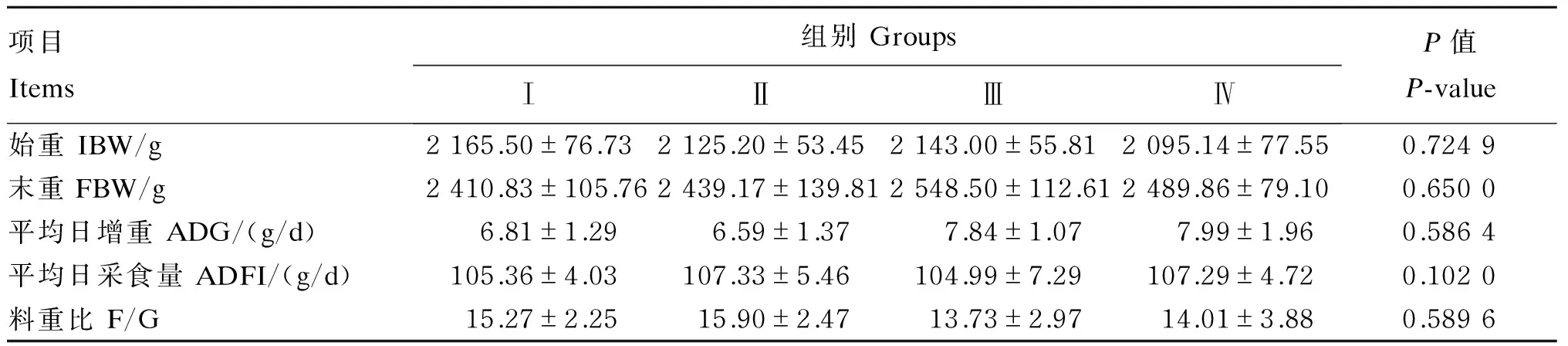
表2 人参多糖对冬毛期雄性水貂生长性能的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异显著(P<0.05)。下表同。
In the same row, values with the same or no letter superscripts mean no significant different (P>0.05), while with different small letter superscripts mean significant different (P<0.05), and with different capital letter superscripts mean significant different (P<0.05). The same as below.
2.1.2 毛皮品质
由表3可知,饲粮中添加不同水平的人参多糖对冬毛期雄性水貂皮长和针毛、绒毛高度均有显著影响(P<0.05)。其中,皮长随着人参多糖添加水平的提高而增大,Ⅳ组达到最大值(60.21 cm),显著高于Ⅰ组(P<0.05);针毛长度也在Ⅳ组达到最大值(23.08 cm),显著高于Ⅰ组(P<0.05);绒毛高度表现为Ⅲ和Ⅳ组差异不显著(P>0.05),但二者均显著高于Ⅰ和Ⅱ组(P<0.05)。
2.2人参多糖对冬毛期雄性水貂血清中蛋白质、脂肪代谢相关指标和部分酶活性的影响
由表4可知,饲粮中添加不同水平的人参多糖对冬毛期雄性水貂血清中蛋白质代谢相关指标如总蛋白、白蛋白、球蛋白和尿素含量的影响不显著(P>0.05),但总蛋白含量随着人参多糖添加水平的提高有升高的趋势。血清中脂肪代谢相关指标如总胆固醇和甘油三酯含量不受饲粮中人参多糖添加水平的显著影响(P>0.05)。对于血清中部分酶活性,Ⅲ组的丙氨酸氨基转氨酶活性显著高于Ⅰ和Ⅱ组(P<0.05),与Ⅳ组差异不显著(P>0.05);Ⅳ组天门冬氨酸氨基转移酶活性显著高于Ⅰ和Ⅱ组(P<0.05),与Ⅲ组差异不显著(P>0.05);碱性磷酸酶活性在各组间均差异不显著(P>0.05)。

表3 人参多糖对冬毛期雄性水貂毛皮品质的影响
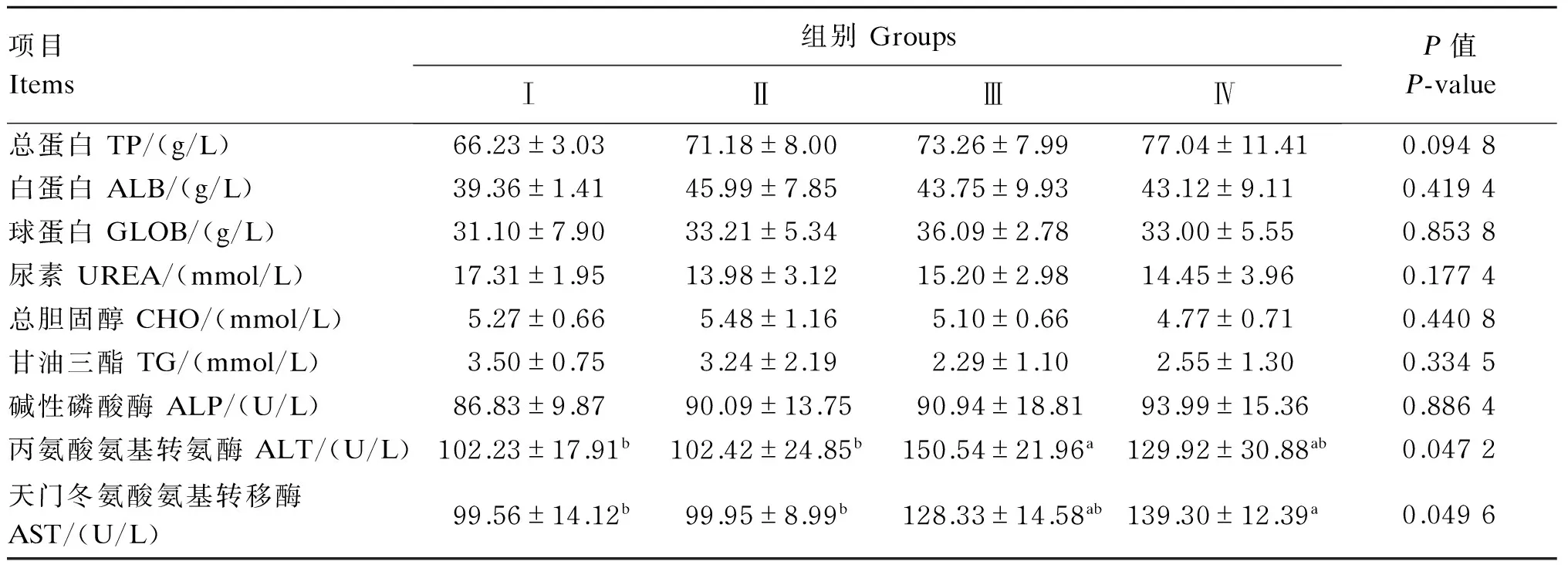
表4 人参多糖对冬毛期雄性水貂血清蛋白质、脂肪代谢相关指标和部分酶活性的影响
2.3人参多糖对冬毛期雄性水貂血清部分免疫指标的影响
由表5可知,饲粮中添加不同水平的人参多糖对冬毛期雄性水貂血清白细胞介素-6和肿瘤坏死因子-α含量有显著影响(P<0.05)。其中,Ⅱ、Ⅲ、Ⅳ组血清白细胞介素-6和肿瘤坏死因子-α含量均显著高于Ⅰ组(P<0.05),Ⅱ、Ⅲ、Ⅳ组间差异不显著(P>0.05)。血清白细胞介素-2含量各组间差异不显著(P>0.05)。

表5 人参多糖对冬毛期雄性水貂血清部分免疫指标的影响
2.4人参多糖对冬毛期雄性水貂肠道形态结构的影响
由表6可知,饲粮中添加不同水平的人参多糖对冬毛期雄性水貂空肠绒毛高度、隐窝深度以及绒毛高度/隐窝深度均有极显著影响(P<0.01)。其中,Ⅰ组绒毛长度及绒毛高度/隐窝深度均极显著低于Ⅱ、Ⅲ、Ⅳ组(P<0.01),Ⅱ、Ⅲ、Ⅳ组之间差异不显著(P>0.05);Ⅰ组隐窝深度极显著高于Ⅱ、Ⅲ、Ⅳ组(P<0.01),Ⅱ、Ⅲ、Ⅳ组之间差异不显著(P>0.05)。
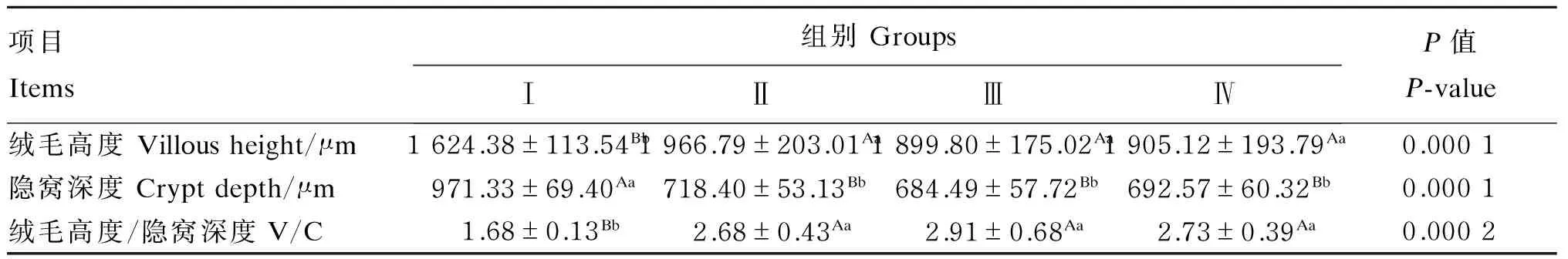
表6 人参多糖对冬毛期雄性水貂肠道形态结构的影响
3 讨 论
3.1人参多糖对冬毛期雄性水貂生产性能的影响
冬毛期水貂以毛皮生长发育为主,因骨骼生长期已过,主要是肌肉的生长和脂肪的沉积,体增重缓慢,尤其是在11月中旬接近取皮期的10 d左右,体重呈现不增加趋势,甚至个别水貂体重略有下降。本研究中,水貂平均日增重各组间差异不显著,平均日采食量和料重比各组间也无显著变化,说明人参多糖对于冬毛期雄性水貂体重增长无明显调节作用。毛皮品质是评价冬毛期水貂生产性能的直接指标。本试验对冬毛期末雄性水貂的皮长、针毛与绒毛高度做了检测,结果发现,随着人参多糖添加水平的提高,雄性水貂皮长以及针毛与绒毛高度均有所增加,且人参多糖添加水平为100 mg/kg时与对照组相比上述指标均达到显著水平。
3.2人参多糖对冬毛期雄性水貂血清生化指标的影响
研究表明,动物的饲粮营养水平、饲粮中功能性添加剂以及内分泌情况等因素会影响到血液中的许多生化指标,血清生化指标是反映动物体某些组织器官机能变化和物质代谢的重要特征,也可反映动物体内营养物质的沉积状况[9]。血清中白蛋白和球蛋白组成了总蛋白,研究表明,血清白蛋白含量反映了机体蛋白质合成代谢的情况,血清总蛋白的含量高有利于促进动物生长并且提高饲料转化率[10]。尿素是哺乳动物蛋白质分解代谢的终产物,在肝脏内通过鸟氨酸循环合成,主要由肾脏排泄。血清尿素含量主要受肾功能以及蛋白质摄入量和分解代谢情况的影响。在水产养殖中,陈勇等[4]报道人参多糖能促进消化酶的分泌、消化肠道内有益菌的繁殖,从而增强异育银鲫的消化功能。习欠云等[3]研究发现人参多糖复合物对南美白对虾的相对增重率无显著影响。本试验中,随着饲粮中人参多糖添加水平的提高,血清总蛋白含量逐渐升高,但饲粮中添加不同水平人参多糖对冬毛期雄性水貂血清白蛋白、球蛋白、总蛋白以及尿素含量均没有产生显著影响,说明人参多糖对水貂蛋白质代谢有促进作用但并没有达到显著效果。血清甘油三酯和总胆固醇含量是反映机体脂肪代谢的指标。本试验中未观察到在饲粮中添加人参多糖有改善水貂脂肪代谢的功能。
血清酶活性高低与相应组织器官的代谢水平和功能状态密切相关,因为绝大部分血清酶来自于动物的各种组织器官,各器官的机能反映了整个动物机体的调节适应以及应激能力[11]。血清酶中的碱性磷酸酶、丙氨酸氨基转氨酶和天门冬氨酸氨基转移酶活性主要反映了肝功能状态[12]。机体处于正常生理状态时,这些酶分布在组织中,在血清中活性较低,一旦某些组织细胞受损时,细胞膜通透性增加,细胞液中的这些酶释放进入血液,使得血清中酶的活性升高[13]。本试验中,Ⅲ组血清丙氨酸氨基转氨酶活性显著高于Ⅰ和Ⅱ组,与Ⅳ组差异不显著,Ⅳ组血清天门冬氨酸氨基转移酶活性显著高于Ⅰ和Ⅱ组,与Ⅲ组差异不显著,同时屠宰试验中并未发现肝脏受损的现象。
已有研究表明,人参多糖和猪苓多糖对大鼠肠道黏膜淋巴细胞功能有显著影响,可以使大鼠外周血单个核细胞(PBMC)和旁血小板溶蛋白(PPL)培养上清液中肿瘤坏死因子-α和干扰素-γ(IFN-γ)含量升高,对大鼠肠道黏膜淋巴细胞功能具有调节作用[14]。另有研究表明,人参多糖能促进黑鲷生长并影响黑鲷的非特异性免疫功能[15]。总结已有研究结果,人参多糖提高机体免疫力的途径主要是调节与免疫相关的基因表达,刺激免疫因子分泌或提高机体抗菌酶活性等。本试验中,在冬毛期雄性水貂饲粮中添加人参多糖显著提高了血清中白细胞介素-6和肿瘤坏死因子-α含量,表明人参多糖通过改变血清免疫因子的含量来增强机体的免疫能力,进而提高抵抗疾病的能力。
3.3人参多糖对冬毛期雄性水貂肠道形态结构的影响
小肠是营养物质消化吸收的主要场所,肠道形态结构与其消化吸收功能密切相关。水貂属于珍贵毛皮动物,其肠道较短,食物消化周期短,肠道排空时间短[6],小肠绒毛结构的改变有利于营养物质的消化吸收。绒毛高度增加后会使小肠接触营养物质的面积增大,从而增强小肠对营养物质的吸收,所以小肠绒毛的形态直接和机体的生长发育有关[16]。小肠绒毛高度、隐窝深度、绒毛高度/隐窝深度都能够反映肠道的功能状态[17],一般认为,绒毛高度/隐窝深度能综合反映小肠的功能状态,较高的绒毛高度/隐窝深度反映了较高的养分吸收能力和较快的生长速度[18]。本试验所使用的人参多糖是从人参中提取的具有特殊生物活性的多糖混合物[8-9]。在水产养殖中,陈勇等[4]报道人参多糖能增进消化酶的分泌、肠道内有益菌的繁殖,从而提高异育银鲫的消化功能。本试验中,在冬毛期雄性水貂饲粮中添加人参多糖极显著地增加了绒毛高度和绒毛高度/隐窝深度,表现为Ⅱ、Ⅲ、Ⅳ组极显著高于Ⅰ组,Ⅱ、Ⅲ、Ⅳ组间差异不显著,说明人参多糖通过增加绒毛高度/隐窝深度调节肠道形态结构,增加营养物质的吸收面积,进而促进营养物质的吸收和利用。
4 结 论
综上所述,饲粮中添加50~100 mg/kg人参多糖可改善冬毛期雄性水貂的肠道形态结构,有利于提高营养物质的消化吸收,同时可提高血清中白细胞介素-6和肿瘤坏死因子-α含量,有利于增强机体免疫能力。
[1] 张彬,林瑞超,冯芳.人参多糖的研究概况[J].中国药事,2004,18(9):566-569.
[2] 李珊珊,金银萍,姚春林,等.人参多糖的结构与活性研究进展[J].中国中药杂志,2014,39(24):4709-4715.
[3] 习欠云,刘小龙,方淑娴,等.人参多糖复合物对南美白对虾免疫增强效果的研究[J].饲料工业,2009,30(6):15-17.
[4] 陈勇,周洪琪.三种多糖对异育银鲫肠道、肝胰脏蛋白酶和淀粉酶活性的影响[J].上海水产大学学报,2005,14(4):4468-4471.
[5] 王卓,孙伟丽,樊燕燕,等.果寡糖对育成期水貂生长性能、营养物质消化率、氮代谢和血清生化指标的影响[J].动物营养学报,2015,27(11) :3613-3619.
[6] 李光玉、杨福合.狐貉貂养殖新技术[M]北京:中国农业科学技术出版社,2006.
[7] 宋利华,王红梅,萧伟.人参多糖的分级及其免疫活性初探[J].中国实验方剂学杂志,2012,18(14):162-166.
[8] 张丽英.饲料分析及饲料质量检测技术[M].2版.北京:中国农业大学出版社,2003.
[9] WANG J P,YOO J S,KIM H J,et al.Nutrient digestibility, blood profiles and fecal microbiota are influenced by chitooligosaccharide supplementation of growing pigs[J].Livestock Science,2009,125(2/3):298-303.
[10] SAGER S M,LANDRY D,MILLAR W J,et al.Depletion of somatostatin-like immunoreactivity in the rat central nervous system by cysteamine dministraion[J].Journal of Neuroscience,1982,2(2):225-231.
[11] GAUGHAN J B,MADER T L.Effects of sodium chloride and fat supplementation on finishing steers exposed to hot and cold conditions[J].Journal of Animal Science,2009,87(2):612-621.
[12] STRANGE R J,SCHRECK C B,GOLDEN J T.Corticoid stress responses to handling and temperature in salmonids[J].Transactions of the American Fisheries Society,1977,106(3):213-218.
[13] RADOSTITS O M,GAY C C,BLOOD D C,et al.Veterinary medicine:a textbook of the diseases of cattle,sheep,pigs,goats and horses[M].9th ed.London:Saunders Ltd.,2000:1819-1822.
[14] 张皖东,吕诚,刘振丽,等.人参多糖和猪苓多糖对大鼠肠道黏膜淋巴细胞功能的影响中草药[J].中草药,2007,38(2):221-224.
[15] 李春震,胡鲲,唐雪莲,等.人参多糖对黑鲷生长性能及抗氧化酶mRNA表达的影响[J].华中农业大学学报,2015,34(6):94-100.
[16] CASPARY W F.Physiology and pathophysiology of intestinal absorption[J].American Journal of Clinical Nrtrition,1992,55(1):2995-3085.
[17] WINZELL M S,SVENSSON H,ARNER P,et al.The expression of hormone-sensitive lipase in clonal β-cells and rat islets is induced by long-term exposure to high glucose[J].Diabetes,2001,50(10):2225-2230.
[18] WU Y B,RAVINDRAN V,THOMAS D G,et al.Influence of method of whole wheat inclusion and xylanase supplementation on the performance,apparent metabolisable energy,digestive tract measurements and gut morphology of broilers[J].British Poultry Science,2004,45(3):385-394.
*Corresponding author, professor, E-mail: tcslgy@126.com
(责任编辑 菅景颖)
Effects of Ginseng Polysaccharide on Performance, Serum Biochemical Indexes and Intestinal Morphology of Male Minks during Winter Hair Period
SUN Weili1ZHANG Ting1YANG Yahan1WANG Zhuo1FAN Yanyan1LI Bin2DU Dongsheng2GU Haijun3LI Guangyu1*
(1. Jilin Provincial Key Laboratory for Molecular Biology of Special Economic Animals, Institute of Special Animal and Plant Sciences, Chinese Academy of Agriculture Sciences, Changchun 130112, China; 2. Shenyang Boyang Feed Co., Ltd., Liaozhong 110201, China; 3. Jilin Teyan Biotechnology Co., Ltd., Changchun 130112, China)
This experiment was conducted to study the effects of diets supplemented with ginseng polysaccharide on performance, serum biochemical indexes and intestinal morphology of male minks during winter hair period. Forty healthy underyearling short hair black male minks at the age of 120 days were randomly divided into 4 groups with 10 replicates per group and 1 mink per replicate. Minks in group Ⅰ (control group) were fed a basal diet, and those in groups Ⅱ, Ⅲ and Ⅳ were fed the basal diet supplemented with 10, 50 and 100 mg/kg ginseng polysaccharide, respectively. The trial lasted for 77 d with 7 d of pretrial period and 70 d of test period. The results showed as follows: diets supplemented with different levels of ginseng polysaccharide had no significant effects on average daily gain, average daily feed intake and feed/gain (P>0.05). Skin length was increased with the ginseng polysaccharide supplemental level increasing, and it in group Ⅳ was significantly higher than that in group Ⅰ (P<0.05); aciculum length in group Ⅳ was the highest and was significantly higher than that in group Ⅰ (P<0.05); villus height in groups Ⅲ and Ⅳ was not significant different (P>0.05), and it in groups Ⅲ and Ⅳ was significantly higher than that in groups Ⅰ and Ⅱ (P<0.05). Diets supplemented with different levels of ginseng polysaccharide had no significant effects on serum protein (total protein, globulin and urea contents) and fat metabolism related indices (total cholesterol and triglyceride contents) (P>0.05), but the total protein had an increase trend with the ginseng polysaccharide supplemental level increasing. Serum alanine aminotransferase (ALT) activity in group Ⅲ was significantly higher than that in groups Ⅰ and Ⅱ (P<0.05), but had no significant difference compared with group Ⅳ (P>0.05); serum aspartate aminotransferase (AST) activity in group Ⅳwas significantly higher than that in groups Ⅰ and Ⅱ (P<0.05), but had no significant difference compared with group Ⅲ (P>0.05); no significant difference was found in serum alkaline phosphatase (ALP) activity among all groups (P>0.05). Serum interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) contents in groups Ⅱ, Ⅲ and Ⅳ were significantly higher than those in group Ⅰ (P<0.05), but no significant differences were found among groups Ⅱ, Ⅲ and Ⅳ (P>0.05); jejunum villous height and villous height/crypt depth were significantly increased by adding ginseng polysaccharide (P<0.01). In conclusion, diet supplemented with 50 to 100 mg/kg ginseng polysaccharide can improve the intestinal morphology of male minks during winter hair period which benefiting for enhancing the digestion and absorption of nutrients, and enhance the IL-6 and TNF-α contents in serum which benefiting for enhancing the body immunity.[ChineseJournalofAnimalNutrition,2017,29(9):3308-3315]
minks; ginseng polysaccharide; winter hair period; serum biochemical indexes; intestinal morphology
10.3969/j.issn.1006-267x.2017.09.035
2017-02-27
吉林省科技发展计划项目(20150101112JC);中国农业科学院科技创新工程(CAAS-ASTIP-2017-ISAPS)
孙伟丽(1982—),女,黑龙江牡丹江人,博士研究生,研究方向为特种经济动物营养与饲养。E-mail: tcsswl@163.com
*通信作者:李光玉,研究员,博士生导师,E-mail: tcslgy@126.com
S816
:A
:1006-267X(2017)09-3308-08
