Toll样受体4在机体免疫中的作用机制及一些营养因子对其的影响
2017-09-16张爱忠
秦 龙 姜 宁 张爱忠 马 迪
(黑龙江八一农垦大学动物科技学院,大庆163319)
Toll样受体4在机体免疫中的作用机制及一些营养因子对其的影响
秦 龙 姜 宁*张爱忠 马 迪
(黑龙江八一农垦大学动物科技学院,大庆163319)
Toll样受体4(TLR4)在机体抵御外源和内源抗原干扰方面具有重要贡献,在连接固有免疫和获得性免疫中起到桥梁作用,TLR4引导的信号通路是近年来生命科学研究的热点内容。通过研究TLR4信号通路,可深入阐明机体免疫机制。本文就近几年国内外对TLR4的研究进行分析,对其结构、分布、配体及作用机制进行综述,并对未来发展方向进行展望,以期为未来科研及医疗提供理论参考。
TLR4;信号通路;机制;免疫
Toll样受体4(Toll like receptor 4,TLR4)是Toll样受体家族(Toll like receptors,TLRs)中发现最早、研究最多、应用最广的一种免疫受体,其具有连接固有免疫和获得性免疫的桥梁作用,为机体最初免疫系统的形成和完善做出了很大的贡献。TLR4独特的跨膜结构成为细胞接收外界信号,并做出相应应答反应的基础,同时,TLR4与细胞内信号传导分子的相互呈递作用,将外界信号级联放大,激活核转录因子-κB(nuclear transcription factor-κB,NF-κB)通路,刺激核酸表达分泌细胞因子进行免疫反应,保护机体免受外源病原体干扰。但是,免疫反应也会带来损伤机体的炎症反应,这种有害的炎症反应是由于TLR4/NF-κB信号通路中的信号传导分子过度活化引起的,若能通过靶向识别上游病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)和损伤相关分子模式(damage-associated molecular patterns,DAMPs)[1],操控信号通路中不受控制的活化,削弱炎症进程,将成为免疫疗法中引人注目的手段。到目前为止,国内外对TLR4作用机制的研究已经相当深入,其主要方向为免疫监视、引导通路及检测手段等,但对其基因方面的研究和应用鲜有报道。本文就近几年国内外对TLR4的研究及其作用机制进行综述,以期为未来科研方向提供新的思路和理论参考。
1 TLR4的结构、分布和配体
TLR4基因定位于9q32~9q33,cDNA长度有3 811 bp,是由879个氨基酸组成的Ⅰ型跨膜蛋白质,属模式识别受体。其结构可分为3个结构域:胞膜外区、跨膜区和胞内区。胞膜外区由富含亮氨酸的氨基酸重复序列(leucine-rich repeat,LRR)构成,包含2段保守模块,呈马蹄状结构域,还包含1个配体结合区域(ligand binding region,LBR),可直接识别PAMPs,该区域在进化过程中具有较大的变异性,从而可以识别不同的配体分子[2]。跨膜区由21个氨基酸(主要是半胱氨酸)螺旋连接而成,与细胞膜结合,有助于TLR4在细胞膜上的定位。胞内区是由大约200个氨基酸残基组成的高度保守的Toll/白细胞介素-1受体(Toll/interleukin-1 receptor,TIR)结构域是TLR4/NF-κB信号通路活化和传导的关键环节。TLR4中的TIR结构域特异性募集接头分子髓样分化因子88(myeloid differentiation primary response protein 88,MyD88)和β干扰素TIR结构域衔接蛋白(TIR-domain-containing adaptor inducing interferon-β,TRIF),与接头分子TIR结构域发生二聚化是活化后TLR4向下游进行信号传递的起始。 TLR4在动物体内分布较为广泛,是巨噬细胞[3]和单核细胞发挥作用的主要分子,在血管平滑肌细胞[4]、中性粒细胞[5]、树突状细胞[6]、小肠上皮细胞、齿龈纤维母细胞[7]、子宫颈平滑肌细胞、呼吸道上皮细胞、胶质细胞[8]、脾脏和心肌细胞等细胞中都存在表达。研究发现,TLR4基因沉默衰弱了过氧化物还原酶Ⅰ(peroxiredoxinⅠ,Prx Ⅰ)诱导血管平滑肌细胞的增殖、分化和迁移[4],影响机体抗氧化应激能力。
脂多糖(lipopolysaccharides,LPS)是TLR4的主要配体,是TLR4免疫监视的主要对象,直接与TLR4发生特异性结合,激活TLR4/NF-κB信号通路。除此之外,TLR4还有类脂A、热休克蛋白60(heat shock protein 60,HSP60)[9]、紫杉醇(taxol)[10]等多种病原相关分子模式。其中损伤相关分子模式是TLR4的主要配体,在机体组织或细胞受到损伤、缺氧、应激等因素刺激后释放到细胞间隙或血液循环中,从而诱导自身免疫或免疫耐受,在关节炎、动脉粥样硬化、肿瘤、系统性红斑狼疮等疾病发生和发展过程中发挥重要作用。在葡萄球菌败血症发生过程中,TLR4基因变异与机体对外源金黄色葡萄球菌免疫应答产生的细胞因子和血浆细胞因子水平有关,虽然金黄色葡萄球菌不直接表达LPS或者激活TLR4,但机体先天免疫抵抗金黄色葡萄球菌却显示出受TLR4调控,而且与革兰阴性菌和LPS具有显著的共性[11]。
2 LPS/TLR4信号转导通路过程
2.1TLR4膜外接收信号
LPS也被称为细菌内毒素(endotoxin),是由类脂A和多糖构成的生物大分子,与蛋白质、磷脂等共同构成革兰氏阴性菌细胞壁外膜。类脂A是LPS的毒性和生物活性中心,具有稳定的结构,无种属特异性,所以由不同的革兰氏阴性细菌所引起的毒性作用大致相同。当革兰氏阴性细菌侵入机体后,细菌外膜上的LPS在细菌周围形成一层保护屏障逃避抗生素,LPS与脂多糖结合蛋白(lipolysaccharide binding protein,LBP)特异性结合,被转运至免疫细胞的膜表面,与膜表面的蛋白质CD-14结合,然后LPS被转运到LRR和髓样分化蛋白2(myeloid differentiation-2,MD-2)上形成蛋白质复合物。钟田雨等[12]利用荧光共振能量转移技术研究活细胞发现,TLR4的Glu24~Met41区域是与MD-2结合的区域。LPS与TLR4结合后,TLR4被激活,发生构象的改变和二聚化。此过程持续时间很短,一般持续4 min左右。
2.2TLR4膜内信号传导
膜内信号传导分为MyD88依赖型和非依赖型,MyD88是由1个短的氨基酸序列连接氨基末端的死亡结构域(DD)和1个羧基端的TIR结构域构成[13]。TLR4与PAMPs结合后,受体发生二聚化,MyD88羧基末端在胞质中与TLR结构相互作用。氨基末端的DD募集下游具有死亡作用域的丝/苏氨酸蛋白激酶(serine/threotine protein kinases)白细胞介素-1受体相关激酶(interleukin-1 receptor-associated kinase,IRAK)1和IRAK2,使其自身磷酸化。IRAK经磷酸化脱离MyD88,结合并激活肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6),此时出现2条不同路径的信号转导通路:一条包括p38[丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族]、激酶[c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)]和干扰素调节因子(interferon regulatory factor,IRF)转录因子家族,直接诱导表达促炎症细胞因子;另一条激活核转录因子-κB抑制物激酶(inhibitor of nuclear factor-κB kinase,IKK)复合体,磷酸化并激活IKK,与NF-κB结合,由此诱导核酸,导致一系列特定基因表达促炎症细胞因子,如肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素-1(interleukin-1,IL-1)、基质金属蛋白酶(matrix metalloproteinase,MMP)等,完成信号通路的传导(图1)。MyD88依赖型信号通路在许多炎症反应中发挥作用,该信号通路在香烟烟雾诱导的肺部炎症中扮演了重要的角色[14]。TLR4的胞内区TIR结构域与Toll样受体相关分子(TRIF-related adaptor molecule,TRAM)相连,作用于TRIF,使其活化并与TRAF6结合,然后将信号传导至IRF-3,将其磷酸化后形成同源二聚体,转位入核,诱导干扰素(interferon,IFN)基因表达。TLR4的信号传导活性受细胞膜中胆固醇水平的调节,进而受到双磷脂[bis (monoacylglycero) phosphate,BMP]的影响。Ciesielska等[15]发现将外源BMP异构体掺入到巨噬细胞的质膜和胞内囊泡中能显著降低LPS刺激的趋化因子的产生,其与控制趋化因子表达的IRF-3的抑制有关。相比MyD88依赖型通路,MyD88非依赖性通路更为简单一些,然而却具有重要的作用,其诱导产生的IFN是一种广谱抗病毒剂,其发挥作用并不是直接杀死或抑制病毒,而是与细胞表面受体结合,诱导细胞表面产生抗病毒蛋白,提高细胞自身免疫力。

TRAF6:肿瘤坏死因子受体相关因子6 tumor necrosis factor receptor-associated factor 6;MAPK:丝裂原活化蛋白激酶 mitogen-activated protein kinase;JNK:c-Jun氨基末端激酶c-Jun N-terminal kinase;IRF:干扰素调节因子 interferon regulatory factor;IFN:干扰素 interferon;IKK:核转录因子-κB抑制物激酶 inhibitor of nuclear factor-κB kinase;IκB:核转录因子-κB抑制蛋白 inhibitor of nuclear factor-κB;NF-κB:核转录因子-κB nuclear factor-κB;TNF:肿瘤坏死因子 tumor necrosis factor;IL-1:白细胞介素-1 interleukin-1;MMP:基质金属蛋白酶 matrix metalloproteinase;TIR:Toll/白细胞介素-1受体 Toll/interleukin-1 receptor;TRAM:Toll样受体相关分子 TRIF-related adaptor molecule;MyD88:髓样分化因子88 myeloid differentiation primary response protein 88;TRIF:β干扰素TIR结构域衔接蛋白 TIR-domain-containing adaptor inducing interferon-β;IRF-3:干扰素调节因子-3 interferon regulatory factor-3;P:磷酸化 phosphorylation;LPS:脂多糖 lipopolysaccharides;LBP:脂多糖结合蛋白 lipolysaccharide binding protein;LRR:富含亮氨酸的氨基酸重复序列 leucine-rich repeat;MD-2:髓样分化蛋白2 myeloid differentiation-2。
图1TLR4引导信号通路
Fig.1 TLR4 lead the signaling pathway
2.3TLR4阻断剂对信号通路的抑制
TLR4阻断剂根据作用位点分为2种:一种为阻断LPS与TLR4的特异性结合,使TLR4无法被激活,信号通路中的信号蛋白处于被抑制状态。利用过氧化磷脂阻断LPS与LBP和CD14的结合,在LPS诱导的组织损伤过程中起到保护作用[16]。已发现小鼠腹水中纯化的TLR4单克隆抗体MTS510能够识别并阻断TLR4与CD14的复合,抑制NF-κB的转位诱导产生促炎症细胞因子[17]。另一种为阻断促炎症信号的传导,对信号通路中的信号蛋白进行抑制而达到阻断目的,主要包括MyD88抑制剂[18]、IRAK抑制剂[19]、IKK阻断剂[20]、NF-κB抑制剂[21]等,对信号通路进行抑制和负反馈调节,抑制了TLR4过度活化引起的自身免疫疾病。TLR4介导的信号通路在各种炎症性发病机制中发挥重要作用,针对相应位点进行可调控的抑制或阻断将有助于今后炎症性疾病的治疗。
2.4TLR4连接先天性免疫和获得性免疫
在先天性免疫反应中,TLR4参与识别首次入侵机体的革兰阴性菌,通过TLR4信号通路,将信号传递至下游,激活NF-κB,转位进入细胞核,启动细胞核内工作,细胞核转录翻译出杀菌物质和促炎症细胞因子。TLR4作为先天性免疫反应中最主要的感受器之一,在病理如炎症性肠病等状态下,对先天性免疫反应产生重要的作用,它在很大程度上决定着先天性免疫反应的启动、强度、范围和发展,在先天性免疫反应中有着无可替代的地位[22]。先天性免疫反应的效应因子以一些抗微生物肽为主,其中研究较多的是防御素(defensin),防御素是一种广谱抗菌肽,通过破坏细菌的细胞膜起杀菌作用[23]。先天性免疫需要经过一系列的生理生化反应后才能起到免疫作用,往往时间过长,同时伴随着机体的炎症反应而造成机体损伤。之后机体需要一种快速准确的免疫方式来抵御同种抗原的再次入侵,在先天性免疫反应过程中,TLR4被LPS激活后,通过信号通路释放细胞因子,刺激获得性免疫的完善,未成熟的CD4+辅助T细胞可分化为2种功能完全不同的亚群Th1和Th2。Th1的细胞因子IFN-γ能促进肠道上皮细胞中TLR4/MD 2信号通路,提高LPS诱导的促炎性细胞因子白细胞介素-8(interleukin-8,IL-8)的分泌[24]。先天性免疫通过TLR4调节获得性免疫,说明TLR4在机体免疫系统中具有重要作用。巨噬细胞构成抵抗结核分歧杆菌的第1道防线,并在连接先天性免疫和获得性免疫中起到重要作用。新型巨噬细胞激活蛋白(Rv2882c)能够使TLR4/NF-κB通路激活,分泌促炎细胞因子,Rv2882c处理巨噬细胞诱导效应或记忆T细胞群和Th1免疫应答的扩增[25]。研究发现,在LPS诱导小鼠时,PrxⅠ提供了保护作用,同时TLR4/NF-κB信号通路产生的细胞因子水平也有显著变化,表明TLR4在机体抗氧化应激和细胞凋亡、增殖、分化、迁移过程发挥了积极作用[26]。
2.5靶向TLR4的疾病治疗
TLR4信号转导通路中进行抑制和阻断是一治疗方法,主要是通过抑制和竞争TLR4信号通路达到目的。目前,已经有许多相关产品投入到实际应用中。沈圆圆等[27]报道,TLR4小分子抑制剂(TK242)可以减轻肾缺血再灌注损伤而起保护作用,其作用与TLR4/NF-κB信号通路介导的炎症反应相关。TLR4信号通路参与了益生菌调节肠道菌群这一过程。刘翔等[28]发现,TLR4信号通路参与了幽门螺杆菌感染(Hp)的致病机制和益生菌治疗Hp的机制。TLR4的表达水平与胃黏膜的炎症病理评分无关,提示TLR4可能并未参与炎症反应的维持,TLR4完成其信号传递的功能后并不参与炎症级联放大的过程,而是由下游其他炎症因子[如白细胞介素-1β(interleukin-1β,IL-1β)]来完成级联放大。吞噬细胞感染人类免疫缺陷病毒(human immunodeficiency virus,HIV)病毒后,将其暴露于革兰氏阴性菌,则降低了病毒在细胞中的复制,然而,当移除革兰氏阴性菌后,则恢复了病毒的复制,说明TLR4在吞噬细胞抑菌方面具有重要作用[29]。此外,TLR4配体被广泛应用于疫苗佐剂,佐剂和疫苗抗原结合可以增强和修饰免疫应答,引入TLR4配体形成了新一代的佐剂[30]。
3 TLR4的作用
3.1在抗菌肽抑菌机制中的作用
现代分子生物学和基因工程等技术实现了对抗菌肽的定性设计,并在众多领域得到了广泛的应用。抗菌肽通常为2级结构,主要作用目标是细菌细胞膜,通过引发细胞膜两侧不可逆的去极化破坏细胞膜,充分发挥抗菌活性。抗菌肽破坏细菌细胞膜,使细菌裂解死亡,细菌内毒素被释放出来,内毒素在体内能够刺激巨噬细胞产生内源性热原质INF、IL-1、白细胞介素-2(interleukin-2,IL-2)等,引起机体的强烈发热反应。巨噬细胞膜上的TLR4起到了识别内毒素,并进行信号传导的功能,经信号通路传导,引起多种细胞因子被释放,上调了病原提呈细胞表面共刺激分子,引起机体产生特异性免疫,对内毒素进行吞噬和降解。但是,TLR4的过度激活会引起细胞因子的表达上调,超出机体免疫系统的控制,产生自身性免疫疾病,这种现象经常出现于幼龄动物,其免疫系统发育尚不完善,特异性免疫尚未成熟,对于各种应激引起的细胞因子释放过多,经常会导致全身性免疫疾病。
3.2在肠道免疫屏障形成中的作用
肠道免疫屏障是由肠道相关淋巴组织、弥散性免疫细胞和免疫活性物质如分泌型免疫球蛋白A(secletory immunoglobutin A,slgA)等组成,是机体免疫系统中最为重要和复杂的部分,主要表现在肠道处于机体内部与外界接触最密切的部位,其营养成分的吸收、多种生化反应的进行、各种细菌的共生和不同抗原的入侵等汇集于此。而且,肠道与其他免疫组织的协同作用和自身免疫作用,肠道黏膜免疫与神经免疫、内分泌免疫形成机体的免疫系统网络[31],共同保护机体健康。
肠黏膜中的肠上皮淋巴细胞、树突状细胞和M细胞等都表达TLR4,TLR4对有害抗原与无害物质进行区分,对肠道进行实时监控,识别并结合有害抗原(主要为LPS),通过信号通路传导使效应细胞产生免疫活性物质,对其进行处理。获得性免疫逐渐形成并发挥主要的免疫作用,当抗原再次入侵,获得性免疫会第一时间释放抗体,对抗原进行准确快速地特异性排除,为幼龄动物断乳提供了保证。提前完善幼龄动物的获得性免疫,有助于早期断乳,具有降低饲养成本、提高生产性能的意义。
3.3在脑-肠轴模型中的作用
脑-肠轴是中枢神经系统与肠道神经系统互相联系的一条纽带,其突出表现于化疗治疗,通过神经给药治疗,引起内源性危险信号的过量表达,显著引起肠道中毒[32]。除此之外,最近有研究表明,在化疗过程中,TLR4在肠上皮细胞的表达与引发肠道毒性密切相关,激活了通路下游的NF-κB,并产生免疫应答[33]。与此同时,肠道炎症通过TLR4对中枢神经系统也具有调节作用 (图2)。
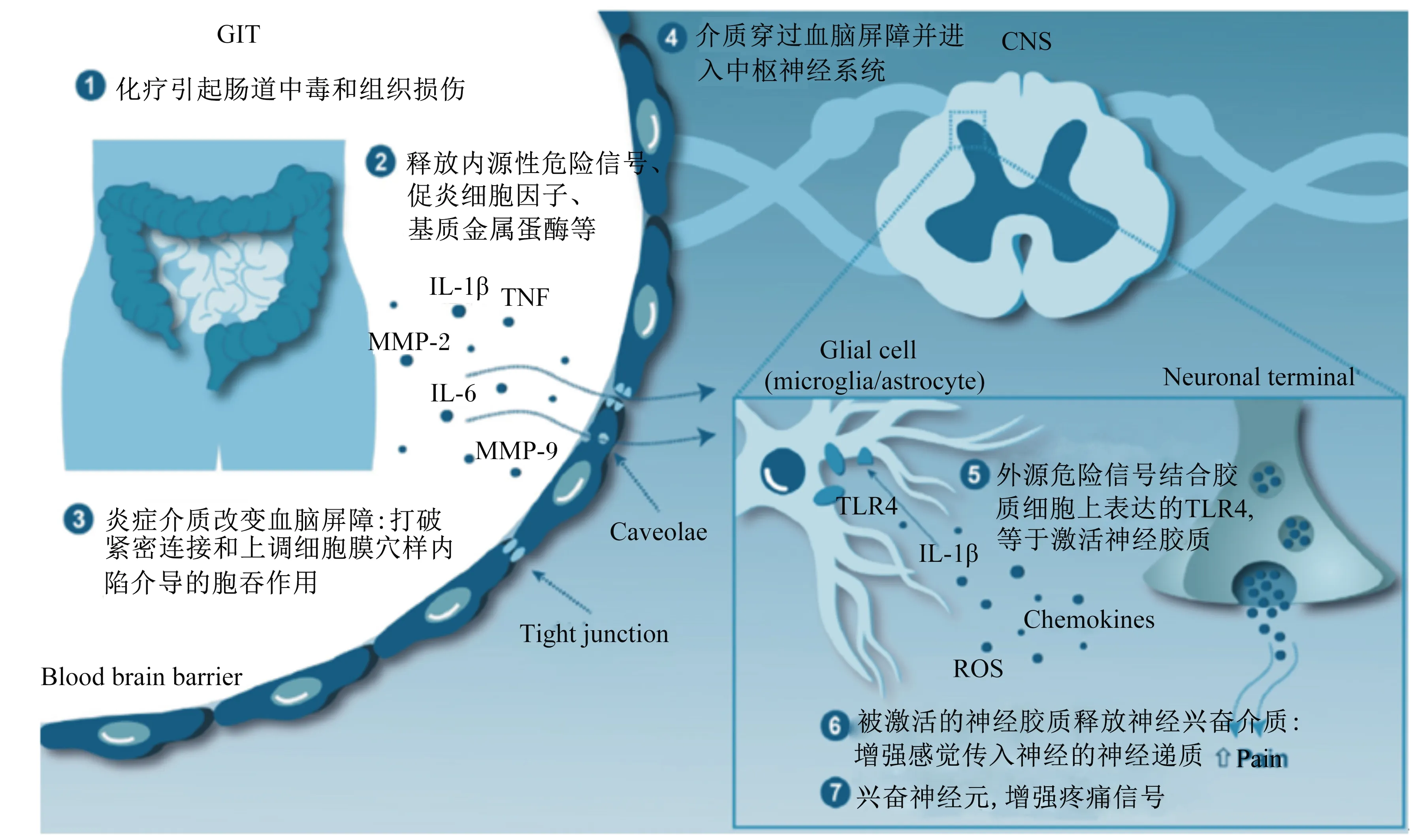
GIT:胃肠道gastrointestinal tract;CNS:中枢神经系统 central nervous system;IL-1:白细胞介素-1 interleukin-1;TNF:肿瘤坏死因子 tumor necrosis factor;MMP-2:基质金属蛋白酶-2 matrix metalloproteinase-2;白细胞介素-6 interleukin-6;MMP-9:基质金属蛋白酶-9 matrix metalloproteinase-9;Blood brain barrier:血脑屏障;Caveolae;小窝;Tight junction;紧密连接;Glial cell (microglia/astrocyte):胶质细胞(小胶质细胞/星形胶质细胞);Neuronal terminal;神经末梢;TLR4;Toll样受体4 Toll like receptor 4;ROS:活性氧簇 reactive oxygen species;Chemokines:趋化因子;Pain:疼痛。
图2肠道通过TLR4对中枢神经系统进行调节
Fig.2 Intestine regulates the central nervous system through TLR4[34]
脑-肠轴模型是近些年研究的热门之一,其机制还在进一步研究中,肠道菌群和肠道免疫将是其机制研究中不可忽略的重点。
3.4在营养因子调控机制中的作用
TLR4在许多营养因子的调控机制中发挥作用,因此,可以用TLR4表达水平来衡量营养因子在动物饲粮中的添加量。研究报道,抗菌肽降低了空肠组织中TLR4信号通路上游调控关键蛋白TLR4、MyD88的表达及炎症相关蛋白NF-κB和核转录因子-κB抑制蛋白-α(inhibitor-α of nuclear factor-κB,IκB-α)的磷酸化水平,缓解肠道炎症的发生[35]。但抗菌肽的过量添加势必会导致TLR4对PAMP敏感性下降,甚至不发挥识别作用,引起机体中毒反应。维生素可增强动物机体的先天性免疫,维生素D通过调节TLR4的表达增强单核细胞和巨噬细胞的抗微生物能力,1,25二羟维生素D3是维生素D的活性成分,体外培养人单核细胞时,加入1,25二羟维生素D3下调了TLR4的表达,使其处于对PAMP低反应状态,阻止TLR4的过度活化和炎症反应[36]。TLR4参与了脂肪酸对N38细胞表达和分泌刺鼠基因相关蛋白(agouti gene-related protein,AgRP)的调节,影响动物采食行为,并控制能量平衡,但脂肪酸调节动物食欲的作用机制还未研究清楚。研究指出,TLR4不仅在病理状态下通过炎症反应,使动物机体产生胰岛素抑制和代谢紊乱,在饥饿生理状态下,对糖脂代谢也具有重要的调控作用[37],可直接与营养因子相互作用,调节机体营养平衡。
4 小 结
以上对TLR4信号通路的传导和调控进行了分析,并对TLR4在先天性免疫和获得性免疫中的桥梁作用进行了介绍,列举了以TLR4信号通路为靶点进行的疾病治疗,就TLR4在抗菌肽抑菌机制、肠道黏膜免疫机制和脑-肠轴模型中的作用进行了介绍。TLR4信号通路对幼龄动物断乳前获得性免疫的完善至关重要,未来可对其信号通路进行深入研究,可有效保护早期断乳幼龄动物的健康,提高生产性能。在此,提出几点展望:1)TLR4在先天性免疫和获得性免疫中起到桥梁作用,操纵TLR4的活化来调控炎症进程和完善免疫系统将成为未来研究的趋势之一;2)TLR4/NF-κB信号通路作为经典促炎性通路被广泛认可,其抑制剂和阻断剂的研究成果颇为丰富,抑制或阻断的持续效果将成为未来研究的重点内容;3)抗菌肽以其广谱抗菌、无残留等特点被认为是抗生素理想替代品,目前研究多为聚阳离子肽,如蛙皮素、天蚕素、家蝇抗菌肽等。与靶点结合一般为静电力吸附,在靶向治疗方面略显不足,近些年有人对TLR4胞外段的克隆、表达及功能活性进行研究,对TLR4胞外段基因与抗菌肽基因进行串联修饰,将提高抗菌肽靶向识别革兰氏阴性菌的能力,可作为未来的研究方向。
[1] GUSTAVSEN A,NYMO S,LANDSEM A,et al.Combined inhibition of complement and CD14 attenuates bacteria-induced inflammation in human whole blood more efficiently than antagonizing the toll-like receptor 4-MD2 complex[J].The Journal of Infectious Diseases,2016,214(1):140-150.
[2] AKIRA S,UEMATSU S,TAKEUCHI O.Pathogen recognition and innate immunity[J].Cell,2006,124(4):783-801.
[3] CHATTERJEE B,BANOTH B,MUKHERJEE T,et al.Late-phase synthesis of IκBα insulates the TLR4-activated canonical NF-κB pathway from noncanonical NF-κB signaling in macrophages[J].Science Signaling,2016,9(457):ra120.
[4] ZHU Z C,ZHENG X M,LI D,et al.Prx1 promotes the proliferation and migration of vascular smooth muscle cells in a TLR4-dependent manner[J].Molecular Medicine Reports,2017,15(1):345-351.
[5] BARRANCO C.Inflammation:soluble MRP8/14 recruits neutrophils via TLR4[J].Nature Reviews Rheumatology,2015,11(6):320.
[6] SAHASRABUDHE N M,DOKTER-FOKKENS J,DE VOS P.Particulate β-glucans synergistically activate TLR4 and Dectin-1 in human dendritic cells[J].Molecular Nutrition & Food Research,2016,60(11):2514-2522.
[7] LAPPIN M J,BROWN V,ZARIC S S,et al.Interferon-γ stimulates CD14,TLR2 and TLR4 mRNA expression in gingival fibroblasts increasing responsiveness to bacterial challenge[J].Archives of Oral Biology,2016,61:36-43.
[8] LI X Q,ZHANG Z L,TAN W F,et al.Down-regulation of CXCL12/CXCR4 expression alleviates ischemia-reperfusion-induced inflammatory pain via inhibiting glial TLR4 activation in the spinal cord[J].PLoS One,2016,11(10):e0163807.
[9] SWAROOP S,SENGUPTA N,SURYAWANSHI A R,et al.HSP60 plays a regulatory role in IL-1β-induced microglial inflammation via TLR4-p38 MAPK axis[J].Journal of Neuroinflammation,2016,13:27.
[10] GE X,CAO Z,GU Y,et al.PFKFB3 potentially contributes to paclitaxel resistance in breast cancer cells through TLR4 activation by stimulating lactate production[J].Molecular & Cellular Biology,2016,62(6):119-125.
[11] CHANTRATITA N,TANDHAVANANT S,SEAL S,et al.TLR4 genetic variation is associated with inflammatory responses in Gram-positive sepsis[J].Clinical Microbiology and Infection,2017,23(1):47.e1-47.e10.
[12] 钟田雨,唐靖,陈登宇,等.利用荧光共振能量转移技术研究活细胞TLR4与MD-2作用结构域[J].生物化学与生物物理进展,2009,36(11):1451-1457.
[13] MCGETTRICK A F,O’NEILL L A.The expanding family of MyD88-like adaptors in Toll-like receptor signal transduction[J].Molecular Immunology,2004,41(6/7):577-582.
[14] CHENG Y,WANG D,WANG B,et al.HMGB1 translocation and release mediate cigarette smoke-induced pulmonary inflammation in mice through a TLR4/MyD88-dependent signaling pathway[J].Molecular Biology of the Cell,2017,28(1):201-209.
[15] CIESIELSKA A,SAS-NOWOSIELSKA H,KWIATKOWSKA K.Bis (monoacylglycero) phosphate inhibits TLR4-dependent RANTES production in macrophages[J].The International Journal of Biochemistry & Cell Biology,2016,83:15-26.
[16] BOCHKOV V N,KADL A,HUBER J,et al.Protective role of phospholipid oxidation products in endotoxin-induced tissue damage[J].Nature,2002,419(6902):77-81.
[17] AKASHI S,SHIMAZU R,OGATA H,et al.Cutting edge:cell surface expression and lipopolysaccharide signaling via the Toll-like receptor 4-MD-2 complex on mouse peritoneal macrophages[J].Journal of Immunology,2000,164(7):3471-3475.
[18] THOMSON A W.MyD88 inhibitors and the continuing challenge of TLR antagonism[J].Transplantation,2017,101(2):230-231.
[19] WANG Z L,WESCHE H,STEVENS T,et al.IRAK-4 inhibitors for inflammation[J].Current Topics in Medicinal Chemistry,2009,9(8):724-737.
[20] MOARBESS G,GUICHOU J F,PANIAGUA-GAYRAUD S,et al.New IKK inhibitors:synthesis of new imidazo[1,2-a]quinoxaline derivatives using microwave assistance and biological evaluation as IKK inhibitors[J].European Journal of Medicinal Chemistry,2016,115:268-274.
[21] JO H,CHOI M,KUMAR A S,et al.Development of novel 1,2,3,4-tetrahydroquinoline scaffolds as potent NF-κB inhibitors and cytotoxic agents[J].ACS Medicinal Chemistry Letters,2016,7(4):385-390.
[22] 李国逊,李宁.Toll样受体在肠黏膜屏障免疫机制的研究进展[J].肠外与肠内营养,2008,15(6):366-368,372.
[23] 胡庆丰,陈同辛.防御素研究进展[J].临床儿科杂志,2015,33(9):831-834.
[24] MUELLER T,TERADA T,ROSENBERG I M,et al.Th2 cytokines down-regulate TLR expression and function in human intestinal epithelial cells[J].Journal of Immunology,2006,176(10):5805-5814.
[25] CJOI H G,CHOI S,BACK Y W,et al.MycobacteriumtuberculosisRv2882c protein induces activation of macrophages through TLR4 and exhibits vaccine potential[J].PLoS One,2016,11(10):e0164458.
[26] 冯丽.PrxⅠ在LPS诱导小鼠免疫反应过程中的调控作用研究[D].硕士学位论文.大庆:黑龙江八一农垦大学,2015.
[27] 沈圆圆,郭松雪.Toll样受体4抑制剂对大鼠肾缺血再灌注损伤的保护作用[J].浙江创伤外科,2015(6):1082-1085.
[28] 刘翔,林漫鹏,丁元伟,等.TLR4在益生菌治疗小鼠Hp感染中的作用[J].中国现代医学杂志.2011,21(1):32-35,40.
[29] AGOSTO L M,HIRENT J B,MICHAELS D H,et al.Porphyromonasgingivalis-mediated signaling through TLR4 mediates persistent HIV infection of primary macrophages[J].Virology,2016,499:72-81.
[30] CARTER D,FOX C B,DAY T A,et al.A structure-function approach to optimizing TLR4 ligands for human vaccines[J].Clinical & Translational Immunology,2016,5(11):e108.
[31] 周正华,马玲玲.肠易激综合征与神经-内分泌-免疫网络关系[J].中国中西医结合消化杂志,2013,21(2):106-109.
[32] BIANCHI M E.DAMPs,PAMPs and alarmins:all we need to know about danger[J].Journal of Leukocyte Biology,2007,81(1):1-5.
[33] HAMADA K,KAKIGAWA N,SEKINE S,et al.Disruption of ZO-1/claudin-4 interaction in relation to inflammatory responses in methotrexate-induced intestinal mucositis[J].Cancer Chemotherapy and Pharmacology,2013,72(4):757-765.
[34] WARDILL H R,VAN SEBILLE Y Z,MANDER K A,et al.Toll-like receptor 4 signaling:a common biological mechanism of regimen-related toxicities:an emerging hypothesis for neuropathy and gastrointestinal toxicity[J].Cancer Treatment Reviews,2015,41(2):122-128.
[35] 易宏波.抗菌肽CWA对断奶仔猪肠道炎症和肠道屏障功能的作用及其机制[D].博士学位论文.浙江:浙江大学,2016.
[36] SADEGHI K,WESSNER B,LAGGNER U,et al.Vitamin D3down-regulates monocyte TLR expression and triggers hyporesponsiveness to pathogen-associated molecular patterns[J].European Journal of Immunolgy,2006,36(2):361-370.
[37] 庞珊珊,乐颖影.Toll样受体4对饥饿代谢的调控作用[J].中国基础科学,2011,13(3):30-32.
*Corresponding author, professor, E-mail: jiangng_2008@sohu.com
(责任编辑 菅景颖)
Mechanism of Toll Like Receptor 4 in Immune Function and Effects of Some Nutritional Factors on It
QIN Long JIANG Ning*ZHANG Aizhong MA Di
(College of Animal Science and Veterinary Medicine, Heilongjiang Bayi Agricultural University, Daqing 163319, China)
Toll like receptor 4 (TLR4) plays important roles in resisting exogenous and endogenous antigen interference, and it is also as a bridge in the connection between innate immunity and acquired immunity. Recently, TLR4-guided signal paths have been a hotspot in immunology, it could explain the immune mechanism in the body in depth through the study of TLR4 signaling pathway. This paper presented an overview about the newest research results of TLR4 in related to the structure, distribution, ligand, mechanism, nutrition-related factors and proposed the direction for future development nationally and internationally, which will provide some references for future scientific research and medical treatment.[ChineseJournalofAnimalNutrition,2017,29(9):3075-3082]
TLR4; signal pathway; mechanism; immunization
10.3969/j.issn.1006-267x.2017.09.008
2017-02-24
国家自然科学基金项目(31472120);黑龙江省自然科学基金项目(C201325);黑龙江省农垦总局科技攻关项目(HNK125B-12-04)
秦 龙(1991—),男,黑龙江宝清人,硕士研究生,从事饲料资源开发与利用的研究。E-mail: byndql@163.com
*通信作者:姜 宁,教授,博士生导师,E-mail: jiangng_2008@sohu.com
S852.4
:A
:1006-267X(2017)09-3075-08
