维生素BT片溶出度检测的方法建立
2017-09-15耿韫郭永辉王润彪
耿韫 郭永辉 王润彪
·药物研究·
维生素BT片溶出度检测的方法建立
耿韫 郭永辉 王润彪
目的建立维生素BT片溶出度的检测方法。方法溶出度采用桨法,以0.1 mol/L盐酸1 000 ml作为溶出介质,转速为50 r/min;含量测定采用高效液相色谱法(HPLC),采用phenomenex Luna C18 (250×4.6 mm,5 m)色谱柱;流动相:磷酸盐缓冲液[取11.5 ml磷酸加入1 900 ml水中,再加入100 ml氢氧化钠(1 mol/L)溶液,调pH值为2.4]-甲醇(95∶5),每1 000 ml加入555 mg庚烷磺酸钠;检测波长:215 nm;流速:1.0 ml/min。结果维生素BT线性范围为 10~1 000 μg/ml(r=1.0000),平均回收率100.56%,溶出曲线表明45 min内维生素BT片可溶出85%以上。结论所建方法操作简便,结果准确可靠,可用于维生素BT片的溶出度测定。
维生素BT片;溶出度;HPLC
维生素BT又叫肉毒碱(Carnitine),是一种类维生素(分子式C7H15NO3),肉毒碱是广泛存在于大自然界中的一种高极性、小分子季胺类化合物,为人体必需营养素,有重要的生化功能和临床应用价值。近年来,肉毒碱在心脑血管疾病、消化道疾病、儿童疾病的预防、治疗以及血液透析患者的营养支持和运动医学及生殖医学等领域,都得到广泛研究和应用。它在哺乳动物中的脂肪代谢和能量产生中也起着特别重要的作用,其中参与脂肪酸的运输和氧化、脂肪的合成、酮体的利用等,在动物性食物中含量高,在植物性食物中含量低。例如:美国科学家曾发现红肉中的“维生素BT”可能引发心血管疾病,研究结果显示,维生素BT在肝脏中的转化物质“氧化三甲胺”与血管脂肪沉积存在密切联系,可以促使人体动脉粥样硬化,从而引发心血管疾病。如果有些人认为维生素BT是一种必需的膳食营养物,那么则会有可能出现人类的膳食中因缺乏维生素BT而引起的缺乏症。截止到目前为止,维生素BT还没有达到这个标准。过量得摄入会产生哪些毒性现在还不清楚。在正常的情况下,不规定膳食中维生素BT的需要量。然而出现代谢异常,会抑制维生素BT的合成,干扰利用或增加维生素BT的分解代谢,疾病可能降临。膳食中经常会供应维生素BT,可以减少疾病的发生。维生素BT常用于消化功能失调,包括消化不良,对于胃酸缺乏症和消化不良和食欲减退和慢性胃炎,以及婴幼儿厌食与食欲缺乏症状有一定的调试和缓解作用。作为辅助药物,现在市场上存在有维生素BT片、维生素BT胶囊,以及一些左旋肉碱胶囊,也是将肉毒碱作为药物的主要成分。目前国内有3个生产厂家,规格均为0.1 g。溶出度是评价口服固体制剂生产工艺和质量的重要方法之一,同时也是口服固体制剂体外一致性评价的有效方法,因此溶出度是口服固体制剂质量控制的重要检测项目。维生素BT片现行的质量标准为国家药品标准WS-10001-(HD-0076)-2002[1],没有设置的溶出度检查,同时国内外也无维生素BT片溶出度测定的相关文献报道。因此,建立准确可靠的维生素BT片溶出度测定方法,可以有效控制维生素BT片的质量,保证药品安全有效。
1 材料
1.1 仪器 Waters e2695的液相色谱仪(美国Waters公司);SOTAX AT 7药物溶出仪(瑞士SOTAX公司);XS105电子天平(瑞士Mettler Toledo公司)。
1.2 试剂与试药 选择纯度为98.3%的维生素BT片(市售品,石药集团欧意药业有限公司生产的批号为:006160301,006160302,006160303这三个批号的试药;其规格均为每片0.1 g);甲醇为色谱纯,盐酸为分析纯。
2 溶出度条件的摸索
2.1 溶出方法 参照其他片剂相关溶出度测定方法,我们采用片剂最为常用的桨法作为溶出方法。
2.2 溶出介质 参照国内外有关药典针对溶出度测定的要求[1],其转速采用50 r/min,对同一批维生素BT片在0.1 mol/L盐酸、pH值4.0醋酸盐缓冲液、pH值6.8磷酸盐缓冲液、水这四种溶出介质中的溶解曲线进行了考察。以时间点为横坐标,相应时间点的累计溶出量为纵坐标,制作溶出曲线。结果发现,维生素BT片在pH值4.0醋酸盐缓冲液、水、pH值6.8磷酸盐缓冲液这三种介质中溶出较快,30 min溶出均为超过85%。而在0.1 mol/L盐酸中溶出相对较慢,故选择0.1 mol/L盐酸作为溶出介质,体积为1 000 ml。见图1。
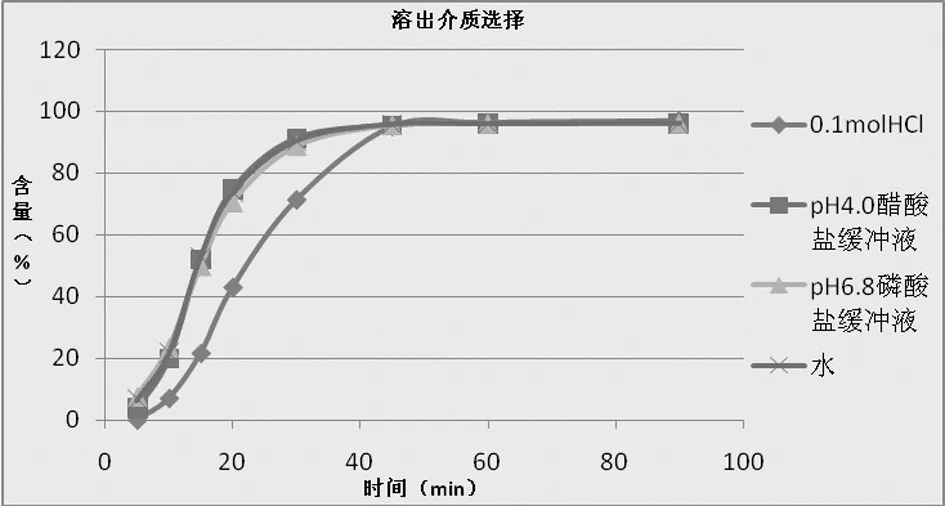
图1 溶出介质选择
2.3 转速 对同一批维生素BT片在0.1 mol/L盐酸中,转速分别采用50 r/min、75 r/min、100 r/min进行溶出曲线考察,以时间为横坐标,每个时间点的累积溶出量为纵坐标,制作溶出曲线。累积溶出量与转速呈正相关性,在75 r/min、100 r/min这2种转速条件下,维生素BT片累积溶出度均大于85%,且片剂溶出度均一性均良好,为更好区分溶出行为,因此选择低转速50 r/min作为实验条件。见图2。

图2 转速选择
2.4 溶出时间及溶出限度 对同一批维生素BT片在0.1 mol/L盐酸中,转速50 r/min且45 min、60 min两个时间点的累积溶出量偏差小于5%,因此确定溶出度取样时间为45 min。同时参照溶出度相关文献和技术要求[1-15],以45 min 溶出量减15%即为溶出限度。45 min溶出量为90.2%,因此溶出限度最终设定为75%。
2.5 建立溶出度方法 根据上述实验摸索,最终确定维生素BT片的溶出条件:采用桨法,0.1 mol/L盐酸1 000 ml作为溶出介质,转速50 r/min,45 min时取溶液适量,滤过,取续滤液,即得。
3 含量测定
3.1 色谱条件 参照维生素BT片现行质量标准WS-10001-(HD-0076)-2002中含量测定的色谱条件[6],经优化后进行维生素BT含量测定。采用phenomenex Luna C18 (250×4.6 mm,5 m)色谱柱;流动相:磷酸盐缓冲液[取11.5 ml磷酸加入1 900 ml水中,再加入100 ml氢氧化钠(1 mol/L)溶液,调pH值为2.4]-甲醇(95∶5),每1 000 ml加入555 mg庚烷磺酸钠;检测波长:215 nm;流速:1.0 ml/min;柱温:30℃;进样量:20 μl。
3.2 对照品溶液 精密称取维生素BT。
3.3 供试品溶液 取维生素BT片,按“2.5”项下进行溶出度实验,取续滤液直接测定。
3.4 线性范围 称取维生素BT对照品10.00 mg,置10 ml量瓶中,加0.1 mol/L盐酸溶解并稀释至刻度,摇匀,配制成983 μg/ml的溶液。分别精密量取上述溶液适量,加0.1 mol/L盐酸溶解并稀释制成浓度为491.5 μg/ml、196.6 μg/ml、98.3 μg/ml、49.15 μg/ml、9.83 μg/ml的对照品溶液,按“3.1”项下进行测定。以浓度为横坐标,峰面积为纵坐标进行线性回归,回归方程为y=33586817.41x-26142.30,r=1.0000,表示在10~1 000 μg/ml的范围内线性良好。
3.5 精密度 取对照品溶液,同一份按“3.1”项下平行测定6次。以峰面积计算精密度结果。得出RSD为0.03%(n=6),表明该方法的精密度良好。
3.6 方法回收率 分别精密量取对照品溶液8 mg、10 mg、12 mg分别置100 ml量瓶中,按比例加入相关辅料,用0.1 mol/L盐酸溶解并稀释至刻度,摇匀,取续滤液,按“3.1”项下进行测定。回收率结果得出:该法的平均回收率为100.56%,RSD为0.36%。见表1。
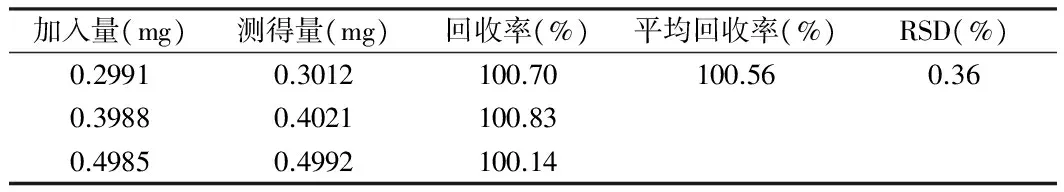
表1 回收率结果
3.7 辅料、滤膜干扰排除 按处方比例称取辅料,混匀,用0.1 mol/L盐酸溶解,取续滤液按“3.1”项下进行测定,结果表明在维生素BT保留时间处无特征峰出现,表明辅料对测定结果无影响。同时取“3.3”项下的供试品溶液,分别采用过滤和离心操作,按“3.1”项下进行测定,结果两种处理方法的结果基本一致,表明滤膜对测定结果也不存在显著干扰。
3.8 稳定性试验 取“3.3”项下的供试品溶液,在室温下分别于0、1、2、4、6、8 h进行测定,结果维生素BT含量的RSD=0.67%(n=6),表明供试品溶液在8 h内稳定性良好。
3.9 溶出度测定 按“2.5”项下溶出度条件对3批维生素BT片进行溶出度实验,采用“3.1”项下色谱条件进行测定。结果表明,建立的维生素BT片溶出度方法可以有效控制产品质量。见表2。

表2 3批维生素BT片溶出度结果 %
4 讨论
4.1 体外溶出度是口服固体制剂的重要指标,与体内生物利用度具有一定相关性。凡检查溶出度的制剂,不再进行崩解时限的检查。近年来研究证明,易溶性药物也会因制剂的配方和工艺不同而致药物溶出度有很大差异,从而影响药物生物利用度和疗效,在USP中规定测定溶出度的制剂有相当数量是易溶性药物[16]。
4.2 固体制剂中的药物在被吸收前,必须经过崩解和溶解然后转为溶液的过程,因此,药物在体内吸收速度通常由溶解的快慢而决定。某些药理作用剧烈、安全指数小、吸收迅速的药物,如果溶出速度太快,会产生明显的不良反应,药效也缩短,故需要对制剂中药物的溶出速率应予以控制。
4.3 影响药物溶出度的因素包括:(1)仪器的性能及操作水平,如介质除气程度、仪器振动情况、搅拌速度、取样点位置等。(2)药物本身因素,如溶解度、药物表面积、药物结构和晶型。(3)制剂因素,如剂型、处方组成、药物的相互作用、药物粒度等。
4.4 仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价,目的使仿制药在质量和疗效上与原研药一致,在临床上可替代原研药,这不仅可以节约医疗费用,同时也可提升我国的仿制药质量和制药行业的整体发展水平,保证公众用药经济,安全、有效[17,18]。仿制药一致性评价在我国是补课,也是创新。
4.5 国家食药监总局(CFDA)2012年启动了仿制药的质量一致性评价工作,涉及20家药品生产企业。2013年发布《仿制药质量一致性评价工作方案》,对75个仿制药品种与原研药的质量比对工作,并将“提高仿制药质量,加快仿制药质量一致性评价”作为改革药品审评审批制度的五大目标之一。2016年CFDA转发了国务院办公厅发布的《关于开展仿制药质量和疗效一致性评价的意见》,意味着一致性评价的大幕事实上已正式拉开。
4.6 仿制药一致性评价过程中,需要药品生产企业的全面参与,深入地开展比对研究,包括处方、质量标准、晶型、粒度和杂质等主要药学指标比较研究,以及固体制剂溶出曲线的比较研究[19]。
4.7 为确保维生素BT片的临床有效性,保证药品质量稳定,对维生素BT片进行溶出度测定十分必要。本文建立的维生素BT片溶出度测定方法重复性好,准确度高,操作简便,可以对维生素BT片产品质量进行有效控制;同时建议的现行维生素BT片药品质量标准中增加溶出度的检测。
4.8 凡检查溶出度的制剂,不再进行崩解时限的检查。
1 国家药典委员会主编.中华人民共和国药典:四部.2015年版.北京:中国医药科技出版社,2015.121-124.
2 姜建国,张西如,宋更申,等.枸橼酸喷托维林制剂溶出度试验方法的建立及42厂家样品考察.中国药房,2013,24:1593-1595.
3 姜建国,苏玉敏,刘玉真.司莫司汀胶囊溶出度测定方法的研究.中国药房,2014,25:3904-3906.
4 张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量.中国医药工业杂志,2009,40:946-949.
5 谢沐风,张启明,陈洁,等.国外药政部门采用溶出曲线评价口服固体制剂内在品质情况简介.中国药事,2008,22:257-259.
6 程奇蕾,余振喜,张启明.HPLC法测定维生素BT的有关物质.药物分析杂志,2008,28:1709-1711.
7 彭兴盛,王也牧,李珺婵,等.尼莫地平片溶出度测定方法改进及不同样品比较.中国药事,2014,28:1227-1230.
8 李洁.复方醋酸甲地孕酮片溶出度检测.中国药事,2013,27:1272-1276.
9 刘小燕,张晓明,王文丽,等.采用多条溶出曲线评价异烟肼片的质量.中国药事,2017,31:16-22.
10 潘强,徐秋阳,潘智鹏.阿莫西林胶囊在不同介质中的溶出度考察.中国药事,2012,26:238-240.
11 谢沐风.溶出曲线相似性的评价方法.中国医药工业杂志,2009,40:308-311.
12 陈贤春,吴清,王玉蓉,等.关于溶出曲线比较和评价方法.中国医院药学杂志,2007,27:662-663.
13 张宁.普通口服固体制剂溶出度试验研究中需关注的问题.中国新药杂志,2013,22:2607-2610.
14 王亚敏.浅谈溶出度检查方法的研究.药物分析杂志,2007,27:1667-1670.
15 仲艳, 胡军华,林夏,等.盐酸决奈达隆片溶出度测定.中国药师,2013,16:858-861.
16 于海霞,周慧,赵文燕,等.减肥胶囊中维生素BT的毛细管电泳法测定.中国医药工业杂志,2016,47:786-788.
17 宋海燕,曾宪惠,刘鸣旺,等.肉毒碱对实验性心肌损伤线粒体呼吸酶的影响.哈尔滨医科大学学报,1997,31:40-42,106.
18 王月华,杜冠华.L-肉毒碱对D-半乳糖衰老模型小鼠的作用.中国老年学杂志,2003,23:49-51.
19 郭新荣,张辉.血清游离和总肉毒碱的酶法测定.临床检验杂志,1999,17:337-339.
050011 石家庄市,河北省药品检验研究院
10.3969/j.issn.1002-7386.2017.19.042
R 916
A
1002-7386(2017)19-3026-03
2017-04-04)
