滑膜肉瘤CT及MRI表现
2017-09-15徐州医科大学附属医院影像科江苏徐州221002
徐州医科大学附属医院影像科(江苏 徐州 221002)
吴 磊 徐 凯
滑膜肉瘤CT及MRI表现
徐州医科大学附属医院影像科(江苏 徐州 221002)
吴 磊 徐 凯
目的分析滑膜肉瘤(Synovial sarcoma,SS)影像学表现,以提高对该病影像学诊断的准确性。方法 回顾性分析经病理证实的15例SSs CT和MRI表现以及相关的临床资料。结果 15例中,男性7例,女性8例,平均年龄42岁(17-65岁),主要症状为病变区疼痛以及明显可触及肿块。平均病程时间约为4.7月(7天-2年),发病部位主要在大腿(n=5)、小腿(n=3)、足(n=1)、腹膜后(n=2)、肺(n=2)和纵隔(n=1)。8例发生于下肢SSs表现为稍大、边界清晰及密度不均匀软组织肿块,平均直径约6.5cm。1例发生于足SS表现为较大的、边界不清及密度不均匀肿块伴邻近楔状骨及跖骨侵犯。其中4例患者在T2WI上可观察到“三重信号”特征。大部分肿块有分叶征象。7例行增强检查患者表现出肿块呈环形或不均匀强化。2例肺部发病患者表现为肺内孤立的、边界清晰及密度不均匀软组织肿块,增强后内部示无强化坏死或囊变区。1例纵隔滑膜肉瘤患者表现为胸腔内巨大的肿块,内部有囊变区伴不规则分隔,囊壁可见强化壁结节。其中8例患者术后因复发或转移死亡。结论 当青壮年患者在下肢发现稍大、边界清晰软组织肿块,伴或不伴囊变,特别是在T2WI上呈现“三重信号”特征时,此时需考虑或提出滑膜肉瘤的可能。诊断的关键还是需要影像结合临床病理。FDG PET对预后评价有帮助。
滑膜肉瘤;计算机断层扫描;磁共振成像
滑膜肉瘤(SS)首次报道于1893年,是好发于青壮年的恶性软组织肿块[1]。它是起源于具有向滑膜组织分化潜能的间叶细胞,而且超过95%的病例存在特异性染色体异位[2]。它最常见发病部位在四肢,尤其是下肢[3-6],也可发生于肺、心脏及头颈部[7]。组织学上滑膜肉瘤可分为四类:单相纤维型、单相上皮细胞型、双相型及低分化亚型[8]。滑膜肉瘤发病率约占所有恶性间质性肿瘤的5%~10%[4,9],5年生存率约50%[8]。笔者就15例经病理证实的SS患者的影像学表现及临床症状进行回顾性分析,以提高对该病诊断的准确性。
1 资料与方法
搜集本院自2010年10月至2015年4月经手术病理证实的SSs患者15例,男性7例,女性8例,平均年龄42岁(17~65岁),主要症状为病变区疼痛以及明显可触及肿块。在这15例中,6例行CT检查,9例行MRI检查,其中6例行CT增强检查,1例行MRI增强检查。CT检查采用Li-Speed 16螺旋CT机扫描,MRI检查采用Signa HD 3.0TMRI机扫描。CT增强扫描使用非离子型造影剂,经肘静脉采用高压注射器注射。剂量1.5ml/kg,平均流速2.5ml/s,注入造影剂35s、70s后进行双期扫描。MRI增强扫描使用钆喷酸葡胺造影剂,经肘静脉采用高压注射器注射。剂量0.2ml/kg,平均流速2.5ml/s。
2 结 果
临床资料:15例患者临床资料见表1。其中,男性7例,女性8例,平均年龄42岁(17~65岁),主要症状为病变区疼痛以及明显可触及肿块。9例发生在下肢的患者中,3例表现为病变区疼痛与肿胀,6例可触及明显肿块。2例腹膜后病灶患者表现为腹痛,1例肺部患者伴有咳嗽、咳痰。平均病程时间约为4.7月(7天~2年)。在我们随访过程中,7例患者在术后平均11.5个月(1个月~3年)有复发,5例患者在术后平均6.8个月(1~3个月)出现转移。最常见转移部位为肺、腹膜后淋巴结及骨。8例患者因复发或转移死亡,平均生存期约11个月(4~18个月)。
CT及MRI表现:8例发生于下肢SSs表现为稍大、边界清晰及密度不均匀软组织肿块,平均直径约6.5cm(图1-2)。1例发生于足SS表现为较大的、边界不清及密度不均匀肿块伴邻近楔状骨及跖骨侵犯。在T1WI上主要表现为等、低信号,T2WI主要以高信号或混杂不均匀信号为主,其中4例患者在T2WI上可观察到“三重信号”特征,这是由于病灶内含有囊变、出血及一些其他混杂成分(图3-4)。大部分肿块有分叶征象。7例行增强检查患者表现出肿块呈环形或不均匀强化。1例发病于腹膜后病变包绕、推移邻近血管,但是在血管腔内并未出现栓子,病变内含有囊变及不规则分隔(图5-7)。另一例腹膜后病变患者出现腹水症状。2例肺部发病患者表现为肺内孤立的、边界清晰及密度不均匀软组织肿块,增强后内部示无强化坏死或囊变区,2例均未出现胸腔积液或气胸(图8-11)。1例纵隔滑膜肉瘤患者表现为胸腔内巨大的肿块,内部有囊变区伴不规则分隔,囊壁可见强化壁结节,右侧胸腔有少量积液,邻近肋骨未受累及(图12-15)。所有患者在发病初期均匀未发现钙化及淋巴结肿大。
病理表现:所有患者均行手术病理证实,镜下可见梭形细胞呈弥漫性分布,伴有一定异型性。免疫组化所有患者BCL-2蛋白及Vim蛋白均呈阳性(100%)。
3 讨 论
滑膜肉瘤(SS)是一种罕见的恶性间质性肿瘤,发病年龄在5岁~85岁(平均年龄35岁)[10]。男性发病率略高(男女比例约1.13)[11]。免疫组化显示上皮标记物EMA,Vim蛋白及BCL-2蛋白阳性。绝大多数SS都存在t(X;18) (p11.2;q11.2)染色体异位,为SS所特有,因此可为诊断提供有力证据[12]。SYT-SSX融合基因可有助于诊断发生在罕见部位的SS[13]。
在本组研究中,15例患者平均年龄约42岁,女性略多于男性(男女比例约7:8)。病人主要临床表现为病变区疼痛及明显可触及的肿块,15例患者发病部位在大腿(n=5)、小腿(n=3)、足(n=1)、腹膜后(n=2)、肺(n=2)和纵隔(n=1)。说明SS主要以累及下肢为主。
其中13例患者病灶边界清晰,未累及邻近结构,极易误诊为良性病变。仅有1例发生于足底SS侵犯邻近楔形骨及跖骨。其实,在所有的软组织肉瘤中,滑膜肉瘤是被常误诊为良性病变的[14]。Jones[14]等人曾在报道过SS在T2WI上“三重信号”征象,即在病变内可观察到相对于脂肪出现低、等及高信号,这是由于肿块内含有囊变、出血及一些其他混杂成分引起的。本组中有4例患者病灶在T2WI上呈现出“三重信号”征象。
在本研究中有2例原发性肺滑膜肉瘤(Primary pulmonary synovial sarcoma,PPSS),PPSS极其罕见,仅占肺部原发性恶性肿瘤的0.5%[8]。恶性程度高,生长较快[15],常通过血行转移。PPSS通常表现为中央型,患者往往会出现一些呼吸系统症状,比如胸痛、咳嗽及咯血等。而周围型肿瘤比较少见,患者可无任何临床症状,当肿瘤侵犯至邻近胸膜时可出胸腔积液或者气胸[16]。本组2例患者均无胸腔积液及气胸,说明肿瘤并没有侵犯到邻近胸膜。但诊断原发性肺滑膜时,还需排除肺部以外的病变,以确定肺内肿瘤并不是由肺外转移而来,因为肺部是滑膜肉瘤最常见的转移部位。本组2例患者无肺外肿瘤性病变。

表1 临床资料
发生于纵隔内滑膜肉瘤极其罕见,于1989年由Witkin[17]等人首次报道。由于纵隔滑膜肉瘤在临床发病率极低,故缺乏典型的临床表现和影像征象。本组患者表现为右侧胸背疼痛。CT增强表现为肿块实性成分明显强化,内部有囊变区伴不规则分隔,囊壁可见强化壁结节,此征象与以往文献报道相符合[18]。
预后不良的因素包括:疾病进展至晚期、肿块体积较大(直径≥5cm)、男性患者、核分裂率>9/10HPF[19]以及肿瘤侵犯邻近结构等,所以早期诊断及治疗至关重要。FDG PET对预后评价有帮助,当治疗前病变区FDG摄取值超过4.4g/ml时,提示肿块复发及转移的风险会大大增加[20]。
SS5年生存率约50%[8],在我们随访过程中,本组7例患者在术后平均11.5个月(1个月~3年)有复发,5例患者在术后平均6.8个月(1~3个月)出现转移。最常见转移部位为肺、腹膜后淋巴结及骨。8例患者因复发或转移死亡,平均生存期约11个月(4~18个月)。
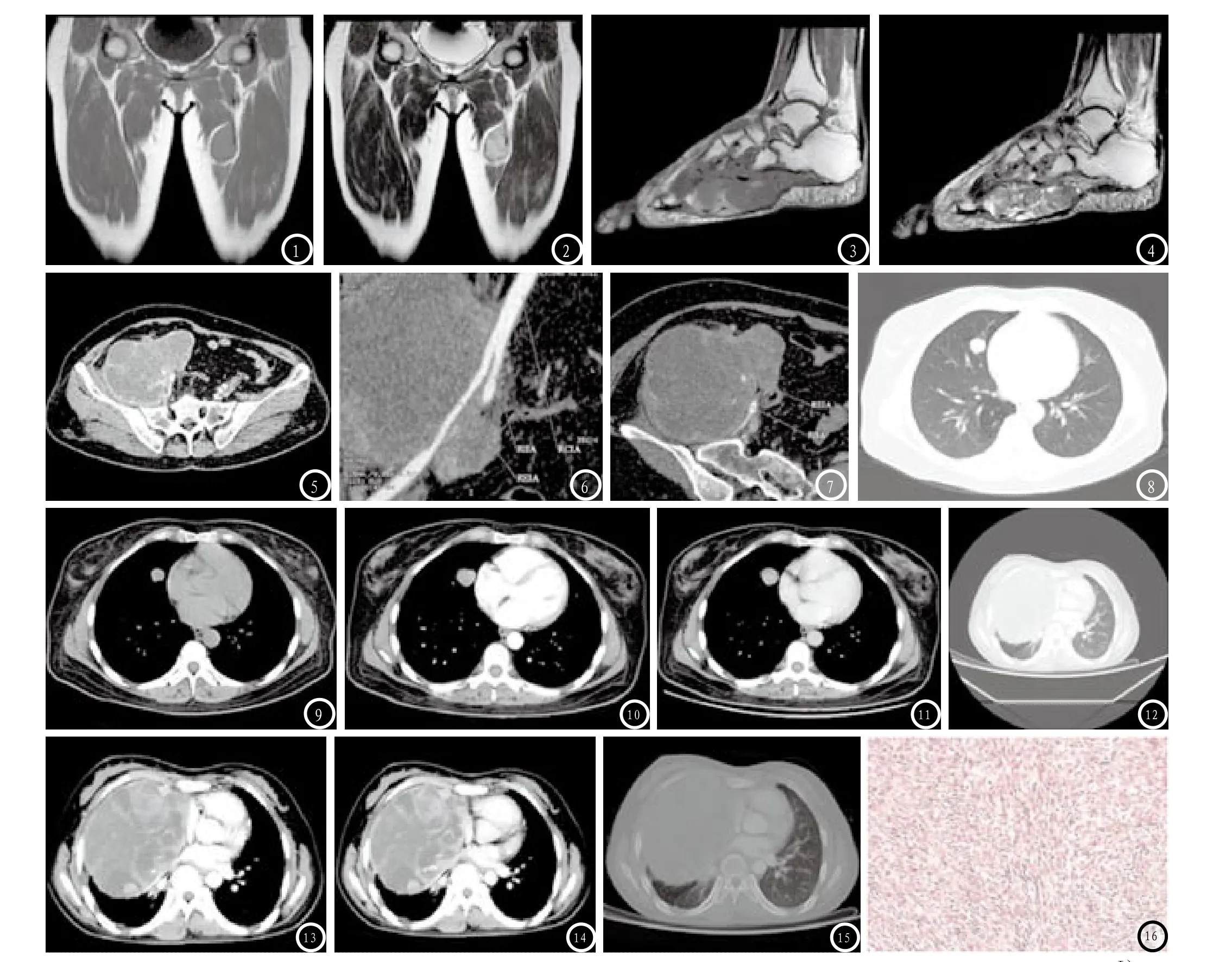
图1-2 38岁女性患者,发生于左侧大腿SS。冠状位MRI显示在左侧大腿内侧肌群内一稍大、边界清晰及密度不均匀肿块(图1,T1WI;图2,T2WI)。图3-4 47岁男性患者,发生在右足底SS。矢状位MRI显示在足底软组织内巨大的、边界不清及密度不均匀肿块,伴有上方楔状骨及跖骨侵犯。肿块内可见“三重信号”特征,即相对于脂肪呈现低、等及高信号(图3,T1WI;图4,T2WI)。图5-7 57岁女性患者,发生在腹膜后SS。轴位CT增强扫描上显示呈中等强化的外生性肿块,内有较大囊变区及不规则分隔(图5)。病变包绕右侧髂外动脉及压迫右侧髂内静脉(图6-7)。图8-11 49岁女性患者,发生在右肺中叶SS。轴位CT平扫+增强显示肺内孤立的、边界清晰及密度不均匀软组织肿块,增强后内部示无强化坏死或囊变区,未见胸腔积液及气胸(图8 肺窗,图9 纵隔窗,图10 动脉期,图11 静脉期)。图12-15 岁女性患者,发生于前纵隔SS。轴位CT增强显示右侧胸腔内巨大的肿块,内部有囊变区伴不规则分隔,囊壁可见强化壁结节,右侧胸腔有少量积液,邻近肋骨未受累及(图12 肺窗,图13 动脉期,图14 静脉期,图15 骨窗)。图16 镜下可见梭形细胞呈弥漫性分布,伴有一定异型性(HE×200)。
总结,当青壮年患者在下肢发现稍大、边界清晰软组织肿块,伴或不伴囊变,特别是在T2WI上呈现“三重信号”特征时,此时需考虑或提出滑膜肉瘤的可能。诊断的关键还是需要影像结合临床病理。FDG PET对预后评价有帮助。
[1]Mccullough A E,Schwartz A J, Taylor V L,et al.Synovial sarcoma presenting as an avascular mass: radiologicpathologic correlation[J]. Skeletal Radiology,2015, 44(2):279-284.
[2]Suurmeijer AJH,de Bruijn D, Geurts van Kessel A,Miettinen MM.Synovial sarcoma.In: Fletcher CDM,Bridge JA, Hogendoorn PCW,Mertens F, editors.WHO Classification of Tumors of Soft Tissue and Bone. Lyon:IARC Press,2013,213-215.
[3]Cadman N L,Soule E H,Kelly P J. SYNOVIAL SARCOMA; AN ANALYSIS OF 34 TUMORS[J].Cancer,1965, 18:613-627.
[4]Mckinsey D S,Mckinsey J P,Brune P R.Diagnosis and management of synovial sarcoma[J].Journal of Surgical Oncology,1997, 83(3):121-126.
[5]O'Sullivan P J,Harris A C,Munk P L.Radiological features of synovial cell sarcoma[J]. British Journal of Radiology, 2008,81(964):346-56.
[6]Wright P H,Sim F H,Soule E H, et al.Synovial sarcoma[J]. Journal of Bone & Joint Surgery American Volume,1982, 64(1):112-122.
[7]Dennison S,Weppler E G.Primary pulmonary synovial sarcoma: a case report and review of current diagnostic and therapeutic standards[J]. Oncologist,2004,9(3):339-342.
[8]Ling W W,Nikolaos P,Lasha G, et al. Primary synovial sarcoma of the lung: can haemothorax be the first manifestation[J]. Journal of Thoracic Disease, 2014,6(12):E249-251.
[9]Kransdorf M J.Benign soft-tissue tumors in a large referral population:distribution of specific diagnoses by age, sex, and location[J].Ajr American Journal of Roentgenology,1995, 164(2):395-402.
[10]Marc L,Antonescu C R,Leung D H, et al.Impact of SYT-SSX fusion type on the clinical behavior of synovial sarcoma: a multiinstitutional retrospective study of 243 patients[J].Cancer Research,2002,62(1):135-140.
[11]Nielsen TO,Poulin NM,Ladanyi M.Synovial sarcoma:recent discoveries as a roadmap to new avenues for therapy[J].Cancer Discov,2015,5(2):124-34.
[12]Rosa Angélica S H,Leonardo Saúl L S,Kuauhyama L O. Synovial sarcomas of the head and neck: comparative analysis with synovial sarcoma of the extremities[J].Auris Nasus Larynx,2013,40(5):476-480.
[13]Namba Y,Kawai A,Naito N,et al.Intraarticular synovial sarcoma confirmed by SYTSSX fusion transcript[J]. Clinical Orthopaedics & Related Research,2002,395(395):221-226.
[14]Deshmukh C,Bakshi A,Bhagwat R,et al.Magnetic resonance imaging features of extremity sarcomas of uncertain differentiation[J].Clin Radiol,2009,62(10):959-960.
[15]Nakano J,Yokomise HHuang C L, Misaki N,et al.Progressive growth of primary synovial sarcoma of the lung[J].Annals of Thoracic & Cardiovascular Surgery Official Journal of the Association of Thoracic & Cardiovascular Surgeons of Asia,2010,16(3):194.
[16]Pp R,Das A,Sarkar A,et al. A primary synovial sarcoma of lung[J].North American Journal of Medical Sciences,2012, 4(5):241-243.
[17]Witkin G B,Miettinen M,Rosai J.A biphasic tumor of the mediastinum with features of synovial sarcoma. A report of four cases[J].American Journal of Surgical Pathology,1989, 13(6):490-499.
[18]Trupiano J K,Rice T W, Herzog K,et al.Mediastinal synovial sarcoma: report of two cases with molecular genetic analysis[J].Annals of Thoracic Surgery,2002,73(2):628-630.
[19]Trassard M,Le Doussal V, Hacène K,et al.Prognostic factors in localized primary synovial sarcoma: a multicenter study of 128 adult patients[J]. J Clin Oncol 2001,19(2):525-534.
[20]Lisle J W,Eary J F,O’Sullivan J,et al. Risk Assessment Based on FDG-PET Imaging in Patients with Synovial Sarcoma[J]. Clinical Orthopaedics & Related Research,2009,467(6):1605-1611.
(本文编辑: 汪兵)
The CT and MRI Features of Synovia Sarcoma
WU Lei, XU Kai. Department of Radiology, the Affiliated Hospital of Xuzhou Medical University, Xuzhou221002, Jiangsu Province, China
ObjectiveTo analyze the radiological and clinicopathological features of synovial sarcoma (SS) to improve its diagnostic accuracy.MethodsWe retrospectively reviewed the computed tomography (CT) and magnetic resonance (MR) imaging of 15 cases of SS confirmed immunohistochemically. Relevant clinical data was also obtained. Results Of 15 cases, there were 7 male and 8 female with a mean age of 42 years(range 17–65 years). The main symptoms were the aggravated pain of the lesion site and enlarged palpable masses. The duration of symptoms varied from 7 days to 2 years with a mean of 4.7 months. Fifteen lesions were located in the thigh (n=5), crus (n=3), foot(n=1), retroperitoneum(n=2), groin(n=1), lung(n=2) and mediastinum (n=1). Eight cases of SSs originating from lower limbs demonstrated a largish, well-defined, heterogeneous masses with an average size of 6.5 cm. One patient with foot lesion showed a large. illdefined, and heterogeneous mass with adjacent cuneiform and metatarsal invasion. A "triple signal" pattern can be observed on T2WI in four of them. Most of the masses showed lobulated in shape. After administration of contrast agents in seven patients, the tumors displayed annular or marked heterogeneous enhancement. The two lung lesions showed isolated, well-demarcated, and heterogeneous masses with internal multiple nonenhancing regions, representing necrosis or cystic degeneration. One mediastinal tumor with large size and cystic area contained irregular septations and mural nodules within them. Eight patients died of recurrences or metastases after surgery or therapy.ConclusionThe diagnosis of SS should be suggested in the adult patient when imaging depicts a largish, well-defined, soft-tissue mass containing area of cystic degeneration in the lower extremity, specially a "triple signal" pattern is detected on T2WI. The key for correct diagnosis is to inosculate imaging to clinicopathological data. FDG PET may be helpful for the assessment of prognosis.
Synovial Sarcoma; Computed Tomography; Magnetic Resonance Imaging
R445.3;R738.5
A
10.3969/j.issn.1672-5131.2017.09.039
2017-07-24
徐 凯
