三种化学物质诱导白三叶草叶斑病抗性的研究
2017-09-13梁巧兰魏列新徐秉良
梁巧兰, 魏列新, 张 娜, 徐秉良
(甘肃农业大学植物保护学院 甘肃省农作物病虫害生物防治工程实验室, 甘肃 兰州 730070)
白三叶草(Trifoliumrepens) 是一种多年生草本植物,是世界上最重要的牧草之一[1]。近年来三叶草在绿肥作物以及园林设计中的应用较多,种植面积不断扩大。但是叶斑病发生日趋严重,已成为限制三叶草栽培的主要病害之一。发病时叶片上产生褐色边缘的白色小圆斑或不规则型病斑,叶片正、反面可见黑色分生孢子,以背面居多,发病严重时叶片干枯死亡,严重影响白三叶草的产量和品质,同时失去观赏价值。目前国内关于白三叶草叶斑病的研究较少,仅李晶[2]、罗禄怡[3]、商鸿生[4,5]、周晓燕[6]、李征[7]等人进行了相关报道。长期以来生产上主要采用化学药剂进行防治,而化学药剂防治存在农药残留、污染等问题,使其观赏价值降低,同时影响人类健康。而诱导抗病性是指植物在各种诱导因子的作用下,使植物体内与抗病有关的基因得到表达,从而产生抗病性,即系统获得抗性(systemic acquired resistance, SAR)[8-10]。目前,植物诱导抗病性为植物病害的防治开辟了一条新途径。利用化学诱抗剂水杨酸、纳米硅、草酸钾、草酸铵诱导植物抗病性已有报道[11-14]。但是,有关兰州市白三叶草叶斑病病原鉴定及利用诱导抗病性防治白三叶草叶斑病的研究国内外尚未见报道。为此,本试验对引起兰州市白三叶草叶斑病的病原菌进行了鉴定,并选用水杨酸、硅酸钾、硅酸钠3种化学物质对白三叶草叶斑病诱导抗性进行了研究,旨在确定这3种化学物质对白三叶草叶斑病抗病性的诱导效果,为白三叶草生长期病害的防治提供理论依据。
1 材料与方法
1.1 供试材料
白三叶草叶斑病病样采自甘肃农业大学校园、北滨河路、植物园、五泉山等地三叶草绿化带;供试白三叶草种植于实验室内(品种为普通白三叶)。
供试化学物质 水杨酸(SA)、硅酸钠(Na2SiO3)、硅酸钾(K2SiO3)购自天津市光复科技发展有限公司,均为分析纯。
1.2 试验方法
1.2.1病原菌分离纯化及鉴定
1.2.1.1 病原菌的分离纯化 将采集的病样清洗干净后,于超净工作台上切取叶片病健交界组织,经0.1%升汞表面消毒10 S,用灭菌水冲洗3~5次后,接种于PDA平板上,置于28℃温箱中培养观察,当边缘长出菌丝时,挑去少量菌丝重新接在新制PDA平板上,直至每一皿的菌落形态一致并产孢后,采用单孢分离法[15]对分离菌进行纯化。
1.2.1.2 分离菌致病性测定 按照柯赫氏法则进行。将分离物配制成孢子悬浮液接种到白三叶草叶片上,在28℃恒温箱中保湿培养,3 d后观察发病情况。待发病后再次分离,并将分离物与1.2.1.1.中分离纯化得到的进行比较,然后保存备用。
1.2.1.3 病原菌的鉴定 显微镜下观察病原菌菌丝及孢子形态,并结合真菌鉴定手册进行鉴定。
1.2.23种化学物质对白三叶草叶斑病病原菌抑菌作用及其诱导抗病效果 采用“生长速率法”,将水杨酸、硅酸钠、硅酸钾用灭菌水分别配制成100 μg·mL-1×50倍、50 μg·mL-1×50倍、25 μg·mL-1×50倍,在无菌条件下取1 mL不同浓度的溶液加入49 mL PDA培养基中摇匀后倒入4个灭菌的培养皿中,以加无菌水为对照,做好标记。在无菌操作条件下将经过PDA活化培养3 d的白三叶草叶斑病菌用灭过菌的打孔器沿菌落边缘制成菌饼,并将菌饼接种于冷却后的含药PDA上,在28℃恒温箱内培养72 h后,用十字交叉法测定菌落的直径,并按下式计算不同化学物质的抑菌率。

将健康的三叶草叶片经75%酒精消毒、灭菌水冲洗干净,用筛选出的无抑菌活性的化学物质(上述不同浓度)处理叶片后,叶面朝上放置于已灭菌并有湿滤纸的培养皿中,2 d后喷雾接种叶斑病病原菌的孢子悬浮液(1.0×l04个·mL-1),用清水作对照,然后室温保湿培养,接种7 d后按下列分级标准调查发病情况,统计发病数,并按下式计算病情指数和诱导抗病效果。
白三叶草叶斑病症状分级标准[15]:0级 无症状;1级:病斑占叶面积1/16;2级:病斑病斑占叶面积1/8~1/4; 3级:病斑占叶面积5/16~1/2;4级:病斑占叶面积9/16~3/4。
1.2.33种化学物质对白三叶草酶活性的影响
1.2.3.1 试验方法 用筛选出的具有诱导抗病效果的一定浓度的水杨酸、硅酸钾和硅酸钠以叶面喷雾的方式处理白三叶草植株,处理2 d后采用喷雾法接种叶斑病病原菌孢子悬浮液(1.0×104个·mL-1),分别设置清水处理(CK)、接菌(Al)、水杨酸(SA)、硅酸钠(Na2SiO3)、硅酸钾(K2SiO3)、水杨酸+接菌(SA+Al)、硅酸钠+接菌(Na2SiO3+Al)、硅酸钾+接菌(K2SiO3+Al)几个不同处理,并于处理后1,3,5,7 d及接种前1 d,采集处理的白三叶草叶片,利用生物化学方法测定多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、过氧化物酶(POD),所有测定重复3次。
1.2.3.2 酶液的提取、活性的测定及计算 分别参考El Ghaouth[16]和中国科学院上海植物生理研究所[17]的方法对苯丙氨酸解氨酶(PAL)进行提取及酶活性测定;POD、PPO的提取采用袁庆华等[20]方法。POD的测定采用愈创木酚作底物,用分光度法测定生成物的含量,在470 nm波长下测定吸光值。以1 mL去离子水代替H2O2为对照[17]。
在上述反应条件下,以每分钟每克鲜样A值变化1.00所需的酶量为1个酶活单位(U)。各样品均测定2次,3个重复。以上数据均采用SPSS 19.0进行LSD法统计分析,P<0.05。
1.2.43种化学物质对白三叶草田间诱导防病效果测定 将3种化学物质配成浓度为25 μg·mL-1的溶液,喷雾处理田间三叶草植株,以不同化学物质作为处理,每个处理样方0.25 m2(约300株),重复3次,以清水喷雾为对照。分别于处理前和处理后7、14 d按1.2.2中分级标准采用5点取样法,每样点随机调查30株,共90个叶片,并按下式计算田间发病率、病情指数(同1.2.2)及诱导防治效果(参考农药田间药效试验准则,略有修改)[18]。

2 结果与分析
2.1 白三叶草叶斑病田间症状
白三叶草叶斑病产生两种类型的病斑,一种为边缘呈褐色或淡绿色的白色小圆斑或不规则型病斑,另一种为白色病斑,无褐色边缘;在秋天病叶正、反面可见黑色分生孢子,以背面居多,茎上产生褐色病斑,严重时茎和叶片干枯死亡(图1)。

图1 白三叶草叶斑病症状(A,B:边缘为褐色的白色病斑;C:白三叶草叶片背面的的病斑;D:白色病斑;E:茎上的褐色病斑及黑色分生孢子;F:对照)
Fig.1 Symptoms of white clover leaf spot disease(A,B,C:white disease spot with brown leaf edge on both the obverse and inverse sides; D: white disease spot on leaf;E: brown disease spot and black conidia on the stems;F: control
2.2 白三叶草叶斑病病原菌鉴定
通过致病性测定和培养形态观察,发现分离纯化的菌株接种白三叶草叶片 5 d后出现褐色病斑,其症状与采集的样品症状一致,并且从病斑上分离得到的分离物与起初分离到的一致,表明该分离物为白三叶草叶斑病的病原菌;在PDA培养基上培养,初期菌落为乳白色、圆形、其上有同心轮纹,后期菌落逐渐转为灰褐色至黑色,同心轮纹渐渐消失。分生孢子梗褐色,分枝或不分枝,有隔。分生孢子暗褐色,卵形至倒棍棒形,具0~6个纵隔膜,1~9个横隔膜,基部圆滑。菌丝无色透明,有分隔。根据病原菌形态特征结合真菌鉴定手册将其鉴定为链孢霉目(Moniliales)、黑霉科(Dematiaceae)豆链格孢菌(Alternariaazukiae)(图2)。

图2 白三叶草叶斑病病原菌(A、B:分别为单孢分离菌前、后期培养形态;C:菌丝及分生孢子)
Fig.2 Pathogen of white clover leaf spot disease(A,B:Colony morphology of single spore isolates at early and final culture; C: Hyphae and spores
2.3 3种化学物质对豆链格孢菌抑菌率活性测定及其诱导抗病效果
通过对不同浓度3种化学物质抑菌活性测定,结果表明水杨酸、硅酸钠和硅酸钾对白三叶草叶斑病菌的抑制作用较低,浓度为100 μg·mL-1时3种化学物质的抑菌率最高,分别为7.55%,4.44%和8.29%,随着浓度的降低,抑菌率逐渐降低,当浓度为25 μg·mL-1时,硅酸钠的抑菌率仅为0.59%(表1)。
诱导抗病性试验结果表明:不同处理的白三叶草叶斑病发生情况不同。经方差分析表明,同一化学物质不同浓度处理的病情指数与对照的病情指数之间均存在显著差异,而且3个浓度处理的病情指数之间也存在显著差异,其中浓度为25 μg·mL-1时3种化学物质处理的病情指数均低于其他两个浓度处理的。同一浓度不同化学物质处理的病情指数与对照的病情指数之间均存在显著差异,浓度为100 μg·mL-1时,水杨酸与硅酸钠处理的病情指数之间存在显著差异,而硅酸钾处理的病情指数介于二者之间;浓度为50 μg·mL-1时,水杨酸与硅酸钠、硅酸钾处理的病情指数之间存在显著差异,而硅酸钠、硅酸钾处理的病情指数之间差异不显著;浓度为25 μg·mL-1时,水杨酸、硅酸钾处理的病情指数与硅酸钠处理的病情指数之间存在显著差异,而水杨酸、硅酸钾2种化学物质处理的病情指数之间差异不显著。统计分析结果表明:所选用的3种化学物质对白三叶草叶片抗豆链格孢菌均有一定诱导作用,在3种浓度下的诱导抗病效果均在45%以上,且低浓度时诱导抗病效果均略高于高浓度处理,当浓度为25 μg·mL-1时,3种化学物质诱导抗病效果均最好,分别为53.18%,53.73%和45.69%(表1)。

表1 3种化学物质对白三叶草叶斑病菌的诱导抗病效果Table 1 Induced resistant effect of three kinds of chemical to Alternaria azukiae
注:不同大写字母表示同一物质不同浓度处理之间差异显著(P<0.05);不同小写字母表示同一浓度不同物质处理之间差异显著(P<0.05)
Note: Different capital letter indicate significant differences among the same substance at different concentration treatments and control at the 0.05 level;different lowercase letters indicate significant differences among the same concentrations of different substance treatments at the 0.05 level
2.4 3种化学物质诱导处理对白三叶草酶活性的影响
2.4.13种化学物质诱导处理对白三叶草叶片多酚氧化酶(PPO)活性的影响 3种化学物质诱导处理对白三叶草叶片中多酚氧化酶(PPO)活性均有影响,PPO活性呈现先升高后降低的趋势,其中硅酸钾(K2SiO3+Al)和硅酸钠(Na2SiO3+Al)诱导处理的叶片中PPO活性在第3 d均达到峰值,水杨酸诱导处理在第5 d达到峰值,分别为0.24,0.05,0.11 U·mg-1·min-1,且25 μg·mL-1硅酸钾诱导(K2SiO3+Al)处理后,在第1,3,5,7 d时PPO活性均高于对照(CK)及其他处理,且与其他处理的酶活性之间存在极显著差异,尤其在第3,5 d时硅酸钾诱导处理(K2SiO3+Al)的PPO活性分别比对照(CK)的提高了92.98%和92.53%,比接菌(Al)处理提高了76.03%和73.63%,比硅酸钠、水杨酸诱导处理的分别提高了79.34%和82.09%、75.61%和46.26%,(图3);水杨酸诱导处理(SA+Al)在第5,7 d时PPO活性高于对照(CK)、接菌(Al)、硅酸钠+接菌(Na2SiO3+Al)处理,分别比对照(CK)提高了86.11%和82.41%、比接菌(Al)提高了50.93%和41.67%、比硅酸钠+接菌(Na2SiO3+Al)处理提高了66.67%和66.67%,但略低于水杨酸(SA)处理;且酶活性之间存在极显著差异;硅酸钠诱导处理(Na2SiO3+Al)的酶活性均低于硅酸钾诱导处理(K2SiO3+Al)和水杨酸诱导处理(SA+Al)(图3)。

图3 3种化学物质诱导处理对三叶草叶片中PPO活性影响
Fig.3 Effect of induction treatment of three chemical substances on PPO activities of white clover leaves
注:不同小写字母表示同一天不同物质处理的酶活性之间差异显著性(P<0.05),下同
Note: Different lowercase letters showed significant differences at the same day of different substance treatments at the 0.05 level,the same as below
2.4.23种化学物质对过氧化物酶(POD)活性的影响 3种化学物质诱导处理对白三叶草叶片中过氧化物酶(POD)的活性均有影响,POD活性呈先升高后降低的趋势,在第5 d时POD活性均达到峰值,分别为9.70,7.92,8.51 U·mg-1·min-1;第1 d时除水杨酸诱导处理的POD活性高于SA、CK和接菌处理外,硅酸钾(K2SiO3+Al)、硅酸钠(Na2SiO3+Al)诱导处理的POD活性低于硅酸钾(K2SiO3)、硅酸钠(Na2SiO3)的处理,高于对照(CK)和接菌(Al)处理;硅酸钾(K2SiO3+Al)诱导处理的分别比对照(CK)、接菌(Al)、硅酸钾(K2SiO3)处理的POD活性高6.65,6.40,0.95 U·mg-1·min-1,水杨酸(SA+Al)诱导处理的POD活性分别比对照(CK)、接菌(Al)、水杨酸(SA)处理的高5.75,5.50,1.76 U·mg-1·min-1,硅酸钠(Na2SiO3+Al)诱导处理的POD活性分别比对照(CK)、接菌(Al)和硅酸钠(Na2SiO3)处理高3.85,3.60和0.26 U·mg-1·min-1,且硅酸钾诱导处理(K2SiO3+Al)的POD活性和水杨酸(SA+Al)、硅酸钠(Na2SiO3+Al)诱导处理的酶活性之间均存在极显著差异(图4)。

图4 3种化学物质诱导处理对三叶草叶片中POD活性影响
Fig.4 Effect of induction treatment of three chemical substances on POD activities of white clover leaves
2.4.33种化学物质对苯丙氨酸解氨酶(PAL)活性的影响 硅酸钾(K2SiO3+Al)、硅酸钠(Na2SiO3+Al)和水杨酸(SA+Al)诱导处理对白三叶草叶片中苯丙氨酸解氨酶(PAL)酶活性均有影响,呈现先升高后降低的趋势,在第5 d时PAL活性均达到峰值,分别为9.63,7.78,8.12 U·mg-1·min-1;其中硅酸钾(K2SiO3+Al)诱导处理后PAL活性分别比水杨酸(SA+Al)和硅酸钠(Na2SiO3+Al)诱导处理高了0.36%,14.69%,15.68%,10.64%和28.74%,19.93%,19.22%,22.38%,比对照(CK)提高了28.41%,25.00%,36.04%, 35.33%,与其他处理的PAL酶活性之间存在极显著差异(图5)。
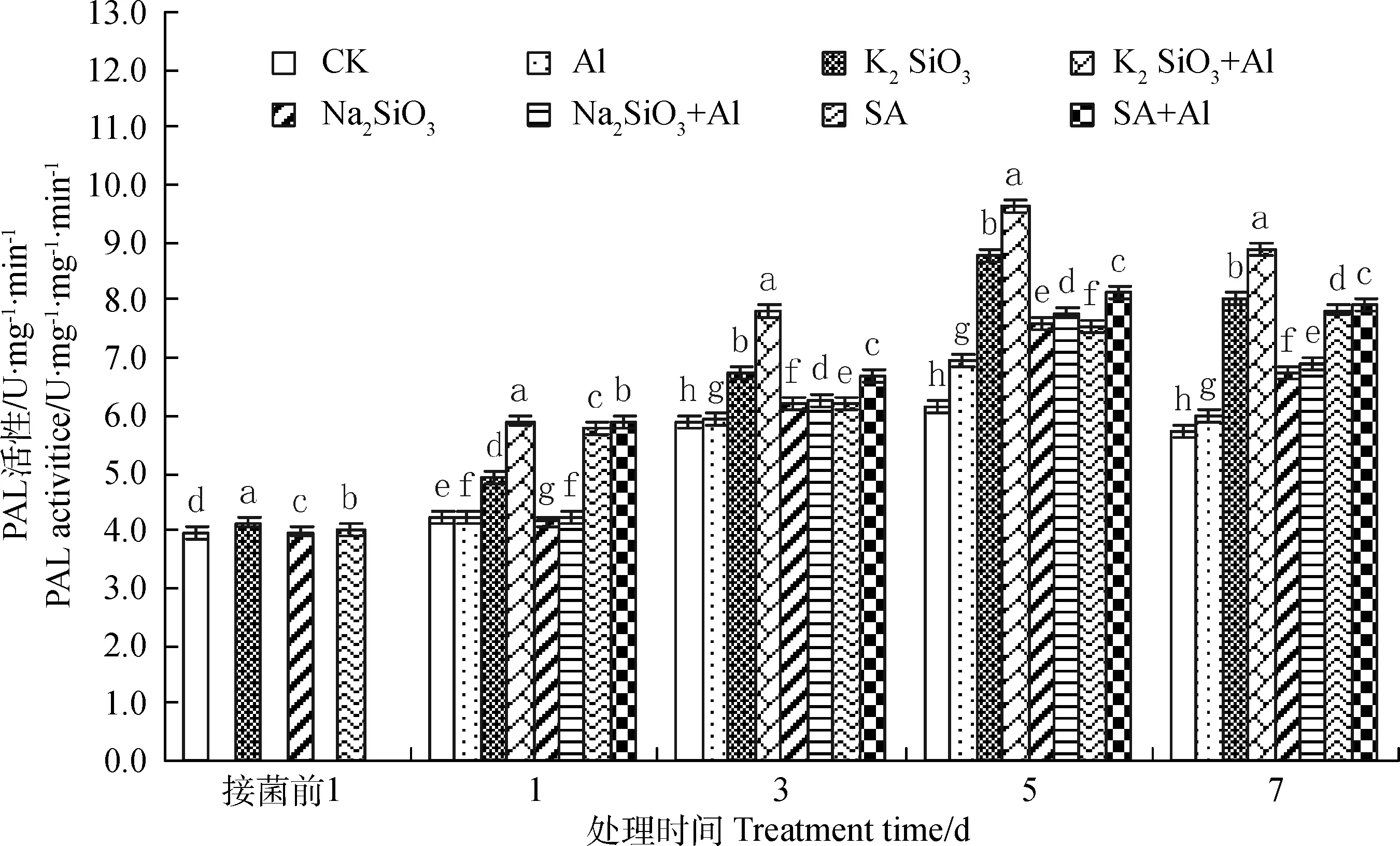
图5 3种化学物质诱导处理对三叶草叶片中PAL活性影响
Fig.5 Effect of induction treatment of three chemical substances on PAL activities of white clover leaves
2.5 3种化学物质对白三叶草田间诱导防病效果测定
田间诱导防病效果测定结果表明3种化学物质对白三叶草抗叶斑病均有一定的诱导防治作用,处理后7 d的诱导防病效果均达到72%以上,其中硅酸钾的诱导防治效果最好为81.22%,水杨酸次之,硅酸钠最低;诱导处理14 d后硅酸钾、硅酸钠和水杨酸的诱导防病效果分别比处理后7 d的降低了64.06%,67.96%和61.35%(表2)。

表2 3种化学物质对白三叶草抗叶斑病田间诱导防治效果Table 2 Inducted resistant effect of three kinds of chemical substances on white clover against leaf spot in the field
3 讨论与结论
3.1 讨论
诱导抗病性是利用物理、化学及生物的方法预先处理植株,改变植物对病害的反应,使原来感病反应产生局部或系统的抗性。水杨酸(salicylic acid, SA)是一种简单的酚类化合物,最先在柳树皮的提取物中被发现,作为一种重要的植物防卫激素,在植物防御反应尤其是SAR中起着重要的作用[19],外源SA 处理可以诱导水稻 (OryzasativaL.)、芒果(MangiferaindicaL.)、花生(ArachishypogaeaLinn.)、香蕉(Musaparadisiaca)、桉树(Eucalyptus)、棉花(AnemonevitifoliaBuch)、玉米(ZeamaysL.)、辣椒(CapsicumannuumL.,)、草坪型高羊茅(Festucaarundinacea)、观赏百合(LiliumL.)等多种植物病害产生局部和系统抗性[13-14,20-21];另外适宜浓度的外源SA可以提高苜蓿的抗旱性及超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性[22]以及初花期扁蓿豆光合作用,提高其干物质产量和饲草品质[23];硅酸钠作为诱抗剂在水稻抗稻瘟病、苹果梨、厚皮甜瓜、杏等采后病害方面有报道;而硅酸钾作为诱抗剂的研究尚未见报道。植物诱导抗性的产生通常是通过酶催化调节而实现,植物受到病原菌侵染或被诱导处理后,与抗病反应密切相关的防御酶活性升高是诱导抗性产生的重要机制之一[8];本试验研究结果表明:SA 、硅酸钾、硅酸钠诱导后能引起白三叶草叶片内POD,PPO 和PAL 活性的升高,这与高峰[24]、李云华[25]、葛永红[25]等报道的在辣椒、花生、棉花、水稻、烟草、玉米等植物上施用SA,苹果梨、杏采后硅酸钠处理对防御酶影响的结果相似。POD是植物体内普遍存在的氧化还原酶,他不仅参与了木质素、酚类物质及植保素的合成,还作为整个代谢途径的调节因子,通过影响植物体内多种代谢途径而在抗病性中起作用,是与植物抗病有关的一种重要酶[27-28]。多酚氧化酶(PPO)是酚类物质氧化的关键酶,参与植物体内酚类物质氧化产生醌类并参与木质素的合成,催化酚类物质氧化形成的预苯酸是合成木质素的前提,可以修复伤口,杀死和抑制病原菌的繁殖而起到抗病作用[29]。PAL活性与植物抗病性密切相关,其活性可作为衡量植物抗病性的生化指标之一。植物感染病原菌后PAL活性明显升高,并表现出规律性的变化,如张淑珍[30]等在对疫霉根腐病菌毒素胁迫下不同大豆抗感品种PAL活性的研究中发现,抗病大豆品种的根、茎和叶中PAL活性在病程的大部分阶段都高于对照,PAL的植物抗病机制主要表现为参与植保素、木质素和酚类物质的合成[31]。由此可见这3种酶活性的提高是植物抗病性增强的具体表现。本试验结果也表明经水杨酸、硅酸钾、硅酸钠诱导处理后,白三叶草叶片组织内病程相关蛋白酶PPO、POD和PAL活性均在短时间内提高,表现出规律性变化,且明显高于对照,表明这三种化学物质能够激活白三叶草叶片的防御体系,使白三叶草叶片产生了对叶斑病的抗性;3种化学物质处理后PPO变化规律不同,硅酸钾、硅酸钠处理可使白三叶草叶片中的PPO在短时间内活性迅速升高,在第3 d达到峰值,水杨酸处理后PPO活性在第5 d达到峰值,而POD、PAL变化一致,可在第5天达到峰值,这表明3种化学物质对白三叶草抗叶斑病的诱导机制可能存在差异,本试验尚未涉及;另外,田间试验结果表明3种化学物质对白三叶草抗叶斑病有一定的诱导防治效果,但随着时间推移诱导防病效果明显降低,对于这3种化学物质的最佳诱导时间、诱导抗病性持效期以及能否诱导白三叶草叶片产生对其他叶部病害的抗性等问题还有待于进一步研究。
3.2 结论
经鉴定发现豆链格孢菌(Alternariaazukiae)为引起兰州地区白三叶草叶斑病的病原菌;浓度为25 μg·mL-1的硅酸钾、硅酸钠、水杨酸对豆链格孢菌抑菌率较低且室内诱导抗病效果最好,分别为53.18%,53.73%和 48.69%;经3种化学物质诱导处理后,白三叶组织内与病程相关的抗氧化酶POD和PPO活性均在短时间内提高,且明显高于对照。3种化学物质田间处理对白三叶草抗叶斑病均有一定的诱导效果,处理后7 d的诱导防病效果均达到72%以上,其中硅酸钾的诱导抗病效果最好,为81.22%;诱导处理14 d后硅酸钾、硅酸钠和水杨酸的诱导防病效果分别比处理后7 d的降低了64.06%,67.96%和61.35%,表明3种化学物质对白三叶草抗叶斑病均有较好的诱导防病作用。
