红花黄色素对TGF-β1诱导的人肺泡上皮A549细胞转分化的抑制作用及其信号转导机制研究※
2017-09-13郭迎科李瑞琴
● 郭迎科 李瑞琴
红花黄色素对TGF-β1诱导的人肺泡上皮A549细胞转分化的抑制作用及其信号转导机制研究※
● 郭迎科 李瑞琴▲
目的:通过体外培养人肺泡上皮细胞A549,用TGF-β1刺激其发生上皮-间质转化,运用现代分子生物学和超微病理学实验技术,探讨红花黄色素在防治肺间质纤维化上皮间质转化中的干预作用及机制。方法:将正常培养的人肺泡上皮细胞A549分6组:正常对照组、TGF-β1诱导组(TGF-β1终浓度为5ng/ml,诱导24h)、地塞米松组(地塞米松2μg/mL)、红花黄色素低、中、高3个剂量干预组(红花黄色素25μg/mL+TGF-β1 5ng/mL、红花黄色素中剂量组红花黄色素50μg/mL+TGF-β1 5ng/mL、红花黄色素高剂量组红花黄色素75μg/mL+TGF-β1 5ng/mL)。TGF-β1 5ng/L干预A549细胞生长24h,采用四甲基偶氮唑盐法(MTT法)检测不同剂量红花黄色素作用于TGF-β1刺激A549细胞后其发生上皮-间质转化后各组的吸光值(OD值),计算其增殖活性,绘制细胞增殖曲线。采用倒置显微镜观察各组细胞的生长状态与形态变化。结果:(1)MTT检测结果显示:与正常对照组相比较,TGF-β1诱导组细胞活力略高,差异具有统计学意义(P<0.05);红花黄色素中药干预组细胞的增殖活力下降,与正常对照组和TGF-β1诱导组相比较,差异有统计学意义(P<0.05)。(2)倒置显微镜观察显示:经过TGF-β1刺激后,A549细胞由正常的铺路石样贴壁生长呈现出间质细胞的特征,呈明显的拉长状态,由鹅卵石状转变为纺锤型或梭型,出现伪足样改变,藤索样生长,类似于成纤维细胞,且细胞之间间隙增大。结论:通过观察红花黄色素各剂量组发现,细胞的形态逐渐接近正常的A549细胞,视野内细胞的数目按一定的剂量效应关系减少。
肺纤维化 红花黄色素 上皮-间质转分化
肺纤维化又称肺间质纤维化(Pulmonary fibrosis,PF),是以弥漫性肺泡炎、肺间质炎症和间质纤维化为特征的病变。随着近年来汽车尾气、工厂废气和工地的扬尘等增多,大气污染加剧,雾霾频发,肺纤维化发病率持续攀升[1]。中医中药在治疗肺纤维化方面具有独特的优势。本实验运用现代分子生物学实验技术,探讨红花黄色素对TGF-β1诱导的人肺泡上皮A549细胞转分化的抑制作用及其信号转导机制研究,为临床应用红花黄色素治疗肺纤维化提供实验室依据。
1 材料
1.1细胞株人肺泡上皮细胞A549(凯基生物公司)
1.2主要药物与试剂人重组TGF-β1(美国PEPROTECH公司);重组细胞因子溶解液稀释套装(联科生物)红花黄色素(山西德元堂药业有限公司,批号H41020330);地塞米松磷酸钠注射液(河南润弘制药股份有限公司,批号1607206);0.9%氯化钠注射液(山东华鲁制药有限公司,批号H37022750)RPMI 1640培养基(Solarbio生物公司);青、链霉素混合液(Solarbio生物公司);胎牛血清(杭州四季青);四甲基偶氮唑蓝(MTT,美国Sigma公司);0.25%胰蛋白酶(Solarbio生物公司);二甲基亚砜(DMSO,Solarbio生物公司)。
1.3仪器二氧化碳培养箱(美国Thermo公司);超净工作台(北京世安公司);全自动高压蒸汽灭菌器(日本TOMY公司);超低温冰箱(美国Thermo公司);倒置相差显微镜(日本Olympus公司);微量移液器(德国Eppendorf公司);水平摇床(江苏海门其林贝尔仪器制造有限公司);酶标仪(美国Thermo公司);细胞培养瓶、96孔细胞培养板(上海圣纳堡生物公司);超低温冰箱(美国Thermo公司);纯水机(美国密理博公司);制冰机(常熟雪科公司);电热恒温鼓风干燥箱(上海一恒科技有限公司);台式离心机(德国Eppendorf公司);低温离心机(美国Thermo公司)。
2 方法
2.1细胞培养[2-3]
2.1.1 细胞复苏 将人肺泡上皮细胞A549从-80℃冰箱中取出,迅速置于37℃水浴锅,一次性手套包裹轻轻摇晃使细胞冻存块快速充分溶化;消毒冻存管管口四周后开启,将溶解好的细胞悬液吸入10mL离心管中,加入双倍体积的10%1640完全培养基,800r/min低速离心5min;去除冻存液,PBS洗涤细胞1~2遍;10%完全培养基重悬细胞,将细胞悬液按照预先设定好的实验步骤接种到新的培养瓶中;标记后入37℃、5%CO2浓度的培养箱。
2.1.2 细胞培养与传代 细胞培养24h,在倒置显微镜下观察其生长状态,待细胞长满约80%时进行细胞传代;弃旧的培养基,PBS洗涤一次细胞,去除多余的培养基;加入适量的0.25%的胰酶消化,消化时间根据镜下观察的细胞形态(变小变圆,即将开始脱落)来控制,终止消化时加入完全培养基进行终止;收集细胞至15mL离心管,离心、洗涤细胞1~2次后制成单细胞悬液;将单细胞悬液接种于新的培养瓶里;标记细胞与实验者信息,置于37℃、5%CO2的培养箱中继续培养。
2.1.3 细胞冻存 取指数生长期A549细胞,消化、离心,弃上清,制成1×106个/mL的单细胞悬液,加入冻存液1mL(RPMI1640:FBS:DMSO=7∶2∶1);放入细胞冻存管并标记、封口,依次于4℃冰箱放置60分钟,-20℃冰箱放置120分钟,最后放入-80℃冰箱保存。
2.2造模及分组根据MTT预实验结果及实验的综合考虑,选取红花黄色素75μg/mL、50μg/mL及25μg/mL的浓度梯度来进行实验,选取地塞米松2μg/mL,该实验分为6组:正常对照组、TGF-β1诱导组(TGF-β1终浓度为5ng/ml,诱导24h)、地塞米松组(地塞米松2μg/mL)、红花黄色素低、中、高3个浓度干预组(红花黄色素高浓度组75μg/mL+TGF-β1 5ng/mL、红花黄色素中浓度组红花黄色素50μg/mL+TGF-β1 5ng/mL、红花黄色素低浓度组 25μg/mL+TGF-β1 5ng/mL)。先用5ng/mL TGF-β1刺激A549细胞24h,然后加入地塞米松及各浓度的红花黄色素;正常对照组则为10%1640完全培养基培养A549细胞。
2.3细胞增殖检测收集细胞取正处于对数生长期的细胞,加胰酶消化,离心后用10%的1640完全培养基制成含2.5×104个/mL的单细胞悬液。接种96孔板根据预实验结果选取的红花黄色素3个浓度,每个计量组设6个复孔,4个时间点,每个时间点设3个复板;在96孔板上加入所制成的细胞悬液,每孔200μL,置于37℃、5%CO2、饱和湿度培养箱中培养24h待细胞贴壁;吸弃培养液,加入不同浓度的药物和正常对照组的完全培养基200μL,培养箱里继续培养;分别于12h、24h、48h取出细胞培养板,每孔加入20μL MTT,继续培养4h;弃上清,加150μL DMSO/孔,摇床震动约20min,充分溶解沉淀;酶联免疫检测仪测定,设定波长为490nm,测出各组的吸光度(OD值),实验重复5次[4-5];以各时间点为横坐标,各组细胞相应的OD值为纵坐标,绘制A549细胞的生长曲线图。
2.4细胞形态检测培养细胞,设置正常对照组、TGF-β1模型诱导组、地塞米松组和红花黄色素高、中、低浓度干预组,倒置显微镜下观察并拍照细胞在不同的时间点的状态表现并拍照保存,取生长24h的细胞图片(放大100倍),对比各组细胞的变化及不同。
3 结果
3.1倒置显微镜观察结果倒置相差显微镜下,采用TGF-β1 5ng/mL干预A549细胞生长24h后,细胞出现显著变化。正常的A549细胞多呈铺路石样上皮细胞形态及生长状态,TGF-β1刺激后,细胞形态变为纺锤形或梭形,出现伪足样改变,呈现拉长状态,细胞之间间隙加大,藤索样生长,连接变得稀疏,类似于成纤维细胞。红花黄色素干预后A549细胞形态逐渐趋于正常。见图1。
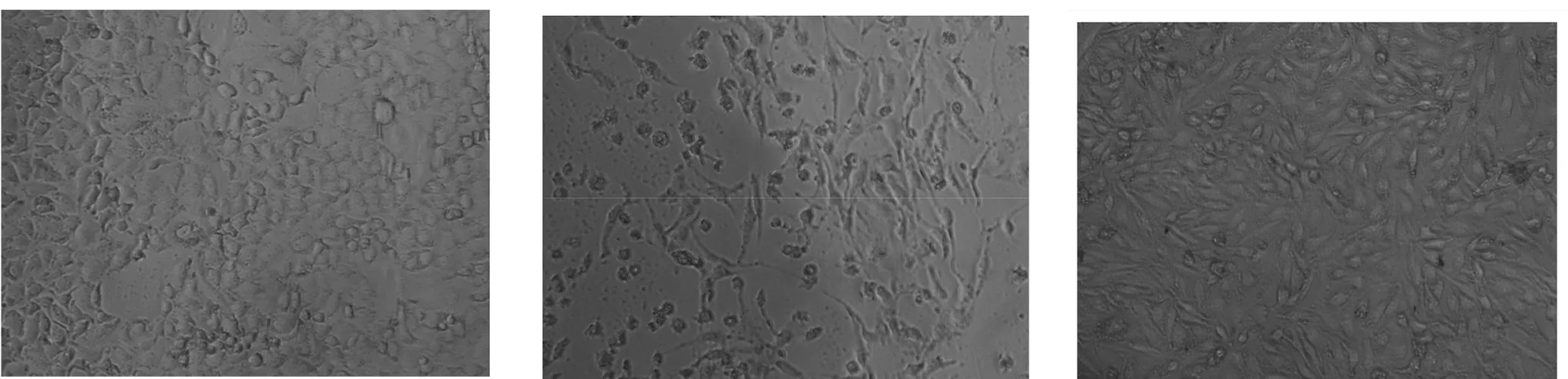
a.正常对照组 b.TGF-β1模型诱导组 c.地塞米松组

d.红花黄色素高浓度组 e.红花黄色素中浓度组 f.红花黄色素低浓度组
图1倒置显微镜观察结果
3.2 MTT检测结果MTT法中测得的实验各组的吸光值,计算出不同浓度的红花黄色素对细胞的增殖的作用。结果显示:TGF-β1 5ng/mL诱导A549细胞,细胞的增殖活性略有增加,与正常对照组细胞比较,差异具有统计学意义(P<0.05);红花黄色素干预细胞后,在一定的药物剂量范围内,随药物剂量的增加,细胞的增殖受到影响。各组间进行比较,12h、24h及48h时,红花黄色素三个浓度组与正常对照组比较差异均有统计学意义(P<0.05);与TGF-β1诱导组比较,12h、24h时红花黄色素三个浓度组均具有统计学意义(P<0.05),48h时仅低浓度组有统计学意义(P<0.05)。见表1、图2。
表1 红花黄色素对A549体外增殖的影响(n=5;;吸光值A490nm)
注:与正常对照组比较,#P<0.05;与TGF-β1诱导组比较,*P<0.05。

图2 红花黄色素对A549体外增殖的影响
4 讨论
肺纤维化是一个不可逆的渐进性疾病,是多种肺部疾病的终末表现,目前缺乏有效的治疗手段和治疗药物。随着科学技术的不断发展与进步,肺纤维化发生机制的分子层次研究方兴未艾,单味或复方中药对不同通路的多靶点的协同治疗将成为中医药防治肺纤维化的新趋势[1]。
上皮间质转化是指有极性的上皮细胞失去其上皮特征并逐渐转化为具有迁徙和侵袭能力的间充质细胞的过程。在致病因素的长期作用下,肺泡上皮细胞的完整性和特征被打乱并重排,引起形态学或生理学上的改变,部分上皮细胞表型发生改变,发生上皮细胞-间质细胞转分化(Epithelial-mesenchymal transition,EMT)。EMT过程有多条信号通路参与,各条信号通路之间通过配体相互交联,使EMT过程在一定程度上维持稳态。
转化生长因子-β(TGF-β)是一种多效性的细胞因子,是目前肺纤维化的研究热点和重要的药物作用靶点。TGF-β可由淋巴细胞、单核细胞、上皮细胞和成纤维细胞等多种细胞产生,通过自分泌和旁分泌的方式调节细胞的增殖、分化、迁移、黏附,调节细胞外基质(Extracellular matrixc,ECM)的代谢,参与肺胚胎发育、组织损伤和修复。大量的实验研究表明,TGF-β在小鼠肺纤维化疾病的过程中起着关键的作用如调节胶原蛋白合成、成纤维细胞增生、细胞凋亡、以及成纤维细胞分化[6]。
研究[7]表明,其致纤维化作用不仅与下游Smad蛋白家族信号通路有关,还与丝裂原活化蛋白激酶家族ERK1/2信号通路密切相关,两者共同调控相应的靶分子转录。有研究显示,博莱霉素(BLM)诱导大鼠肺纤维化模型中肺组织各时间段ERK1、ERK2、磷酸化ERK1/2的表达明显高于同期对照组,说明信号蛋白ERK1/2在肺泡炎症和纤维化阶段均参与了BLM致肺纤维化的发病过程[8]。国内外研究表明,在博来霉素、二氧化硅、石棉和电离辐射致肺纤维化的人和动物模型中均有磷酸化的ERK(p-ERK)表达增加,再次证明ERK信号通路在一定程度上参与了纤维化病变的发生[9]。由此可见,ERK信号通路可能是TGF-β1对细胞调控作用中最为重要的通路之一。Davis等[10]与Mucsi等[11]均在各自研究中发现,给细胞转染显性失活的ERK,可抑制TGF-β1刺激的纤溶酶原激活物抑制剂-1(PAI-1)和I型胶原(COL-I)增强子等的活性;而转染相应的野生型ERK质粒却引起胶原基因的表达增加。TGF-β介导的ERK通路是肺纤维化形成最为重要的通路之一。研究发现[12],TGF-β受体I(TβRI)主要介导TGF-β1的促纤维化作用,TGF-β受体II(TβRⅡ)则主要参与抑制细胞生长。组织纤溶酶原激活物抑制因子(PAI-1)是重要的ECM成分。活化后的丝裂原活化蛋白激酶(motogen-activated protein kinases,MAPKs)转位到细胞核,激活转录因子,调节相应效应基因而发挥作用。研究显示[13],ERK磷酸化(p-ERK)蛋白水平明显上调,ERK蛋白表达水平无大变化,TβRI可经Ras/ERK通路促进胶原合成,印证了ERK依赖的受体活化型Smad(R-Smad)接头域的磷酸化作用增强了I型胶原合成,提示ERK和Smads信号之间在胶原产生上存在着协同作用。
TGF-β诱导的EMT在肺纤维化的形成过程中扮演非常重要的角色,EMT的分子机制及逆转EMT的分子机制目前尚不是很明确,进一步研究影响上皮间质转化这一病理生理现象的调控因素及其在肺纤维化中的作用及相关信号通路,是目前肺纤维化的靶向药物研究和治疗思路。
红花黄色素(Saffower Yellower)是菊科植物红花[14]的干燥花的主要生理活性成分,具有扩张周围血管、降低血压、抑制血小板聚集、增强纤维蛋白溶解、降低全血黏度等作用。红花活血通经,祛瘀止痛,在临床上主要用于治疗闭塞性脑血管疾病、冠心病、脉管炎。近年来,关于红花黄色素的抗纤维化作用引起了人们的关注,并进行了许多体内外实验[2]。研究[3]已发现: 红花黄色素可缓解大鼠和小鼠急性肺部炎症损伤所致的水肿、淤血及炎症因子表达的升高,红花黄色素能缓解大鼠慢性阻塞性肺疾病发病过程中的炎症损伤;以红花黄色素为主要成分的红花注射液能缓解博来霉素诱导的大鼠肺纤维化以及红花黄色素可抑制 TGF-β1诱导人肺泡上皮细胞A549活化。
本研究表明TGF-β1能刺激人肺泡上皮细胞向间质细胞发生转变,红花黄色素作用后12h、24h及48h三个浓度组与正常对照组比较差异均有统计学意义(P<0.05),A549细胞形态逐渐趋向于正常。与TGF-β1诱导组比较,12h、24h时红花黄色素三个浓度组均具有统计学意义(P<0.05),而48h时仅低浓度组有统计学意义(P<0.05),由此可见红花黄色素能抑制TGF-β1诱导的人肺泡上皮细胞A549发生向间质细胞转变的趋势。其调控因素及在肺纤维化中的作用机制及相关信号通路的研究,是我们下一步探索的方向。
[1]郭迎科,李瑞琴,丁玉文.肺纤维化发病机制的细胞因子研究进展[J].亚太传统医药杂志.2016,12(19):69-71.
[2]赛利斯.细胞和组织培养相关技术、病毒、抗体、免疫细胞化学-细胞生物学实验手册[M].北京:科学出版社,2008:42-182.
[3]兰 容,周珍辉.动物细胞培养基本技术方法[M].北京:化学工业出版社,2010:14-95.
[4]刘建文.细胞培养技术在药理学研究中的应用[M].北京:化学工业出版社,2010:56-120.
[5]向 丽,朱 江,曾 静.细菌药敏试验MTT法与常量稀释法比较性研究[J].泸州医学院学报,2006,29(1):45-46.
[6]董晓峰,赵 静,王献华,等.转化生长因子β1相关基因在肺纤维化中的作用[J].现代预防医学,2012,39(6):1548.
[7]KamarajuAK,Roberts A B.Role of Rho/ROCK and p38MAP kinase pathways in transforming growth factor-beta-mediated Smad-dependent growth inhibition of human breast carcinoma cells in vivo[J].J Biol Chem,2005,280(2):1024-36.
[8]徐 芳,徐启勇,叶燕青. ERK信号通路在肺纤维化大鼠中的研究[J].武汉大学学报(医学版),2005,26(3):322-5.
[9]赵明哲,刘靖华,李玉花,等.ERK信号通路的信号转导调控机制[J].国际病理科学与临床杂志,2009,29(1):15-19.
[10]DavisB H,Chen A,Beno D A.Raf and mitogen-activated protein kinase regulate stellate cell collagen gene expression[J].J Biol Chem,1996,271:11039-42.
[11]Mucsi I,SkoreckiK L,GoldbergH J.Extracellular signa-l regulated kinase and the small GTP-binding protein,rac,contribute to the effects of transforming growth factor-B1on gene expression[J].J BiolChem,1996,271:16567-72.
[4]杨雅茹,黄 艳,李 俊.TGF-βl介导的Smads与ERK通路在肺纤维化中的作用及相互关系[J].中国药理学通报,2010,26(5): 561-563.
[13]TaoYY,Wang X L,LiuCH. Salvianolic acid-B effects on TGF-βl/ERK signaling transducfion in NIH/3T3 fibroblast[J].J Cap Med Univ,2007,28(2):192-195.
[14]高学敏.中药学[M].北京:中国中医药出版社,2006.
2017年度河南省高等学校重点科研项目(No.17A310020);河南省科技厅基础与前沿技术研究(No.112300410052);河南省高等学校重点科研项目(No.17A310020);河南中医药大学研究生创新项目(No.2016YCX004)
李瑞琴,女,教授,硕士生导师。主要从事中医药防治肺纤维化。E-mail:xyzjane1314@163.com
河南中医药大学(450046)
▲
