中华倒刺鲃不同生理性能对降温的响应速率
2017-09-12覃英莲付康康付世建
覃英莲,柏 杨,付康康,付世建
重庆师范大学, 进化生理与行为学实验室, 重庆市动物生物学重点实验室, 重庆 400047
中华倒刺鲃不同生理性能对降温的响应速率
覃英莲,柏 杨,付康康,付世建*
重庆师范大学, 进化生理与行为学实验室, 重庆市动物生物学重点实验室, 重庆 400047
为了考查长期高温驯化的中华倒刺鲃(Spinibarbussinensis)幼鱼快速降温后不同生理功能对低温环境的响应速率,将实验鱼分为2组分别在15℃和25℃条件下长期驯养(8周),随后25℃组快速降温至15℃(降温组),同时15℃组(恒低温对照组)温度保持不变;在降温后的第1、2、4和8周分别测定和比较降温组和恒温对照组实验鱼的温度耐受能力、游泳能力、自发活动水平、摄食代谢和生长性能等相关生理指标。结果显示:降温后,低温耐受能力(CTmin)1周时就达到稳定与对照组不再有差异,而高温耐受能力(CTmax)2周时才达到稳定;与对照组相比,降温处理导致实验鱼自发活动水平(运动时间百分比,PTM和运动总距离,TDM)显著上升,且此差异持续整个驯化周期(P< 0.05);降温组的临界游泳速度(Critical swimming speedUcrit)在降温的1—2周均显著小于对照组(P< 0.05),直到4周才达到稳定;降温组实验鱼特殊动力作用(Specific dynamic action SDA)持续时间和摄食后代谢峰值(Peak metabolic rate PMR)与对照组在降温1—4周均没有显著差异;尽管降温组有更高的摄食率,其食物转化效率和增重率均显著低于对照组(P< 0.05)。研究表明:中华倒刺鲃在水体温度下降后,不同生理功能的稳定速率存在差异,这可能与不同生理功能的生态关联及内在机制的不同有关;降温处理导致机体生长受阻,其主要原因可能是由于应对环境温度变动的逆境胁迫、生理功能调整以及自发活动增加所导致的能量消耗上升所致。
温度驯化;热耐受;可塑性;运动;生长性能
温度是自然界最重要的生态因子之一,一方面直接作用于机体生化反应速率,进而对个体运动能力和生长性能产生重要影响;另一方面,温度通过影响环境食物丰度和水体理化性质,间接支配着生物的生理功能状态[1- 3]。研究显示,鱼类的温度耐受能力与其环境温度密切相关,且对鱼类的地理分布具有重要影响[4]。在相关研究中,通常采用临界温度作为温度耐受能力的指标。游泳运动是鱼类获取食物和逃避敌害等生命活动的重要实现方式[5],临界游泳速度(Ucrit)是评价其能力的重要指标[6],与机体最大代谢率(MMR)密切相关。自发运动是指不依赖外部刺激,仅由动物内部的状态所引起的活动,同样与鱼类的觅食、迁移和逃避敌害等行为密切相关[7],研究者主要采用运动时间(PTM)和移动距离(TDM)等作为自发运动水平的衡量指标[8-9]。研究发现,温度对鱼类的游泳能力和自发运动水平均有显著影响[10]。生长是机体与适合度关联的重要特征参数,温度的改变通常会影响到个体的摄食、消化和同化能力(通常以鱼类摄食后的代谢变化衡量),进而影响其生长性能[11-12]。鱼类的热耐受能力、游泳活动(包括运动能力和自发运动水平)、摄食代谢和生长性能对个体生存能力和种群的繁衍均具有重要的意义。由于上述不同生理功能的生态学关联各异,涉及的内在机制也截然不同,理论上不同生理功能对温度变化的响应速率可能存在较大差异,相关研究对于揭示鱼类对环境温度变动的适应能力具有重要的意义。
近年来由于气候变化、水利工程的建设和其他人类活动的干扰,水体温度状况发生了显著的变化。目前人们更多的是关注全球气候变暖的问题,然而由于水体密度的物理学特性,水体温度下降的速率和幅度远远大于温度上升,在自然界和人工养殖的水体中降温对鱼类生理产生的胁迫比升温显得更为严峻。更为重要的是,有关鱼类热生物学的相关工作主要关注长期温度驯化(4—8周)对相关生理指标的影响。然而,鱼类生理功能对快速温度变化(特别是降温)的响应能力,即短期快速适应能力可能决定其能否在变温后的水体正常生存繁衍,而相关研究却鲜有报导。因此,本研究选取了我国特有的暖水性鱼类中华倒刺鲃(Spinibarbussinensis)为研究对象,其栖息地生境温度在夏季和秋季可能出现高达10℃的快速降温过程[13]。本研究通过对长期高温驯化(25℃)后快速降温组和恒定低温条件下(15℃)中华倒刺鲃幼鱼温度耐受、游泳能力、自发运动、摄食代谢和生长性能的比较,探讨在快速温度变化条件下该种鱼不同生理功能在新的温度条件下稳定速率,即对快速温度变化的响应速率。
1 材料与方法
1.1 实验鱼的来源及驯养
实验鱼(4—6 g,N=500)购于四川水产校,随机平均分为两组分别置于15(±1)℃和25(±1)℃水温条件下在实验室自制的自净化循环控温水槽中驯养两个月。驯养期间实验用水为曝气后的自来水,保证水体溶氧≥ 90%饱和溶氧,光制为12L∶12D,每天定时以维持日粮水平的商业饵料投喂一次。
1.2 实验方案
驯养两个月后,将25℃水槽驯养的实验鱼分配到3个实验水槽驯化(即3个重复),随后水槽温度以每天2℃的速率降至15℃,即降温组;15℃水槽驯养的实验鱼同样分配至3个水槽,但水温保持不变,即恒(低)温对照组。两组实验鱼在15℃下驯化8周,分别在驯化的1、2、4和8周时选取大小相近的实验鱼进行鱼体大小、热耐受、游泳能力、自发运动、摄食代谢和生长性能等相关实验参数的测定(所有实验鱼均不重复使用,相关测定方法见后)。为消除体重对实验参数测定的影响,除生长实验(饱足投喂)外均采用维持日粮水平投喂1次。实验测定前所有实验鱼均禁食24 h以消除消化活动的影响[14]。除温度耐受实验外,所有实验均在15(±1)℃水温下进行。
1.3 实验操作方法
1.3.1 热耐受的测定
采用临界温度法(Critical thermal methodology)[15]对实验鱼的热耐受能力进行测定。将每组实验鱼(N=10,3个重复水槽分别选取3、3和4尾实验鱼)转移到与驯化水温相同(15℃)的热耐受测试系统中。待实验鱼适应1 h后,用加热棒或冷水机控制水温使其以0.3℃/min[3]的速率升温(或降温),采用数字温度计持续监测水温。在整个实验过程中保证水体溶氧饱和度≥90%饱和溶氧。以实验鱼失去平衡时的温度作为临界温度(临界高温CTmax或临界低温CTmin)[4]。CTmax和CTmin是通过对失去平衡的实验鱼的百分比与温度进行线性回归,再由“内插法”得到50%个体失去平衡所对应的温度值求得[16]。
1.3.2Ucrit的测定
采用本实验室自行研制的游泳代谢测定仪测定[17],为消除转移过程对实验鱼胁迫的影响,实验前将单尾实验鱼移入游泳代谢仪的游泳管中适应1 h,适应期间游泳管内的水流速度为6 cm/s(≈1倍体长)。Ucrit的测定采用逐步提高法,初始速度为6 cm/s,之后以每档6 cm/s的流速增量(Δv)逐步增加水流速度直至实验鱼力竭。每档速度的游泳历时为(ΔT)20 min。力竭标准:实验鱼不能抵抗水流而后退且在游泳代谢仪尾端筛板处停留20s以上[18]。Ucrit的计算公式[18]如下:
Ucrit=U+(t/T)ΔU
(1)
式中,Ucrit为临界游泳速度(cm/s),U为实验期间实验鱼顺利完成设定时间(20min)的最大游泳速度(cm/s),ΔU为流速增量(6 cm/s),T为各速度梯度下设定的时间(20min),t为实验鱼在力竭速度档的游泳时间。在测定Ucrit的过程中用溶氧仪同步测定各游泳速度下的耗氧率(MO2),保证水体溶氧水平不低于80%。每2 min计算一次MO2,具体计算公式如下:
MO2=(St-Sb)×60×Vol/m
(2)
St为实验鱼游泳时溶氧值随时间变化斜率的绝对值;Sb为无实验鱼存在的溶氧值随时间变化斜率的绝对值(细菌耗氧量),60为时间常数(min);Vol为扣除实验鱼体积后的仪器水体系统总体积(L);m为实验鱼体重(kg)。Ucrit测定过程中MO2最大值定义为MMR。
1.3.3 自发运动的测定
将每组实验鱼(N=8,3个水槽分别选取3、3和2尾)分别移入单个自发运动测定装置(直径30 cm,水深10 cm)中,在恒温、≥90%饱和溶氧条件下适应12 h过夜,于第2天的9:00、15:00和21:00时用摄像头对实验鱼的活动进行持续15 min的拍摄。拍摄结束后对视频进行分析,计算实验鱼在拍摄期间的TPM(%)和TDM(cm)。
1.3.4 摄食代谢的测定
摄食代谢即食物特殊动力作用(SDA)采用本实验室自行设计的流水式呼吸代谢测定仪进行测定[19]。测定前将禁食24 h后的实验鱼从各实验处理组转移至测定仪的呼吸室中。转移后的实验鱼在呼吸室中适应24 h后开始测定MO2,共测定3次,每次测定的时间间隔为1 h,将3次的平均值作为实验鱼的标准代谢率(Standard metabolic rate, SMR)。由于实验鱼在呼吸室内不会自主摄食,故在测定SMR后立即将实验鱼转移到养殖单元,饱足投喂商业饵料(投喂时间为0.5 h),随后将实验鱼重新移入呼吸室中。立即测定实验鱼摄食后的MO2,连续测定12 h,时间间隔为1 h。每尾实验鱼摄食后的MO2计算公式如下:
MO2=ΔO2×v/m
(3)
式中,ΔO2表示实验鱼所在呼吸室与空白对照的溶氧差值,v表示实验鱼所在呼吸室的水体流量(L/s),m表示实验鱼的体重(kg)。通过溶氧仪测定呼吸室出口处水体获取溶氧值,通过收集单位时间呼吸室末端的水体得到流量数据。
衡量摄食代谢的相关指标有:①SDA持续时间(Duration,h),即实验鱼从摄食到MO2恢复到SMR的时间;②摄食代谢峰值(Peak metabolic rate,PMR;mgO2/(kg.h)),即SDA过程中最大的耗氧率值;③SDA系数(SDA coefficient,%),SDA总耗能占摄食总能量的比例。
1.3.5 生长性能的测定
生长实验与其他测定同期进行,即驯养结束后从各温度组选取24尾大小相似的实验鱼喂养于3个养殖单元中(每单元8尾)。每天按时(09:00)饱足投喂1次,并记录实验鱼的摄食情况,在每个驯化周期结束后称量实验鱼的体重、体长。计算增重率(Weight gain,%/d)、摄食率(Feed rate,%/d)和食物转化效率(Feed efficiency)。
摄食率(FR,%d-1)=100×Fc/[(Wt+W0)/2]/t
(4)
增重率(WG,%d-1)=100×(Wt-W0)/t
(5)
食物转化效率(FE)=(Wt-W0)/Fc
(6)
式中,W0为初始体重(g),Wt为终末体重(g),t为实验时间(d),Fc为总的摄食量(g)。
1.4 数据统计
实验数据以Excel(2003)进行常规计算,随后用SPSS 17.0对数据进行统计分析。以身体大小(体长或体重)为协变量,数据经正态分布和方差同质性检验后,采用双因素协方差分析检验实验处理(降温组对恒低温对照组)和时间对实验参数的影响,显著性水平为P<0.05。如有显著差异采用Duncan多重比较或t检验分析驯化时间或实验处理的统计差异。
2 实验结果
2.1 中华倒刺鲃热耐受对降温的响应速率
CTmax:实验处理对CTmax有显著影响,且此影响随驯化时间延长而消除(交互作用:P< 0.05)(图1,表1)。降温组和恒低温对照组的CTmax仅在1周驯化后差异显著(P<0.05),而在驯化2—8周后均无显著差异。驯化时间对CTmax有显著影响,恒低温对照组CTmax驯化1周时显著低于其他时间,而降温组驯化1周的CTmax显著高于其他驯化时间(P<0.05)。
CTmin:两实验处理组的CTmin没有显著差异(图1,表1)。驯化时间对CTmin有显著影响,且随着驯化周期的延长实验鱼的CTmin逐渐下降(P<0.05)。其中,恒低温对照组驯化4周和8周显著小于驯化1周(P<0.05);而降温组驯化2周和4周显著小于1周,而驯化8周显著小于其他所有驯化时间(P<0.05)。
2.2 中华倒刺鲃游泳能力对降温的响应速率
随着游泳速度的上升,不同实验组的MO2均显著上升(P< 0.05)(图2),且总体上同一游泳速度下恒低温对照组高于降温组(图2,P<0.05)。相对于驯化1周和2周,驯化4周和8周后其差距逐渐缩小。
Ucrit:温度处理和驯化时间对Ucrit均有显著影响且存在交互作用(P<0.05)(图3,表1)。驯化初期,恒低温对照组的Ucrit显著大于降温组(P<0.05)。随着时间延长,对照组Ucrit显著下降,而降温组Ucrit没有显著变化,因此驯化4周和8周时,降温组与恒低温对照组的Ucrit不再有显著差异甚至大于恒低温对照组。
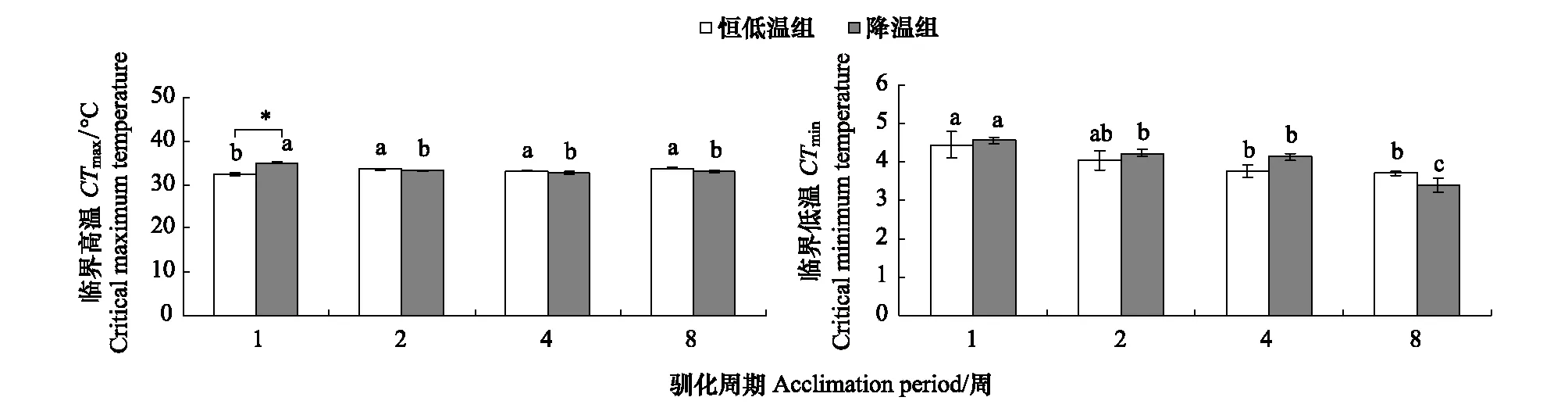
图1 温度变化对中华倒刺鲃热耐受的影响(平均值±标准误,N=10)Fig.1 The effect of thermal treatment on thermal tolerance in qingbo (Mean±S.E, N=10)*表示同一驯化时期不同温度处理组间有显著差异(P<0.05),a, b, c表示同一温度处理组不同驯化时期有显著差异(P<0.05)
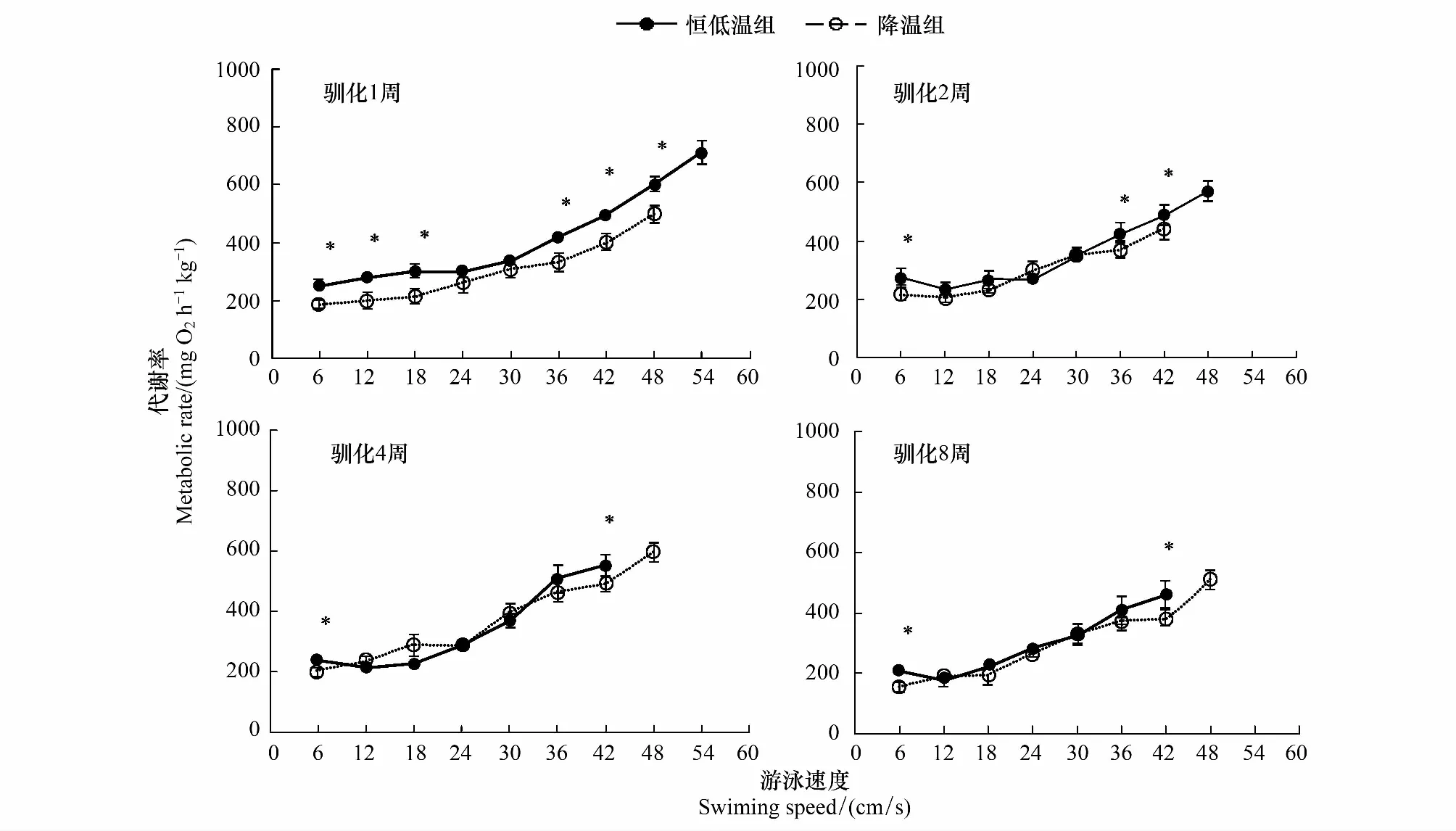
图2 不同游泳速度下实验鱼的代谢率(平均值±标准误,N=12)Fig.2 The metabolic rate of experimental fish swum under different swimming speed (Mean±S.E, N=12)*表示同一游泳速度下不同处理组有显著差异

图3 温度变化对中华倒刺鲃游泳能力的影响(平均值±标准误,N=12)Fig.3 The effect of thermal treatment on swimming performance in qingbo (Mean±S.E, N=12) *表示同一驯化时期不同处理组有显著差异,a, b, c表示同一处理组不同驯化时期有显著差异
MMR:温度处理和驯化时间对MMR均有显著影响且存在交互作用(P<0.05)(图3,表1)。驯化初期,恒低温对照组的MMR显著大于降温组(P<0.05)。恒低温对照组MMR在驯化1—4周没有显著变化,而驯化8周时显著下降(P<0.05);降温组在驯化2和4周比驯化1周相比显著上升,然后在驯化8周时显著下降(P<0.05)。因此恒低温对照组和降温组的MMR在驯化1周时差异最为显著,驯化2—8周其差异显著缩小。
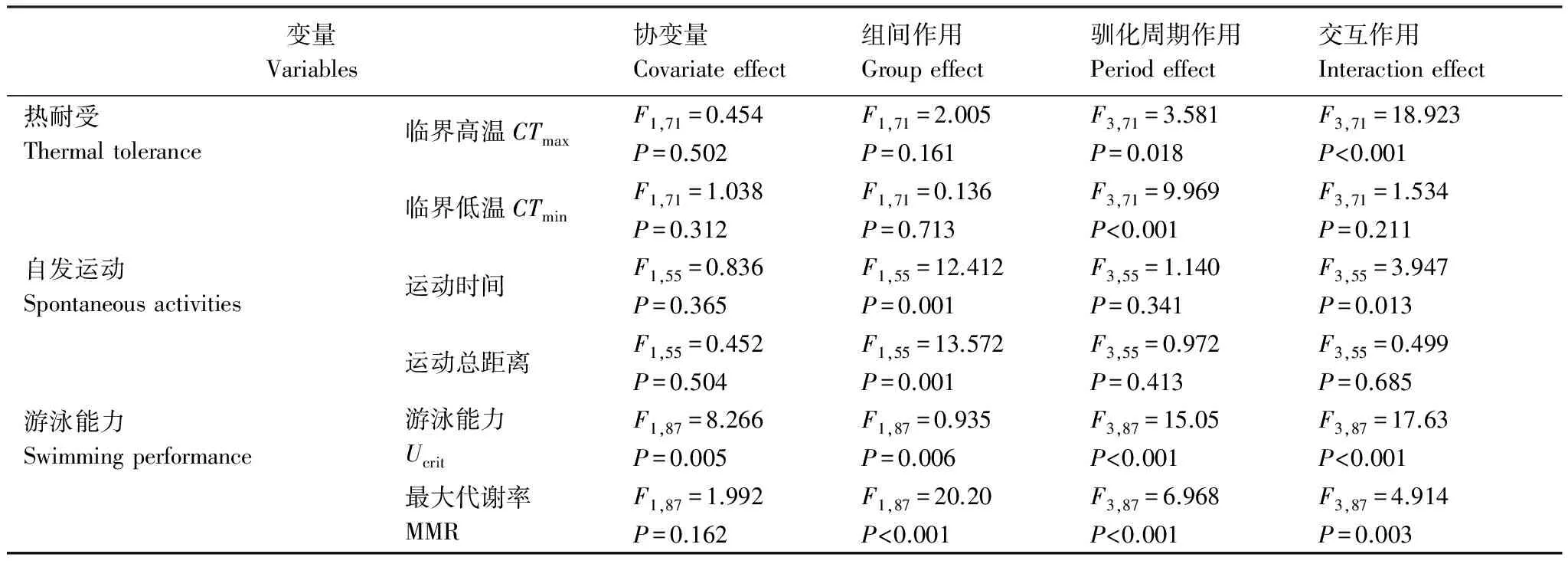
表1 温度驯化和驯化周期对实验鱼测量变量的双因素协方差分析
2.3 中华倒刺鲃自发运动对降温的响应速率
温度处理对PTM和TDM均有显著影响(P< 0.05)(图4,表1)。降温组的PTM和TDM均显著大于恒低温对照组,但PTM的差异随驯化时间的延长有所增加(交互作用,P=0.013)。

图4 温度变化对中华倒刺鲃自发运动的影响(平均值±标准误,N=8) Fig.4 The effect of thermal treatment on spontaneous activities in qingbo (Mean±S.E, N=8)*表示同一驯化时期不同温度处理组差异显著(P<0.05)a,b表示同一温度处理组不同驯化时期差异显著(P<0.05)
2.4 中华倒刺鲃SDA对降温的响应速率
经摄食后,各实验组代谢均呈现先上升后逐渐回落的过程(图5)。经统计分析表明:温度处理和驯化周期对SMR和SDA持续时间均无显著影响(表2);驯化周期对恒低温对照组的PMR没有显著影响,却导致降温组的PMR呈现下降趋势,且经8周驯化后降温组的PMR显著低于同期恒低温对照组(P<0.05);温度处理对SDA系数有显著影响,除2周驯化外降温组的SDA系数均显著小于恒低温对照组(P<0.05)。
2.5 降温对中华倒刺鲃生长性能的影响
温度处理和驯化周期对增重率均有显著影响(P<0.05),其中恒低温对照组增重率随驯化周期延长而上升,且在8周时显著大于降温组(P<0.05);驯化第一周未进行摄食量的统计,驯化2和4周时恒低温对照组的摄食率显著低于变温组(P<0.05),随驯化时间的延长恒低温对照组摄食率显著上升而降温组无显著变化(交互作用,P<0.05),导致8周时二者无显著差异;温度处理对摄食效率有显著影响,其中,恒低温对照组的摄食效率显著高于降温组(表3,P<0.05)。

图5 中华倒刺鲃的摄食后代谢反应Fig.5 The postprandial metabolic response of qingbo0h为摄食时间,平均值±标准误,重复数见表2
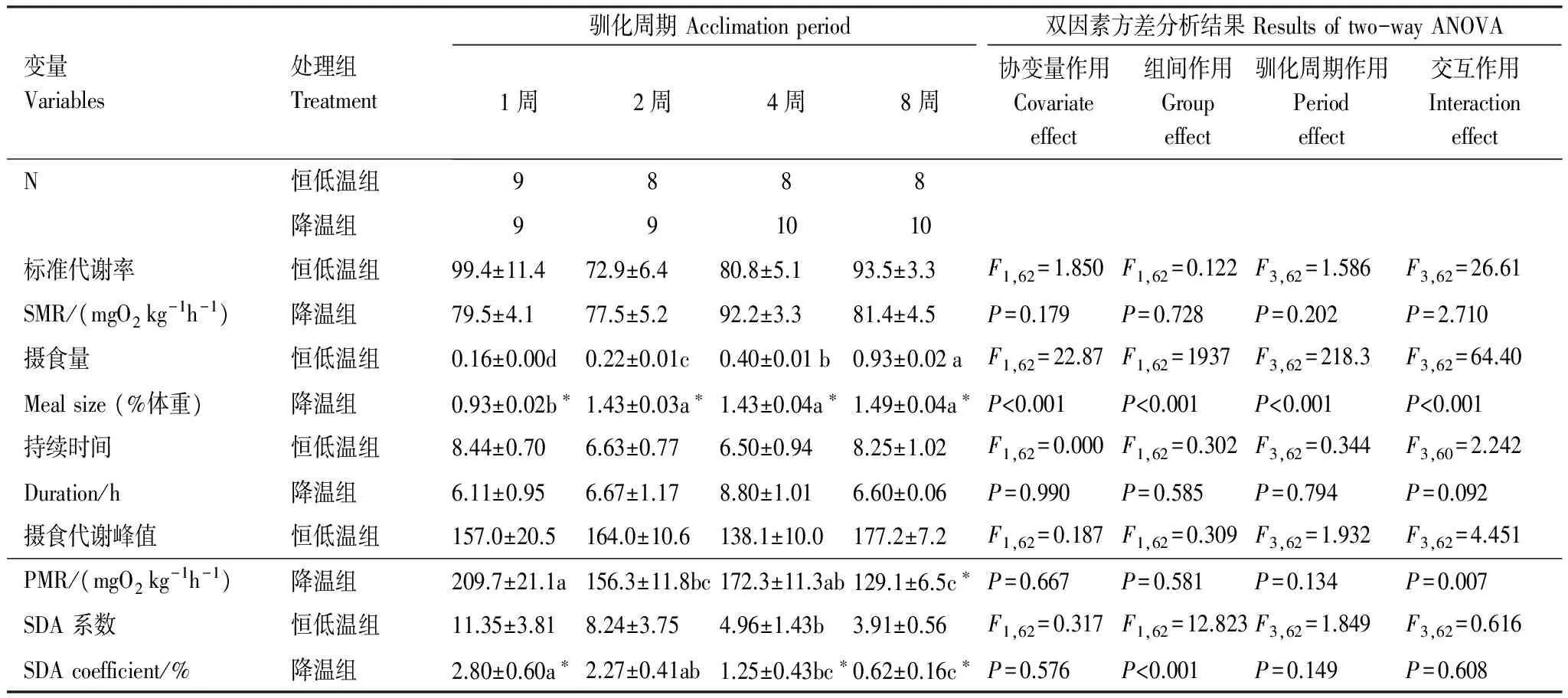
变量Variables处理组Treatment驯化周期Acclimationperiod双因素方差分析结果Resultsoftwo-wayANOVA1周2周4周8周协变量作用Covariateeffect组间作用Groupeffect驯化周期作用Periodeffect交互作用InteractioneffectN恒低温组9888降温组991010标准代谢率恒低温组99.4±11.472.9±6.480.8±5.193.5±3.3F1,62=1.850F1,62=0.122F3,62=1.586F3,62=26.61SMR/(mgO2kg-1h-1)降温组79.5±4.177.5±5.292.2±3.381.4±4.5P=0.179P=0.728P=0.202P=2.710摄食量恒低温组0.16±0.00d0.22±0.01c0.40±0.01b0.93±0.02aF1,62=22.87F1,62=1937F3,62=218.3F3,62=64.40Mealsize(%体重)降温组0.93±0.02b∗1.43±0.03a∗1.43±0.04a∗1.49±0.04a∗P<0.001P<0.001P<0.001P<0.001持续时间恒低温组8.44±0.706.63±0.776.50±0.948.25±1.02F1,62=0.000F1,62=0.302F3,62=0.344F3,60=2.242Duration/h降温组6.11±0.956.67±1.178.80±1.016.60±0.06P=0.990P=0.585P=0.794P=0.092摄食代谢峰值恒低温组157.0±20.5164.0±10.6138.1±10.0177.2±7.2F1,62=0.187F1,62=0.309F3,62=1.932F3,62=4.451PMR/(mgO2kg-1h-1)降温组209.7±21.1a156.3±11.8bc172.3±11.3ab129.1±6.5c∗P=0.667P=0.581P=0.134P=0.007SDA系数恒低温组11.35±3.818.24±3.754.96±1.43b3.91±0.56F1,62=0.317F1,62=12.823F3,62=1.849F3,62=0.616SDAcoefficient/%降温组2.80±0.60a∗2.27±0.41ab1.25±0.43bc∗0.62±0.16c∗P=0.576P<0.001P=0.149P=0.608
*表示同一驯化周期两实验组间比较有显著差异 a, b, c 表示同一实验组不同驯化周期间的比较有显著差异; SMR:标准代谢率Standard metabolic rate;PMR: 摄食代谢峰值Peak metabolic rate;SDA: 特殊动力作用Specific dynamic action

表3 实验处理和驯化期对中华倒刺鲃生长性能的影响
*表明同一周期不同实验组间有显著差异;a, b, c 表明同一实验组不同驯化周期有显著差异
3 讨论
水环境的温度由于地理分布、气候及人为等的原因存在着较大幅度的波动,而包括鱼类在内的水生生物在长期的进化过程中形成了从生理生化到行为等一系列的适应机制,以相应的生态对策适应特定的生存环境。水体温度已经被证实对鱼类的机体性能和分布有着重要影响,这种影响主要是通过其热耐受能力、代谢特征、运动能力及生长性能等体现[20]。本实验室以往有关中华倒刺鲃的研究发现,高温(25℃)驯化的实验鱼的主要生理功能均显著高于低温驯化的实验鱼(15℃)[13]。而本研究的主要目的是检验高温驯化的实验鱼经降温后,这种前期驯化的生理差异何时消除,以及这种消除速率在不同生理功能间有无差异。本研究发现经过快速降温后,中华倒刺鲃的低温耐受和高温耐受能力分别于降温的1—2周达到稳定,与恒低温对照组无显著差异;而游泳运动能力在4周达到稳定;消化功能可能在短期(1周内)得以调整稳定。另外,降温处理导致机体生长受阻,其主要原因可能是由于应对环境变动的逆境胁迫、生理功能调整以及自发活动增加所导致的能量消耗上升所致,而与摄食率关系不大。
3.1 中华倒刺鲃热耐受对降温的响应速率
研究发现由于地理分布和季节更替导致鱼类生境水体温度的时、空异质性对机体的热耐受特征有显著的影响[4, 21]。实验室条件下,驯化温度对热耐受指标如CTmax和CTmin的影响在包括中华倒刺鲃在内的多数鱼类得到证实[22]。与以往工作不同的是,本研究着重关注快速降温导致包括热耐受能力在内的生理功能变化的稳定速率(即何时与恒低温对照组不再有差异)。先前的研究发现25℃条件下驯化的中华倒刺鲃幼鱼的CTmax和CTmin均高于15℃[23]。本研究发现,降温后,CTmax和CTmin分别在2周和1周与对照组不再有显著差异,表明前期驯化条件下的高温和低温耐受特征分别于2周和1周内得以消除。另外,两温度组CTmin均随驯化时间延长呈下降趋势,可能因为随着实验进程实验鱼体质改善导致温度耐受能力的提高。
3.2 中华倒刺鲃游泳能力对降温的响应速率
以往的研究发现25℃条件下驯化的中华倒刺鲃幼鱼的Ucrit比15℃驯化条件下的高出约30%[24],而本研究发现,在降温后的1—2周,降温组的Ucrit反而显著低于恒低温对照组。说明中华倒刺鲃进入新的温度环境后,不仅先前在游泳能力上的驯化优势完全消除,而且机体为应对变温胁迫对生物机能的影响导致其运动能力下降。这与其MMR的变化趋势一致,说明呼吸代谢能力的下降是运动能力下降的重要原因之一。然而在降温的4和8周后,降温组的Ucrit不再低于恒低温对照组,说明前期高温驯化和变温胁迫的影响在4周内得以消除。另外,驯化4和8周降温组的MMR依然低于恒低温对照组,而Ucrit高于(4周)或没有差异。这表明降温组比恒低温对照组具有更高的游泳效率(即相同游泳速度下代谢率更低),从图2可以看出,这种游泳效率的差异随着驯化时间延长而逐渐缩小。
值得一提的是对照组Ucrit在整个实验周期呈下降趋势,而降温组没有变化,这可能因为实验室单调情况下惰性和囚禁效应[25]导致机体运动能力下降在恒低温对照组的体现;而降温组没有变化是由于其在低温驯化下游泳能力的逐渐恢复与惰性和囚禁效应相抵消所致。
3.3 中华倒刺鲃自发运动对降温的响应速率
自发运动是动物不依赖外部刺激仅由内部状态引起的活动,是生理状态和行为特征的直观表现。低温条件下由于机体生理功能的下调[3],加之食物资源通常也随之减少[2],理论上自发运动会低于高温条件下,这在大西洋鲑鱼(Salmosalar)等的研究中得到证实[23]。本研究降温组有关自发运动参数PTM和TDM均显著大于恒低温对照组。驯化前期降温组较高的自发运动可以解释为由于先前高温条件行为特征并未消除[23]或新的温度环境的逆境所致[25]。然而驯化4到8周降温组的相关指标依然高于对照组。这可能提示,就自发运动而言,8周的温度驯化还不足以消除先前高温经历的影响。相关机制值得进一步研究。但降温组较高的自发运动可能是其生长性能较低的原因(摄食量高而食物转化率低)。
3.4 中华倒刺鲃生长性能对降温的响应
本研究发现,降温组的生长速率显著低于恒低温对照组,而降温组的摄食率与恒低温对照组差别不大(第2周时甚至高于恒低温对照组)。说明降温组生长性能的下降主要是食物转化效率下降所致。这极有可能是由于降温组鱼类对抗逆境胁迫、以及体内生理生化调整等生理过程导致的额外的能量消耗所致[26]。另外,降温组自发运动水平的提高所导致的日常代谢增加也是食物转化效率下降的重要原因之一。由于技术原因,没有对第一周摄食数据进行统计,但从第2—8周的生长数据可以看出:由于适应逆境条件增加生理功能和自发活动所导致的能量消耗随着驯化时间的延长可能有所下降。
由于实验鱼摄食率低,不便进行摄食水平的定量,本研究SDA实验采取饱足投喂方式。降温组的摄食水平总体上高于恒低温对照组。而摄食水平对SDA各参数均有显著影响[4],干扰了温度处理和驯化周期对消化功能影响的分析结果。然而研究发现温度处理和周期对SDA持续时间均无显著影响,降温组和对照组的PMR在1—4周均没有差异,而以往的研究发现驯化温度对中华倒刺鲃的SDA各参数有显著影响。这表明中华倒刺鲃的消化功能可能在温度变化后的短期内恢复。
本研究发现中华倒刺鲃在经过长期的高温驯化及短期降温过渡到低温后,其生理和行为特征相应改变以适应新的低温条件。但不同功能间的稳定速率存在差异,这可能与不同功能的生态学关联及不同功能涉及的内在机制差异相关。总体上消化功能和热耐受能力调整稳定的速率最快,而游泳能力稳定速度较慢。另外,降温处理导致机体生长受阻程度随着驯化时间的延长而减小,但其影响持续存在于整个实验周期。
[1] Hoffmann A A, Sgrò C M. Climate change and evolutionary adaptation. Nature, 2011, 470(7335): 479- 485.
[2] Pörtner H O, Farrell A P. Physiology and climate change. Science, 2008, 322(5902): 690- 692.
[3] Peng J, Cao Z D, Fu S J. The effects of constant and diel-fluctuating temperature acclimation on the thermal tolerance, swimming capacity, specific dynamic action and growth performance of juvenile Chinese bream. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2014, 176: 32- 40.
[4] Beitinger T L, Bennett W A, McCauley R W. Temperature tolerances of North American freshwater fishes exposed to dynamic changes in temperature. Environmental Biology of Fishes, 2000, 58(3): 237- 275.
[5] Oufiero C E, Garland Jr T. Repeatability and correlation of swimming performances and size over varying time-scales in the guppy (Poecilia reticulata). Functional Ecology, 2009, 23(5): 969- 978.
[6] Plaut I. Critical swimming speed: its ecological relevance. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2001, 131(1): 41- 50.
[7] Xia J G, Niu C J, Pei X J. Effects of chronic exposure to nonylphenol on locomotor activity and social behavior in zebrafish (Danio rerio). Journal of Environmental Sciences, 2010, 22(9): 1435- 1440.
[8] Nilsson G E, Rosen P R, Johansson D. Anoxic depression of spontaneous locomotor activity in crucian carp quantified by a computerized imaging technique. Journal of Experimental Biology, 1993, 180(1): 153- 162.
[9] Fu S J, Zeng L Q, Li X M, Pang X, Cao Z D, Peng J L, Wang Y X. The behavioural, digestive and metabolic characteristics of fishes with different foraging strategies. Journal of Experimental Biology, 2009, 212(14): 2296- 2302.
[10] 付成, 曹振东, 付世建. 温度和饥饿对鲤鱼幼鱼静止代谢率及自发运动的影响. 动物学杂志, 2012, 47(2): 85- 90.
[11] Zeng L Q, Cao Z D, Fu S J, Peng J L, Wang Y X. Effect of temperature on swimming performance in juvenile southern catfish (Silurus meridionalis). Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2009, 153(2): 125- 130.
[12] Luo Y P, Xie X J. Effects of temperature on the specific dynamic action of the southern catfish, Silurus meridionalis. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2008, 149(2): 150- 156.
[13] 庞旭, 付世建, 曹振东, 张耀光. 饥饿和温度驯化对中华倒刺鲃静止代谢和游泳能力的影响. 生态学报, 2016, 36(7): 1854- 1860.
[14] Wang F, Chen B J, Cao Z D, Wang Y X, Fu S J. The influence of starvation on fast-start performance of Spinibarbus sinensis. Acta Ecologica Sinica, 2012, 32(6): 291- 296.
[15] Manush S M, Pal AK, Chatterjee N, Das T, Mukherjee S C. Thermal tolerance and oxygen consumption of Macrobrachium rosenbergii acclimated to three temperatures. Journal of Thermal Biology, 2004, 29(1): 15- 19.
[16] Lyytikäinen T, Koskela J, Rissanen I. Thermal resistance and upper lethal temperatures of underyearling Lake Inari Arctic charr. Journal of Fish Biology, 1997, 51(3): 515- 525.
[17] Yan G J, He X K, Cao Z D, Fu S J. An interspecific comparison between morphology and swimming performance in cyprinids. Journal of Evolutionary Biology, 2013, 26(8): 1802- 1815.
[18] Lee C G, Farrell A P, Lotto A, Hinch S G, Healey M C. Excess post-exercise oxygen consumption in adult sockeye (Oncorhynchus nerka) and coho (O. kisutch) salmon following critical speed swimming. Journal of Experimental Biology, 2003, 206(18): 3253- 3260.
[19] Fu S J, Xie X J, Cao Z D. Effect of fasting and repeat feeding on metabolic rate in southern catfish, Silurus meridionalis chen. Marine and Freshwater Behaviour and Physiology, 2005, 38(3): 191- 198.
[20] Sandblom, E, Gräns A, Axelsson M, Seth H. Temperature acclimation rate of aerobic scope and feeding metabolism in fishes: implications in a thermally extreme future. Philosophical Transactions of the Royal Society B: Biological Sciences, 2014, 281(1794): 20141490.
[21] 王云松. 南方鲇、瓦氏黄颡鱼和中华倒刺鲃幼鱼的热耐受特征及其比较研究[D]. 重庆: 重庆师范大学, 2009.
[22] Seebacher F, Franklin C E. Determining environmental causes of biological effects: the need for a mechanistic physiological dimension in conservation biology. Philosophical Transactions of the Royal Society B: Biological Sciences, 2012, 367(1596): 1607- 1614.
[23] Castonguay M, Cyr D G. Effects on temperature on spontaneous and thyroxine-stimulated locomotor activity of Atlantic cod. Journal of Fish Biology, 1998, 53(2): 303- 313.
[24] Pang X, Yuan X Z, Cao Z D, Fu S J. The effects of temperature and exercise training on swimming performance in juvenile qingbo (Spinibarbus sinensis). Journal of Comparative Physiology B, 2013, 183(1): 99- 108.
[25] Gräns A, Jutfelt F, Sandblom E, Jönsson E, Wiklander K, Seth H, Olsson C, Dupont S, Ortega-Martinez O, Einarsdottir I, Björnsson B T, Sundell K, Axelsson M. Aerobic scope fails to explain the detrimental effects on growth resulting from warming and elevated CO2 in Atlantic halibut. Journal of Experimental Biology, 2014, 217(5): 711- 717.
[26] Cao Z D, Fu S J. The effect of exhaustive exercise training and fasting on post-exercise oxygen consumption rate in southern catfish (Silurus meridionalis Chen). Acta Hydrobiologica Sinica, 2009, 33(5): 837- 843.
ThematebolizeresponseofdifferentphysiologicalperformancestodecreasedtemperatureinSpinibarbussinensis
QIN Yinglian, BAI Yang, FU Kangkang, FU ShiJian*
LaboratoryofEvolutionaryPhysiologyandBehavior,ChongqingKeyLaboratoryofAnimalBiology,ChongqingNormalUniversity,Chongqing400047,China
To investigate the matebolize response of different physiological performances to decreased temperature of long-term high-temperature-acclimated juvenile qingbo (Spinibarbussinensis), the experimental fish were reared at 15 or 25℃ for 8 weeks, respectively; then the temperature of the 25℃ group was decreased to 15℃ (treatment group), and the temperature of the 15℃ group remained the same (control group). The thermal tolerance capacity (critical maximum temperature,CTmaxand critical minimum temperature,CTmin), maximum sustainable swimming speed (critical swimming speed, Ucrit), spontaneous activities (percent time spent moving (PTM) and total distance moved (TDM)), specific dynamic action (peak postprandial metabolic rate (PMR)), and growth performance (feed rate, feed efficiency, and weight gain) of fish in both temperature groups were measured at 1, 2, 4, and 8 weeks after the temperature was decreased. There was no significant difference in cold tolerance capacity as suggested byCTminbetween the treatment and control groups, whereas the heat tolerance capacity, as suggested byCTmaxof the treatment group, was significantly higher than that of the control group one week after the temperature decrease, and thereafter there was no difference between the groups. The temperature decrease resulted in a significant improvement of spontaneous activities suggested by higher PTM and TDM than those of the control group (P< 0.05), and such differences persisted throughout the experimental period. The Ucritof the treatment group was significantly lower than that of the control group at 1 and 2 weeks after the temperature decrease, and the impaired swimming capacity disappeared after 4 weeks of temperature acclimation. The PMR and SDA duration did not show any differences between the treatment and control groups from 1 to 4 weeks after the temperature decrease. The food efficiency and weight gain of the treatment group were generally lower than those of the control group, although the treatment group unusually showed a higher food rate. This suggested that there were profound differences among response speeds of different physiological performances to decreased temperature, which were possibly related to differences in their ecological correlations and underlying mechanisms. The temperature decrease in the treatment group resulted in impaired growth performance, which was mainly due to the additional energy expenditure involved in thermal stress responses, regulation of physiological functions, and elevated spontaneous activities.
temperature acclimation; thermal tolerance; plasticity;locomotion; growth performance
国家自然科学基金项目(31172096)
2016- 04- 30; < class="emphasis_bold">网络出版日期
日期:2017- 03- 22
10.5846/stxb201604300825
*通讯作者Corresponding author.E-mail: shijianfu9@cqnu.edu.cn
覃英莲,柏杨,付康康,付世建.中华倒刺鲃不同生理性能对降温的响应速率.生态学报,2017,37(15):5179- 5188.
Qin Y L, Bai Y, Fu K K, Fu S J.The matebolize response of different physiological performances to decreased temperature inSpinibarbussinensis.Acta Ecologica Sinica,2017,37(15):5179- 5188.
