前列腺影像报告与数据系统对前列腺特异性抗原灰区前列腺癌的诊断价值*
2017-09-12张配配李拔森闵祥德冯朝燕
康 振,张配配,李拔森,闵祥德,冯朝燕,可 赞,王 良
(华中科技大学同济医学院附属同济医院放射科,武汉 430030)
论著·临床研究
前列腺影像报告与数据系统对前列腺特异性抗原灰区前列腺癌的诊断价值*
康 振,张配配,李拔森,闵祥德,冯朝燕,可 赞,王 良△
(华中科技大学同济医学院附属同济医院放射科,武汉 430030)
目的 评估前列腺影像报告与数据系统(PIRADS v2)对前列腺特异性抗原(PSA)灰区前列腺癌(PCa)的诊断价值。方法 纳入2012-2016年总共2 200例行前列腺磁共振成像(MRI)检查病例中PSA为4~10 ng/mL,穿刺活检或手术切除前行多参数MRI(mp-MRI)检查,未接受任何形式治疗的PCa及前列腺增生(BPH)患者,收集mp-MRI图像及临床资料,回顾性分析其mp-MRI,根据PIRADS v2对所有病灶定量评分,记录PIRADS v2分值及病灶所在区域。以经直肠超声(TRUS)引导穿刺活检或手术切除标本病理结果为金标准。运用ROC曲线计算PIRADS v2诊断PSA灰区PCa的诊断价值,Logistic回归分析前列腺癌的危险因素。结果 共纳入15例PCa患者和30例BPH患者,两组患者在年龄、tPSA、fPSA、f/tPSA、前列腺体积、PSA密度(PSAD)差异均无统计学意义(P>0.05)。PIRADS v2诊断PCa的曲线下面积(AUC)=0.932(95%CI0.822~0.984),P<0.01;最佳切点为PIRADS v2≥4分,诊断敏感性为88.89%,特异性为87.10%,阳性预测值为80.00%,阴性预测值为93.10%。Logistic回归显示,PIRADS v2评分是PCa的独立预测因子,Hazard Ratio(HR)=17.847(3.745~85.078),P<0.01。PIRADS v2评分与病理Gleason评分呈正相关(r=0.585,P=0.022)。结论 PIRADS v2评分对PSA灰区PCa具有较高的诊断价值,且与病理结果具有相关性。
前列腺增生;前列腺肿瘤;前列腺特异抗原;前列腺影像报告与数据系统
在世界范围内,前列腺癌(prostate cancer,PCa)居男性肿瘤发病率第2位,致死率第6位[1]。诊断指标前列腺特异性抗原(prostate specific antigen,PSA)的应用可使55~69岁PCa相关病死率降低约32%[2],但因仅具有中等准确性可能造成过度诊断、不必要穿刺及惰性肿瘤的激进治疗[3]。4~10 ng/mL的PSA灰区给医生及患者带来诊断和治疗困扰。经直肠超声(transrectal ultrasonography,TRUS)引导的前列腺穿刺敏感性和特异性低,容易漏诊尤其是前尖部的肿瘤[4],且易造成出血、脓毒症等并发症。2012年,前列腺影像报告和数据系统(prostate imaging reporting and data system,PIRADS)被用于前列腺影像的标准化解读并指导靶向穿刺[5],能避免1/3的PSA灰区患者穿刺[6],且具有成本-经济效益[7]。2015年,美国放射学院(ACR)、欧洲泌尿生殖放射协会(ESUR)、AdMeTech基金会在PIRADS基础上颁布PIRADS version 2 (PIRADS v2),使得PIRADS的解读更加简化。本研究旨在以穿刺活检及手术病理为金标准,评价PIRADS v2对PSA灰区PCa的诊断价值。
1 资料及方法
1.1 一般资料 该研究为回顾性研究;纳入标准:本院2012-2016年,PSA为4~10 ng/mL,穿刺活检或手术切除前行多参数磁共振成像(mp-MRI)检查,未接受任何形式的治疗;病理参考为TRUS引导穿刺活检或手术切除标本病理证实的PCa或前列腺增生(BPH)。
1.2 MRI扫描及图像分析 所有患者在穿刺或手术前均行3T MRI检查(Siemens Skyra,3T),线圈采用18通道腹部相控阵线圈,扫描方案包括T2WI、DWI、PWI,具体参数为:T2WI,TR 6 750 ms,TE 104 ms,层厚3 mm,层间距3 mm,FOV 253 mm×180 mm,激励次数2次,矩阵346×384;DWI(TR 4 500 ms,TE 90 ms,层厚3 mm,层间距3 mm,FOV 260 mm×185 mm,矩阵90×64,扩散敏感b值分别为100、800、1 500 s/mm2;PWI,VIBE序列,TR 5.08 ms,TE 1.77 ms,时间分辨率7 s,层厚3.5 mm,层间距0 mm,FOV 365 mm×260 mm,对比剂为Gd-DTPA(拜耳公司),注射速率2 mL/s,剂量0.1 mmol/kg。纳入的病例由两名分别具有15年泌尿生殖系统影像诊断经验和5年放射科工作经验的医生在不知病理结果的情况下根据PIRADS v2对所有病灶定量评分,记录PIRADS v2分值及病灶所在区域,遇有分歧,则商讨决定。PIRADS v2评分按等级分为1~5分。
1.3 前列腺病理 前列腺穿刺为TRUS引导下穿刺活检,穿刺针为18G穿刺针,常规采用6区12针穿刺方法,对mp-MRI可疑的病灶,在12针穿刺基础上选择性地多穿刺1针或2针;对于最终PCa病理,则仅纳入根治术病例,对于最终BPH病理,不限术式,标本经10%福尔马林固定,用石蜡包埋切片,由泌尿专业病理医师观察切片并进行报告,报告内容包括病变位置及诊断结果,对于PCa病灶,同时报告Gleason评分,将mp-MRI病灶位置与病理病变位置相对应。
1.4 统计学处理 统计分析软件采用SPSS 19.0、MedCalc 11.4.2.0。评估的因子包括:年龄,PSA[包括总PSA(tPSA)、游离PSA(fPSA)]水平,f/tPSA,前列腺体积(0.52×最大前后径×最大左右径×最大上下径),PSA密度(tPSA/前列腺体积)。计算PIRADS v2的ROC曲线下面积(AUC),Logistic回归分析PCa的危险因素。以P<0.05为差异有统计学意义。
2 结 果
2.1 纳入病例基本特征 研究共计纳入15例PCa患者和30例BPH患者,PCa由穿刺病理确诊10例,由根治术病理确诊5例,BPH由穿刺病理确诊15例,经尿道前列腺电切病理确诊15例。PCa患者的平均年龄为66.50岁,tPSA水平平均为7.18 ng/mL,fPSA水平平均为1.57 ng/mL,f/tPSA平均为20.40,前列腺体积平均为50.00 cm3, PSA密度(PSAD)平均为0.18 ng·mL-1·cm-3。BPH患者的平均年龄为67.50岁,tPSA水平平均为7.16 ng/mL,fPSA水平平均为1.34 ng/mL,f/tPSA平均为21.10,前列腺体积平均为54.20 cm3, PSAD平均为0.16 ng·mL-1·cm-3。PCa和BPH患者在年龄、tPSA、fPSA、f/tPSA、前列腺体积、PSAD方面比较,差异均无统计学意义(P>0.05)。
2.2 TRUS穿刺及手术病理结果 病灶按部位及影像学特征计录病灶数量,如部位不同,各记为1处病灶,如部位所在区域相同且影像学特征类似,计为1处病灶。15例PCa患者共有19处病灶,其中18处为PCa,1处为BPH。18处PCa病灶PIRADS v2评分情况为1分0处,2分0处,3分2处,4分8处,5分8处;30例BPH患者共有31处病灶,其PIRADS v2评分情况为1分0处,2分21处,3分6处,4分3处,5分1处。
2.3 PIRADS v2对PCa的诊断价值 对PIRADS v2诊断PCa进行ROC曲线分析,AUC=0.932[95%CI0.822~0.984],P<0.01。最佳切点为PIRADS v2≥4分,敏感性为88.89%,特异性为87.10%,阳性预测值为80.00%,阴性预测值为93.10%,见图1。Logistic回归显示,PIRADS v2评分是PCa的独立预测因子,Hazard Ratio(HR)=17.847[3.745,85.078],P<0.01。
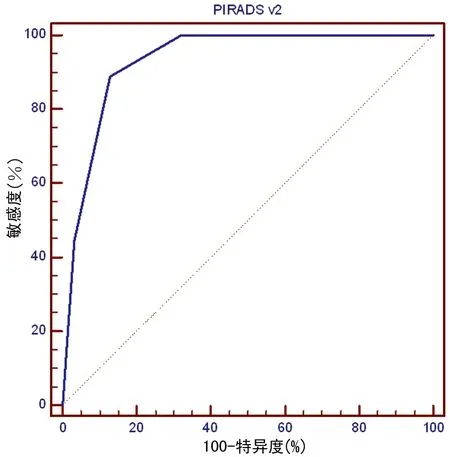
图1 PI-RADS v2诊断PSA灰区PCa的ROC分析
2.4 PSA灰区癌灶PI-RADS V2评分与Gleason评分的相关性分析 对15例PSA灰区的癌灶PIRADS v2评分与病理结果Gleason评分进行Spearman相关分析,结果显示r=0.585,P=0.022,PIRADS v2评分与病理Gleason评分呈正相关,见表1。
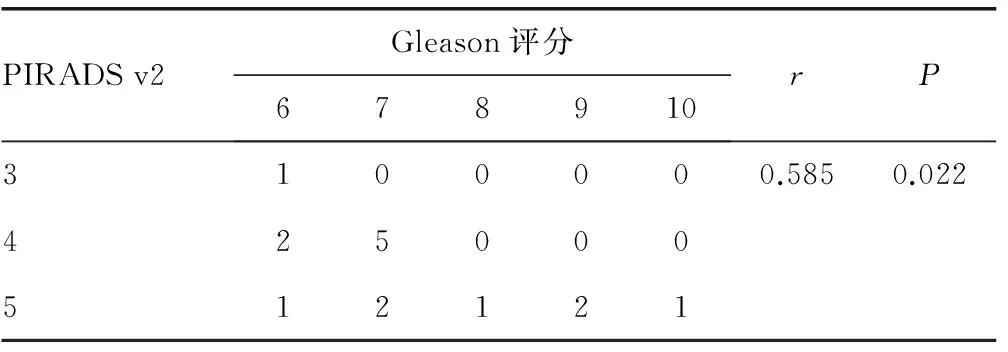
表3 PSA灰区癌灶PI-RADS V2评分与Gleason评分的相关性分析(n)
3 讨 论
PCa在世界范围内是男性常见肿瘤,在美国发病率位居第1位,其在美国的5年生存率可高达95%,但亚洲的PCa 5年生存率为40%~87%,低于美国[8],早期发现对患者的预后具有很大的影响。PSA在1986年被美国FDA确认应用于PCa的监测中,并于1991年被证明可以提高PCa的发现率[9]。但在随后的研究中,前列腺、肺、直结肠、卵巢癌筛查研究(PLCO)研究随访7~10年发现PSA筛查并未改变PCa的病死率[10];欧洲PCa随机筛查研究发现为防止1例患者死于PCa,需要对1 410例进行筛查,对48例患者进行治疗[11]。因此于2012年,美国预防工作小组不推荐PSA用于PCa的筛查[12],并于2015年进行该推荐的效果评价,该推荐减少了16.4% PSA升高的进一步评估和21.4%前列腺穿刺活检[13]。但不可否认,PSA目前在临床中诊断PCa及治疗后评估病情变化仍占有重要地位,因此如何提高PCa的无创检出率及诊断准确率是临床面临的一个重要问题。
而PSA灰区定义为PSA水平在4~10 ng/mL,在此区间,同时存在BPH和PCa,给临床诊断和治疗带来一定的困扰。本研究从2012-2016年接受前列腺MRI检查的患者中,纳入PSA灰区患者共计75例,其中PCa患者仅15例,这在一定程度上可以代表中国人群PSA灰区的发病率(3.4%)及PSA灰区PCa患者的患病率(0.7%),对PSA灰区患者人口统计学资料具有一定的贡献。
本研究发现tPSA、fPSA、f/tPSA、PSAD在PCa与BPH之间差异无统计学意义(P>0.05),可能原因之一是对于PSA灰区的PCa及BPH患者,PSA均在4~10 ng/mL,变异度较小。因此tPSA、fPSA、f/tPSA、PSAD在两者间无统计学差异,可能原因之二为本研究纳入病例较少有关,导致该研究中这些基本临床资料差异无统计学意义。有研究纳入153例PCa和306例BPH患者,显示f/tPSA≤0.16,PSAD≥0.15 ng·mL-1·cm-3能用于诊断灰区的PCa[14]。但从中可以看出,对于PSA灰区的患者,诊断具有一定的难度和不确定性,这也是本研究的关注要点和创新点之一。
2012年,ESUR颁布PIRADS用于前列腺影像的标准化解读,其包括T2WI、DWI、PWI及MRS,后于2015年颁布version 2,在PIRADS基础上进一步简化并删除MRS的应用。一项纳入12篇研究的系统评价得出结论:对于未进行穿刺或穿刺阴性而最终病理确诊的PCa患者,mp-MRI能发现44%~87% PCa,排除63%~98% PCa,能够减少系统或靶向穿刺活检[15];且有研究报道mp-MRI漏诊的多为低级别器官局限性PCa,95.4%高级别PCa能够被mp-MRI排除,并推荐对于PSA升高但mp-MRI阴性的患者可考虑继续随访而不是立即穿刺[16]。
本研究的另一创新点在于将2015年新颁布的公认的PIRADS v2评分用于评估临床难以定论的PSA灰区前列腺疾患患者,这在一定程度上能帮助临床医生对PSA灰区患者进行临床决策分析,包括动态随访或穿刺活检进一步确诊。本研究显示,以PIRADS V2≥4分为界,PIRADS v2诊断具有较高的阴性预测值,约为93.10%,这和Girometti等[6]的研究结论类似。同时诊断敏感性和特异性均较高,分别为88.89%、87.10%,可以为影像和临床诊断PCa提供一定的参考依据。本研究结果还显示,PIRADS v2评分可独立预测发生PCa的可能性,显示可将前列腺的形态学特征及MRI功能成像特征作为PCa的危险因子,且与Gleason评分呈正相关,对于诊断PSA灰区的PCa具有较高的价值,证实了PIRADS v2的应用价值。
该研究的局限性在于纳入研究病例较少,这与PSA灰区PCa患者比例较低有关,在中国人群可能更低。该研究全面搜索2012-2016年PSA灰区患者,共得到15例PCa患者和60例BPH患者,依统计学原理及防止统计学偏差,本研究纳入15例PCa患者和30例PBH患者进行统计,仍具有一定的代表性。
综上所述,PIRADS v2评分对PSA灰区PCa具有很高的诊断价值,且与病理结果具有相关性,有助于鉴别诊断PSA灰区PCa与BPH,值得临床推广应用。
[1]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2]Roobol MJ,Kranse R,Bangma CH,et al.Screening for prostate cancer:results of the Rotterdam section of the European randomized study of screening for prostate cancer[J].Eur Urol,2013,64(4):530-539.
[3]Salido-Guadarrama AI,Morales-Montor JG,Rangel-Escareo C,et al.Urinary microRNA-based signature improves accuracy of detection of clinically relevant prostate cancer within the prostate-specific antigen grey zone[J].Mol Med Rep,2016,13(6):4549-4560.
[4]Lecornet E,Ahmed HU,Hu Y,et al.The accuracy of different biopsy strategies for the detection of clinically important prostate cancer:a computer simulation[J].J Urol,2012,188(3):974-980.
[5]Barentsz JO,Richenberg J,Clements R,et al.ESUR prostate Mr guidelines 2012[J].Eur Radiol,2012,22(4):746-757.
[6]Girometti R,Fau-Como MG,Fau-Brondani GG,et al.Negative predictive value for cancer in patients with "gray-zone" PSA level and prior negative biopsy:preliminary results with multiparametric 3.0 Tesla MR[J].J Magn Reson Imaging,2012,36(4):943-950.
[7]Cerantola Y,Dragomir A,Tanguay S,et al.Cost-effectiveness of multiparametric magnetic resonance imaging and targeted biopsy in diagnosing prostate cancer[J].Urol Oncol,2016,34(3):119.e1-119.e9.
[8]Allemani C,Weir HK,Carreira H,et al.Global surveillance of cancer survival 1995-2009:analysis of individual data for 25,676,887 patients from 279 population-based registries in 67 countries (CONCORD-2) [J].Lancet,2015,385(9972):977-1010.
[9]Catalona WJ,Smith DS,Ratliff TL,et al.Measurement of prostate-specific antigen in serum as a screening test for prostate cancer[J].N Engl J Med,1991,324(17):1156-1161.
[10]Andriole GL,Crawford ED,Grubb RL,et al.Mortality results from a randomized prostate-cancer screening trial[J].N Engl J Med,2009,360(13):1310-1319.
[11]Schröder FH,Hugosson J,Roobol MJ,et al.Screening and prostate-cancer mortality in a randomized European study[J].N Engl J Med,2009,360(13):1320-1328.
[12]Moyer VA.Screening for prostate cancer:U.S.Preventive Services Task Force recommendation statement[J].Ann Intern Med,2012,157(2):120-134.
[13]Mcginley KF,Mcmahon GC,Brown GA.Impact of the US preventive services task force grade D recommendation:assessment of evaluations for elevated prostate-specific antigen and prostate biopsies in a large urology group practice following statement revision[J].Rev Urol,2015,17(3):171-177.
[14]Liu B,Pan TJ.Role of PSA-related variables in improving positive ratio of biopsy of prostate cancer within serum PSA gray zone[J].Urologia,2015,81(3):173-176.
[15]Fütterer JJ,Briganti A,De Visschere P,et al.Can clinically significant prostate cancer be detected with multiparametric magnetic resonance imaging?A systematic review of the literature[J].Eur Urol,2015,68(6):1045-1053.
[16]De Visschere PJ,Briganti A,Fütterer JJ,et al.Role of multiparametric magnetic resonance imaging in early detection of prostate cancer[J].Insights Imaging,2016,7(2):205-214.
Diagnostic value of prostate image report and data system (PIRADS version 2) in prostate cancer with grey zone of prostate specific antigen*
KangZhen,ZhangPeipei,LiBasen,MinXiangde,FengZhaoyan,KeZan,WangLiang△
(DepartmentofRadiology,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan,Hubei430030,China)
Objective To access the diagnostic value of Prostate Imaging Reporting and Data System (PIRADS version 2) for prostate cancer (PCa) in prostate specific antigen (PSA) grey zone(4-10 ng/mL).Methods Treatment naive PCa and BPH patients with an increase of PSA 4-10 ng/mL from 2200 patients underwent prostate MRI from 2012 to 2016 were included,multiparameter magnetic resonance imaging (mp-MRI) prior biopsy or prostatectomy and clinical data were obtained,mp-MRI were retrospectively analyzed quantitatively by a radiology expert with 15 years experience in urogenital system imaging diagnosis and a doctor with 5 years experience in radiology diagnosis blind to the pathology results according to PIRADS v2,PIRADS v2 score and lesion zone were recorded respectively,in case of disagreement,dicision was made through discuss.TRUS guided biopsy or prostatectomy pathology serves as gold reference.Diagnostic value of PIRADS v2 for PSA grey zone PCa was calculated by receiver operating characteristic (ROC) curve,logistic regression analysis was used to access the risk factors of PCa.Results 15 PCa and 30 BPH patients were included.There was no significant difference between these two groups in age,tPSA,fPSA,f/tPSA,prostate volume and PSA density.The area under ROC curve of PIRADS v2 in diagnosing PCa was 0.932[95%CI0.822-0.984],P<0.01.Using a cutoff PIRADS≥4,the diagnosis sensitivity was 88.89%,specificity 87.10%,and positive predictive value 80%,negative predictive value 93.10%,respectively.Logistic regression analysis showed that PIRADS v2 score was an independent risk factor for predicting PCa,with a hazard ratio 17.847[3.745-85.078],P<0.01.There was a positive correlation between PIRADS v2score and gleason score,r=0.585,P=0.022.Conclusion PIRADS v2 has a significantly high diagnosis value in diagnosing PSA grey zone PCa and a good correlation with pathology results.
prostatic hyperplasia;prostatic neoplasms;prostate specific antigen;prostate imaging reporting and data system
10.3969/j.issn.1671-8348.2017.22.008
国家自然科学基金资助项目(8167070843)。 作者简介:康振(1989-),住院医师,硕士,主要从事前列腺癌影像诊断及介入治疗的研究。△
, E-mail:wang6@tjh.tjmu.edu.cn。
R737.25
A
1671-8348(2017)22-3050-03
2017-02-20
2017-04-08)
