碳酸丙烯酯/季铵盐溶液中H2O对CO2电还原反应的影响作用及机理分析
2017-09-12沈风霞陈天友李青远贾友见
沈风霞,陈天友,李青远,宋 宁,贾友见,施 锦,*
(1.昆明理工大学 冶金与能源工程学院,云南 昆明 650093;2.昆明理工大学 省部共建复杂有色金属资源清洁利用国家重点实验室,云南 昆明 650093)
碳酸丙烯酯/季铵盐溶液中H2O对CO2电还原反应的影响作用及机理分析
沈风霞1,陈天友1,李青远2,宋 宁1,贾友见1,施 锦1,2*
(1.昆明理工大学 冶金与能源工程学院,云南 昆明 650093;2.昆明理工大学 省部共建复杂有色金属资源清洁利用国家重点实验室,云南 昆明 650093)
设计了一种新型双室隔膜电解池,可以在碳酸丙烯酯(PC)/四丁基高氯酸铵(TBAP)电解液中,将CO2电还原为CO. 由于CO2电还原反应本身有H2O生成,深入探究了H2O对有机电解液电化学性能和电极反应过程的影响作用及相关机理. 结果表明,当PC/TBAP中含有H2O时,电解液电导率增大,黏度降低,CO2溶解性增强. 由于碳酸丙烯酯具有疏水性,当含H2O量超过6.8%时,H2O从PC/TBAP中分层析出,电解液的性质不会因水的积累而发生改变. 反应过程中,H2O对反应中间体(CO2·-自由基)具有稳定作用,使得过电位降低、电流密度升高. 在PC/TBAP/6.8% H2O中电还原CO2时,生成CO的最高电流效率达到89%,电流密度达到9.18 mA/cm2,电极不中毒,电化学反应可以稳定进行.
双室隔膜电解池;二氧化碳电还原;碳酸丙烯酯;金电极
CO2是造成全球气候变暖的主要气体成分,同时也是一种来源丰富、价格低廉的潜在碳资源[1-2]. 利用可再生能源将CO2转化为高值化学品,实现碳资源循环利用,是化学工业极为关注的重大科学问题[3]. 拟采用图1所示的研究思路实现CO2资源化利用:利用可再生电能为电解电源,用电催化还原的方法将CO2、H2O转化为合成气(CO+H2)[4-5],再用传统的工业技术将合成气转化成甲醇、甲酸、乙烯、塑料、纤维、橡胶等高值化学品,或采用费托合成技术将合成气转化汽油、柴油等液态燃料. 基于上述研究思路,可以开辟出一条以CO2、H2O和电能为基本要素生产高值化学品和液态燃料的新途径. 与传统方法相比(用化石燃料生产高值化学品和液态燃料)[6],图1所示的技术途径具有工艺简单、绿色环保、安全易操作等优点.

图1 以CO2, H2O和电能为基本要素生产燃料和高值化学品Fig.1 High value added chemicals and fuel route from CO2, H2O and renewable electricity
将CO2电还原为CO,是上述研究思路的关键环节. CO2是非极性分子,在有机溶剂中具有良好的溶解性,因此,在有机溶剂中将CO2电还原为CO具有独到的优势. 常用的有机溶剂主要有乙腈(AN)、N-N二甲基甲酰胺(DMF)、二甲亚砜(DMSO)、碳酸丙烯酯(PC)四种,由于乙腈有毒且容易挥发[7],DMF有毒且容易水解[8],DMSO熔点高(18 ℃)且容易凝固[9-10],在实际应用中均存在难以克服的问题. 碳酸丙烯酯(PC)是一种性能优异的有机电化学溶剂,同时也是工业上常用的CO2吸收剂[11],具有化学性质稳定、电化学窗口宽和沸点高等特点[12-17],因此,尝试采用PC作为电还原CO2的有机溶剂. 咪唑类离子液体是一种新兴的有机支持电解质[18-22],对CO2电还原反应具有催化作用,但由于咪唑类离子液体价格昂贵,且在低电位条件下容易分解变质(CO2电还原需要很高的过电位)[23],因而不适合大规模应用. 四丁基高氯酸铵(TBAP)是常用的有机支持电解质,具有化学性质稳定、电化学窗口宽、离子导电率高、价格低廉、易于制取等优点[24],因此拟在碳酸丙烯酯(PC)/四丁基高氯酸铵(TBAP)溶液中电还原CO2制CO.
由于CO2电还原反应本身有H2O生成,随着反应的进行,PC/TBAP中必然出现大量的H2O,H2O是有机电解液中重要的活性成分,对CO2电还原反应具有很强的影响作用[25],但这方面的研究工作未见文献报道. 本文作者重点研究了在PC/TBAP中,H2O对有机电解液电导率、黏度和CO2溶解性的影响,并探究H2O对CO2电还原反应动力学过程的影响机理.
1 实验部分
1.1 仪器和试剂
碳酸丙烯酯(PC,纯度99.99%)购于国药集团化学试剂有限公司,离子交换膜(Nafion117)购于杜邦公司,CO2、H2、N2、Ar(纯度≥99.99%)购于昆明氧气厂,四丁基高氯酸铵(TBAP,纯度≥99.99%)购于阿拉丁试剂公司.
电化学实验在电化学工作站(上海辰华CHI 660 E)上完成;用DDS-307A电导率仪和NDJ-5S黏度计测定阴极电解液的电导率和黏度;SF-3型微量水分测定仪测定电解液中的含水量;气相色谱仪(江苏安捷伦GC7890)测定阴极气相反应产物;5A分子筛色谱柱和碳分子筛色谱柱(兰州化学物理研究所色谱中心)测定CO和H2,载气流速25 mL/min,气化室温度130 ℃,热导池温度110 ℃,柱箱温度130 ℃.
1.2 实验方法

实验前用0.5 μm的Al2O3粉末在麂皮上抛光金电极,经超声清洗,丙酮除油后,用二次H2O将金电极清洗干净. 电化学测试前,在阴极电解液中通入Ar 30 min以除去溶解氧,再通入CO230 min,使电解液中的CO2达到饱和. 测试过程中,持续通入CO2,流量控制在30 mL/min.
电解反应过程中,阳极发生H2O的氧化反应,生成O2和H+,H+扩散进入阴极室,与CO2发生还原反应,生成CO和H2O. 电极反应方程式为:
阴极反应: CO2+ 2e-+ 2H+= CO + H2O;
阳极反应: 2H2O-4e-= O2+ 4H+;
阴极副反应: 2H++ 2e-= H2

图2 电化学反应装置Fig.2 Structure of the electrochemical reaction cell for CO2 reduction
2 结果与讨论
2.1 H2O对有机电解液电导率、黏度和CO2溶解性的影响机理
在PC/TBAP中加入不同浓度的H2O,测定溶液的电导率、黏度,结果如图3所示:随着H2O含量的增加,溶液的电导率逐渐增加,黏度逐渐降低. 当H2O含量达到5%时,电导率达到最高值18.61 mS/cm[27]. 继续加入H2O,电导率开始降低,当溶液中H2O含量达到6.8%时,H2O含量达到饱和,H2O从有机电解液中分层析出,上层为H2O,下层为有机溶液. 当整个体系中H2O的总量超过87.0%时,有机溶剂溶入H2O中,相界面消失,形成均相溶液,电导率随溶液中H2O含量的增加而降低,黏度维持稳定.
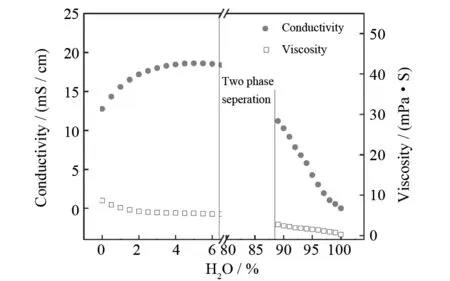
图3 H2O对有机电解液电导率和黏度的影响Fig.3 Water effects on conductivity and viscosity of the organic electrolyte
H2O从有机电解液中分层析出的性质,在工业应用方面非常重要. 由于CO2电还原生成CO的反应本身有H2O生成,在长周期电解过程中,H2O在有机电解液中不断积累,当H2O含量超过6.8%时,H2O从有机电解液中分层析出,有机电解液的性质不会因H2O的过量积累而发生明显改变. 因此,PC/TBAP溶液在工业应用方面具有独到的优势.
为了研究H2O对有机电解液溶解CO2性能的影响,在0.1 mol/L的PC/TBAP溶液中加入H2O,测得CO2的溶解度随H2O含量的变化关系(图4). 从图4中可以看出,CO2的溶解度随H2O含量增加而逐渐增大,当H2O含量增加到6.8%时,混合电解液中CO2的溶解性达到最大值0.332 mol/L,进一步加入H2O后,H2O从电解液中分层析出.

图4 H2O对有机电解液溶解CO2性能的影响Fig.4 Water effects on CO2 solubility of the organic electrolyte


图5 H2O对有机电解液电导率、黏度和CO2溶解性的影响机理分析Fig.5 Mechanism of water effects on conductivity, viscosity and CO2 solubility of the organic electrolyte
2.2 循环伏安测试结果分析
在0.1 mol/L PC/TBAP中,通入Ar 30 min,测得循环伏安曲线如图6(a)所示. 从图6(a)中可以看出,当电位正于-2.56 V时,没有出现还原电流,当电位负于-2.56 V时,出现了还原电流,说明电解液的电化学窗口为-2.56 V;在上述溶液中通入CO230 min,得到CO2饱和的溶液,测得循环伏安曲线如图6(b)所示. 可以看出,当电位低于-1.73 V,有还原电流出现,且电位越负,电流密度越大,图6(b)的还原电流明显大于图6(a),说明CO2发生了电化学还原反应;在CO2饱和的PC/TBAP溶液中加入6.8%的H2O,测得循环伏安曲线如图6(c)所示. 可以看出,还原电流比图6(b)更大,起步点位正移至-1.37 V,原因在于H2O为CO2电还原反应提供了H+,促进了CO2电还原反应的进行.

图6 循环伏安测试结果:(a) PC/ TBAP-blank (b) CO2饱和的PC /TBAP (c) CO2饱和的PC/TBAP/6.8% H2OFig.6 Cyclic voltammograms detected in: (a) PC/ TBAP-blank (b)CO2-saturated PC / TBAP (c) CO2-saturated PC/TBAP/6.8% H2O
2.3 恒电位电解与气相色谱测试结果分析
分别在0.1 mol/L的PC/TBAP和PC/TBAP/6.8% H2O中通入CO2,得到CO2饱和的溶液,然后进行恒电位电解,为了防止电解液变质,电极电位采用-2.5 V(图6a),测试结果如图7所示. 从图7中可以看出,当PC/TBAP中不加H2O时,测得电流密度为3.6 mA/cm2(图7a). 而当PC/TBAP溶液中含有6.8%的H2O时,电流密度增加至9.18 mA/cm2(图7b),明显高于PC/TBAP溶液中测得的结果.
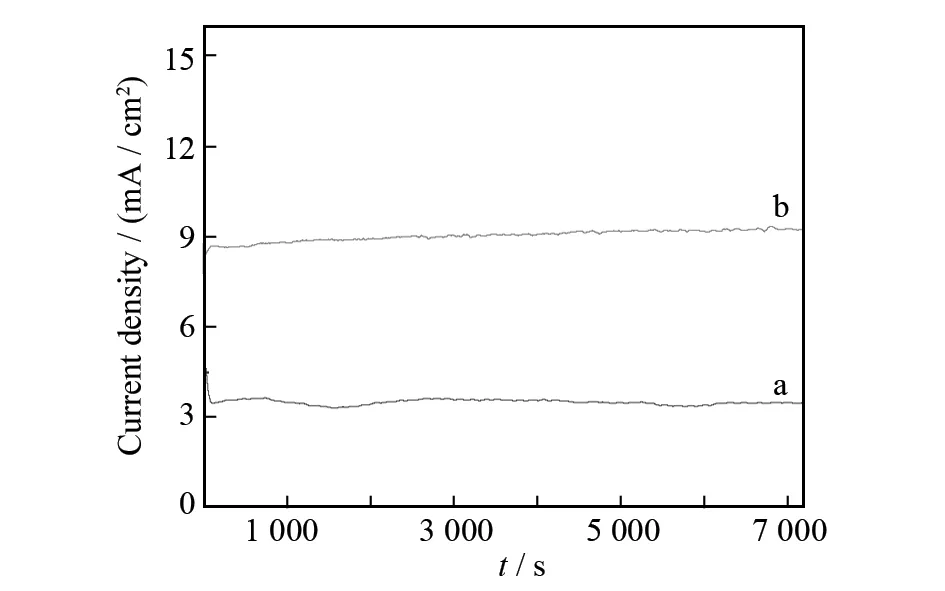
图7 恒电位电解测试结果:(a)CO2饱和的PC / TBAP (b) CO2饱和的PC/TBAP/6.8% H2OFig.7 Potentiostatic electrolysisdetected in: (a)CO2-saturated PC / TBAP (b) CO2-saturated PC/TBAP/6.8% H2O
根据气相色谱测试结果,采用式(1),计算生成CO和H2的电流效率[28-29]:
(1)
式中η为电流效率,n为生成CO的物质的量,F为法拉第常数,Q为生成nmol CO消耗的电量.
当阴极电解液为PC/TBAP时,生成CO和H2的电流效率随电解时间的变化曲线如图8(a)所示. 从图8(a)中可以看出,当电解反应刚开始进行时,生成CO的电流效率仅为52%,这是由于反应生成的CO部分溶解在有机电解液中[30],导致计算结果偏低. 由于CO2电还原反应本身有H2O生成,使得电解液中H2O的含量不断增加,促进了CO2电还原反应的进行,使生成CO的电流效率逐渐升高. 反应进行40 min后,生成CO的电流效率达到并稳定在92%. 由于电解液中有H2O存在,导致阴极上有H2生成,但电流效率很低,随着反应的进行,电解液中的H2O越来越多,生成H2的电流效率逐渐增高,40 min后,生成H2的电流效率在5%左右,直到反应结束.
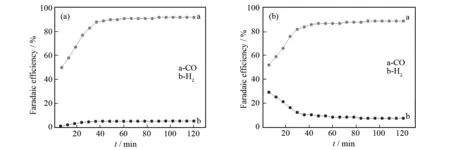
图8 电流效率计算结果:(a)CO2饱和的PC / TBAP (b) CO2饱和的PC/TBAP/6.8% H2OFig.8 Faradaic efficiencies results detected in: (a)CO2-saturated PC / TBAP (b)CO2-saturated PC/TBAP/6.8% H2O
当PC/TBAP中含6.8% H2O时,生成CO、H2的电流效率随时间的变化曲线如图8(b)所示. 从图8(b)中可以看出,当电解反应刚开始进行时,生成CO的电流效率只有50%,这是由于部分CO溶解在电解液中,导致测定结果偏低,随着反应的进行,电流效率逐渐增大,反应进行40 min后,生成CO的电流效率稳定在89%,直至反应结束. 电解反应刚开始进行时,生成H2的电流效率达29%,40 min后,生成H2的电流效率降到7%左右,直至反应结束.

图9 在CO2饱和的PC/TBAP/6.8% H2O溶液中不同电位下的CO、H2电流效率Fig.9 Faradaic efficiency of CO and H2 detected in CO2-saturated PC/TBAP/6.8% H2O at variation potential
在PC/TBAP/6.8% H2O中,测得生成CO、H2的电流效率如图9所示,当电位为-1.4 V时,生成CO的电流效率为0,生成H2的电流效率高达99.6%;当电位低于-1.5 V时,有CO生成,随着电位负移,生成CO的电流效率急剧增加,同时,生成H2的电流效率急剧降低,当电位达到-2.5 V时,生成CO的效率达到85%,生成H2的电流效率降低至15%. 上述结果表明,生成CO的反应对析氢反应有抑制作用[31],其机理如图10所示. 当反应刚开始进行时,电极表面的活性点未被任何物质占据,析氢反应的速率很快,电流效率较高;随着反应的进行,由CO2电还原生成的中间产物吸附在活性点上(CO2电还原反应速率较慢),导致析氢反应速率减慢,电流效率降低,40 min后,反应达到稳定状态.

图10 CO2电还原反应对析氢过程具有抑制作用Fig.10 Hydrogen evolution is suppressed by a layer of CO generated from CO2 reduction
2.4 Tafel测试结果分析
为了分析电极反应动力学特征,分别在0.1 mol/L PC/TBAP和PC/TBAP/6.8% H2O中测定了塔菲尔曲线,结果如图11所示.

图11 塔菲尔曲线测试结果:(a)CO2饱和的PC / TBAP;(b) CO2饱和的PC/TBAP/6.8% H2OFig.11 Tafel curves for CO2 reduction detected in: (a)CO2-saturated PC / TBAP; (b) CO2-saturated PC/TBAP/6.8% H2O
从图11可以看出,当PC/TBAP中不含H2O时,测得平衡电位为-1.95 V,说明CO2电还原反应需要很高的过电位;当PC/TBAP中含有H2O时,平衡电位正移至-1.50 V,说明H2O对CO2电还原反应具有催化作用.
根据塔菲尔公式[32]:

(2)
(3)
(4)
其中η为过电位,a和b为塔菲尔常数,i为电流密度,i0为交换电流密度,R为气体常数,T为绝对温度,n为电子转移数,α为传递系数,F为法拉第常数,Rct为电荷转移电阻[33]. 结合实验结果,求得CO2电化学还原反应的动力学参数如表1所示,当PC/TBAP中不含H2O时,测得交换电流密度为0.978 4×10-4A/cm2(表1),电荷转移电阻为131.296 1 Ω/cm2;当PC/TBAP中含有6.8% H2O时,交换电流密度增至1.446 5×10-4A/cm2,电荷转移电阻降低为88.807 5 Ω/cm2,说明加入H2O后CO2电还原反应更容易进行.
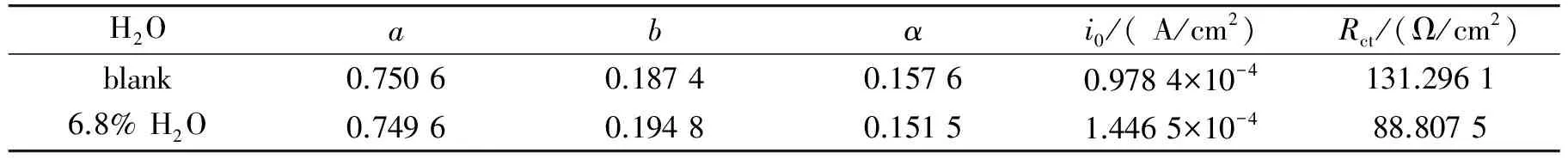
表1 CO2在Au电极上发生电还原反应时的动力学参数
H2O对CO2电还原反应的催化作用机理如图12所示:吸附在电极表面的CO2经单电子还原后,生成高能态CO2·-自由基,CO2·-自由基与H2O相互作用,生成HCO2·-,降低了反应的活化能,HCO2·-得到一个电子后被进一步还原成CO,CO从电极表面脱附逸出[34].

图12 CO2电还原反应机理分析Fig.12 Reaction mechanism analysis of CO2 reduction
3 结论
在双室隔膜电解池中,研究了CO2在PC/TBAP中的电催化还原反应,分析了H2O对有机电解液电导率、黏度和CO2溶解性的影响. 结果表明:当H2O含量增加时,有机电解液的电导率升高,黏度降低,CO2溶解度增加. 电化学测试结果表明,在PC/TBAP/6.8% H2O中电还原CO2时,H2O对CO2·-自由基具有稳定作用,使得交换电流增加、电荷转移电阻降低、电流密度升高、电流效率增加,说明H2O对CO2电还原反应有催化作用. 在PC/TBAP/6.8% H2O中电还原CO2具有广阔的应用前景.
[1] REMUZGO L, TRUEBA C, SARABIA J M. Evolution of the global inequality in greenhouse gases emissions using multidimensional generalized entropy measures [J]. Physica A: Statistical Mechanics and its Applications, 2016, 444: 146-157.
[2] KO J, KIM B K, HAN J W. Density functional theory study for catalytic activationand dissociation of CO2on bimetallic alloy surfaces [J]. Journal of Physical Chemistry C, 2016, 10(2): 143-151.
[3] KUMAR B, BRIAN J P, ATLA V, et al. New trends in the development of heterogeneous catalysts for electrochemical CO2reduction [J]. Catalysis Today, 2016, 270: 19-30.
[4] 黄传敬, 郑小明, 费金华. 甲烷二氧化碳重整制合成气镍-钴双金属催化剂[J]. 应用化学, 2001, 18(9): 741-745.
HUANG Z J, ZHENG X M, FEI J H. Reforming of methane with carbon dioxide to syngas over Ni-Co bimetallic catalysts [J]. Chinese Journal of Applied Chemistry, 2001, 18(9): 741-745.
[5] 卞潮渊, 慕韩锋. 基于煤和天然气联合制取合成气工艺研究进展[J]. 化工进展, 2016, 35(10): 3136-3141.
BIAN C Y, MU H F. Research progress based on coal and natural gas to produce syngas [J]. Chemical Industry and Engineering Progress, 2016, 35(10): 3136-3141.
[6] MATTHEWS L R, NIZIOLEK A M, ONEL O, et al. Biomass to liquid transportation fuels via biological and thermochemical conversion: process synthesis and global optimization strategies [J]. Industrial & Engineering Chemistry Research, 2015, 5(2): 205-223.
[7] 梁浩然, 李建晓, 汪朝阳, 等. Glaser反应研究新进展[J]. 有机化学, 2014, 28(6): 1263-1268.
LIANG H R, LI J X, WANG C Y, et al. New progress on GIaser coupling reaction [J]. Chinese Journal of Organic Chemistry, 2011, 31(4): 586-590.
[8] JIANG S, YANG X, CHEN J, et al. Microstructure construction and composition modification of CeO2macrospheres with superior performance [J]. Inorganic Chemistry Frontiers, 2016, 3(1): 92-96.
[9] 杨晓庆, 黄卡玛, 贾国柱. 二甲基亚砜-水混合溶液的等效介电常数特异性研究[J]. 化学学报, 2008, 66(9): 1107-1110.
YANG X Q, HUANG K M, JIA G Z. Specific phenomenon of permittivity of DMSO-H2O mixture solution [J]. Acta Chimica Sinica, 2008, 66(9): 1107-1110.
[10] JERAGH B, ALI M S, ELASMY A A. Crystal structure, complexation, spectroscopic characterization and antimicrobial evaluation of 3,4-dihydroxybenzylidene isonicotinyl-h ydrazone [J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 145: 295-301.
[11] LACKNER K S. Capture of carbon dioxide from ambient air [J]. The European Physical Journal Special Topics, 2009, 76(1): 93-106.
[12] JR K W F, LEACH S. Electrochemical reduction of carbon dioxide to methane, methanol, and Co on Ru electrodes [J]. Journal of the Electrochemical Society, 1985, 132(1): 259-260.
[13] BAYARDON J, HOLZ J, DIPLCHEM B S, et al. Propy-lene carbonate as a solvent for asymmetric hydrogenations [J]. Angewandte Chemie International Edition, 2007, 46(31): 5971-5974.
[14] KAWANAMI H, SASAKI A, MATSUI K, et al. A rapid and effective synthesis of propylene carbonate using a supercritical CO2-ionic liquid system [J]. Chemical Communications, 2003, 34(31): 0464-0469.
[15] ZHANG S S, XU K, ALLEN J L, et al. Effect of propylene carbonate on the low temperature performance of li-ion cells [J]. Journal of Power Sources, 2002, 110(1): 216-221.
[16] IZUTSU K. Electrochemistry in nonaqueous solutions [M]. Darmstadt: Wiley-VCH, 2009, 48(5): 599-599.
[17] KATAYAMA N, KAWAURA T, BABA Y, et al. Thermal stability of propylene carbonate and ethylene carbonate-propylene carbonate-based electrolytes for use in li cells [J]. Journal of Power Sources, 2002, 109(2): 321-326.
[18] 张所波, 丁孟贤, 高连勋, 等. 离子液体在有机反应中的应用[J]. 有机化学, 2002, 22(3): 159-163.
ZHANG S B, DING M X, GAO L X, et al. Application of ionic liquids in organic reactions [J]. Chinese Journal of Organic Chemistry, 2002, 22(3): 159-163.
[19] 吴晓萍, 刘志平, 汪文川. 分子模拟研究气体在室温离子液体中的溶解度[J]. 物理化学学报, 2005, 21(10): 1138-1142.
WU X P, LIU Z P, WANG W C. MoleclIar dynamics simulation of gas solubility in room temperature ionic liquids [J]. Acta Physico-Chimica Sinica, 2005, 21(10): 1138-1142.
[20] 王勇, 李浩然, 吴韬, 等. 烷基咪唑型卤盐类离子液体的合成机理研究[J]. 物理化学学报, 2005, 21(5): 517-522.
WANG Y, LI H R, WU T, et al. Reaction mechanism study for the synthesis of alkylimidazolium-based halide ionic liquids [J]. Acta Physico-Chimica Sinica, 2005, 21(5): 517-522.
[21] SHI J, SHI F, SONG N, et al. A novel electrolysis cell for CO2reduction to CO in ionic liquid/organic solvent electrolyte [J]. Journal of Power Sources, 2014, 259: 50-53.
[22] SCOVAZZO P, CAMPER D, KIEFT J, et al. Regular solution theory and CO2gas solubility in room-temperature ionic liquids [J]. Industrial & Engineering Chemistry Research, 2004, 43(21): 6855-6860.
[23] NEUBAUER S S, SCHMID B, RELLER C, et al. Alkalinity initiated decomposition of mediating imidazolium ions in high current density CO2electrolysis [J]. Chemelectrochem, 2016, 4: 160-167.
[24] HOUSE H O, FENG E, PEET N P. Comparison of various tetraalkylammonium salts as supporting electrolytes in organic electrochemical reactions [J]. Journal of Organic Chemistry, 1971, 36(16): 2371-2375.
[25] 张现萍, 黄海燕, 靳红利, 等. 水溶液中电化学还原CO2的研究进展[J]. 化工进展, 2015, 34(12): 4139-4144.
ZHANG X P, HUANG H Y, JIN H L, et al. Progress of the electrochemical reduction of CO2in aqueous electrolyte [J]. Chemical Industry and Engineering Progress, 2015, 34(12): 4139-4144.
[26] SHI J, SHI F, SONG N, et al. A novel electrolysis cell for CO2reduction to CO in ionic liquid/organic solvent electrolyte [J]. Journal of Power Source, 2014, 259(4): 50-53.
[27] 杨冬伟, 王晓春, 李露, 等. CO2在离子液体/有机溶剂/水复合电解液中电催化还原[J]. 化学工程, 2015, 43(9): 1-5.
YANG D W, WANG X C, LI L, et al. Electrochemical reduction of CO2in ionic liquid/organic solvent/water electrolyte [J]. Chemical Engineering, 2015, 43(9): 1-5.
[28] NEWMAN J S. Design of an electrochemical cell making syngas (CO+H2) from CO2and H2O reduction at room temperature [J]. Journal of the Electrochemical Society, 2008, 155(1): B42-B49.
[29] WEIMER T, SCHABER K, SPECHT M, et al. Methanol from atmospheric carbon dioxide: a liquid zero emission fuel for the future [J]. Energy Conversion & Management, 1996, 37(6/8): 1351-1356.
[30] SHI J, LI Q Y, SHI F, et al. Design of a two-compartment electrolysis cell for the reduction of CO2to CO in tetrabutylammonium perchlorate/propylene carbonate for renewable electrical energy storage [J]. Journal of the Electrochemical Society, 2016, 163(7): G82-G87.
[31] HORI Y. Electrochemical CO2reduction on metal electrodes [M]. New York: Modern Aspects of Electroche-mistry, Springer, 2008: 89-189.
[32] BARD A J, FAULKNER L R. Electrochemical methods: principles and applications [J]. New York: Wiley and Sons, 2001: 386-428.
[33] BARD A J, FAULKNER L R. Electrochemical methods-fundamentals and applications [M]. Beijing: Chemical Industry Press, 2012: 71-72.
[34] GENNARO A, ISSE A A, SEVERIN M G, et al. Mechanism of the electrochemical reduction of carbon dioxide at inert electrodes in media of low proton availability [J]. Journal of the Chemical Society, Faraday Transactions, 1996, 92(20): 3963-3968.
[责任编辑:吴文鹏]
Water effects on CO2electro-reduction in propylene carbonate/ tetrabutylammonium perchlorate solution
SHEN Fengxia1, CHEN Tianyou1, LI Qingyuan2, SONG Ning1, JIA Youjian1, SHI Jin1,2*
(1.FacultyofMetallurgicalandEnergyEngineering,KunmingUniversityofScienceandTechnology,Kunming650093,Yunnan,China;2.StateKeyLaboratoryofComplexNonferrousMetalResourcesCleanUtilization,KunmingUniversityofScienceandTechnology,Kunming650093,Yunnan,China)
A novel two-chamber electrolysis cell was studied for electrochemical reduction of CO2into CO in propylene carbonate (PC)/tetrabutylammonium perchlorate (TBAP) electrolyte. Because the electrochemical reduction of CO2into CO naturally produce water, the presence of water in the organic electrolyte is inevitable. This work has focused on the investigation of the water effects on the performance of the organic electrolyte and the process of CO2reduction. The experiment results showed that the presence of water in PC/TBAP had a positive effect on the performance of the electrolyte, such as increasing the conductivity, decreasing the viscosity and improving the CO2solubility. When the water content is more than 6.8%, water is separated from the organic electrolyte automatically and the property of electrolyte is not changed significantly. The electrochemical reduction of CO2into CO was studied in the PC/TBAP electrolyte with containing 6.8% water, the Faradic efficiency reached 89% and the current density reached 9.18 mA/cm2. During the long term electrolysis process, deactivation was not found on the surface of Au electrode.
two-chamber electrolysis cell; electrochemical reduction of CO2; propylene carbonate; Au electrode
2017-04-20.
国家自然科学基金(51164020).
沈风霞(1991-),女,硕士生,研究方向为冶金电化学.*
,E-mail:shijin1118@163.com.
O646
A
1008-1011(2017)04-0474-08
