微波辅助法合成新黄酮类化合物骨架
2017-09-12殷姝君李兴军王晓静
殷姝君, 孙 捷, 李兴军, 李 娜, 王晓静*
(1.济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250200; 2.山东省医学科学院药物研究所, 山东 济南 250062; 3.国家卫生部生物技术药物重点实验室,山东省罕少见病重点实验室,山东 济南 250062)
微波辅助法合成新黄酮类化合物骨架
殷姝君1,2,3, 孙 捷2,3, 李兴军1, 李 娜1,2,3, 王晓静2,3*
(1.济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250200; 2.山东省医学科学院药物研究所, 山东 济南 250062; 3.国家卫生部生物技术药物重点实验室,山东省罕少见病重点实验室,山东 济南 250062)
探索了一种新黄酮类化合物骨架的新的合成方法,以取代苯甲醛和丙二酸为起始原料,在哌啶的催化下生成取代苯基丙烯酸衍生物;采用微波辅助的方法,以三氟乙酸为溶剂,取代苯基丙烯酸衍生物和苯酚类化合物反应合成了新黄酮类化合物;研究了微波反应功率、反应时间等因素对产物收率的影响,并确定了优化反应条件. 在最优条件下,以61%~85%的收率得到6种含不同取代基的新黄酮类化合物骨架. 用MS、IR和1H-NMR对目标产物的结构进行了表征.
新黄酮类化合物;微波反应;三氟乙酸
新黄酮类化合物又名4-芳基香豆素,是指具有C6-C3-C6骨架且在4位上具有一个芳基结构的一类化合物. 化合物的结构与功能相关,4-芳基香豆素类物质多样的结构赋予了它们丰富的活性[1]. 研究发现,新黄酮类化合物具有抗菌[2-3]、抗艾滋病病毒[4]、抗肿瘤[5-6]、抗疟原虫[7-8]、抗氧化[9]、抗过敏[10]、抗炎等生物活性[11-13]. 3,4-二氢-4-芳基香豆素类化合物(新黄酮类化合物的骨架)作为4-芳基香豆素类的氢化衍生物,具有与其相似的生物活性[14-16]. 毫无疑问,4-芳基香豆素的研究对于未来医药领域的发展具有重要意义,3,4-二氢-4-芳基香豆素类化合物也逐渐成为研究热点,因此合成更多的此类化合物有利于对其生物活性进行更深入的探索. 目前合成3,4-二氢-4-芳基香豆素类化合物的方法主要有多聚磷酸法(PPA)[17]、三氯氧磷/三氟化硼乙醚法[18]、三氟乙酸法[19]、蒙脱土催化法[15]等几种方法,存在反应时间长、反应条件剧烈不易控制、操作复杂、反应条件苛刻等问题. 本文作者综合考虑以上方法的优缺点,将微波辅助法引入三氟乙酸法中,探索了反应时间、微波反应功率等条件对产物收率的影响,并确定了优化反应条件,合成了一系列新黄酮类化合物骨架. 该方法反应时间短,基本上一个小时左右就可以得到目标产物,大大节省了人力、物力;产品收率高,反应后得到的粗品纯度就可达到98%左右,可满足大部分的应用,省去了纯化时间;原料廉价易得,腐蚀性小,不污染环境,具有现代绿色有机合成的特点.
1 实验部分
1.1 材料和仪器
4-甲氧基苯甲醛,3,4,5-三甲氧基醛,香兰素,异香兰素,上海海曲化工有限公司;3,4-二甲氧基苯甲醛,哌啶,丙二酸,国药集团化学试剂有限公司;间苯二酚,三氟乙酸,无水乙醇,吡啶,天津大茂化学试剂厂;浓盐酸,莱阳康德化工有限公司;所用试剂均为分析纯,实验用水均为蒸馏水.
集热式恒温加热磁力搅拌器,循环水真空泵,郑州长城科工贸有限公司;WBFY-205微波反应器,巩义市予华仪器有限公司;ZF-6型三用紫外分析仪,上海嘉鹏科技有限公司;真空干燥箱,上海精宏实验设备有限公司;WRR熔点仪,上海精密科学仪器有限公司;Nicolet Avatar 330红外分析仪,美国热电公司;Bruker Avance 6002型核磁共振仪,瑞士Bruker公司;Trap VL型质谱仪,1100高效液相分析仪,美国Agilent公司.
1.2 合成
以取代苯甲醛1a-1e为起始原料,在吡啶和哌啶存在条件下进行缩合反应,再经无水乙醇重结晶,得到取代苯基丙烯酸类化合物2a-2e[20],2a-2e在三氟乙酸存在下,经过微波辅助与苯酚类化合物发生氢芳化反应得到目标化合物3a-3f[21],合成路线见图1.
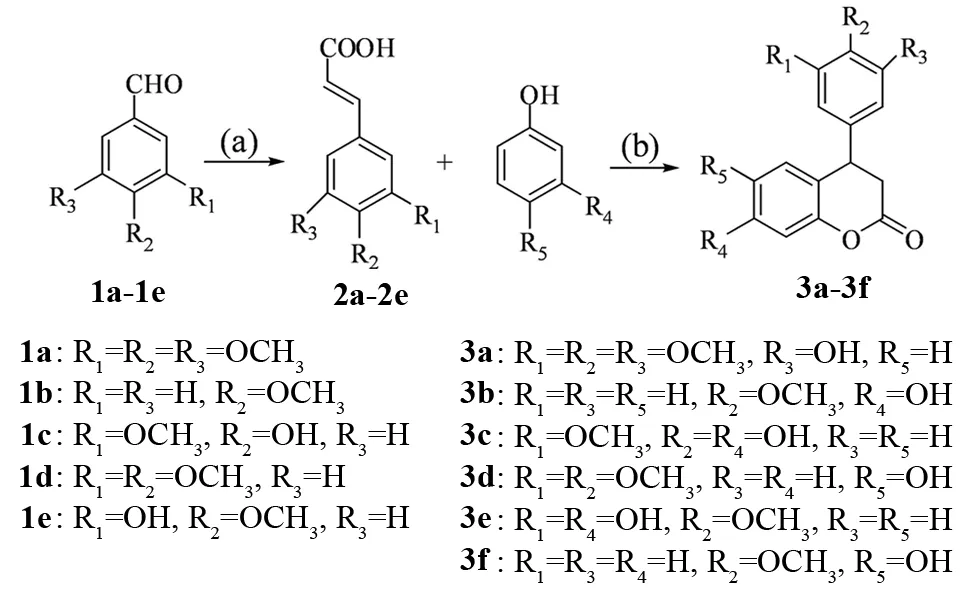
反应试剂与条件:(a) 丙二酸,吡啶,哌啶,80℃;(b) 三氟乙酸,微波,加热.图1 新黄酮类化合物骨架的合成路线Fig.1 Synthetic route of neoflavonoids framework
1.2.1 取代苯基丙烯酸类化合物2a-2e的合成
在100 mL的三颈反应瓶中加入120 mmol丙二酸、100 mmol苯甲醛类化合物1a-1e,25 mL(248 mmol)吡啶,1 mL(10.2 mmol)哌啶,加热至回流,反应8 h,反应完毕,冷却10 min,加入70 mL冰盐酸(3 mol/L)溶液,放置一夜,抽滤,用500 mL水洗涤沉淀,得到白色粗品. 粗品用无水乙醇重结晶,得白色苯基丙烯酸类化合物2a-2e纯品,收率为80%~97%.
1.2.2 目标化合物3a-3f反应条件探索
在100 mL的三颈反应瓶中加入1.19 g(5 mmol)3,4,5-三甲氧基苯丙烯酸、0.6 g(5.5 mmol)间苯二酚、6 mL(58mmol)三氟乙酸,搅拌均匀后将该混合物置于常压微波反应器中,设置微波功率,TLC监测反应进程(展开剂,石油醚和乙酸乙酯体积比为2∶1),反应完毕后将反应液倒入50 mL冰水中,有沉淀析出,放置一夜陈化,抽滤,得4-(3′,4′,5′-三甲氧基苯基)-7-羟基-3,4-二氢香豆素. 经过试验确定优化条件后,又在优化条件下合成了一系列新黄酮类化合物骨架.
2 结果与讨论
2.1 微波功率和反应时间对产物收率的影响
分别研究了120、100、80 W这三个功率下不同反应时间对产品收率的影响,保持其他条件不变的情况下进行试验,结果见图2-4. 由图2可见,微波功率为120 W时反应时间在30~50 min内,目标产物4-(3′,4′,5′-三甲氧基)-7-羟基-3,4-二氢香豆素的产率逐渐增加,50 mim后收率就开始下降.
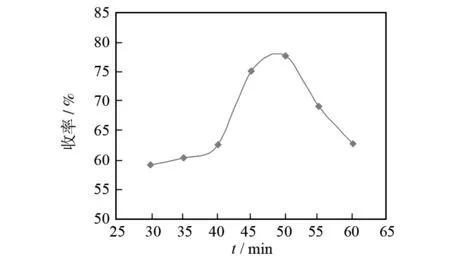
图2 120 W功率下不同反应时间对产物收率的影响Fig.2 Effect of different reaction times on yield of 120 W

图3 100 W功率下不同反应时间对产物收率的影响Fig.3 Effect of different reaction times on yield of 100 W
由图3可以看出反应时间在30~50 min内,产品收率逐渐增加;50 min后随着反应时间增加,目标产物的收率开始下降,推断由于反应时间过长,副产物增加导致. 因此,在此功率下,最佳反应时间为50 min,4-(3′,4′,5′-三甲氧基)-7-羟基-3,4-二氢香豆素的收率为83.42%,经LC-MS检测产品纯度为98%.
图4显示45~55 min内,目标化合物的收率随时间增加而迅速增加;55~70 min时收率有所增加,但相对而言较缓慢;70 min后目标产物的收率开始急剧下降. 因此,此功率下反应时间在65~70 min之间,目标产物的收率相对较高,最高时能达到84.23%.

图4 80 W功率下不同反应时间对产物收率的影响Fig.4 Effect of different reaction times on yield of 80 W
2.2 产品分析
合成的6个目标化合物的结构经质谱、核磁共振氢谱及红外谱确证,其理化常数、波谱数据见表1.

表1 目标化合物的收率、熔点、质谱、1H-NMR和IR数据
3 结论
通过以上实验确定了新黄酮类化合物骨架的优化反应条件,采用微波辅助的方法,微波功率为80 W,反应时间为70 min,4-(3′,4′,5′-三甲氧基)-7-羟基-3,4-二氢香豆素的收率为84.23%. 之后在此优化条件下合成了3b-3f 5个含不同取代基的新黄酮类化合物骨架,产品纯度和收率都很高. 初步证实该方法可广泛应用于合成新黄酮类化合物骨架,且本方法本方法工艺简单、操作方便、反应条件温和、反应时间短且产率较高;另外副产物少,不腐蚀设备,适合市场大规模生产,这为进一步研究新黄酮类化合物,寻找药物先导化合物提供了新方法. 另外试验中发现含羟基较多的原料在应用此方法合成新黄酮类化合物骨架时,产物稍杂,陈化不易得到固体,微波功率稍微降低或减少反应时间,所得产物纯度更高,初步推断是由于多羟基的物质本身较活泼导致,具体原因有待进一步考证.
[1] 李娜, 孙捷, 孙敬勇, 等. 4-芳基香豆素类化合物的活性及合成方法研究进展[J]. 中国医药工业杂志, 2015, 46(12): 1352-1365.
LI N, SUN J, SUN J Y, et al. Progress in bioactivities and synthetic methods of 4-arylcoumarins [J]. Chinese Journal of Pharmaceuticals, 2015, 46(12): 1352-1365.
[2] CANNING C, SUN S, JI X, et al. Antibacterial and cytotoxic activity of isoprenylated coumarin mammea A/AA isolated from mammea africana [J]. Journal of Ethnopharmacology, 2013, 147(1): 259-262.
[3] GARAZD M M, GARAZD Y L, KHILYA V P. Neoflavones. 1.Natural distribution and spectral and biological properties [J]. Chemistry of Natural Compounds, 2003, 39(1): 54-121.
[4] GARAZD M M, GARAZD Y L, KHILYA V P. Neoflavones. 2. Methods for synthesizing and modifying 4-arylcoumarins [J]. Chemistry of Natural Compounds, 2005, 41(3): 245-271.
[5] BILLARD C, MENASRIA F, QUINEY C, et al. 4-arylcoumarin analogues of combretastatins stimulate apoptosis of leukemic cells from chronic lymphocytic leukemia patients [J]. Experimental Hematology, 2008, 36(12): 1625.
[6] TAECHOWISAN T, LU C, SHEN Y, et al. Antitumor activity of 4-arylcoumarins from endophytic streptomyces aureofaciens CMUAc130 [J]. Journal of Cancer Research and Therapeutics, 2007, 3(2): 86-91.
[7] PIERSON J T, DUMETRE A, HUTTER S, et al. Synthesis and antiprotozoal activity of 4-arylcoumarins [J]. European Journal of Medicinal Chemistry, 2010, 45(3): 864-869.
[8] ARGOTTE-RAMOS R, RAMIREZ-AVILA G, RODRIGUEZ G M C, et al. Antimalarial 4-phenylcoumarins from the stem bark of hintonia latiflora [J]. Journal of Natural Products, 2006, 69(10): 1442-1444.
[9] ZHANG K, DING W, SUN J, et al. Antioxidant and antitumor activities of 4-arylcoumarins and 4-aryl-3,4-dihydrocoumarins [J]. Chemistry of Natural Compounds, 2012, 107(1): 203-210.
[10] TAECHOWISAN T, LU C, SHEN Y, et al. 4-arylcoumarin inhibits immediate-type allergy [J]. Food and Agricultural Immunology, 2007, 18(3/4): 203-211.
[11] KUMAR P, KUSHWAHA P, KHEDGIKAR V, et al. Neoflavonoids as potential osteogenic agents from dalbergia sissoo, heartwood [J]. Bioorganic & Medicinal Chemistry Letters, 2014, 24(12): 2664-2668.
[12] COMBES S B, BARBIER P, DOUILLARD S, et al. Synthesis and biological evalmnion 4-arylcoumarins analogues of combretastatins [J]. Journal of Medicina Chemistry, 2011, 59(9): 3153-3162.
[13] SUN J, DING W X, ZHANG K Y, et al. Efficient synthesis and biological evaluation of 4-arylcoumarin derivatives [J]. Chinese Chemical Letters, 2011, 22(6): 667-670.
[14] KUMAR A, SINGH B K, TYAGI R, et al. Mechanism of biochemical action of substituted 4-methylcoumarins. Part 11: comparison of the specificities of acetoxy derivatives of 4-methylcoumarin and 4-phenylcoumarin to acetoxycoumarins: protein transacetylase [J]. Bioorganic & Medicinal Chemistry, 2005, 13(13): 4300-4305.
[15] LEE J M, TSENG T H, LEE Y J. Cheminform abstract: an efficient synthesis of neoflavonoid antioxidants based on montmorillonite K-10 catalysis [J]. Cheminform, 2001, 2001(15): 2247-2254.
[16] ROELENS F, HUVAERE K, DHOOGE W, et al. Regioselective synthesis and estrogenicity of (+/-)-8-alkyl-5,7-dihydroxy-4-(4-hydroxyphenyl)-3,4-dihydrocoumarins [J]. European Journal of Medicinal Chemistry, 2005, 40(10): 1042-1051.
[17] MAJUMDER P L, CHATTERJEE S, MUKHOTI N. The reactions of phenols withα,β-unsaturated aromatic acids in presence of polyphosphoric acid: synthetic and mechanistic studies [J]. Journal-Indian Chemical Society, 2001, 78(10): 743-755.
[18] 孙捷, 丁为现, 高艳明, 等. 3,4-二氢-4-芳基香豆素类化合物的合成及其生物活性研究[J]. 中国药物化学杂志, 2011, 21(1): 19-24.
SUN J, DING W X, GAO Y M, et al. Synthesis and biological activity of 3,4-dihydrogen -4-arylcoumarins [J]. Chinese Journal of Medicinal Chemistry, 2011, 21(1): 19-24.
[19] GOZUM V P, MEBANE R C. Solvent-free and atom efficient conversion of aldehydes into nitriles [J]. Green Chemistry Letters and Reviews, 2013, 6(2): 149-150.
[20] ROBBINS R J, SCHMIDT W F. Optimized synthesis of four isotopically labeled (13C-enriched) phenolic acids via a malonic acid condensation [J]. Journal of Labelled Compounds, 2004, 47(11): 797-806.
[21] JAIN N, KRISHNAMURTY H G.β,β-dimethylac-rylophenones: BF3·Et2O-POCl3catalysed acylation of phenols usingβ,β-dimethylacrylic acid [J]. Indian Journal of Chemistry, 1999, 38B(16): 1237-1241.
[责任编辑:刘红玲]
Microwave-assisted synthesis of neoflavonoids framework
YIN Shujun1,2,3, SUN Jie2,3, LI Xingjun1, LI Na1,2,3, WANG Xiaojing2,3*
(1.SchoolofMedicineandLifeSciences,UniversityofJinan-ShandongAcademyofMedicalSciences,Jinan250200,Shandong,China;2.InstituteofMateriaMedica,ShandongAcademyofMedicalSciences,Jinan250062,Shandong,China; 3.KeyLaboratoryforBiotech-DrugsMinistryofHealth,KeyLaboratoryforRare&UncommonDiseasesofShandongProvince,Jinan250062,Shandong,China)
A new method for the synthesis of neoflavonoids framework was studied. The substituted phenylacrylic acid derivatives were prepared by substituted phenylaldehyde and malonic acid in the presence of piperidine catalyst. With trifluoroacetic acid as a solvent, neoflavonoids were synthesized via reaction between substituted phenylacrylic acid derivatives and phenols with microwave-assisted method. The effects of microwave reactive power and reaction time on the yield were investigated, and the optimal reaction condition was established. Six neoflavonoid compounds with different substituent groups were synthesized in 61%-85% yields under the optimized reaction conditions. The structures of all products were confirmed by the corresponding mass spectrum (MS), nuclear magnetic resonance spectrum (1H-NMR) and infrared spectroscopy(IR).
neoflavonoids; microwave reaction; trifluoroacetic acid
2017-01-17.
山东省自然科学基金(ZR2015YL041).
殷姝君(1991-), 女, 硕士生, 研究方向为药物化学.*
, E-mail: xj68cn@163.com.
O625
A
1008-1011(2017)04-0444-05
