IL-23诱导人外周血单个核细胞对MUTZ-1细胞增殖、凋亡及相关基因表达的影响
2017-09-12王瑞仓刘艳芬杨洁周洁李杰郝洪岭
王瑞仓 刘艳芬 杨洁 周洁 李杰 郝洪岭
·论著·
IL-23诱导人外周血单个核细胞对MUTZ-1细胞增殖、凋亡及相关基因表达的影响
王瑞仓 刘艳芬 杨洁 周洁 李杰 郝洪岭
目的白介素-23(IL-23)诱导人外周血单个核细胞对骨髓增生异常综合征(MDS)细胞系MUTZ-1增殖、凋亡及相关基因表达的影响。方法采用密度梯度离心法分离获得正常人外周血单个核细胞(PBMNC),细胞分4组:阴性对照组(未加IL-23),3个浓度IL-23组(2、10、50 ng/ml),体外诱导72 h,并与MUTZ-1共培养。MTT实验检测MUTZ-1细胞增殖。流式细胞仪检测MUTZ-1细胞凋亡和细胞周期变化。Real time-PCR和Western-blot检测MUTZ-1细胞Bax、Bcl-2、caspase-3、survivin mRNA和蛋白表达。结果2、10、50 ng/ml IL-23诱导的PBMNC与 MUTZ-1细胞共培养后,MUTZ-1细胞增殖速度、S期细胞比例明显降低,细胞凋亡率、G0/G1期细胞比例明显增加,呈时间和浓度依赖性,与阴性对照组比较差异均有统计学意义(P<0.05);同时Bax、caspase-3 mRNA和蛋白表达明显上调,Bcl-2、survivin mRNA和蛋白表达明显下调,呈时间和浓度依赖性,与阴性对照组比较差异均有统计学意义(P<0.05)。结论IL-23诱导PBMNC能够明显抑制MUTZ-1细胞增殖,促进MUTZ-1细胞凋亡,其机制与上调Bax、caspase-3表达、下调Bcl-2、survivin表达有关。
IL-23;MUTZ-1细胞;增殖;凋亡;基因表达
骨髓增生异常综合征(MDS)是一种起源于造血干细胞的克隆性疾病,以病态或无效造血、一系或多系血细胞质/量异常、易进展为急性髓系白血病为特征,患者生存期短[1,2]。近年来,MDS发病率存在逐年上升趋势[3]。目前,异基因造血干细胞移植是缓解患者疾病进展的重要手段。但由于骨髓供体缺乏、患者年龄限制等因素导致只有少数MDS患者接受此疗法,且移植后并不能明显降低患者病死率[4]。另外,临床治疗MDS还采用化疗、靶向治疗、诱导分化治疗等,但疗效均不甚满意,原因主要在于这些方法不能杀灭所有肿瘤细胞,患者极易复发[5]。白介素-12(IL-12)家族是一类结构类似、亚基间通过二硫键结合的细胞因子家族,主要包括IL-12、IL-23、IL-27、IL-35,在细胞免疫应答中发挥重要调控作用。研究发现,IL-12家族成员与肿瘤发生、发展密切相关,其中IL-23是IL-12家族的重要成员,主要发挥抗肿瘤及抗肿瘤转移作用[6]。本课题组前期研究发现,IL-23能促进人外周血单个核细胞(PBMNC)对白血病K562细胞的杀伤力[7]。而细胞增殖和凋亡是MDS的主要发病机制。目前,有关IL-23应用于MDS治疗及对肿瘤细胞增殖和凋亡的影响研究尚少。本研究旨在探讨IL-23诱导正常人PBMNC对MDS细胞系MUTZ-1增殖、凋亡及相关基因表达的影响,以期为MDS的免疫治疗提供理论依据和实验基础。
1 材料与方法
1.1 药物与试剂 MUTZ-1细胞购自北京协和细胞库;重组人IL-23购自美国R&D公司;人淋巴细胞分离液、CCK-8试剂盒购自武汉博士德生物工程有限公司;RPMI1640培养基、胎牛血清(FBS)购自美国Gibco公司;caspase-3、survivin一抗购自美国Invitrogen公司;PrimeScriptTM RT Master Mix(Perfect Real Time)反转录试剂盒购自日本Takara公司;Trizol、实时荧光定量试剂盒购自美国Promega公司;细胞裂解液、BCA蛋白浓度测定试剂盒、高灵敏度化学发光检测试剂盒购自北京康为世纪生物科技有限公司。
1.2 仪器 倒置显微镜购自日本Nicon公司;Chemi DocTM XRS+化学发光凝胶成像系统购自美国Biorad公司;7300型Real time-PCR扩增仪购自美国ABI公司。
1.3 实验方法
1.3.1 MUTZ-1的培养:MUTZ-1加入含10%FBS的RPMI 1640培养基,于37℃、5%CO2、饱和湿度条件下常规培养MUTZ-1细胞,每2~3天传代1次。
1.3.2 PBMNC的分离、培养及分组:采集健康人清晨空腹静脉血5 ml,肝素抗凝,PBS 1∶1稀释,采用Ficoll密度梯度离心法分离得到PBMNC,加入含10% FBS的RPMI 1640培养基,于37℃、5% CO2、饱和湿度条件下常规培养。细胞分4组:阴性对照组(PBMNC培养基中未加IL-23),3个浓度IL-23组(PBMNC培养基中分别加入2、10、50 ng/ml IL-23),体外诱导72 h,并与MUTZ-1共培养。
1.3.3 MTT实验:将各组MUTZ-1细胞接种于96孔板,调整细胞密度为2×104/ml,每孔200 μl,于第1、3、5、7天每孔加入MTT溶液(5 mg/nl)20 μl,4 h后离心,收集细胞,加入DMSO 150 μl,振荡混匀,在酶标仪570 nm波长处测定光密度值(A570)。
1.3.4 流式细胞术:将4组MUTZ-1细胞接种于24孔板,调整细胞密度为1×105个/孔,于第1、3、5、7天后胰酶消化细胞,PBS洗涤,加入标记荧光素FITC的Annexin V 5 μl,PI染液10 μl室温避光反应5 min,流式细胞仪检测细胞凋亡率。收集MUTZ-1细胞,PBS洗涤,70%乙醇固定24 h,PI染色,流式细胞仪分析细胞周期。
1.3.5 Real time-PCR:Trizol提取细胞总RNA,严格按照试剂盒说明书加样进行逆转录反应,ABI 7300型荧光定量PCR仪扩增。引物序列,由上海生工生物工程技术服务有限公司合成。用所选仪器自带的分析软件计算后得到各样本、各基因扩增的Ct值,以GAPDH为内参照基因,目的基因表达相对值RQ=2-ΔΔCt。见表1。

表1 Real time-PCR引物序列及扩增产物长度
1.3.6 Western-blot:提取细胞总蛋白,半干法电泳转移至聚偏二氟乙烯(PVDF)膜,10%脱脂奶粉封闭 2 h。依次加入特异性一抗和辣根过氧化物酶标记的羊抗鼠IgG,用化学发光法显色、定影。用UVP软件扫描测定蛋白条带IOD值,GAPDH作为内参照,以目的蛋白与GAPDH吸光度值的比值表示目的蛋白相对表达水平。
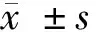
2 结果
2.1 IL-23诱导PBMNC对MUTZ-1细胞增殖的影响 第1天4组比较,差异无统计学意义(P>0.05)。第2~7天,随着IL-23浓度的加大,IL-23组MUTZ-1细胞增殖速度明显降低,其中50 ng/ml IL-23组MUTZ-1细胞增殖速度较10 ng/ml IL-23组降低,后者较2 ng/ml IL-23组降低,3组增殖速度均低于阴性对照组(P<0.05)。见表2。
2.2 IL-23诱导PBMNC对MUTZ-1细胞凋亡的影响 4组第1天比较,差异无统计学意义(P>0.05)。第3~7天,随着IL-23浓度的加大,IL-23组MUTZ-1细胞凋亡率明显增加,其中50 ng/ml IL-23组MUTZ-1细胞凋亡率较10 ng/ml IL-23组增加,后者较2 ng/ml IL-23组增加,3组凋亡率均高于阴性对照组(P<0.05)。见表3。
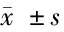
表2 IL-23诱导PBMNC对MUTZ-1细胞增殖的影响
注:与阴性对照组比较,*P<0.05;与2 ng/ml IL-23组比较,#P<0.05;与10 ng/ml IL-23组比较,△P<0.05
2.3 IL-23诱导PBMNC对MUTZ-1细胞周期的影响 4组第1天,G0/G1、S、G2/M比较,差异无统计学意义(P>0.05)。第3~7天,随着IL-23浓度的加大,IL-23组MUTZ-1细胞G0/G1期细胞比例明显增加,其中50 ng/ml IL-23组MUTZ-1细胞G0/G1期细胞比例较10 ng/ml IL-23组增加,后者较2 ng/ml IL-23组增加,3组G0/G1期细胞比例均高于阴性对照组(P<0.05);同时IL-23组MUTZ-1细胞S期细胞比例明显降低,其中50 ng/ml IL-23组MUTZ-1细胞S期细胞比例较10 ng/ml IL-23组降低,后者较2 ng/ml IL-23组降低,3组S期细胞比例均低于阴性对照组(P<0.05);IL-23对G2/M期细胞作用不明显。见表4。
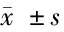
表3 IL-23诱导PBMNC对MUTZ-1细胞凋亡的影响
注:与阴性对照组比较,*P<0.05;与2 ng/ml IL-23组比较,#P<0.05;与10 ng/ml IL-23组比较,△P<0.05
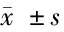
表4 IL-23诱导PBMNC对MUTZ-1细胞周期的影响
注:与阴性对照组比较,*P<0.05;与2 ng/ml IL-23组比较,#P<0.05;与10 ng/ml IL-23组比较,△P<0.05
2.4 IL-23诱导PBMNC对MUTZ-1细胞相关基因表达的影响 随着IL-23浓度的加大,IL-23组Bax、caspase-3 mRNA和蛋白表达明显增加,其中50 ng/ml IL-23组Bax、caspase-3 mRNA和蛋白表达较10 ng/ml IL-23组增加,后者较2 ng/ml IL-23组增加,3组Bax、caspase-3 mRNA和蛋白表达均高于阴性对照组(P<0.05);同时IL-23组Bcl-2、survivin mRNA和蛋白表达明显降低,其中50 ng/ml IL-23组Bcl-2、survivin mRNA和蛋白表达较10 ng/ml IL-23组降低,后者较 2 ng/ml IL-23组降低,3组Bcl-2、survivin mRNA和蛋白表达均低于阴性对照组(P<0.05)。见表5、6。
表5 IL-23诱导PBMNC对MUTZ-1细胞相关基因表达的影响
注:与阴性对照组比较,*P<0.05;与2 ng/ml IL-23组比较,#P<0.05;与10 ng/ml IL-23组比较,△P<0.05
3 讨论
目前,MDS治疗尚缺乏有效手段。对于有明确白血病表征且条件允许的患者,应尽早抑制异常造血克隆并恢复机体正常造血功能。对于病情平稳、没有明确白血病表征的患者,临床治疗应以增加血细胞质/量、改善患者生活质量为主。因此,如何诱导MDS异常造血克隆细胞凋亡并促使机体正常造血功能恢复是治疗MDS的关键。
表6 IL-23诱导PBMNC对MUTZ-1细胞相关基因表达的影响
注:与阴性对照组比较,*P<0.05;与2 ng/ml IL-23组比较,#P<0.05;与10 ng/ml IL-23组比较,△P<0.05
研究显示,MDS早期正常造血克隆和异常造血克隆同时存在,骨髓造血主要表现为过度增殖和过度凋亡,而MDS晚期异常造血克隆占主导地位,骨髓造血主要表现为过度增殖和凋亡抑制[8]。细胞凋亡是由促凋亡基因和凋亡抑制基因共同调控的基本生理过程。促凋亡蛋白和抗凋亡蛋白之间能够形成同源或异源二聚体,其中Bcl-2/Bax比值是影响细胞凋亡进程的关键因素[9,10]。Caspase-3是细胞凋亡进程中最重要的效应分子,细胞在凋亡刺激信号作用下,线粒体释放细胞色素C,后者与胞浆蛋白结合,进而活化caspase-9并促使其释放caspase-3,之后细胞凋亡进入不可逆阶段[11]。研究显示,caspase-3在促进白血病L1210细胞凋亡中发挥重要作用[12]。Survivin是机体发挥抗凋亡作用的重要蛋白,研究显示survivin表达增强与肿瘤发生密切相关[13]。
本研究同样选用2、10、50 ng/ml IL-23体外诱导PBMNC 72 h,并与MUTZ-1共培养,观察PBMNC对MUTZ-1细胞增殖、凋亡、细胞周期及相关基因表达的影响。MTT实验结果显示,随着IL-23浓度加大,MUTZ-1细胞增殖速度明显降低,凋亡率明显增加,与阴性对照组比较差异有统计学意义(P<0.05);且随着培养时间延长,细胞增殖速度逐渐降低,凋亡率逐渐增加,说明不同浓度IL-23诱导PBMNC均能显著抑制MUTZ-1细胞增殖,并促进MUTZ-1细胞凋亡,具有浓度和时效依赖性。另外,我们通过观察不同浓度IL-23诱导PBMNC后对MUTZ-1细胞G0/G1期、S期变化,认为IL-23诱导PBMNC抗MDS的可能机制是使肿瘤细胞G0/G1期发生阻滞,从而抑制了细胞分裂、增殖和分化。我们进一步检测了凋亡相关基因Bax、Bcl-2、caspase-3、survivin表达,结果显示,随着IL-23浓度加大,IL-23组Bax、caspase-3 mRNA和蛋白表达较阴性对照组明显上调,Bcl-2、survivin mRNA和蛋白表达较阴性对照组明显下调,且随着IL-23作用时间延长,Bax、caspase-3 mRNA和蛋白表达逐渐上调,Bcl-2、survivin mRNA和蛋白表达逐渐下调,说明不同浓度IL-23诱导PBMNC后可通过上调Bax、caspase-3表达、下调Bcl-2、survivin表达发挥诱导MUTZ-1细胞凋亡的作用,具有浓度和时效依赖性。
总之,IL-23体外诱导PBMNC能够明显抑制MUTZ-1细胞增殖,促进MUTZ-1细胞凋亡,并使肿瘤细胞周期停滞在G0/G1期,且具有浓度和时效依赖性,其机制可能通过上调Bax、caspase-3表达、下调Bcl-2、survivin表达来发挥作用。本研究对骨髓增生异常综合征的临床治疗具有一定参考价值。
1 Nolte F,Hofmann WK.Molecular mechanisms involved in the progression of myelodysplastic syndrome.Future Oncol,2010,6:445-455.
2 Greenberg PL,Attar E,Bennett JM,et al.NCCN clinical practice guidelines in onclogy:myelodysplastic syndromes.J Natl Compr Canc Netw,2011,9:30-56.
3 Ma XM.Epidemiology of myelodysplastic syndromes.Am J Med,2012,125:S2-S5.
4 Warlick ED,Cioc A,Defor T,et al.Allogenic stem celltransplantation for adultswith myelodysplastic syndromes:importance of pretransplant disease burden.Biol Blood Marrow TRANSPLANT,2009,15:30-38.
5 张诚.小剂量HA方案联合亚砷酸治疗高危骨髓增生异常综合征疗效观察.中华实用诊断与治疗杂志,2014,28:93-94.
6 陈倩倩,黎霏霏.IL-12家族抗肿瘤作用的研究进展.国际检验医学杂志,2014,35:1453-1455.
7 周洁,杨洁,李杰,等.IL-23单独或联合IL-2诱导人外周血单个核细胞对K562细胞杀伤效应的实验研究.中国实验血液学杂志,2013,21: 1137-1131.
8 Barzi A,Sekeres MA.Myelodysplastic syndromes:apractical approach to diagnosis and treatment.Cleve Clin J Med,2010,77:37-44.
9 夏国华,陈宝安,芦慧霞,等.2-甲氧基雌二醇对SKM-1细胞凋亡中 bcl-2/bax 表达的影响.中国老年学杂志,2010,30:3507-3508.
10 孙耘玉,王淑君,陈宝安.藤黄酸对 SKM-1 细胞生长抑制作用及其机制.中国实验血液学杂志,2013,21:105-109.
11 Mazumder S,Plesca D,Almasan A.Caspase-3 activationis a critical determinant of genotoxic stress-induced apoptosis.Methods Mol Biol,2008,414:13-21.
12 晓花,薛天阳,许伟,等.Caspase3在MG-132诱导白血病L1210细胞凋亡过程中的作用.中国小儿血液与肿瘤杂志,2010,15:112-114.
13 Cheung CH,Huang CC,Tsai FY,et al.Survivin-biology and potential as a therapeutic target in oncology.Onco Targets Ther,2013,6:1453-1462.
14 Ford D,Easton DF,Stratton M,et al.Genetic heterogeneity and penetrance analysis of the VRCA1 and BRAC2 genes in brest cancr families.The Breast Cancer Linkage Consortium.Am J Hum Genet,1998,62:676-689.
15 Cugno M,Zanichelli A,Foieni F,et al.C1-inhibitor deficiency and angioedema:molecular mechanisms and clinical progress.Trends Mol Med,2009,15:69-78.
16 Cocco C,Canale S,Frasson C,et al.Interleukin (IL)-23 acts as anti-tumor agent on childhood B-acute lymphoblastic leukemia cells.Blood,2010,116:3887-3898.
17 Shan B,Yu L,Shimozato O,et al.Expression of interleukin-21 and 23 in human esophageal tumors produced antitumor effects in nude mice.Anticancer Res,2004,24:79-82.
18 Hu P,Hu HD,Chen M,et al.Expression of interleukins-23 and 27 leads to successful gene therapy of hepatocellular carcinoma.Mol Immunol,2009,46:1654-1662.
EffectsofPBMNCinducedbyIL-23ontheproliferation,apoptosisandgeneexpressionofMUTZ-1cells
WANGRuicang*,LIUYanfen,YANGJie*,etal.
*DepartmentofHematology,HebeiProvincialPeople’sHospital,Shijiazhuang050051,China
ObjectiveTo observe the effects of peripheral blood mononuclear cell (PBMNCs) induced by IL-23 on the proliferation,apoptosis and gene expression of MUTZ-1 cells-a human myelodysplastic syndrome (MDS) cell line.MethodsThe PBMNCs were isolated by ficoll density gradient centrifugation.The cells were divided into four groups:control group (without IL-23),three different concentration IL-23 groups (2,10,50ng/ml),which were induced in vitro for 72 hours.Then PBMNCs were co-cultured with MUTZ-1 cells.MTT assay was used to detect the proliferation of MUTZ-1 cells.Flow cytometry was used to detect the cell cycle and cell apoptosis.Real time-PCR and Western-blot were used to detect the expression levels of Bax,Bcl-2,caspase-3 and survivin mRNA and protein.ResultsAfter MUTZ-1 cells were co-cultured with PBMNCs induced by 2,10,50ng/ml IL-23,respectively, the cell proliferation rate of MUTZ-1 and cell proportion at phase S were significantly decreased,however, the cell apoptosis rate and cell proportion at phase G0/G1 were significantly increased,with a concentration-dependent and time-dependent manner,as compared with those in control group (P<0.05).Meanwhile,the expression levels of Bax,caspase-3 mRNA and protein were obviously up-regulated,but the expression levels of Bcl-2,survivin mRNA and protein were significantly down-regulated, with a concentration-dependent and time-dependent manner,as compared with those in control group (P<0.05).ConclusionThe PBMNCs induced by IL-23 can inhibit cell proliferation of MUTZ-1 cells and can promote apoptosis of MUTZ-1 cell,and its action mechanism may be correlated with up-regulating the expressions of Bax and caspase-3 and down-regulating the expressions of Bcl-2 and survivin.
IL-23;MUTZ-1 cells; proliferation; apoptosis; gene expression
10.3969/j.issn.1002-7386.2017.18.004
项目来源:河北省医学科学研究重点课题计划(编号:ZD20140444)
050051 石家庄市,河北省人民医院血液科(王瑞仓、杨洁、周洁、李杰、郝洪岭);河北省唐山市人民医院血液科(刘艳芬)
郝洪岭,050051 石家庄市,河北省人民医院血液科;
E-mail:h0707@163.com
R 551.31
A
1002-7386(2017)18-2739-05
2017-02-09)
