山羊肺泡巨噬细胞的分离、培养与鉴定
2017-09-12吉小芳俞慧清岳亮亮徐旭俊陈建泉成国祥刘宗平
吉小芳,俞慧清,岳亮亮,徐旭俊,陈建泉,成国祥,刘宗平
技术方法
山羊肺泡巨噬细胞的分离、培养与鉴定
吉小芳1,2,俞慧清1*,岳亮亮1,3,徐旭俊1,陈建泉1,成国祥1,刘宗平2
巨噬细胞是机体造血系统中可塑性较强的细胞,存在于机体的多个组织中,并且具有强大的功能多样性。巨噬细胞具有吞噬和消化病原体、感染细胞及死亡细胞碎片、募集和调节其他免疫细胞参与炎性反应及帮助组织修复等功能[1,2]。当机体受到抗原刺激时,血液中的单核细胞在趋化因子的引导下,进入抗原侵入的局部组织,进一步分化成各类炎症巨噬细胞。
肺泡巨噬细胞是机体抵抗病原微生物侵袭肺脏的第一道防线,接触到致病因子后,肺泡巨噬细胞伸出伪足将其包围形成封闭小体,与细胞内大的溶酶体融合,达到杀死致病因子的目的。但有一些致病因子在进化过程中,产生了抵御机体免疫的机制,如结核杆菌中的硫酸鸟苷酯可抑制巨噬细胞中吞噬体与溶酶体结合,使结核杆菌在巨噬细胞中长期生存[3]。另一方面,肺泡巨噬细胞还参与特异性免疫[4,5],对抗原进行加工提呈,分泌多种细胞因子调节、启动炎性反应,是研究肺部感染的重要细胞模型。
目前,已有关于小鼠、猪、牛等巨噬细胞分离培养方法的报道[6-9],但关于山羊肺泡巨噬细胞的体外分离培养仍有待充实。本研究旨在前人研究的基础上,结合肺气管灌洗及密度梯度离心,从山羊肺脏中获得高纯度、高活性的肺泡巨噬细胞,为深入研究巨噬细胞的生物特性和抗胞内菌的免疫功能研究奠定基础。
1 材料和方法
1.1 实验动物及试剂
山羊由上海转基因研究中心实验羊牧场提供,本研究方案获得上海转基因研究中心动物伦理委员会批准[No.G2016-05];羊外周血单核细胞分离液、羊巨噬细胞培养基均购自天津市灝洋生物制品科技有限公司;胰酶、小牛血清均购自GIBCO公司;台盼蓝、4%多聚甲醛等均为国产分析纯试剂;鸡红细胞从家鸡静脉取得,与Alseveve液按1∶4比例混合于4度保存备用;瑞氏-姬姆萨复合染液购自上海歌凡生物科技有限公司,荧光标记抗羊CD14抗体(ab186689)购自于Abcam公司;BD FACSCalibur流式细胞仪为美国BD公司产品,流式细胞检测委托上海张江公共服务平台进行。
1.2 实验方法
1.2.1 山羊肺巨噬细胞的分离培养
采取新鲜山羊肺脏,将肺脏提起保持不动,结扎气管,用200 mL无菌PBS通过气管冲洗肺脏内部,每次50 mL,重复4次。冲洗过程中适当轻轻按摩肺叶,使肺巨噬细胞慢慢释放出来,将含巨噬细胞的冲洗液收集到入一个预冷的烧杯中,用双层无菌纱布过滤除去杂质。若滤液混有部分血细胞,再用外周血单核细胞分离液处理滤液,具体步骤可参考分离液说明书。简要地,先向灭菌离心管中依次加入分层试剂A和D,再加入肺泡滤液,使各液面清晰分层,然后离心30 min,小心吸取第二层试剂D层和第三层乳白色细胞层,加入 PBS洗涤两次,收集细胞。
悬浮细胞进行细胞计数,用预热的羊巨噬细胞培养液将细胞浓度调整到0.5×106个/mL,置于6 cm2的组织培养皿中,于5% CO237℃温箱培养。1~2 h后更换培养基,去除未贴壁的淋巴细胞,继续培养。
1.2.2 台盼蓝染色检测细胞存活率
将0.4%的台盼蓝染液与等体积细胞悬液混合,染色2~3 min,取1滴混合悬液于细胞计数器内。镜下观察可见,死细胞被染成淡蓝色,而活细胞拒染,计数蓝染细胞和未蓝染细胞。
1.2.3 肺泡巨噬细胞培养特性观察
细胞培养后,每日用倒置相差显微镜观察细胞形态变化及生长状况。培养四周后,采用姬姆萨染色,进一步观察细胞形态。
1.2.4 吞噬鸡红细胞试验
将分离培养两小时的细胞取一部分进行鸡红细胞吞噬试验,约1×105个细胞悬浮于2 mL培养液中;将5%的鸡红细胞用培养基洗涤两次,加入0.5 mL至巨噬细胞悬液中,混合后将细胞移置培养皿中,置于5% CO237℃温箱孵育;1 h后轻轻吹打,收集细胞。将混合细胞悬液涂片,晾干后采用瑞氏-姬姆萨复合染液染色细胞,具体操作见说明书。染色后细胞置于显微镜下观察,分析细胞吞噬情况。细胞吞噬百分率按以下公式计算: 细胞吞噬率(%)=吞噬细胞/(吞噬细胞+未吞噬细胞)×100%。1.2.5 流式细胞术分析细胞纯度
体外培养四周后,取部分细胞用0.25%的胰酶将巨噬细胞消化下来, 800 rpm离心5 min,用冰冷的PBS洗一次;用1 mL含5% FBS的PBS重悬细胞,冰上孵育10 min,800 rpm/min离心5 min;用 200 μL含5% FBS的PBS重悬1×106个细胞,加入 10 μL 的抗羊CD14抗体,避光孵育1 h。800 rpm离心5 min,去上清,加入1 mL含5% FBS的PBS重悬细胞,再次离心去上清,重复3次,最后一次用200 μL含5% FBS的PBS重悬细胞,实验设经相同方法处理的肺成纤维细胞作对照,流式细胞仪上检测细胞表面CD14表达水平,流式检测委托上海张江公共服务平台进行。
2 结果
2.1 分离细胞的培养与形态观察
分离的细胞经台盼蓝染色,极少数细胞呈蓝染,平均95%以上细胞均未着色,细胞形态饱满,为状态较好的活细胞。铺板后两小时可观察到不规则形的细胞贴满培养皿,同时也有一些圆形的未贴壁细胞浮在上面;更换培养基,洗去未贴壁细胞继续培养,两天后可见细胞有所收缩,体积较小,多数细胞伸出较短伪足,形态变得不规则,折光性较好(图1A);细胞培养一周,细胞体积有所增大,贴壁牢固,伸出的伪足多种多样,呈椭圆形、星形、梭形或不规则形,胞浆丰富(图1B);培养四周后,细胞体积进一步增大,大部分细胞呈煎蛋状,胞质内出现空泡,细胞开始老化(图1C)。
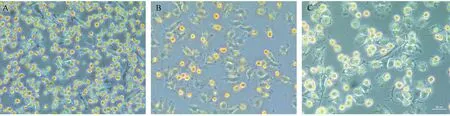
注:(A)经筛选后培养两天的细胞,细胞开始伸出触角;(B)培养一周的细胞,细胞形状多样,贴壁牢固,胞质丰富,伪足突出;(C)培养四周的细胞,呈煎蛋状,胞质内有空泡;(图1A,B,C放大倍数均为×100)。图1 体外培养的肺泡巨噬细胞不同时期形态图(Bar=50 μm)Note.(A)Cells cultured for 2 days, stretched out tentacles;(B)Cells cultured for one week, being morphologically diverse, adherent firmly, cytoplasm rich, and with prominent pseudopodia;(C)Cells cultured for 4 weeks, like an omelette,contain vacuoles.Fig.1 Morphology of alveolar macrophages at different stages
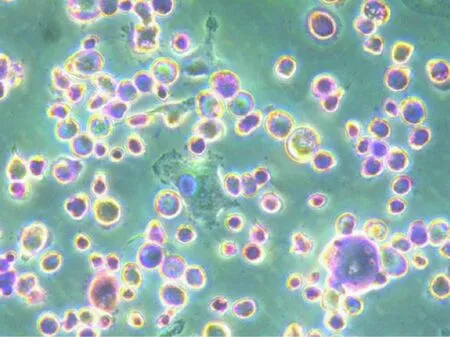
图2 体外培养近一个月的巨噬细胞经姬姆萨染色(×200)Fig.2 Macrophages cultured in vitro for about one month. Giemsa staining.

注:白色箭头所指为正在吞噬多个红细胞的巨噬细胞,灰色箭头所指为鸡红细胞。图3 羊巨噬细胞吞噬鸡红细胞 (瑞氏-姬姆萨复染,×400)Note. The white arrow indicates a macrophage that phagocytosed many red blood cells. The grey arrow refer to chicken red blood cells.Fig.3 Goat macrophages engulfed chicken red blood cells. Wright-Giemsa stained
将体外培养一个月的巨噬细胞在培养皿内进行姬姆萨染色,可见细胞着色较深,大小不一,大部分呈煎蛋状,伪足较短。
2.2 吞噬鸡红细胞试验
将分离培养的细胞进行鸡红细胞吞噬试验,孵育1 h后收集细胞,采用瑞氏-姬姆萨复合染液染色,在油镜下观察。在细胞涂片中可见鸡红细胞的细胞核染成较深的蓝色,胞浆紫红色;羊巨噬细胞整体染成蓝色,细胞较大。巨噬细胞吞噬了一个或多个鸡红细胞,在胞浆中形成吞噬体,鸡红细胞边缘被巨噬细胞溶酶体消化,红细胞核染色较深;有些红细胞附着在巨噬细胞周边,有些已经正在被包裹形成吞噬体(图3)。鸡红细胞吞噬结果表明分离的羊肺泡巨噬细胞具有很强的吞噬作用,计数200个细胞,平均54.5%的巨噬细胞吞噬了或者正在吞噬鸡红细胞。
2.3 流式细胞术分析巨噬细胞纯度
收集体外培养四周的羊巨噬细胞,并以肺成纤维细胞作阴性对照,消化后与荧光标记的抗羊CD14抗体共孵育,在流式细胞仪(BD FACSCalibur)上检测山羊肺泡巨噬细胞CD14表达水平,结果见图4、5。图4所示,收集的山羊肺泡巨噬细胞中有93.7%的细胞表达了CD14;图5所示,收集的对照成纤维细胞中只有0.26%的细胞表达了CD14;M1为荧光标记阴性区间,M2为荧光标记阳性区间。实验表明,本研究经体外培养获得了高纯度的巨噬细胞。
3 讨论
巨噬细胞是机体天然免疫系统的重要组成部分,具有吞噬杀伤、递呈抗原、启动免疫应答及抗肿瘤等功能[10],成功分离肺泡巨噬细胞,对深入了解巨噬细胞如何抵抗病原体研究提供了重要的材料,有助于对疾病的预防与控制。

注:(a)流式细胞收集图;(b)流式结果分析图。图4 肺泡巨噬细胞表面CD14表达情况Note.(a)Flow cytometric map of cell collection;(b)Flow cytometric analysis chart.Fig.4 Expression of CD14 on alveolar macrophages

注:(a)流式细胞收集图;(b)流式结果分析图。图5 肺成纤维细胞表面CD14表达情况(对照)Note.(a)Flow cytometric map of cell collection;(b)Flow cytometric analysis chart.Fig.5 CD14 expression on the surface of lung fibroblasts(Negative control)
巨噬细胞分离过程中常会有血红细胞及成纤维细胞的污染,培养过程中肺成纤维细胞分裂旺盛,生长快,体外培养很容易成为优势细胞,从而抑制巨噬细胞的生长。本研究在用PBS灌注分离肺泡中的巨噬细胞时,增加了巨噬细胞分离液密度梯度离心的步骤,根据巨噬细胞与红细胞及成纤维细胞密度的微小差异,利用单个核细胞分离液进行分离,离心后形成多个液面分层,选择单核细胞层进行贴壁培养,从而去除了血红细胞及肺泡成纤维细胞的污染,成功获得了高纯度的肺泡巨噬细胞。体外培养的巨噬细胞经显微镜下观察,细胞形态丰富多样,有伪足和突起伸出,胞浆丰富,具有典型的巨噬细胞形态特征。
吞噬功能是检验巨噬细胞活力的重要方法之一,张华等[7]向小鼠腹腔注射鸡红细胞,进行巨噬细胞吞噬试验,间隔12 h后收集细胞,发现红细胞吞噬率为26.0%;韩忠燕等[8]将巨噬细胞与鸡红细胞共孵育16 h后收集细胞,发现23.6%的细胞吞噬了鸡红细胞。本研究将分离培养的山羊肺泡巨噬细胞进行鸡红细胞吞噬试验,37℃共孵育1 h后收集细胞,发现巨噬细胞吞噬率为54.5%。本研究结果相比之前报道的效率稍高,可见进行巨噬细胞吞噬试验时,影响吞噬结果的不仅有细胞活性,还有两种细胞共孵育的时间、数量比等。吞噬是一个动态的过程,若两者共孵育时间过长,部分巨噬细胞已经崩解,观察到的吞噬率会偏低;本研究中鸡红细胞量较多,大部分巨噬细胞都吞噬了多个鸡红细胞。
CD14是一种通过糖基磷脂酰肌醇锚定于细胞膜表面的糖蛋白,分布于单核细胞、巨噬细胞膜表面脂质丰富的区域,而在内皮细胞等表面则未发现CD14的存在,目前已被广泛用来鉴定单核巨噬细胞[12,13]。陈玉惠等[9]将牛外周血单核巨噬细胞在体外分化培养后,流式检测其表面CD14的阳性率为62.43%,林炜明等[11]用免疫磁珠法分离外周血单核细胞,CD14的阳性率从分选前的10%提高到85.8%;本研究中分离的山羊肺泡巨噬细胞在体外培养近一个月后,其表面经检测有93.76%的细胞表达CD14,说明培养的巨噬细胞仍具有其固有的免疫学特性,并且纯度极高,无其它细胞污染。
本研究通过PBS灌注法,结合密度梯度离心,成功的从山羊肺脏中分离了高纯度的CD14+肺泡巨噬细胞,肺泡巨噬细胞在体外形态多样,有伪足和突起伸出,呈典型的巨噬细胞特征;分离培养的细胞具有很好的吞噬活性及生物学特性,为巨噬细胞相关的疾病机理的研究提供了材料。
[1] Tan SY, Krasnow MA. Developmental origin of lung macrophage diversity[J]. Development, 2016,143(8):1318-1327.
[2] Wynn TA,Chawla A,Pollard JW.Origins and hallmarks of macrophages: development, homeostasis,and disease[J].Nature,2013,496(7446):445-455.
[3] Mayanja-Kizza H, Johnson JL, Hirsch CS,et al. Macrophage-activating cytokines in human immununo deficiency virus type 1-infected and -uninfected patients with pulmonary tuberculosis[J]. Infect Dis,2001,183(12):1805-1809.
[4] Kim JY, Sohn JH, Choi JM, et al. Alveolar macrophages play a key role in cockroach-induced allergic inflammation via TNF-α pathway[J].PLoS One,2012,7(10):e47971.
[5] Balhara J, Gounni AS. The alveolar macrophages in asthma:a double-edged sword[J].Mucosal Immunol,2012,5(6):605-609.
[6] 张华,曲震,寰王莹,等.小鼠腹腔巨噬细胞的分离培养与吞噬功能测定[J].黑龙江医药科学,2007,30(5):9-10.
[7] 韩忠燕,黄海愉,沈前程,等.水牛肺泡巨噬细胞的分离、培养及鉴定[J].广西农业科学,2010,41(7):719-722.
[8] 杨克礼,田永祥,梁望旺,等.猪肺泡巨噬细胞的分离与原代培养[J].国外畜牧学: 猪与禽,2011,31(4):52-52.
[9] 陈玉惠,周伟光,高晶,等.牛外周血单核细胞的分离培养与鉴定[J].畜牧与饲料科学,2013,34(5):21-22.
[10] Geissmann F, Manz MG, Jung S, et al. Development of monocytes, macrophages, and dendritic cells[J].Science,2010,5327(5966):656-661. [11] 林炜明,戴爱玲,尹会方,等.人外周血巨噬细胞培养及功能鉴定[J].中国免疫学杂志,2015,31:86-89.
[12] Cheng SM, Chang SJ, Tsai TN, et al. Differential expression of distinct surface markers in early endothelial progenitor cells and monocyte-derived macrophages[J].Gene Expr,2013,16(1):15-24.
[13] Erbel C, Rupp G, Helmes CM, et al. An in vitro model to study heterogeneity of human macrophage differentiation and polarization[J].J Vis Exp,2013,12(76):e50332.
(1.上海转基因研究中心,上海 201203; 2.扬州大学兽医学院,扬州 225009; 3.扬州大学生物科学与技术学院,扬州 225009)
目的 建立一种高纯度的肺泡巨噬细胞分离培养方法,为研究巨噬细胞生物学特性,开展细胞内寄生菌存活机理研究提供材料。方法 在无菌环境下以PBS多次灌洗山羊肺脏,收集细胞后,用外周血单核细胞分离液结合密度梯度离心法从混合细胞中分离出羊肺泡巨噬细胞;培养于含10%胎牛血清的细胞培养基中,倒置显微镜下观察细胞形态,并利用其对鸡红细胞的吞噬功能检测细胞活性;采用流式细胞术检测单核巨噬细胞表面特征性标志CD14。结果 获得的贴壁细胞具典型的巨噬细胞形态学特征,有伪足和突起伸出,呈现圆形及不规则形状,胞浆丰富,胞体较大;培养的巨噬细胞54.5%吞噬了鸡红细胞,具有较强的吞噬活性;在体外连续培养近一个月,仍有93.7%的细胞能特异性表达CD14抗原,具有巨噬细胞特异性免疫表型。结论 本研究获得的山羊肺泡巨噬细胞纯度高、生物活性好,为开展细胞内寄生菌的疾病机理研究提供了细胞模型。
山羊;巨噬细胞;分离培养;形态学观察;体外吞噬;流式细胞鉴定
Isolation, culture and identification of goat alveolar macrophages
JI Xiao-fang1,2, YU Hui-qing1*, YUE Liang-liang1,3, XU Xu-jun1, CHEN Jian-quan1, CHENG Guo-xiang1, LIU Zong-ping2
(1.Shanghai Transgenic Research Center,Shanghai 201203, China; 2.College of Veterinary Medicine, Yangzhou University, Yangzhou 225009; 3.College of Biological Science and Technology, Yangzhou University, Yangzhou 225009)
Objective In order to study the biological characteristics of macrophages and provide the materials to study the survival mechanism of intracellular parasites, we conducted this study to establish a high-purity alveolar macrophage isolation and culture method.Methods Goat lungs were lavaged with normal saline in sterile environment several times, and cells were collected and then goat alveolar macrophages were purified by density gradient centrifugation using peripheral blood mononuclear cells (PBMC) solution. The isolated goat alveolar macrophages were cultured in cell culture medium containing 10% fetal bovine serum and cell morphology was observed under an inverted microscope every day,and the phagocytic activity of the cells was detected by chicken red blood cell phagocytosis test. Flow cytometry was used to detect CD14, a characteristic monocyte-macrophage surface marker.Results The adherent cells were characterized by typical macrophage morphology, pseudopodia and protrusions, showing round and irregular shape, rich cytoplasm, and large cell body. Of the cultured macrophages, 54.5% could phagocytize chicken erythrocytes and showed good phagocytic activity. After one month of in vitro culture, 93.7% of the cells were able to express CD14 antigen, which had a macrophage-specific immunophenotype. Conclusions The alveolar macrophages obtained in this study have high purity and good bioactivity, thus provide a cell model for studying the immune mechanism of intracellular parasites.
Goat; Alveolar macrophage; Isolation and culture; Morphology; In vitro phagocytosis; Flow cytometry
国家转基因重点专项(2014ZX0800801B);上海市科技兴农攻关项目(沪农科攻字2014第7-1-12号)。
吉小芳(1990-),女,硕士生,研究方向:转基因动物与生物制药。E-mail: 15205275290@163.com
俞慧清(1974-),副研究员,博士,研究方向:转基因动物与生物制药。E-mail: yhq202@hotmail.com
R-33
A
1671-7856(2017) 08-0075-05
10.3969.j.issn.1671-7856. 2017.08.015
2016-12-12
