尿酸排泄不良型高尿酸血症动物模型的建立
2017-09-12沈桂芹于世家
沈桂芹,于世家
研究报告
尿酸排泄不良型高尿酸血症动物模型的建立
沈桂芹1,于世家2*
尿酸是嘌呤代谢的最终产物,由于人类的尿酸酶基因在进化过程中发生了突变,缺乏尿酸酶,嘌呤代谢最终大部分以尿酸形式排出,这使得人类的血尿酸水平远远高于其他哺乳动物。而实验常用的啮齿类动物,因为具有尿酸酶,可将尿酸降解为尿囊素后排出体外[1]。因此,为了使动物模型与人类的尿酸代谢更加接近,设法消除或抑制尿酸酶的活性就成为了关键。本实验研究选择使用尿酸酶抑制剂与两种常用的抑制尿酸排泄的药物(吡嗪酰胺和乙胺丁醇)分别联合应用,建立尿酸排泄不良型高尿酸血症的大鼠模型,从而优化尿酸排泄不良型高尿酸血症大鼠模型的建立方法,为临床针对高尿酸血症属于尿酸排泄不良型的患者治疗药物的选择及研发提供可靠的、稳定的实验动物模型,也为药物治疗机制的研究奠定基础。
1 材料和方法
1.1 实验动物
SPF级雄性SD大鼠30只,7~8周龄,体重180~220 g,购自辽宁长生生物技术有限公司[SCXK(辽)2010-0001]。大鼠购入后,饲养在辽宁中医药大学实验动物中心[SYXK(辽)2015-0001]。常规颗粒饲料喂养,12 h昼夜节律,自由饮水进食,实验设计及实施过程中严格遵循动物实验的3R原则[2]。
1.2 主要试剂与仪器
1.2.1 试剂
氧嗪酸钾(potassium oxonate,批号:20160625),吡嗪酰胺(pyrazinamide,批号:20160629),均购自北京Solarbio公司;盐酸乙胺丁醇片(ethambutol hydrochloride,批号:1509351)购自沈阳红旗制药有限公司;尿酸(UA)试剂盒(批号:20160606),肌酐(Cr)试剂盒(批号:20160606),尿素氮(BUN)试剂盒(批号:20160518)等均购自南京建成生物技术有限公司。
1.2.2 仪器
美国Thermo Scientific Multiskan MK3型酶标仪,购自赛默飞世尔(上海)仪器有限公司;湘仪GL-21MC高速冷冻离心机,购自湘仪仪器生产公司;Sorvall@Biofuge primoR D-37520 Osterode低温高速离心机,Thermo Electron Corporation生产;德国IKA T10 Basic ULTRA-TURRAX@高速匀浆机 BS25,购自上海悦丰仪器仪表有限公司。
1.3 实验方法
1.3.1 药物配制
将盐酸乙胺丁醇药片压碎,加生理盐水配成混悬液(2.5 g/100 mL)[3]。用0.9%氯化钠注射液加入少量3 mol/L的NaOH[4]调整pH值至7.4~7.6溶解氧嗪酸钾(2 g/100 mL),用0.22 μm孔径微孔滤膜过滤后备用。用0.9%氯化钠注射液加入吡嗪酰胺配置成溶液(1.5 g/100 mL)[5、6]。
1.3.2 动物分组
将30只雄性SD大鼠,适应性喂养一周,然后采用随机数字法将大鼠随机分为三组:正常对照组、模型Ⅰ组、模型Ⅱ组,每组10只大鼠。
1.3.3 干预因素
正常对照组:经口灌胃生理盐水,1 mL/100 g·d-1;腹腔注射生理盐水,1 mL/100 g,一日两次;皮下多点注射生理盐水,1.25 mL/100 g,一日两次。
模型I组:经口灌胃乙胺丁醇混悬液,1 mL/100 g·d-1;腹腔注射生理盐水,1 mL/100 g,一日两次;皮下多点注射氧嗪酸钾溶液,1.25 mL/100 g,一日两次。
模型II组:经口灌胃生理盐水,1 mL/100 g·d-1;腹腔注射吡嗪酰胺溶液,1 mL/100 g,一日两次;皮下多点注射氧嗪酸钾溶液,1.25 mL/100 g,一日两次。
1.3.4 标本采集及处理
分别于造模前、造模第1周、3周、5周上代谢笼,收集24 h尿、便标本。记录总尿量、总便量。然后留取部分标本处理后采用手工法(比色法)[7]检测尿酸含量。同时经球后静脉丛穿刺采血,分离并收集血清,采用手工法(比色法)检测血清中尿酸、肌酐、尿素氮、AST、ALT含量。实验结束后,摘取肝脏及肾脏组织,进行苏木素-伊红染色,观察肝脏、肾脏病理改变。
1.4 统计学方法

2 结果
2.1 造模前、后各组大鼠尿酸含量及尿量比较
造模前各组大鼠尿酸含量及尿量检测结果显示:各组间比较,差异无显著性(P> 0.05)(见图1)。
造模后各组大鼠尿酸含量及尿量检测结果显示:造模第1周时,与空白对照组比较,模型Ⅰ、Ⅱ组大鼠血尿酸水平均明显升高(P< 0.01),模型组间比较差异无显著性(P> 0.05);随着造模时间的延长,模型Ⅰ组血尿酸逐渐下降,且差异有显著性(P< 0.05),而模型Ⅱ组血尿酸一直保持在高水平,各时间点比较差异无显著性(P> 0.05)(详见图1)。
连续给药期间,模型Ⅰ、Ⅱ组大鼠尿液中尿酸浓度出现先升高后降低的变化,但模型Ⅰ组24 h尿量差异无显著性(P> 0.05),24 h尿液中尿酸总量也呈现出先升高后降低的变化;模型Ⅱ组24 h尿量出现了逐渐增加的趋势(P< 0.05),24 h尿液中尿酸总量变化无显著性差异(P> 0.05)(详见图2~4)。
模型Ⅰ组大鼠便尿酸在连续给药第3周和第5周显著高于造模前和造模第1周(P< 0.01),而模型Ⅱ组大鼠各时间点粪便中尿酸含量变化无显著性差异(P> 0.05)(详见图5)。

注:与空白对照组比较,*P < 0.05,**P < 0.01;与模型Ⅰ组比较,#P<0.05, ##P < 0.01;与造模前比较,△△P< 0.01;与造模1周比较,○P< 0.05,○○P < 0.01。图1 各组大鼠血清中尿酸含量测定结果Note. Compared with blank group,*P < 0.05,**P < 0.01; Compared with model groupⅠ,#P<0.05, ##P < 0.01;Compared with before dosing,△△P< 0.01;Compared with dosing for one week,○P< 0.05,○○P < 0.01.Fig.1 Determination of uric acid in serum of rats in each group
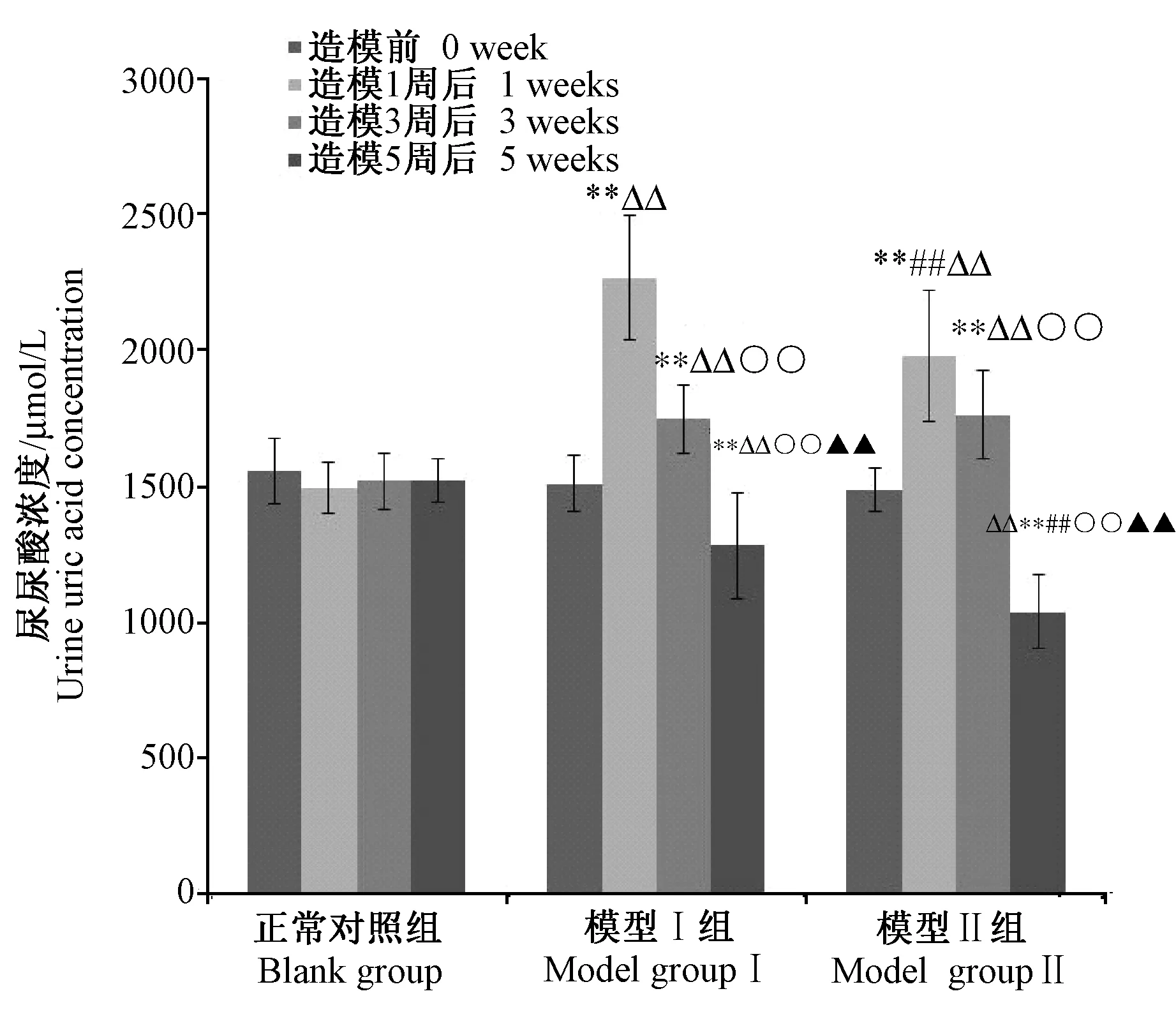
注:与空白对照组比较,**P < 0.01;与模型Ⅰ组比较,##P < 0.01;与造模前比较,△△P< 0.01;与造模1周比较,○○P < 0.01;与造模3周比较,▲▲P < 0.01。图2 各组大鼠尿液中尿酸浓度结果Note. Compared with blank group,**P < 0.01; Compared with model groupⅠ,##P < 0.01;Compared with before dosing,△△P< 0.01;Compared with dosing for one week,○○P < 0.01;Compared with dosing for three weeks,▲▲P < 0.01.Fig.2 The concentration of uric acid in urine of rats in each group
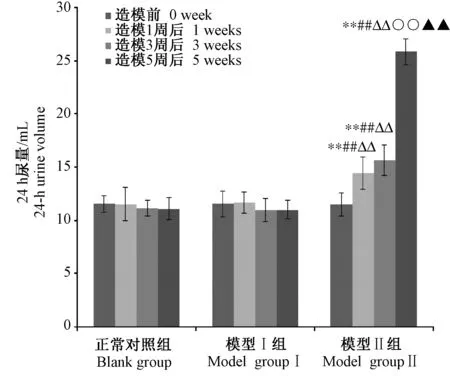
注:与空白对照组比较,**P < 0.01;与模型Ⅰ组比较,##P < 0.01;与造模前比较,△△P< 0.01;与造模1周比较,○○P < 0.01;与造模3周比较,▲▲P < 0.01。图3 各组大鼠24 h尿量Note. Compared with blank group,**P < 0.01; Compared with model groupⅠ,##P < 0.01;Compared with before dosing,△△P< 0.01;Compared with dosing for one week,○○P < 0.01;Compared with dosing for three weeks,▲▲P < 0.01.Fig.3 24 hours urine volume of rats in each group
2.2 造模前、后各组大鼠肝、肾功能检测
造模前后各组大鼠肝、肾功能检测结果显示:各组间比较,差异无显著性(P> 0.05)。
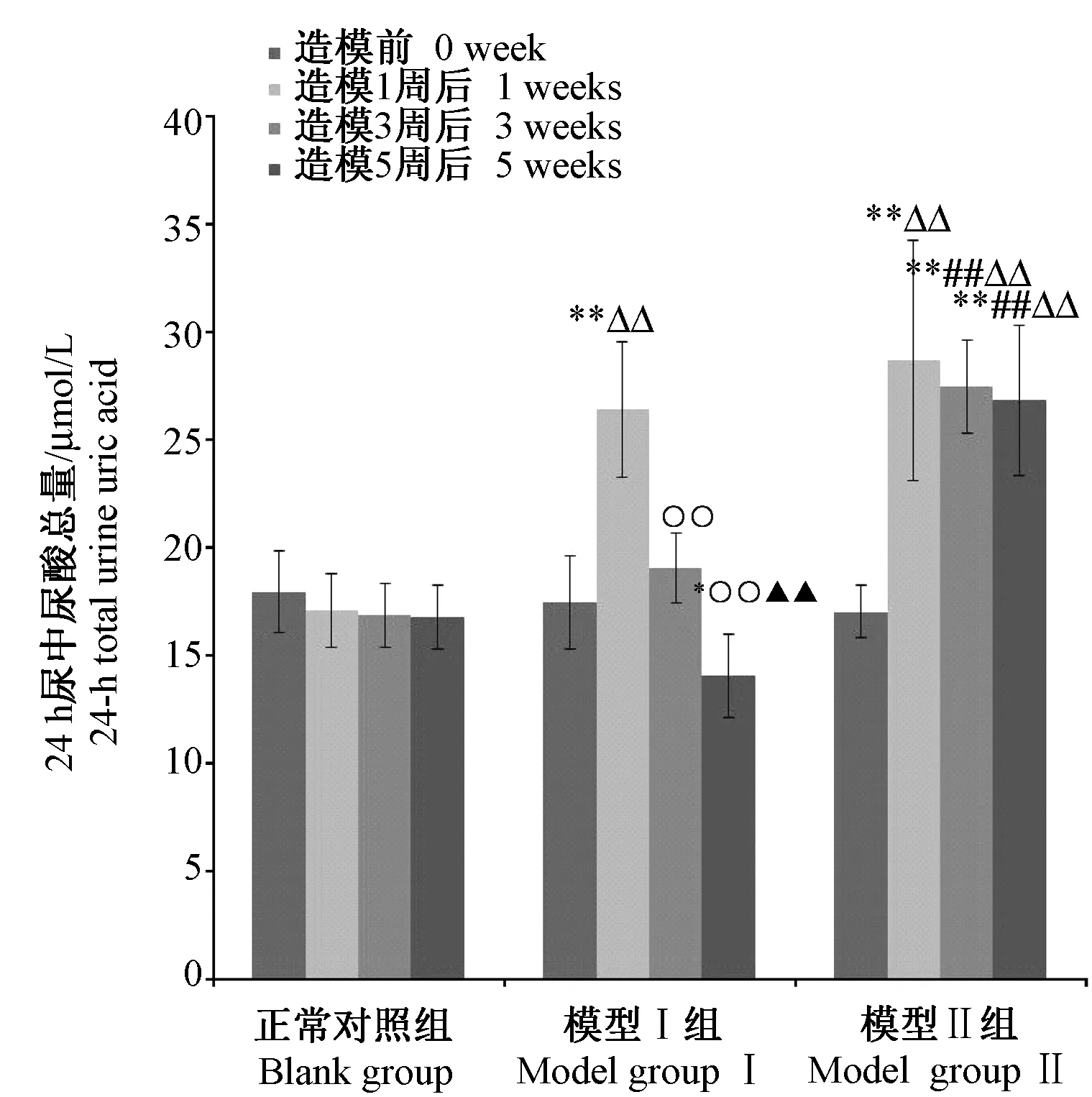
注:与空白对照组比较,*P < 0.05,**P < 0.01;与模型Ⅰ组比较,##P < 0.01;与造模前比较,△P < 0.05,△△P< 0.01;与造模1周比较,○○P < 0.01;与造模3周比较,▲▲P < 0.01。图4 各组大鼠24 h尿液中尿酸总量Note. Compared with blank group,*P < 0.05,**P < 0.01; Compared with model groupⅠ, ##P < 0.01;Compared with before dosing,△P < 0.05,△△P< 0.01;Compared with dosing for one week,○○P < 0.01;Compared with dosing for three weeks,▲▲P < 0.01.Fig.4 24-h total urine uric acid in the rats
,
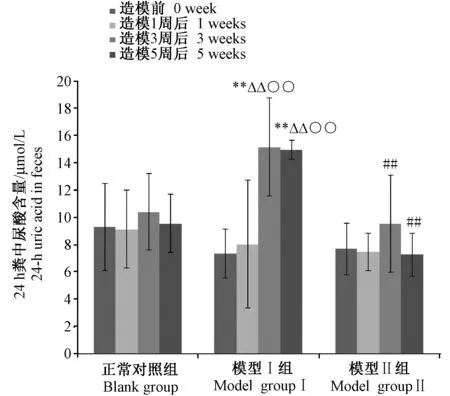
注:与空白对照组比较,**P < 0.01;与模型Ⅰ组比较,##P < 0.01;与造模前比较,△△P< 0.01;与造模1周比较,○○P < 0.01。图5 各组大鼠24 h粪便中尿酸含量检测结果Note. Compared with blank group,**P < 0.01; Compared with modelⅠgroup,##P < 0.01;Compared with before dosing,△△P< 0.01;Compared with dosing for one week,○○P < 0.01.Fig.5 Detection of 24-h uric acid of the rats excreted in feces
2.3 肝、肾组织病理改变
与正常对照组比较,模型Ⅰ组及模型Ⅱ组大鼠肝脏组织病理均未见明显病理变化,无肝细胞肿胀、嗜酸性变或坏死汇管区未见炎症反应,肝血窦间隙正常,模型Ⅰ组偶见脂质颗粒沉积,见图6。同时肾脏组织病理显示肾单位结构较完整,肾小管结构清晰,管腔规则,未见扩张及坏死。模型Ⅰ组偶见个别上皮细胞水肿,胞浆淡染,均未见炎症细胞,见图7。
3 讨论
临床上根据血尿酸水平和尿液中尿酸排泄情况,将高尿酸血症分为[8]尿酸排泄不良型、尿酸生成过多型和混合型。而临床研究结果显示,90%左右的原发性高尿酸血症属于尿酸排泄不良型[9,10]。因此,笔者从临床疾病分型出发,设计建立尿酸排泄不良型高尿酸血症动物模型。在以往研究中,氧嗪酸钾的剂量从50 mg/kg[11]到600 mg/kg[12]均可成功建模,而皮下注射的给药方式[13]可以使血尿酸升高后持续更长时间,因此结合预实验结果,本研究选择皮下注射氧嗪酸钾300 mg/kg的给药方法。而腹腔注射吡嗪酰胺的剂量则主要根据成人用量[5]换算折合成大鼠用量[6]300 mg/kg的剂量。参考以往相关文献[14],确定灌胃给予乙胺丁醇混悬液250 mg/kg的剂量。
应用氧嗪酸钾+吡嗪酰胺连续给药一周可以成功建模。其中血尿酸、24 h尿尿酸总量显著升高,并且在整个实验过程中一直保持在同一高水平,而便尿酸总量、肝功能、肾功能在实验过程中没有明显变化,说明此方法建立的高尿酸血症模型血尿酸平稳,肾脏排泄尿酸量恒定,对肠道排泄尿酸几乎没有影响,对肝脏及肾脏在短时间内没有损害。无论从尿酸代谢还是高尿酸血症的形成机制上,此方法建立的高尿酸血症动物模型与人类更加接近,是更为理想的尿酸排泄不良型高尿酸血症大鼠模型的复制方法。
[1] Wu XW,Muzny DM,Lee CC,et al.Two independent mutational events in the loss of urate oxidase during hominoid evolution [J].J Mol Evol,1992,34(1):78-84.
[2] 瞿叶清, 哈惠馨, 郭玉琴,等. 3R原则在医学动物实验工作中的应用[J]. 实验动物科学, 2010, 27(6):84-85.
[3] 施琬,黄惠珠,李钟,等.建立高尿酸血症动物模型实验研究[J].新中医,2015,47(6):273-276.
[4] 王凯.高尿酸血症的代谢组学研究及尿酸性肾损伤动物模型的构建[D].上海应用技术学院,2016.
[5] 孟昭亨.痛风[M].北京,北京医科大学中国协和医科大学联合出版社,1997,17.
[6] 施心献.现代医学实验动物学[M].北京:人民军医出版社,2000,332-335.
[7] 王玲, 李群. 冠心病患者肠道菌群分布及其与尿酸代谢的关系分析[J]. 现代消化及介入诊疗, 2012, 17(6):327-330.
[8] 中华医学会内分泌学分会.高尿酸血症和痛风治疗中国专家共识[Z].中华医学会第十二次全国内分泌学学术会议,2013.
[9] 中国医师协会心血管内科医师分会,中国医师协会循证医学专业委员会.无症状高尿酸血症合并心血管疾病诊治建议专家共识[J].中国全科医学,2010,13(4):1145-1149。
[10] Dincer HE, Dincer AP, Levinson DJ. Asymptomatic hyperuricemia: to treat or not to treat[J]. Cleveland Clin J Med, 2002, 69(8):594, 597, 600.
[11] 徐立, 时乐. 小鼠代谢性高尿酸血症模型的复制方法初探[J]. 中国比较医学杂志, 2006, 16(1):1-4.
[12] 马通军.大鼠高尿酸血症模型的建立与降尿酸中药的筛选[D].天津医科大学,2003.
[13] 徐立, 时乐, 仲文欣. 尿酸酶抑制剂在大鼠急性高尿酸血症模型复制中的应用[J]. 中国比较医学杂志, 2007, 19(3):2349-2350.
[14] 熊湘明, 曲竹秋, 贾锡莲. 大鼠高尿酸血症肾损害模型的建立[J]. 中国比较医学杂志, 2005, 15(4):206-209.
(1.辽宁中医药大学,沈阳 110032; 2.辽宁中医药大学附属医院,沈阳 110032)
目的 探讨构建尿酸排泄不良型高尿酸血症大鼠模型的可靠方法,为尿酸排泄不良型高尿酸血症发病机制的研究及治疗方案的优化奠定基础。方法 采用氧嗪酸钾(300 mg/kg)分别与吡嗪酰胺(300 mg/kg)、乙胺丁醇(250 mg/kg)联合造模。连续给药1周、3周、5周,检测大鼠血、尿、便中尿酸水平,同时检测肝、肾功能,并进行组织学病理切片观察。结果 氧嗪酸钾与乙胺丁醇联合造模组大鼠血尿酸出现先升高后降低的现象,而氧嗪酸钾与吡嗪酰胺联合造模组在连续给药期间血尿酸和尿液中尿酸升高平稳。两种方法对肝脏、肾脏均无明显损害。结论 氧嗪酸钾与吡嗪酰胺联合能有效建立尿酸排泄不良型高尿酸血症大鼠模型,且模型稳定性好,其发病过程更符合临床尿酸排泄不良型高尿酸血症的病程。
高尿酸血症;氧嗪酸钾;吡嗪酰胺;乙胺丁醇;大鼠动物模型
Establishment of a rat model of hyperuricemia associated with uric acid
excretion disorder
SHEN Gui-qin1, YU Shi-jia2*
(1.Liaoning University of Traditional Chinese Medicine,Shenyang 110032,China; 2.Affiliate Hospital of Liaoning University of Traditional Chinese Medicine,Shenyang 110032)
Objective To explore a reliable method to establish a rat model of hyperuricemia associated with abnormal uric acid excretion, and to lay the foundation for the study of pathogenesis of uric acid excretion disorder and the optimization of the treatment plan. Methods The models were established respectively by potasium oxonate(300 mg/kg) with pyrazinamide (300 mg/kg) or ethambutol(250 mg/kg). Continuous dosing for 1, 3 and 5 weeks, to determine the content of uric acid in rat blood, urine, and stool, the function of liver and kidney was detected and pathological examination was performed. Results The blood uric acid in the potasium oxonate and ethambutol group was increased first and then decreased, while in the potasium oxonate and pyrazinamide group were increased steadily and the excretion of uric acid in urine was stable during the continuous administration. The two methods showed no harmful effect on the liver and kidney function. Conclusions A stable rat model of hyperuricemia associated with uric acid excretion disorder can be effectively established by potassium oxonate and pyrazinamide, exhibiting similar manifestations of clinical hyperuricemia and uric acid excretion disorder.
Hyperuricemia; Potassium oxonate; Pyrazinamide; Ethambutol; Rat model
辽宁省卫计委资助项目(LNCCC-D54-2015);沈阳市科技计划项目(F15-139-9-39)。
沈桂芹(1981-),女,主治医师,博士研究生,研究方向:内分泌相关疾病中西医治疗。E-mail: 108172067@qq.com
于世家(1957-),男,主任医师,博士生导师,研究方向:内分泌相关疾病中西医治疗。E-mail: lnsgq2010@163.com
R-33
A
1671-7856(2017) 08-0055-05
10.3969.j.issn.1671-7856. 2017.08.011
2016-11-28
