类风湿关节炎复合高血压疾病模型的建立及评价
2017-09-12严尚学
张 影,周 月,严尚学,魏 伟
研究报告
类风湿关节炎复合高血压疾病模型的建立及评价
张 影,周 月,严尚学*,魏 伟
类风湿关节炎(rheumatiod arthritis, RA)是一种常见的系统性自身免疫病,以对称性关节肿胀、疼痛、炎症细胞浸润、滑膜衬里层细胞增生为主要病理特征,多数患者伴有骨与软骨破坏,并最终导致残疾[1]。中国每年发病人数高达500万,发病率约为0.32%~ 0.36%,有200余万人致残[2]。
研究表明,RA患者的血管内皮功能异常、动脉硬化程度和动脉粥样硬化斑块数量明显增加[3,4],其高血压(hypertension, HT)发生率比一般人群高达30%[5];RA伴发高血压患者的心血管器官损伤(如左心室异常、舒张功能不全、系统性动脉顺应性降低)发生率也比非高血压RA患者的发生率显著升高[6,7],这些研究提示了RA既可导致心血管疾病的发生发展,同时,高血压也成为增加RA患者心血管疾病发生率与死亡率的主要风险因素。HT与RA相互交叉影响,探索其防治措施及其病理机制成为目前的研究热点。
佐剂性关节炎(adjuvant arthritis, AA)模型动物在临床表现、病理学、免疫学改变等方面与人RA有许多相似特征,是研究RA病理机制和筛选评价治疗RA药物的理想动物模型[8]。两肾一夹(two kidney one clip, 2K1C)高血压模型是一种模拟人类肾性高血压的经典动物模型[9]。在本研究中,我们首次将这两个动物模型建成类风湿关节炎复合高血压疾病(arthritis-hypertension disease, AHD)模型,并探索AHD模型的病理特点,以期更好地研究RA与HT之间的相互影响及病理机制。
1 材料和方法
1.1 实验动物及分组
SPF级雄性SD大鼠,40只,体重(160±10)g,5~6周龄,购置并饲养于安徽医科大学实验动物中心[SCXK(皖)2011-002][SYXK(皖)2011-007]。40只SD大鼠随机分为正常组8只、AA组10只、高血压(HT)组10只、AHD组12只。本实验符合动物伦理和福利要求,实验方案按照“3R”原则得到本单位实验动物伦理委员会批准。
1.2 主要试剂与仪器
卡介苗,购自成都生物制品研究所有限公司;YLS-7B型足趾容积测量仪,创博环球生物科技有限公司产品;ALC-NIBP型无创血压测量分析系统,上海奥尔科特生物科技有限公司产品。
1.3 实验方法
1.3.1 AA大鼠模型的建立[10]
卡介苗80℃水浴恒温灭活1 h,与灭菌的液体石蜡充分研磨成浓度为10 mg/mL完全弗氏佐剂,于大鼠左后足跖注射0.1 mL致炎。
1.3.2 高血压大鼠模型的建立[11]
采用手术法建立2K1C高血压大鼠模型。大鼠术前禁食过夜,自由饮水。3%戊巴比妥钠溶液按0.2 mL/100 g体重腹腔注射麻醉大鼠,外科手术暴露出左肾动脉,用内径为0.25 mm银夹将左肾动脉缩窄,缝合皮肤,术后肌肉注射青霉素抗感染治疗3 d。
1.3.3 AHD模型的建立
在建立2K1C高血压大鼠模型的基础上,同时于大鼠左后足跖注射0.1 mL完全弗氏佐剂致炎建立模型。
1.3.4 炎症指标测定、关节炎指数、致炎率的测定
关节肿胀度测定:致炎前用足爪容积测量仪测量大鼠足爪(非致炎侧)容积,炎症出现后,每隔3 d测一次足爪容积,关节肿胀度(mL)=|致炎后足爪容积-致炎前足爪容积|[12]。
关节炎指数评分:炎症出现后,每隔3 d进行关节炎指数评分,观察每组大鼠的继发病变。关节炎指数评分标准:0=正常;1=踝关节出现红斑和轻微肿胀;2=踝关节到跖关节或掌关节红斑和轻微肿胀;3=踝关节到跖趾关节或掌关节出现红斑和中度肿胀;4=踝关节到趾关节出现红斑和重度肿胀。每只大鼠最多评16分[12]。
致炎率计算:每组大鼠非致炎侧出现红肿的百分率,致炎率(%)=每组炎症大鼠数量 / 每组动物总数量×100%。
1.3.5 高血压判定标准
造模前用血压测量仪测量尾动脉压6次,取平均值作为基线压,造模后每周测量一次。血压高于基线20 mmHg且高于140 mmHg被认为2K1C高血压模型成功[11]。
1.3.6 病理学检查
第35天处死大鼠,取大鼠胸主动脉、踝关节和脾脏组织,10%福尔马林固定、HE染色镜检。在镜下用cellSens Entry软件测量胸主动脉的中膜厚度、横切面积和管腔直径[13];观察大鼠踝关节中滑膜细胞增殖、细胞浸润、血管翳生成及骨与软骨破坏等病理变化;以及脾脏生发中心数量、淋巴细胞浸润、白髓增生、红髓浸润的病理改变[14]。
1.4 统计学方法
2 结果
2.1 AHD模型关节肿胀度、关节炎指数、致炎率和血压值的变化情况
AA、AHD组大鼠免疫后第11天,右后足趾开始肿胀,随着病程延长,关节肿胀度和关节炎指数逐渐升高,第20~23天关节炎指数处于较高水平,第27天后,关节炎指数开始降低,但关节肿胀仍维持较高水平。与AA组比较,AHD模型大鼠关节肿胀度、关节炎指数明显升高(详见图1A、B)。与AA组相比,AHD模型大鼠炎症发病率有升高趋势(详见图1C)。手术法造模后第2周,HT模型及AHD模型大鼠血压开始升高,随着病程延长,血压值逐渐升高且第4周达到平稳值,与HT组相比,AHD模型大鼠血压值明显升高(详见图1D)。筛选成模大鼠后各组只数:正常组8只,AA组7只,HT组9只,AHD组10只。
2.2 AHD模型大鼠胸主动脉结构变化情况
如图2所示,与正常组相比,HT、AHD模型大鼠血管中膜厚度、横截面积明显增加,管腔直径明显降低;与HT组大鼠相比,AHD模型大鼠血管中膜厚度、横截面积明显增加,管腔直径明显降低,提示HT、AHD模型大鼠出现胸主动脉血管重构,AA炎症可加重2K1C引起的高血压大鼠血管损伤。
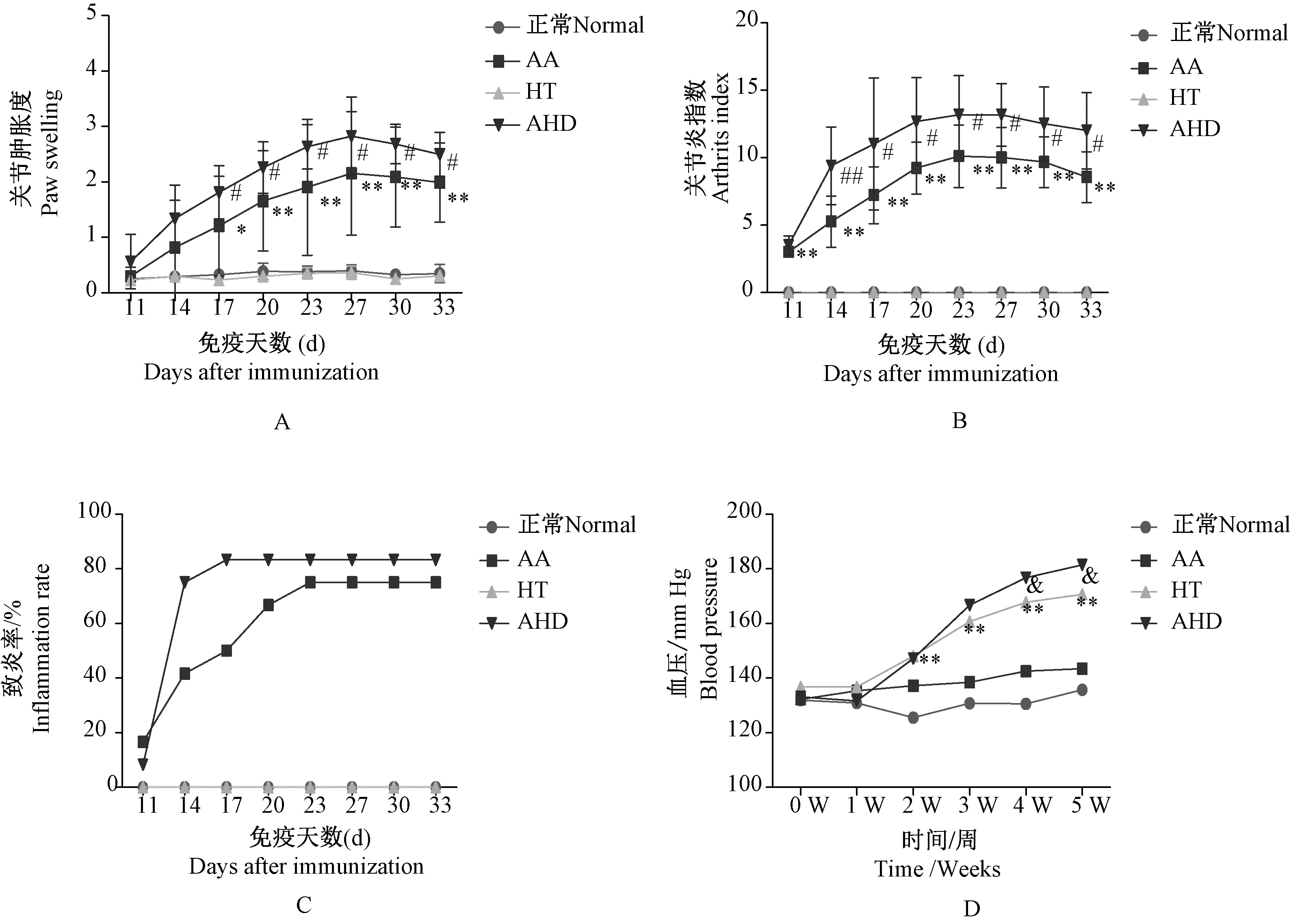
注:与正常组比较,*P < 0.05,**P < 0.01;与AA组比较,#P < 0.05,##P < 0.01;与HT组比较,&P < 0.05。图1 AHD模型足爪肿胀、关节炎指数、致炎率和血压值的变化情况Note.Compared with the normal group,*P < 0.05,**P < 0.01; Compared with the AA group,#P < 0.05,##P < 0.01; Compared with the HT group,&P < 0.05.Fig.1 Changes of paw swelling, arthritis index, the incidence of inflammation and blood pressure of AHD model rats
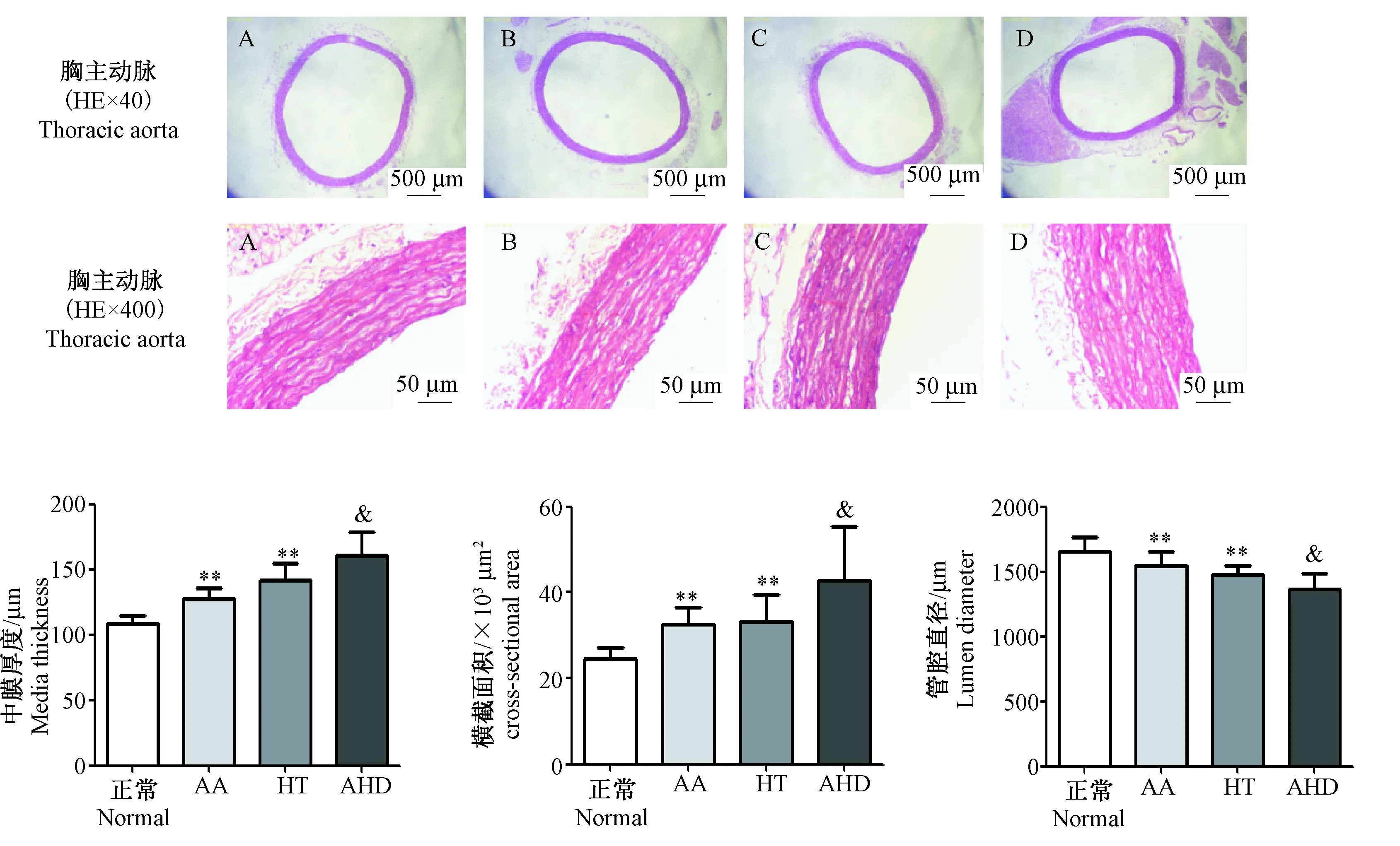
注:A:正常组;B:AA组;C:HT组;D:AHD组。与正常组比较,**P < 0.01;与HT组比较,&P < 0.05。图2 AHD模型大鼠胸主动脉结构变化情况Note.A:Normal group; B:AA group; C:HT group; D: AHD group. Compared with the normal group,**P< 0.01; Compared with the HT group,&P< 0.05.Fig.2 Structural changes of thoracic aorta in the AHD model rats
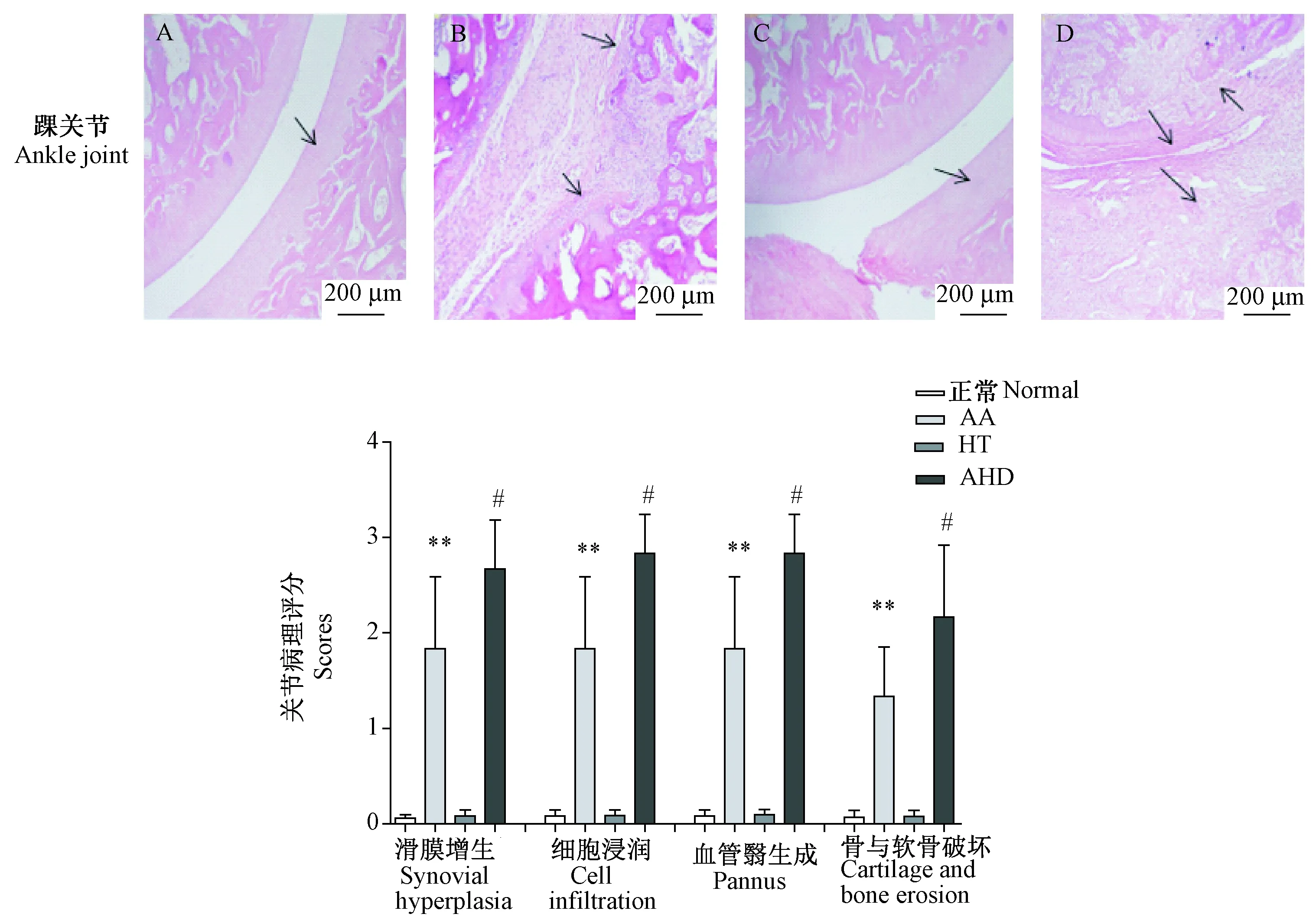
注:A:正常组;B:AA组;C:HT组;D:AHD组。A、C:箭头指正常关节腔及正常软骨表面;B:箭头指软骨被严重破坏,关节腔大量炎症细胞增生、浸润;D:箭头指关节腔有大量细胞浸润、血管翳生成、骨与软骨被破坏;与正常组比较,**P < 0.01;与AA组相比,#P < 0.05。图3 AHD模型大鼠关节病理变化情况Note.A:Normal group; B:AA group; C:HT group; D: AHD group. A, C: Arrows point to normal articular and normal cartilage surfaces; B: Arrows point to the cartilage was severely damaged, a large number of inflammatory cell were present, infiltrating the joint cavity; D:Arrows point to the joint cavity showing a large number of cell infiltration, pannus formation, and bone and cartilage destruction. Compared with the normal group,**P < 0.01; Compared with the AA group,#P < 0.05.Fig.3 Pathological changes of the joints in AHD model rats

注:A:正常组;B:AA组;C:HT组;D:AHD组。W:白髓;R:红髓;L:淋巴滤泡;GC:生发中心。与正常组相比,**P < 0.01;与AA组相比,#P < 0.05。图4 AHD模型大鼠脾脏病理变化情况Note.A:Normal group; B:AA group; C:HT group; D: AHD group. W:White pulp; R:Red pulp; L:Lymphoid follicles; GC: Germinal centers. Compared with the normal group,**P < 0.01; Compared with the AA group,#P < 0.05.Fig.4 Pathological changes of spleen in the AHD model rats
2.3 AHD模型大鼠关节病理变化情况
关节病理检查结果表明(图3),与正常组相比,AA、AHD大鼠关节明显肿胀,关节腔大量滑膜细胞增生、炎症细胞浸润、血管翳生成、骨与软骨被破坏。与AA大鼠相比,AHD模型大鼠关节病理评分明显升高。正常组和HT组大鼠关节组织无明显病理改变。提示,AA、AHD大鼠出现了明显的关节炎症,且2K1C引起的高血压可加重关节炎症病理改变。
2.4 AHD模型大鼠脾脏病理变化情况
脾脏组织病理检查结果显示(图4),与正常组相比,AA、AHD大鼠脾脏组织生发中心数量增加、大量淋巴细胞浸润、白髓弥漫性增生、红髓浸润。与AA组相比,AHD模型大鼠脾脏组织病理评分明显升高。正常组和HT组动物脾脏组织无明显病理改变。提示,AA、AHD大鼠具有明显的脾脏病理变化,2K1C引起的高血压可加重AA大鼠的脾脏病理改变。
3 讨论
大量临床研究表明[6,7,15-17],RA患者的心血管功能发生了异常改变,而高血压等心血管疾病则是导致RA患者死亡的最重要因素之一,RA与HT二者互相影响加重了病情发展,建立AHD疾病模型对研究二类疾病关联的发病机制以及筛选和研究治疗药物作用具有重要意义。有报道阐述了RA与HT二类疾病之间的相互作用机制,表明炎症条件下升高的C-反应蛋白(CRP)水平减少内皮细胞一氧化氮(NO)、增加内皮素-1的产生,引起血管收缩、血压升高;而升高的血压导致粘附分子、促炎因子的表达并进入循环系统,升高CRP的水平,诱发炎症反应[18]。
在本研究中,AHD模型大鼠血压明显升高,关节肿胀,关节肿胀指数、关节病理、主动脉血管损伤、脾脏病理变化明显,且模型大鼠的血清中血管紧张素Ⅱ、肿瘤坏死因子α等炎症介质水平显著升高(结果未附),具有RA和高血压动物模型的典型特征,提示AHD模型成功建立。
AA模型是经典的RA动物模型[10,19],造模第11天右后非致炎侧足爪开始肿胀,第20天关节炎指数处于较高水平,第23天关节肿胀处于较高水平,第27天后关节肿胀开始缓解但仍维持较高水平,关节炎指数开始降低。手术法诱导的2K1C高血压模型大鼠[20,21]在造模第2周血压开始升高,第4~5周血压可达稳定值,第7~8周后血压逐渐下降。因此,AHD大鼠的模型症状评价以造模第27~35天为宜。
本研究还初步观察了RA和HT对各自疾病模型的影响。实验结果表明,与AA大鼠相比,AHD模型大鼠足爪肿胀度、关节肿胀指数明显升高且关节炎发病病程早、发病率高,脾脏病理评分也明显升高,提示高血压可能加速了RA的炎症进程;与HT组大鼠相比,AHD模型大鼠血压值明显升高,胸主动脉的中膜厚度、横截面积明显增加,管腔直径明显降低,提示RA的炎症过程加重了HT模型大鼠的血管损伤,导致血压进一步升高。
综上,AHD模型症状明显,操作简单,是研究RA与高血压的疾病病理机制、筛选治疗药物的理想动物模型。
[1] Wei F, Xu S, Jia X, et al. BAFF and its receptors involved in the inflammation progress in adjuvant induced arthritis rats[J].Int Immunopharmacol, 2016, 31:1-8.
[2] Essouma M, Noubiap JJ. Is air pollution a risk factor for rheumatoid arthritis?[J]. J Inflamm (Lond), 2015, 12:48.[3] Stamatelopoulos KS, Kitas GD, Papamichael CM, et al. Atherosclerosis in rheumatoid arthritis versus diabetes: a comparative study[J]. Arterioscler Thromb Vasc Biol, 2009, 29(10):1702-1708.
[4] Södergren A, Karp K, Boman K, et al. Atherosclerosis in early rheumatoid arthritis: very early endothelial activation and rapid progression of intima media thickness[J]. Arthritis Res Ther, 2010, 12(4):R158.
[5] Han C, Robinson DW Jr, Hackett MV, et al. Cardiovascular disease and risk factors in patients with rheumatoid arthritis, psoriatic arthritis, and ankylosing spondylitis[J]. J Rheumatol, 2006, 33(11):2167-2172.
[6] Midtbø H, Gerdts E, Kvien TK, et al. The association of hypertension with asymptomatic cardiovascular organ damage in rheumatoid arthritis[J].Blood Press, 2016, 25(5):298-304.
[7] Rudominer RL, Roman MJ, Devereux RB, et al. Independent association of rheumatoid arthritis with increased left ventricular mass but not with reduced ejection fraction[J]. Arthritis Rheum, 2009, 60(1):22-29.
[8] 宋珊珊,张玲玲,魏伟.实验性关节炎动物模型建立及病理机制研究进展[J].中国药理学通报, 2011, 27(12): 1648-1652.
[9] Cervenka L, Vaněková I, MalJ, et al. Genetic inactivation of the B2 receptor in mice worsens two-kidney, one-clip hypertension: role of NO and the AT2 receptor[J]. J Hypertens, 2003, 21(8):1531-1538.[10] Wang D, Hu S, Wei Wet al. AngiotensinⅡ type 2 receptor correlates with therapeutic effects of losartan in rats with adjuvant-induced arthritis[J]. J Cell Mol Med, 2013, 17(12):1577-1587.
[11] 王文靖, 潘毅, 杨涛. 两肾一夹型高血压大鼠模型的改良及评价[J].中国实验方剂学杂志, 2012, 18(1): 203-205.
[12] 李培培, 解国雄, 宋珊珊, 等. 大鼠佐剂性关节炎模型表现特征及评价指标[J].中国新药杂志, 2012, 28(5): 453-457.
[13] Huang LL, Pan C, Wang L, et al. Protective effects of grape seed proanthocyanidins on cardiovascular remodeling in DOCA-salt hypertension rats[J]. J Nutr Biochem, 2015, 26(8): 841-849.
[14] Zhang L,Li P,Song S,et al. Comparative efficacy of TACI-Ig with TNF-alpha inhibitor and methotrexate in DBA/1 mice with collagen-induced arthritis[J]. Eur J Pharmacol,2013, 708(1-3):113-123.
[15] Sandoo A, Kitas GD, Carroll D, et al. The role of inflammation and cardiovascular disease risk on microvascular and macrovascular endothelial function in patients with rheumatoid arthritis: a cross-sectional and longitudinal study[J].Arthritis Res Ther, 2012, 14(3):R117.
[16] Ikdahl E, Rollefstad S, Hisdal J, et al. Sustained improvement of arterial stiffness and blood pressure after long-term rosuvastatin treatment in patients with inflammatory joint diseases: results from the RORA-AS Study[J]. PLoS One, 2016, 11(4): e0153440.[17] Amaya-Amaya J, Montoya-Sánchez L, Rojas-Villarraga A. Cardiovascular involvement in autoimmune diseases[J]. Biomed Res Int, 2014,(3):367359.
[18] Panoulas VF, Metsios GS, Pace AV, et al. Hypertension in rheumatoid arthritis[J]. Rheumatology (Oxford), 2008, 47(9):1286-1298.
[19] Chang Y, Jia X, Wei W, et al. CP-25, a novel compound, protects against autoimmune arthritis by modulating immune mediators of inflammation and bone damage[J]. Sci Rep, 2016,6:26239.
[20] Yu TT, Guo K, Chen HC, et al. Effects of traditional Chinese medicine Xin-Ji-Er-Kang formula on 2K1C hypertensive rats: role of oxidative stress and endothelial dysfunction[J]. BMC Complement Altern Med, 2013,13:173.
[21] Maia RC,Sousa LE,Santos RA, et al. Time-course effects of aerobic exercise training on cardiovascular and renal parameters in 2K1C renovascular hypertensive rats[J]. Braz J Med Biol Res, 2015, 48(11):1010-1022.
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,安徽省抗炎免疫药物协同创新中心,合肥 230032)
目的 建立类风湿关节炎复合高血压疾病(arthritis-hypertension disease, AHD)大鼠模型,并对该模型的特点进行评价。方法 实施外科手术用0.25 mm银夹缩窄大鼠左肾动脉建立高血压(hypertension, HT)模型,同时于大鼠左后足跖注射0.1 mL完全弗氏佐剂致炎建立AHD模型。无创血压测量分析系统测量尾动脉压。足爪容积测量仪测量大鼠非致炎侧关节肿胀度,并分析关节炎指数与炎症发生率。第35天处死大鼠,收集胸主动脉、踝关节及脾脏组织HE染色并进行病理学检查。结果 AHD模型大鼠关节明显肿胀,关节腔大量滑膜细胞增生、炎症细胞浸润、血管翳形成,脾脏生发中心数量增加、大量淋巴细胞浸润、白髓弥漫性增生、红髓浸润。关节炎指数、炎症发生率以及关节、脾脏组织病理评分较佐剂性关节炎(adjuvant arthritis, AA)大鼠明显升高;同时,AHD模型大鼠血压显著升高,胸主动脉中膜厚度、横截面积明显增加,管腔直径明显降低,且其血压值和血管损伤程度较HT大鼠明显升高或加重。结论 用完全弗氏佐剂足跖皮内注射法合并外科手术缩窄左肾动脉法可成功建立大鼠AHD模型。
类风湿关节炎复合高血压;佐剂性关节炎;高血压
Establishment and evaluation of a rat model of arthritis-hypertension disease
ZHANG Ying, ZHOU Yue, YAN Shang-xue*, WEI Wei
(Institute of Clinical Pharmacology, Anhui Medical University, Key Laboratory of Anti- inflammatory and Immune Medicine, Ministry of Education, Anhui Collaborative Innovation Center ofAnti-inflammatory and Immune Medicine, Hefei 230032, China)
Objective To establish and evaluate a rat model presenting symptoms of arthritis-hypertension disease (AHD). Methods A total of forty healthy 5-6 week-old male SD rats were used in this study. Hypertension was induced by constriction of the left renal artery by two kidney one clip (2K1C) with a 0.25 mm silver clamp, and AHD model was established by injecting 0.1 mL complete Freund adjuvant to the left hind paw. Tail artery pressure was measured with a non-invasive blood pressure measurement system. The degree of swelling in the non-inflammatory joint of rats was measured with a paw volume measuring instrument, the arthritis index and incidence of inflammation were evaluated. The rats were sacrificed on the 35thday. The thoracic aorta, ankle joint and spleen tissues were examined by pathology using HE staining. Results The joint of AHD model rat was significantly swollen, extensive synovial cell hyperplasia, inflammatory cell infiltration, vascular pannus formation, and bone and cartilage destruction. The number of germinal centers in spleen was increased, and a large number of lymphocyte infiltration, diffuse proliferation of white pulp, and red pulp infiltration were present. The arthritis index, incidence of inflammation and histopathological scores of the joint and spleen were significantly higher than adjuvant arthritis (AA) rats; meanwhile, the blood pressure of AHD model rat was significantly increased, the thickness and cross-sectional area of thoracic aorta were significantly increased, while the lumen diameter was significantly reduced. The blood pressure and vascular injury were significantly increased or aggravated compared with the HT rats. Conclusions A rat model of arthritis-hypertension disease is successfully established by using complete Freund adjuvant intradermal injection to the footpad and surgery to narrow the left renal artery.
Arthritis hypertension disease; Adjuvant arthritis; Hypertension
国家自然科学基金(81330081,81302784,81673444);安徽省自然科学基金(1508085MH182);安徽医科大学博士科研资助基金(XJ201534)。
张影(1991-),女,硕士,研究方向:抗炎免疫药理学。E-mail:1374393895@qq.com
严尚学(1973-),男,副研究员,硕士生导师,研究方向:抗炎免疫药理学。E-mail:yan-shx@163.com
R-33
A
1671-7856(2017) 08-0034-06
10.3969.j.issn.1671-7856. 2017.08.007
2016-12-08
