金纳米颗粒表面电荷密度介导的纳米生物效应研究
2017-09-11张铭倚
张铭倚
(国家知识产权局专利局专利审查协作天津中心, 天津,300304)
金纳米颗粒表面电荷密度介导的纳米生物效应研究
张铭倚
(国家知识产权局专利局专利审查协作天津中心, 天津,300304)
本文由11-巯基十一烷酸(MUA)和1-辛硫醇(OT)组成的混合自组装单层构建表面电荷密度不同的 GNPs(33%,50%,67%和100% MUA GNPs),并研究了它们与血清蛋白的相互作用以及对巨噬细胞的活性影响。实验发现,33%和50% MUA GNPs 在培养基环境中保持良好的稳定性,67%和100% MUA GNPs 在培养基环境中稳定性显著降低,且100% MUA GNPs 稳定性最差。100% MUA GNPs造成巨噬细胞RAW264.7新陈代谢活性异常增高,并且引起DNA损伤。
纳米颗粒;表面电荷密度;纳米-蛋白相互作用;DNA损伤
1 引言
表面修饰是纳米材料降低表面势能的重要方式之一,同时也为其引入新的性质和功能用途。在纳米医药领域,调控表面性质可用于影响纳米颗粒与蛋白的热力学和动力学反应,导致其生物效应的不同[1]。目前纳米颗粒在医药领域最大的使用屏障是如何能降低其非特异性蛋白吸附,从而避免被单核吞噬系统识别和清除,以保证其在体内的靶向性。例如,将纳米颗粒表面修饰上中性配体PEG是目前最有效和常用的阻止蛋白吸附的方法[2,3]。研究证明,颗粒表面的电荷性质调控其进入细胞的途径和效率,例如,正电荷颗粒具有较强的膜粘附性,因为细胞表面的负电荷基团丰富(如唾液酸、磷脂分子头部的极性基团等),导致正电荷纳米颗粒可以首先通过静电吸附作用吸附在细胞表面,然后通过诱导网格蛋白介导的内吞作用进入细胞。负电荷纳米颗粒虽然与细胞的粘附性稍差,但是也可以通过非特异性途径进入细胞[4]。除了电性质,表面电荷密度的调节也会影响纳米颗粒的细胞摄取。例如,Villanueva等[5]用肝素和二巯基丁二酸(DMSA)修饰氧化铁得到负电荷密度不同的纳米颗粒,并作用于宫颈癌细胞(Hela),DMSA-氧化铁颗粒的细胞摄取率明显低于肝素包被的颗粒,且后者进一步引起细胞有丝分裂纺锤体形貌异常。但是由于两种分子的结构差异明显,因此无法确定导致这些差异的根本原因和机理。这里,我们利用金原子和巯基之间的配合作用,在金纳米颗粒(GNPs)表面修饰上不同比例的11-巯基十一烷酸(MUA)和1-辛硫醇(OT),二者结构相近,一个带有负电荷羧基,一个是中性分子。我们从蛋白分子和细胞层面,初步探讨不同负电荷密度的纳米颗粒表面的生物效应。
2 实验部分
2.1 金纳米颗粒修饰
将18nm金纳米颗粒(实验室自己合成)与巯基化合物混合,室温下氮气氛下反应过夜。其中,巯基化合物由不同比例的11-巯基十一烷酸(MUA)和1-辛硫醇(OT)组成(购自Sigma美国公司),根据MUA比例的不同将样品分别记为33%MUA GNPs,50%MUA GNPs,67%MUA GNPs和100%MUA GNPs。
2.2 不同表面修饰GNPs与血清的相互作用
将33%MUA GNPs,50%MUA GNPs,67%MUA GNPs和100%MUA GNPs分别与含有10%胎牛血清的Hanks(均购自AmrescoInc, USA)缓冲液在37℃下孵育半小时和24小时,然后用UV-Vis(普析通用,中国)扫描400-800 nm范围。
将金纳米颗粒与FBS在37℃下孵育30分钟后,在1%琼脂糖凝胶上120 V电泳18分钟。
2.3 细胞活性检测
RAW264.7小鼠巨噬细胞(北京协和细胞库)活性用CCK-8试剂(Dojindo Laboratories, Kumamoto, Japan)检测,酶标仪上450 nm读数。
2.4 彗星电泳
将细胞用GNPs处理12小时后,按下述步骤进行碱性彗星电泳[7]:在载有正常熔点的琼脂糖磨砂载玻片上,加入含有10 μL的细胞和90 μL0.5%的低熔点琼脂糖,加盖玻片,置4℃下冷却10分钟,使胶凝固。去盖玻片后再铺一层低熔点琼脂糖。凝固后,放于新鲜配制的裂解液(2.5M NaCl, 100 mM EDTA, 10 mM Tris-HCl, pH 10, 用前加入1%TrionX-100和10%DMSO)中2小时(4℃)。将载玻片取出,用清水洗两遍后放入预冷的碱性电泳液中(1 mM EDTA和300 mM NaOH)解螺旋20 min,在25 V、300 mA条件下电泳20 min。电泳结束后,用中和液(400 mM Tris-HCl缓冲液,pH 7.4)洗涤两次,每张载玻片加30 μL GelRed并加盖玻片染色5 min。每张片子上随机观察至少80个细胞。用CASP软件分析细胞的尾力矩,并用SPSS16.0(美国IBM公司)进行统计分析。
3 结果与讨论
3.1 表面羧基化程度不同GNPs与血清蛋白的相互作用
根据Mie散射理论[6],当金属纳米颗粒稳定性降低,颗粒间距减小到粒径量级时,颗粒会在更长的光波处发生表面等离子体共振吸收(Surface Plasmon Resonance, SPR),导致吸收峰的红移和波谱展宽。18 nm GNPs的SPR吸收峰在520 nm附近,当分散性降低时,SPR吸收峰发生红移,波带展宽。利用这一原理,我们观察GNPs在含有10%FBS的Hanks液中的稳定性。吸收光谱结果(图1)显示33%和50%MUA GNPs在培养基中稳定性良好,孵育24小时后,光谱没有出现展宽和波峰红移。67%MUA GNPs在培养基中孵育0.5小时后出现波峰小范围红移,孵育24小时后半峰展宽。100%MUA GNPs在培养基中稳定性最差,加入样品的瞬间金颗粒溶液颜色由酒红色变为蓝色,吸收光谱结果显示波峰出现明显的红移,且随着时间的延长,半峰宽增大。以上结果表明,在10%FBS培养基环境中,33%和50%MUA GNPs的分散性没有受到影响。但随着MUA比例进一步增加,67%MUA GNPs SPR吸收峰出现小范围红移和半峰展宽。说明血清蛋白结合在该样品上,并对该样品的分散性产生一定的影响。100%MUA GNPs加入到培养基环境中短时间内颜色发生明显变化,SPR吸收峰出现大范围红移,半峰展宽,说明该样品与血清蛋白能快速的形成复合物,导致样品分散性急剧降低。

图1 表面电荷密度不同GNPs分别在Hanks液(含10%FBS)中孵育不同时间后的SPR吸收峰位置变化。上端插入图为100%MUA GNPs的光谱扫描结果
当GNPs吸附蛋白后,其电泳行为必定受到影响,进一步使用凝胶电泳法观察血清蛋白对表面电荷密度不同的GNPs电泳行为的影响(图2)。33%和50%MUA GNPs与FBS孵育后,颗粒的迁移率与原样品几乎相同(条带1-4)。其中,50%MUA GNPs与血清孵育后,条带4较条带1颜色浅,且在上方能看到极浅的扩散条带(粉色框标示),说明该组分样品能够少量的吸附蛋白,从而小范围的影响其电泳行为;67%MUA GNPs中这一现象更加明显(橘色框),且条带5和6之间出现明显的距离。条带7和8之间的距离最大,且有一部分样品阻滞在点样孔附近。

图2 凝胶电泳检测血清蛋白对GNPs电泳性质的影响。1,3,5,7分别是33%,50%,67%和100%MUA GNPs的电泳条带;2,4,6,8分别是相应的GNPs与100%FBS孵育20分钟后的电泳条带
随着表面MUA比例的增加,血清蛋白对颗粒的凝胶阻滞现象越来越明显。值得关注的是100%MUA GNPs与血清孵育后的两条条带(泳道8),一条在点样孔附近,一条与原颗粒样品间距比其他三个样品都大。结合SPR吸收峰结果,一方面说明100%MUA GNPs样品表面负电荷密度最大,另一方面也说明该样品对血清蛋白的吸附作用最强,导致其表面电荷性质受到强烈干扰。
3.2 纳米颗粒对细胞活性的影响
CCK-8检测细胞活性的原理是,通过直接检测线粒体内脱氢酶的酶活性间接说明细胞的活性变化。因此,CCK-8直接测定的是细胞的新陈代谢活性。结果表明GNPs在1-8 nM范围内(图3),没有造成巨噬细胞新陈代谢活性的明显降低。但是,100%GNPs样品在高浓度造成活性明显增高。我们推测,当大量颗粒进入细胞,引起细胞较强的应激反应,细胞的代谢能力明显增强。
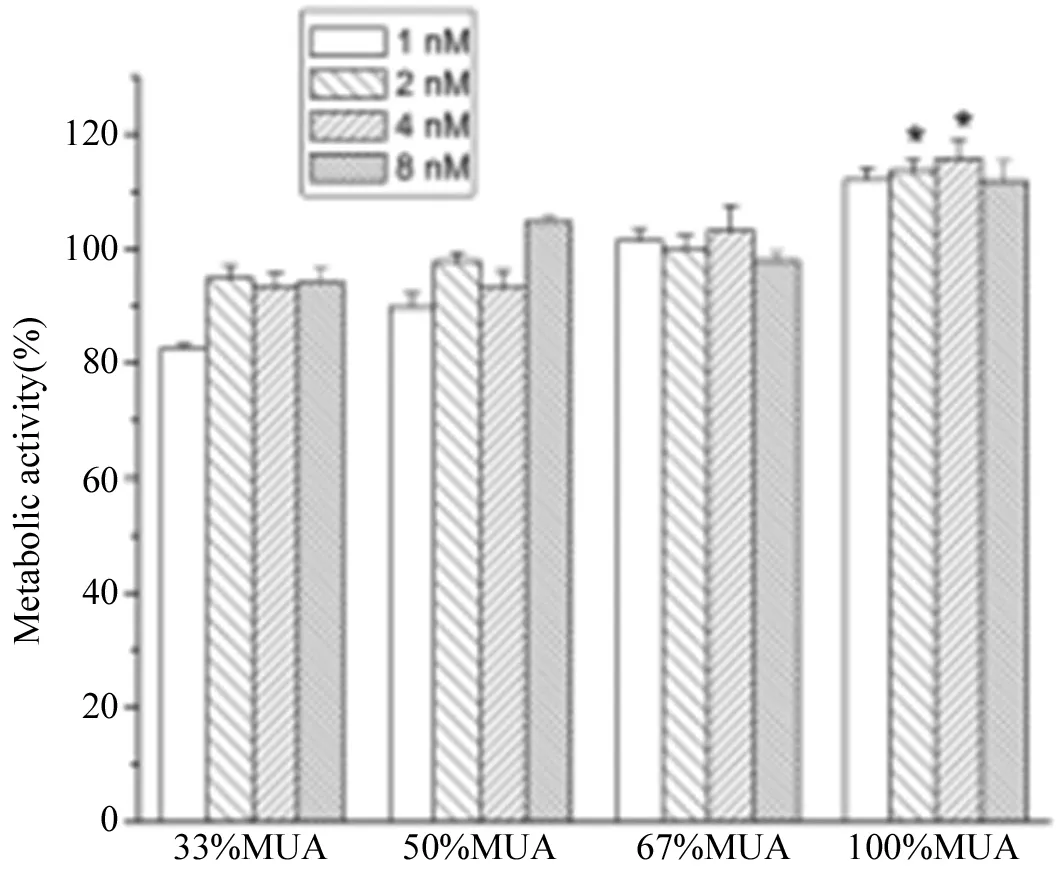
图3 不同浓度GNPs处理后,巨噬细胞的新陈代谢活性。每个样品重复5遍,P<0.05。
3.3 纳米颗粒对细胞DNA的损伤效应
检测表面电荷密度不同的GNPs对RAW 264.7 DNA稳定性的影响,彗星电泳结果显示(图4)颗粒浓度为2 nM时,只有100%MUA GNPs造成明显的DNA单链损伤。100%MUA GNPs大量进入细胞后,引起线粒体等细胞微观结构受损,可能是该样品在低浓度下即造成DNA损伤的原因。

图4 碱性彗星电泳检测GNPs对RA264.7细胞DNA稳定性的影响。上图为彗星电泳结果示意图:a-对照,b-33%MUA GNPs,c-50%MUA GNPs,d-67%MUA GNPs,e-100MUA GNPs。处理浓度为2 nM。下图为统计分析后得到的彗尾力矩结果,每个样品中至少分析细胞数80个,每个样品重复三遍,p<0.01。
4 结论
早期在进行混合自组装单层的研究中,发现将带有相反电荷的两种表面活性剂分子共吸附在金平面上,能有效阻止蛋白的非特异性吸附[8]。在此基础上,Ji Jian等将10-巯基十烷基磺酸和10-巯基十烷基溴化铵按3:7、5:5和7:3混合吸附到16 nm GNPs上,发现三种颗粒也能很好的阻止血清蛋白吸附[9]。本文研究了表面羧基化程度不同的金纳米颗粒的生物效应。得到以下结果:使用疏水/亲水性不同的1-辛硫醇(OT)和11-巯基十一烷酸(MUA)构建不同电荷密度的GNPs,抵抗血清蛋白吸附顺序如下33%MUA GNPs>50%MUA GNPs>67%MUA GNPs>100%MUA GNPs。33%和50%MUA GNPs在培养基环境中保持良好的稳定性,两种表面修饰能有效阻止血清蛋白在颗粒表面的吸附,大大降低巨噬细胞对两种颗粒的识别和吞噬。67%和100%MUA GNPs在培养基环境中稳定性显著降低,其中100%MUA GNPs稳定性最差。血清蛋白在两种表面的吸附逐渐增加,彗星电泳结果表明该样品2nM即可造成DNA明显损伤。
[1] Verma A.Effect of surface propertieson nanoparticle-Cell Interactions [J].Small, 2010, 6(1):12-21.
[2] Walkey C D. Nanoparticle size and surface chemistry determine serum protein adsorption and macrophage uptake [J]. Journal of the American Chemical Society, 2012, 134(4):2139-2147.
[3] Xie Jin. Controlled PEG ylation of monodisperse Fe3O4nanoparticles forreduced non-specific uptake by macrophage cells [J]. Advanced Materials, 2007, 19(20):3163-3166.
[4] Harush-Frenkel O . Targeting of nanoparticles to the clathrin-mediated endocytic pathway [J]. Biochemcal and Biophysical Research Communication, 2007, 353(1):26-32.
[5] Villanueva A. The influence of surface functionalization on the enhanced internalization of magnetic nanoparticles in cancer cells [J]. Nanotechnology, 2009, 20(11):115103.
[6] Mie G. Articles on the optical characteristics of turbid tubes, especially colloidal metal solutions [J]. Annalen der Physik-Berlin, 1908, 25(3):377-445.
[7] Zhang Ming yi. Variation in the internalization of differently sized nanoparticles induces different DNA-damaging effects on a macrophage cell line [J]. Archives of Toxicology, 2011, 85(12): 1575-1588.
[8] Chen S F. Strong resistance of a thin crystalline layer of balanced charged groups to protein adsorption [J]. Langmuir, 2006, 22(19), 8186-8191.
[9] Liu X S. Minimizing nonspecific phagocytic uptake of biocompatible gold nanoparticles with mixed charged zwitterionic surface modification [J]. Journal of Materials Chemistry, 2012, 22(5), 1916-1927.
Surface charge densities-mediated nano-bio effect of GNPs
ZHANGMing-yi
(Patent Examination Cooperation Tianjin Center of the Patent Office. SIPO, Tianjin, 300304,China)
A mixed SAMs containing 11-mercaptoundecanoic acid (MUA) and 1-octanethiol (OT) was used to construct GNPs with different surface charge densities. The interaction between GNPs and fetal bovine serum get stronger when more MUA was adsorbed on the nanoparticle surface. 100% MUA GNPs caused an abnormal increase of metabolic activity as well as DNA damage. These results indicated that it is feasible to control the interaction of nanoparticles with bovine serum by regulation their surface charge densities, which influenced their cellular uptake process by macrophages and subsequent bio-effects.
nanoparticles;surface-charge density;nano-protein interaction;DNA damage
2017-05-06.
张铭倚(1985-),女,博士,E-mail:zhangmytracy@126.com.
2095-7386(2017)02-0041-04
10.3969/j.issn.2095-7386.2017.02.008
O 614.123
A
