盐胁迫对红豆草幼苗生长和离子积累及分配的影响
2017-09-08伍国强刘海龙王春梅李善家
伍国强,贾 姝,刘海龙,王春梅,李善家
(1.兰州理工大学生命科学与工程学院,甘肃 兰州 730050;2.中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州 730050)
盐胁迫对红豆草幼苗生长和离子积累及分配的影响
伍国强1,贾 姝1,刘海龙1,王春梅2,李善家1
(1.兰州理工大学生命科学与工程学院,甘肃 兰州 730050;2.中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州 730050)
以3周龄红豆草(Onobrychisviciaefolia)幼苗为材料,研究了不同浓度(0、5、25、50、100和200 mmol·L-1)NaCl及50 mmol·L-1处理不同时间(0、1、3、5、7和9 d)对其生长和离子积累及分配的影响,以期解析红豆草响应盐胁迫的生理机制。结果表明,与对照(0 mmol·L-1)相比,5、25和50 mmol·L-1NaCl对红豆草幼苗生长影响不大;而100和200 mmol·L-1明显抑制其生长。随着盐浓度增加,红豆草地上部和根Na+浓度呈显著增加趋势(P<0.05),其中50~200 mmol·L-1下,地上部Na+浓度较对照增加14~39倍。特别是200 mmol·L-1使根Na+净吸收速率较对照增加了35倍,使整株总Na+量和地上部Na+相对分配比例分别增加了93%和45%;而显著降低了根的K+、Na+选择性运输能力。在50 mmol·L-1NaCl下,随着处理时间延长,地上部和根Na+浓度也呈逐渐增加趋势,但根中的Na+到7 d时达到最大,然后呈下降趋势;相反,K+浓度均呈缓慢下降趋势,且根中的浓度始终高于地上部。由此可见,在5~50 mmol·L-1NaCl下,红豆草通过维持其体内K+、Na+稳态平衡抵御盐胁迫;而在100和200 mmol·L-1下,红豆草地上部积累大量Na+,但其叶片Na+区域化及K+选择性转运能力较弱,导致植株体内Na+、K+稳态紊乱,产生离子毒害,从而抑制其生长。
红豆草;盐胁迫;离子选择性吸收;Na+/K+
盐胁迫是影响植物生长和作物产量的主要非生物因素之一[1-3],全球约有20%的灌溉地遭受盐渍化的威胁[4]。我国盐碱地面积约为3.5×107hm2[5],约占世界的1/10[6],主要分布在北方干旱、半干旱地区和东部滨海地区[7-8],严重制约着我国农牧业生产和生态环境可持续性发展。土壤中少量的盐分(主要是Na盐)有利于一些盐生植物的生长;然而,过多的盐分则会对大多数植物、特别是甜土植物造成伤害,主要表现为离子毒害和渗透胁迫[2,9]。在高盐条件下,介质中的Na+进入植物细胞,抑制细胞对K+的吸收,降低植物体内K+/Na+比,破坏细胞内离子稳态平衡[10-11]。当离子稳态失衡时,细胞内绝大多数代谢酶的活性会受到影响,甚至丧失活性[12],导致代谢系统紊乱,光合作用减弱,生长受到抑制,严重时出现植株萎蔫,甚至死亡现象[13]。
红豆草(Onobrychisviciaefolia)是一种优良的多年生豆科牧草,被誉为“牧草皇后”[14-15],在我国北方干旱、半干旱地区广泛种植。其根系发达,根上有块状根瘤,可以生物固氮,有效提高土壤肥力;营养丰富,产量高,含有大量单宁,牲畜喜食且不引起膨胀病;花色粉红艳丽,气味芳香,也是一种较为理想的绿化、美化和观赏植物[16-19]。目前,有关盐胁迫对红豆草种子萌发、生活力和其固氮作用的研究报道较多[20-24]。包桂荣等[20]采用NaCl和Na2CO3各6个浓度梯度(0、500、1 000、2 000、3 000和4 000 mg·L-1)溶液对红豆草种子进行处理,发现低盐浓度(500 mg·L-1)能提高种子发芽率,但高盐浓度则降低种子发芽率和发芽势及胚根、胚芽长度。尽管有关红豆草耐盐机制方面的研究取得了一些进展[16],然而盐胁迫下其体内离子积累及分配规律尚不清楚。鉴于此,本研究以3周龄红豆草幼苗为材料,探究不同浓度NaCl处理下其生长和不同组织Na+、K+的积累和分配,以期进一步揭示红豆草响应盐胁迫的生理机制。
1 材料与方法
1.1 植物材料及生长条件
供试红豆草品种为“甘肃”,种子由兰州大学草地农业科技学院李彦忠教授馈赠。试验于2015年3月-9月在兰州理工大学生命科学与工程学院植物培养室进行。挑选籽粒饱满、均匀一致的种子,播种在装有蛭石的塑料盘(5 cm× 5 cm× 5 cm,每盘8孔)中,每孔播5~6粒种子,浇灌蒸馏水进行萌发,待两片子叶露出蛭石后,浇灌1/2 Hoagland营养液进行培养。营养液配方为:2 mmol·L-1KNO3,0.5 mmol·L-1NH4H2PO4,0.25 mmol·L-1MgSO4·7H2O,0.1 mmol·L-1Ca(NO3)2·4H2O,0.5 mmol·L-1Fe-citrate,92 μmol·L-1H3BO3,18 μmol·L-1MnCl2·4H2O,1.6 μmol·L-1ZnSO4·7H2O,0.6 μmol·L-1CuSO4·5H2O,0.7 μmol·L-1(NH4)6M·7O24·4H2O。待第1片真叶出现后,间苗,每孔留3株。培养室昼夜温度 (28±2) ℃/(23±2) ℃,光照时间16 h·d-1,光强为500~600 μmol·(m2·s)-1,空气相对湿度为60%~80%。每两天更换一次营养液。
1.2 试验处理
3周龄红豆草幼苗按如下方案处理:1)分别用含0(对照)、5、25、50、100和200 mmol·L-1NaCl的1/2 Hoagland营养液处理7 d;2)用含50 mmol·L-1NaCl的1/2 Hoagland营养液分别处理0(对照)、1、3、5、7和9 d。每个处理设8次重复。每两天更换一次处理液,以保持恒定的NaCl浓度。
1.3 生理指标测定
鲜重和干重:参考Wu等[25]的方法略有修正,将植物材料用蒸馏水冲洗表面灰尘和残留盐分后,用吸水纸吸干其表面水分,将其分为地上部和根,分别称取鲜重;然后将样品装在信封中,杀青后,置于80 ℃烘干至恒重,称取干重。
Na+、K+浓度和K+/Na+:参考Yue等[26]的方法并略有修正,将恒重的干样品在研钵中,研磨至粉末状后,放入试管中,添加 100 mmol·L-1冰乙酸,密封试管,置于96 ℃沸水中水浴2 h。过滤后,上清液稀释适当倍数后,在火焰光度计(2655-00,Cole-Parmer Instrument Co.,USA)上测定Na+和K+浓度。K+/Na+计算方法参考文献[27]。K+、Na+选择性吸收(SA)和选择性运输(ST)能力及根K+、Na+净吸收速率的计算方法参考文献[27-28]。
1.4 数据分析
采用SPSS 19.0软件(SPSS Inc.,USA)对试验数据进行单因素方差分析,显著性差异分析采用Duncan检验进行(P<0.05),采用Excel 2007制图。
2 结果与分析
2.1 不同浓度NaCl对红豆草幼苗生长的影响
与对照(0 mmol·L-1)相比,5、25和50 mmol·L-1NaCl对红豆草地上部鲜重没有显著性影响(P>0.05);在100和200 mmol·L-1NaCl下,植株地上部鲜重较对照分别降低了21%和23%(P<0.05)(图1)。50、100和200 mmol·L-1NaCl下,幼苗地上部干重较对照分别显著下降了29%、35%和28%(P<0.05)(图1)。然而,盐浓度的变化对红豆草幼苗根的鲜重和干重无显著影响(P>0.05)。

图1 不同浓度NaCl对红豆草鲜重和干重的影响Fig. 1 Effect of different concentrations of NaCl on fresh and dry weight in sainfoin
注:不同小写字母表示处理间差异显著(P<0.05)。下同。
Note: Different lowercase letters indicate significant difference at the 0.05 level; similarly for the following figures.
2.2 不同浓度NaCl对红豆草Na+、K+离子积累和分配的影响
随着NaCl浓度的增加,无论地上部还是根中的Na+浓度均呈显著增加趋势(P<0.05),但相比之下,地上部增加的幅度则更大(图2)。50、100和200 mmol·L-1NaCl使地上部Na+浓度较对照分别增加了14、26和39倍,而使根中K+浓度分别显著降低了17%、25%和36%。与对照相比,不同浓度NaCl处理均显著降低了幼苗地上部和根K+/Na+。
进一步分析发现,随着NaCl浓度的增加,红豆草植株K+、Na+选择性运输能力呈下降趋势(图3),而K+、Na+选择性吸收能力和Na+净吸收速率均呈逐渐增加趋势(P<0.05)(图3)。尤其是在200 mmol·L-1NaCl下,根Na+净吸收速率较对照增加了35倍,而K+、Na+选择性转运能力下降了82%。

图2 不同浓度NaCl对红豆草Na+、K+浓度和K+/Na+的影响Fig. 2 Effect of different concentrations of NaCl on Na+, K+ concentrations and K+/Na+ in sainfoin
在200 mmol·L-1NaCl处理下,植株总Na+含量和地上部Na+相对分配比例较对照分别增加了93%和45%,而根Na+相对分配比例降低了77%(P<0.05)(表1)。50、100和200 mmol·L-1NaCl处理使总K+含量较对照显著降低,但地上部的K+相对分配比例显著较对照增加,而根中的分配比例仅200 mmol·L-1NaCl处理较对照则显著下降。由此可见,盐处理下红豆草一方面通过根吸收大量的Na+转运至地上部,另一方面在一定程度上维持其体内K+的稳态平衡。
2.3 50 mmol·L-1NaCl处理不同时间对红豆草生长的影响
在50 mmol·L-1NaCl下,处理3 d时植株地上部鲜重和干重较对照(0 d)分别增加了27%和77%(P<0.05)(图4)。处理3 d时根鲜重达到最大值,较对照增加了49%(P<0.05)(图4)。
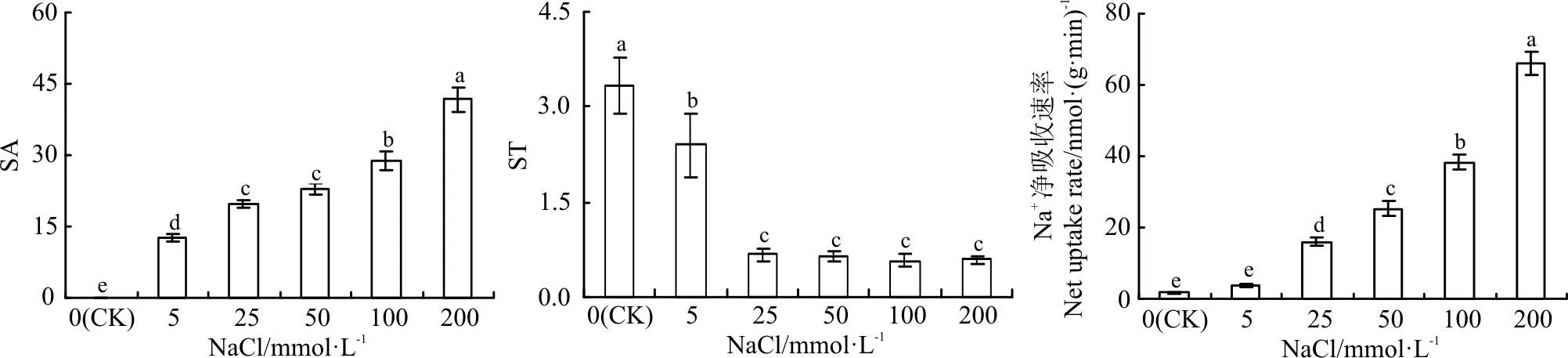
图3 不同浓度NaCl对红豆草选择性吸收(SA)、选择性运输(ST)值和Na+净吸收速率的影响Fig. 3 Effect of different concentrations of NaCl on selective absorption(SA), selective transportation(ST), and Na+ net uptake rate in sainfoin

NaCl/mmol·L-1总Na+含量TotalNa+amount/μmol·plant-1总K+含量TotalK+amount/μmol·plant-1Na+相对分配比例Na+relativedistribution/%地上部Shoot根RootK+相对分配比例K+relativedistribution/%地上部Shoot根Root0(CK)20.4±1.6d196.0±13.6ab48.1±2.9c51.9±2.9a74.5±1.3bc25.5±1.3ab529.5±1.8d182.7±7.8abc65.2±3.1b34.8±3.1b78.7±2.6ab21.3±2.6bc25109.2±7.8c211.3±6.6a82.8±1.8a17.2±1.8c75.1±1.1bc24.9±1.1ab50146.8±12.5c163.2±8.6c82.3±1.5a17.7±1.5c73.5±1.2c26.5±1.2a100247.5±21.2b175.2±12.7c85.5±1.6a14.5±1.6c75.4±1.7bc24.6±1.7ab200309.6±21.4a159.1±10.5c88.2±0.8a11.8±0.8c80.7±1.4a19.3±1.4c
注:同列不同小写字母表示相同指标不同处理间差异显著(P<0.05)。
Note: Different lowercase letters within the same column indicate significant difference among different treatments at the 0.05 level.

图4 50 mmol·L-1 NaCl处理不同时间对红豆草鲜重和干重的影响Fig. 4 Effect of different lasting times on fresh and dry weight in sainfoin under 50 mmol·L-1 NaCl
2.4 50 mmol·L-1NaCl处理不同时间对红豆草Na+、K+离子积累和分配的影响
在50 mmol·L-1NaCl下,随着处理时间延长,地上部和根Na+浓度均呈逐渐增加趋势,而根中Na+浓度到处理7 d时达到峰值,随后呈下降趋势(图5)。在处理5 d之前根Na+浓度显著高于地上部(P<0.05),7 d时二者无显著差异(P>0.05),而9 d时地上部显著高于根(图5)。另外,地上部和根K+浓度随着处理时间的延长呈缓慢下降趋势;相比之下,根中的K+浓度始终高于地上部(图5)。处理1 d时,地上部和根K+/Na+较对照显著降低,但地上部降低幅度更大;随后呈缓慢下降趋势,二者维持在同一水平(图5)。
在50 mmol·L-1NaCl下,随着处理时间的延长,植株K+、Na+选择性吸收和运输能力均呈显著下降趋势(P<0.05),处理9 d时其较对照分别降低了82%和76%(图6)。根Na+净吸收速率在处理5 d时达到最小值,与处理1 d时相比下降了14%(图6)。从处理1 d开始,根K+净吸收速率呈逐渐降低趋势,处理9 d时较对照降低了91%(P<0.05)(图6)。
在50 mmol·L-1NaCl下,处理9 d时植株总Na+含量和地上部Na+相对分配比例较对照分别增加了95%和35%,而根中相对分配比例降低了66%(P<0.05)(表2)。9 d时植株总K+含量较对照增加15%(表2)。由此可见,随着处理时间长,植株体内Na+的积累量随之增加,并将其大多数积累在地上部。
3 讨论与结论
红豆草是一种优质的豆科牧草,主要种植在内蒙古、新疆、陕西、甘肃和青海等省(区)[19],这些地区由于频繁性季节交替作用,其环境变化常引发土壤干旱和盐碱化,使红豆草种子萌发和幼苗生长受到严重威胁。生物量是植物对盐胁迫反应的综合体现,也是植物耐盐性的重要指标[29]。对于大多数植物而言,当外界Na+浓度超过一定水平时会产生毒害作用。然而,对一些盐生植物来说,Na+又是一种有益离子[3,25]。在本研究中,当盐浓度低于50 mmol·L-1时,红豆草生长良好,相似结果在霸王(Zygophyllumxanthoxylum)、细叶滨藜(Atriplexgmelini)和盐地碱蓬(Suaedasalsa)中均有报道[26,30-31]。盐胁迫下,这些植物一方面可通过增加叶片的肉质化程度、提高组织含水量;另一方面促进植株新叶的生长、提高其生物量,将叶片中的 Na+稀释到毒害水平以下,以适应盐渍生境[26,30-31]。与对照相比,添加5、25和50 mmol·L-1NaCl对红豆草地上部鲜重没有显著影响,而100和200 mmol·L-1分别显著降低了21%和23%(P<0.05)(图1),50~200 mmol·L-1显著降低了幼苗地上部干重(图1)。这些结果表明,红豆草对盐胁迫的耐受能力有限,浓度高于50 mmol·L-1的盐溶液则抑制其生长。

图5 50 mmol·L-1 NaCl处理不同时间对红豆草Na+ 、K+ 和K+/Na+的影响Fig. 5 Effect of different lasting times on Na+, K+, and K+/Na+ in sainfoin under 50 mmol·L-1 NaCl

图6 50 mmol·L-1 NaCl处理不同时间对红豆草SA、ST、Na+和K+净吸收速率的影响Fig. 6 Effect of different lasting times on SA, ST, Na+ and K+ net uptake in sainfoin under 50 mmol·L-1 NaCl

处理天数Treatmentdays/d总Na+含量TotalNa+amount/μmol·plant-1总K+含量TotalK+amount/μmol·plant-1Na+相对分配比例Na+relativedistribution/%地上部Shoot根RootK+相对分配比例K+relativedistribution/%地上部Shoot根Root0(CK)10.5±0.8f175.6±10.2b54.7±3.8d45.3±3.8a71.2±0.8cd28.8±0.8ab137.3±3.2e208.0±13.8a67.8±3.2c32.2±3.2b70.1±1.3d29.9±1.3a361.0±3.2d219.8±9.4a73.1±2.7bc26.9±2.7bc76.6±0.4a23.4±0.4d598.5±8.0c218.7±12.3a70.0±1.4c30.0±1.4b74.1±1.0abc25.9±1.0bcd7151.5±9.2b210.5±4.4a79.4±1.2ab20.6±1.2cd75.8±1.3ab24.2±1.3cd9199.7±12.5a207.4±10.6a84.4±0.8a15.6±0.8d73.5±0.9bc26.5±0.9bc
盐胁迫下,植物体内积累的大量Na+会抑制细胞对K+的吸收,从而使K+含量下降,导致K+、Na+稳态失衡[32-33]。赵昕等[34]研究发现,盐胁迫(100和200 mmol·L-1)下盐生植物盐芥(Thellungiellahalophila)从介质中吸收的大多数Na+积累在根中,限制其转运到叶中,使叶中保持较高K+/Na+,从而适应盐渍环境。叶武威等[35]报道认为,棉花(Gossypiumhirsutum)具有较强的离子区域化能力,使Na+积累在在茎和叶柄中,而K+转运至叶片中,以维持光合器官较高K+/Na+。此外,霸王、盐地碱蓬、甜菜(Betavulgaris)和枸杞(Lyciumbarbarumin)等能从介质中吸收大量Na+,并将其区域化至叶片的液泡中,一方面可降低细胞渗透势,增强细胞吸水能力;另一方面可降低Na+在细胞质中过量积累,减轻对细胞的毒害作用[26,31,36-37]。本研究发现,当盐浓度低于50 mmol·L-1时,幼苗根中的Na+积累量高于地上部,由此说明红豆草能够限制的Na+从根向地上部转运,从而使叶片中维持较低的Na+水平。然而,当外界NaCl浓度为100和200 mmol·L-1或者50 mmol·L-1处理9 d时,幼苗地上部的Na+含量显著高于根部,由此说明,当红豆草被动吸收的Na+超过根容纳范围时,只能将其转运至地上部叶中,但红豆草液泡区域化能力有限,Na+便会在细胞质积累,对植株造成离子毒害,从而抑制其生长。
K+、Na+选择性吸收和选择性转运能力是衡量植物耐盐性的重要指标,不同植物对离子的选择性吸收和转运能力有所不同[38]。在本研究中,在200 mmol·L-1下,K+、Na+选择性吸收能力最大,类似结果在沙芥(Pugioniumcornutum)中也有报道[39]。然而,与50 mmol·L-1处理相比,在200 mmol·L-1下红豆草地上部K+显著增加24%,而K+/Na+无显著差异(图2),表明高浓度NaCl下红豆草在一定程度上能通过限制Na+、增强K+的选择性吸收,使叶中积累更多的K+,维持恒定的K+/Na+。Wu等[40]研究表明,5~200 mmol·L-1NaCl处理下,向日葵(Helianthusannuus)根部K+的选择性吸收能力显著增强,而对K+的选择性转运能力显著降低。在本研究中,不同盐浓度处理下,ST均显著性下降,表明红豆草根系限制Na+、促进K+向地上部运输的能力较弱。
综上所述,当盐浓度低于50 mmol·L-1时,红豆草将吸收的Na+积累在根中,限制Na+转运至地上部,以保护叶片免受Na+毒害,从而维持其正常生长。然而,当盐浓度为100和200 mmol·L-1时,红豆草根部被动吸收的大量Na+转运并积累在地上部叶片,但其叶片Na+区域化及对K+的选择性转运能力较弱,使植株体内K+、Na+稳态失衡,产生离子毒害,从而抑制其生长。
References:
[1] Shabala S,Cuin T A.Potassium transport and plant salt tolerance.Plant Physiology,2008,133:651-669.
[2] Munns R,Tester M.Mechanisms of salinity tolerance.Annual Review of Plant Biology,2008,59:651-681.
[3] Wakeel A,Farooq M,Qadir M,Schubert S.Potassium substitution by sodium in plants.Critical Reviews in Plant Sciences,2011,30:401-413.
[4] Zhao Q,Zhang H,Wang T,Chen S X,Dai S J.Proteomics-based investigation of salt-responsive mechanisms in plant roots.Journal of Proteomics,2013,82:230-253.
[5] 王秀丽,张凤荣,王跃朋,奉婷,廉晓娟,王艳.农田水利工程治理天津市土壤盐渍化的效果.农业工程学报,2013,29(20):82-88. Wang X L,Zhang F R,Wang Y P,Feng T,Lian X J,Wang Y.Effect of irrigation and drainage engineering control on improvement of soil salinity in Tianjin.Transactions of the Chinese Society of Agricultural Engineering,2013,29(20):82-88.(in Chinese)
[6] 赵可夫,李法曾,樊守金,冯立田.中国的盐生植物.植物学通报,1999,16(3):201-207. Zhao K F,Li F Z,Fan S J,Feng L T.Halophytes in China.Chinese Bulletin of Botany,1999,16(3):201-207.(in Chinese)
[7] 赵可夫.植物对盐渍逆境的适应.生物学通报,2002,37(6):7-10. Zhao K F.Plants adapt to salt stress.Bulletin of Biology,2002,37(6):7-10.(in Chinese)
[8] Zhu J K.Plant salt tolerance.Trends in Plant Science,2001,6(2):66-71.
[9] 曾洪学,王俊.盐害生理与植物抗盐性.生物学通报,2005,40:1-3. Zeng H X,Wang J.Salt stress physiology and plant salt resistance.Bulletin of Biology,2005,40:1-3.(in Chinese)
[10] Tester M,Davenport R.Na+tolerance and Na+transport in higher plant.Annals of Botany,2003,91(5):503-527.
[11] 彭云玲,保洁,叶龙山,王永健,燕利斌.NaCl胁迫对不同耐盐性玉米自交系萌动种子和幼苗离子稳态的影响.生态学报,2014,34(24):7320-7328. Peng Y L,Bao J,Ye L S,Wang Y J,Yan L B.Ion homeostasis in germinating seeds and seedlings of three maize inbred lines under salt stress.Acta Ecologica Sinica,2014,34(24):7320-7328.(in Chinese)
[12] Amtmann A,Sanders D.Mechanisms of Na+uptake by plant cells.Advances in Botanical Research,1999,29:75-112.
[13] 李善家,韩多红,王恩军,武燕.外源甜菜碱对盐胁迫下黑果枸杞种子萌发和幼苗保护酶活性的影响.草业科学,2016,33(4):674-680. Li S J,Han D H,Wang E J,Wu Y.Effects of exogenous betaine on seed germination and antioxidase activities ofLyciumrutheniumseedlings under NaCl stress.Pratacultural Science,2016,33(4):674-680.(in Chinese)
[14] Celiktas N,Can E,Hatpoglu R,Avc S.Somatic embryogenesis,callus production,and plantlet growth in sainfoin (OnobrychisviciifoliaScop.).New Zealand Journal of Agricultural Research,2010,49:383-388.
[15] Christine H C,Franck C,Smith M J,Brown T A.Onobrychisspecies with special focus on the forage cropOnobrychisviciifoliaScop.Genetic Resources and Crop Evolution,2012,59:1777-1788.
[16] 周万海,师尚礼,周娟娟.NaCl胁迫对甘肃红豆草生理特性的影响.草原与草坪,2012,32(3):1-5. Zhou W H,Shi S L,Zhou J J.Effect of salt stress on physiological properties ofOnobrychisviciifoliacv. Gansu.Grassland and Turf,2012,32(3):1-5.(in Chinese)
[17] 刘居琛,鲁鸿佩.干旱山区红豆草丰产高产栽培及利用技术.旱作农业,2012,(19):3-4. Liu J S,Lu H P.Arid mountain sainfoin high yield cultivation and use of technology.Rainfed Agriculture,2012,(19):3-4.(in Chinese)
[18] 王增法,柴华,崔婷婷.红豆草的优良特性及利用.养殖技术顾问,2013(6):218.
[19] 柴素荣,吴振国.适宜兰州新区绿化种植的节水型草坪地被植物.农业科技与信息,2012(13):27-30. Chai S R,Wu Z G.Lanzhou new area suitable water-saving lawn afforestation planting ground cover plants.Agricultural Science and Technology,2012(13):27-30.(in Chinese)
[20] 包桂荣,乌日汗,宝布仁·琪琪格,王慧利,陈蕾.不同盐分对红豆草种子萌发的影响.内蒙古民族大学学报,2010,25(6):640-642. Bao G R,Wurihan,Baoburen·Qiqige,Wang H L,Chen L.Effect of saline on seed germination ofOnobrychisviciaefolia.Journal of Inner Mongolia University for Nationalities,2010,25(6):640-642.(in Chinese)
[21] 惠文森.红豆草种子生活力和发芽率的相关性比较.西北民族大学学报,2008,29(71):59-61. Hui W S.The correlation between sainfoin seed vigour and germination rate.Journal of Northwest University for Nationalities,2008,29(71):59-61.(in Chinese)
[22] 王玉祥,徐珊,陈爱革,张博.盐胁迫对奇台红豆草种子萌发的影响.中国农学通报,2011,27(20):40-44. Wang Y X,Xu S,Chen A G,Zhang B.Effects of salt stress on germination ofOnobrychisviciaefoliaQitai.Chinese Agricultural Science Bulletin,2011,27(20):40-44.(in Chinese)
[23] Prevost D,Bordeleau L M,Antoun H.Symbiotic effectiveness of indigenous arctic rhizobia on a temperate forage legume sainfoin (Onobrychisviciaefolia).Plant and Soil,1987,104:63-69.
[24] Prevost D,Bromfield E S P.Effect of low root temperature on symbiotic nitrogen fixation and competitive nodulation ofOnobrychisviciaefolia(sainfion) by strains of arctic and temperate rhizobia.Biology and Fertility of Soils,1991,12:161-164.
[25] Wu G Q,Feng R J,Liang N,Yuan H J,Sun W B.Sodium chloride stimulates growth and alleviates sorbitol-induced osmotic stress in sugar beet seedlings.Plant Growth Regulation,2015,75(1):307-316.
[26] Yue L J,Li S X,Ma Q,Zhou X R,Wu G Q,Bao A K,Zhang J L,Wang S M.NaCl stimulates growth and alleviates water stress in the xerophyteZygophyllumxanthoxylum.Journal of Arid Environments,2012,87:153-160.
[27] Wang S M,Zhang J L,Flowers T J.Low-affinity Na+uptake in the halophyteSuaedamaritima.Plant Physiology,2007,145(2):559-571.
[28] Wang C M,Zhang J L,Liu X S,Li Z,Wu G Q,Cai J Y,Flowers T J,Wang S M.Puccinelliatenuifloramaintains a low Na+level under salinity by limiting unidirectional Na+influx resulting in a high selectivity for K+over Na+.Plant,Cell and Environment,2009,32:486-496.
[29] Boscaiu M,Estrelles E,Soriano P,Vicente O.Effects of salt stress on the reproductive biology of the halophytePlantagocrassifolia.Biologia Plantarum,2005,49(1):141-143.
[30] Matoh T,Watanabe J,Takahashi E.Effects of sodium and potassium salts on the growth of a halophyteAtriplexgmelini.Soil Science and Plant Nutrition,1986,32(3):451-459.
[31] Wang B,Lttge U,Ratajczak R.Effects of salt treatment and osmotic stress on V-ATPase and V-PPase in leaves of the halophyteSuaedasalsa.Journal of Experimental Botany,2001,52:2355-2365.
[32] Schroeder J I,Ward J M,Gassmann W.Perspectives on the physiology and structure of inward rectifying K+channels in higher plants:Biophysical implications for K+uptake.Annual Review of Biophysics and Biomolecular Structure,1994,23(1):441-471.
[33] Nedjimi B,Daoud Y.Ameliorative effect of CaCl2on growth,membrane permeability and nutrient uptake inAtriplexhalimussubsp.schweinfurthiigrown at high (NaCl) salinity.Desalination,2009,249:163-166.
[34] 赵昕,赵敏桂,谭会娟,刘玉冰.NaCl胁迫对盐芥和拟南芥K+,Na+吸收的影响.草业学报,2007,16(4):21-24. Zhao X,Zhao M G,Tan H J,Liu Y B.Compare of K+and Na+content absorption in leaves and roots ofThellungiellahalophilaandArabidopsis.Acta Prataculturae Sinica,2007,16(4):21-24.(in Chinese)
[35] 叶武威,庞念厂,王俊娟,樊宝相.盐胁迫下棉花体内Na+的积累,分配及耐盐机制的研究.棉花学报,2006,18(5):279-283. Ye W W,Pang N C,Wang J J,Fan B X.Characteristics of absorbing,accumulating and distribution of Na+under salinity stress on cotton.Cotton Science,2006,18(5):279-283.(in Chinese)
[36] Liu H,Wang Q Q,Yu M M,Zhang Y Y,Wu Y B,Zhang H X.Transgenic salt-tolerant sugar beet constitutively expressing anArabidopsisthalianavacuolar Na+/K+antiporter gene,AtNHX3,accumulates more soluble sugar beet less salt in storage roots.Plant,Cell and Environment,2008,31(9):1325-1334.
[37] 袁惠君,刘轲,王春梅,谢辉灿,李虎军,贾鸿震.两个宁夏枸杞品种的耐渗透胁迫和耐盐特征比较.草业科学,2016,33(4):681-690. Yuan H J,Liu K,Wang C M,Xie H C,Li H J,Jia H Z.The differences between two cultivars ofLyciumbarbaruminosmotic stress tolerance and salt tolerance.Pratacultural Science,2016,33(4):681-690.(in Chinese)
[38] Wang S M,Zheng W J,Ren J Z,Zhang C L.Selectivity of various types of salt-resistant plants for K+over Na+.Journal of Arid Environment,2002,52:457-472.
[39] 岳利军,袁坤,李海伟,康建军,王锁民.荒漠植物沙芥苗期对不同浓度NaCl的适应机制.草业学报,2016,25(1):144-152. Yue L J,Yuan K,Li H W,Kang J J,Wang S M.Adaptive responses of eremophytePugioniumcornutumseedlings to different concentrations of NaCl.Acta Prataculturae Sinica,2016,25(1):144-152.(in Chinese)
[40] Wu G Q,Jiao Q,Shui Q Z.Effect of salinity on seed germination,seedling growth,and inorganic and organic solutes accumulation in sunflower (HelianthusannuusL.).Plant,Soil and Environment,2015,61(5):220-226.
(责任编辑 武艳培)
Effect of salt stress on growth, ion accumulation, and distribution in sainfoins seedlings
Wu Guo-qiang1, Jia Shu1, Liu Hai-long1, Wang Chun-mei2, Li Shan-jia1
(1.School of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, China; 2.Lanzhou Institute of Husbandry and Pharmaceutical Science, CAAS, Lanzhou 730050, China)
In this study, we investigated the effects of different concentrations of NaCl (0, 5, 25, 50, 100 and 200 mmol·L-1) over different time periods (0, 1, 3, 5, 7 and 9 d), after 50 mmol·L-1NaCl treatment, on growth, ion accumulation, and distribution in 3-week-old sainfoin (Onobrychisviciifolia) seedlings. Results showed that concentrations of 5, 25, and 50 mmol·L-1did not significantly affect plant growth, while concentrations of 100 and 200 mmol·L-1significantly inhibited growth when compared with that in the control (0 mmol·L-1)(P<0.05). With the increase of NaCl concentrations, Na+concentrations in both shoot and root tended to increase. Compared with the control, the addition of 50~200 mmol·L-1NaCl increased shoot Na+concentration by 14~39 times, respectively. In particular, concentrations of 200 mmol·L-1significantly increased root Na+net uptake rates, total Na+amount, and relative shoot Na+distribution by 35-fold, 93% and 45%, respectively; whereas it reduced selective transport capacity for K+over Na+from roots to shoots. At 50 mmol·L-1NaCl, with increased treatment time, Na+accumulation in both shoot and root tended to increase, but that in the roots reached a peak on the 7th day and reduced subsequently. In contrast, K+concentrations showed a decreasing trend, to a larger degree in root than in shoot. These results indicate that under NaCl concentrations of 5~50 mmol·L-1, sainfoin plants could adapt to salt stress by maintaining K+and Na+homeostasis; while under 100 and 200 mmol·L-1, plants passively accumulated a large amount of Na+in shoots, where ions compartmentation and selective transport capacity for K+over Na+were weak, thus disrupting the balance of Na+and K+and resulting in osmotic stress and growth inhibition.
Onobrychisviciaefolia; salt stress; ion selective uptake; Na+/K+
Wu Guo-qiang E-mail:wugq08@126.com
10.11829/j.issn.1001-0629.2016-0447
2016-08-25 接受日期:2016-11-11
国家自然科学基金项目(31460101、31260294);兰州市人才创新创业专项(2014-2-6);兰州理工大学“红柳杰出人才”培养计划项目(J201404)
伍国强(1976-),男,甘肃通渭人,副教授,博士,主要从事植物逆境生理与分子生物学研究。E-mail:wugq08@126.com
S541+.9;S503.4
A
1001-0629(2017)08-1661-08
伍国强,贾姝,刘海龙,王春梅,李善家.盐胁迫对红豆草幼苗生长和离子积累及分配的影响.草业科学,2017,34(8):1661-1668.
Wu G Q,Jia S,Liu H L,Wang C M,Li S J.Effect of salt stress on growth, ion accumulation, and distribution in sainfoins seedlings.Pratacultural Science,2017,34(8):1661-1668.
