棉花花铃期低温对叶片PSI和PSII光抑制的影响
2017-09-07飞杨延龙王娅婷马慧张旺锋
肖 飞杨延龙王娅婷马 慧张旺锋,*
1石河子大学生命科学学院, 新疆石河子832003;2石河子大学农学院 / 新疆生产建设兵团绿洲生态农业重点实验室, 新疆石河子832003
棉花花铃期低温对叶片PSI和PSII光抑制的影响
肖 飞1杨延龙2王娅婷2马 慧2张旺锋2,*
1石河子大学生命科学学院, 新疆石河子832003;2石河子大学农学院 / 新疆生产建设兵团绿洲生态农业重点实验室, 新疆石河子832003
选用陆地棉(Gossypium hirsutum L.)品种新陆早45号, 在室外盆栽至开花结铃期后, 移至人工气候室, 模拟新疆棉花花铃期易出现的低温逆境条件, 设置处理 T (16℃/10℃, 昼/夜), 以常温(30℃/18℃, 昼/夜)处理作为对照, 采用叶绿素荧光和P700同步测定技术, 研究低温对棉花花铃期叶片光合机构PSII能量分配、PSI氧化还原状态及环式电子传递流的影响。结果表明, 与对照相比, 低温处理显著降低了棉花叶片PSII光适应状态下最大光化学量子产量(Fv′/Fm′)、光化学猝灭系数(qP)和 PSII有效光化学量子产量[Y(II)], 并使 PSII非调节性能量耗散[Y(NO)]和调节性能量耗散[Y(NPQ)]量子产量显著升高, 诱导PSII发生光抑制。低温引起棉花叶片光合机构PSI受体侧限制[Y(NA)]显著下降和供体侧限制[Y(ND)]显著升高, 但未引起有效的PSI复合体含量(Pm)显著降低, 表明与PSII相比, 棉花叶片PSI对低温不敏感。此外, 低温引起环式电子传递量子产量[Y(CEF)]以及与 PSII实际量子产量比率的[Y(CEF)/Y(II)]显著升高, 进一步表明在低温下, 光破坏防御机制中环式电子传递流对棉花PSI、PSII起着重要的保护作用, 是主要的光破坏防御机制。非光化学热耗散(NPQ)和调节性非光化学热耗散[Y(NPQ)]与[Y(CEF)]具有显著的正相关关系, 表明低温引起棉花花铃期叶片PSII反应中心过度关闭产生过剩的激发能, 造成了PSII可逆的光抑制, 环式电子传递流的响应及较高的调节性能量耗散共同保护了棉花叶片PSI和PSII免受光抑制的损伤, 这可能是棉花叶片PSI对低温不敏感的重要原因。
棉花; 低温; 光抑制; 光合作用; 环式电子传递流
低温是限制植物地理分布及生长的重要环境因子之一, 低温也是影响我国农业生产的主要气象灾害之一。对喜温植物而言, 低温不仅影响生化代谢过程中酶活性, 同时增加光系统发生光抑制的可能性, 造成植物光合机构的损伤[1-2]。PSII被认为是光合机构中对低温最敏感的组分[3-4]; 但也有研究发现, 高等植物活体内存在PSI选择性光抑制, 即在低温条件下, PSI比PSII更易发生光抑制[5-7]。PSI光抑制的敏感性往往与光照强度密切相关[8], 植物在强光下更容易发生PSII光抑制并限制线性电子传递流[9-10], 从而缓解PSI光抑制[11-12]。低温往往增加PSI光抑制的敏感性[11], 因为低温抑制植物二氧化碳固定的酶活性进而抑制碳同化速率, 导致还原力NADPH在PSI受体侧的过度积累, 引起PSI受体侧的过度还原[13], 促进羟基自由基的产生, 最终加速 PSI光抑制[14]。在低温弱光下, 植物 PSII并不会轻易发生光抑制, 而低温限制碳同化速率, 造成PSI受体侧电子传递受阻, 而导致PSI优先发生光抑制[5,15-16]。
植物具有复杂的光破坏防御机制。研究发现, 黄瓜和拟南芥等植物遭受低温胁迫后, 光合作用环式电子传递在保护PSI光抑制损伤过程中起着重要的作用[17-19]。环式电子传递不仅能将 P700氧化为 P700+, 猝灭过剩激发能对PSI的损伤[20], 而且能消耗过多的还原力NADPH[21]。此外, PSII向PSI线性电子传递流的阻断和抑制也能保护PSI免受光抑制造成的光损伤[22-24]。然而, Niyogi[25]研究发现, 线性电子传递在保护 PSI免受光抑制损伤的同时,却导致 PSII反应中心激发能的过量积累, 并会加重 PSII损伤。如果过剩激发能未能及时通过非光化学热耗散(NPQ)途径和其他电子库消耗, PSII逐渐加重的光抑制将会产生更多的活性氧破坏光合机构[10,26]。因此, 除 NPQ途径外, 环式电子传递在保护 PSII免遭过剩激发能损伤的过程中起着重要的作用[19,27-29]。
棉花起源于热带, 属典型喜温作物, 对低温极其敏感,尤其在花铃期, 可能严重影响棉花生长导致产量大幅下降[30]。植物光合作用对外界环境条件极为敏感[31], 棉花花铃期光合机构的正常运转及光合能力的高低直接影响产量[32]。但有关低温逆境条件下棉花光合生理变化的研究[33],大多局限于常规光合生理指标的测定, 有关棉花光合机构对低温的敏感性及潜在的光损伤防御机制的研究报道较少。新疆具大陆性干旱气候, 多年来在7月下旬至8月初棉花花铃期, 是适宜棉花生长的高温时期, 但易发生异常的降温过程。因此, 研究棉花叶片光合作用对异常低温的响应, 分析光合机构PSII能量分配、P700氧化还原状态和围绕PSI的环式电子传递等生理过程, 揭示棉花花铃期低温下叶片生理变化的原因具有重要意义, 研究结果将为新疆棉花栽培管理及育种资源筛选提供科学依据。
1 材料与方法
1.1 试验材料准备
选用新疆目前主栽棉花(Gossypium hirsutum L.)新陆早45号。于2015年4月12日, 取饱满种子播于25 cm×20 cm 砵的盆 中, 培养基质为蛭石、珍珠岩、优良土壤, 三者按1∶1∶1混合。棉花出苗后每盆留1株, 共200盆, 在室外自然条件下培养, 常规水肥供应, 并注意适时防虫除草, 确保棉株生长良好、株高均匀一致。
1.2 试验设计及处理
待棉花进入开花结铃期, 挑选生长健壮、长势均匀一致的棉株每处理30盆, 搬至顶置光照型人工气候室(南京恒裕仪器设备制造有限公司), 依据北疆夏秋交替时节棉花花铃期易发生的降温天气条件(主要是新疆石河子 7月下旬至 8月上旬, 近 10年以来低温天气变化特征, 详见https://shzqx.gov.cn/), 并参照邹陈等[30]的研究将温度处理设置为T (16°C/10°C, 昼/夜)和CK (30°C/18°C, 昼/夜,也为恢复处理期间生长温度), 各处理光强均为 600 μmol photons m–2s–1, 光周期为14 h/10 h (昼/夜, 白天起止时间为 8:00–22:00), 相对湿度维持在 65%~70%左右。处理方法及持续周期参照邹陈等[30]和 Liu等[34]的方法并略有改动。分别于低温处理前1 d、低温处理后1、3、5、7和9 d, 处理停止恢复正常温度后1、3和5 d (记为R1、R3和R5) 测定相关指标, 每次测定时间均为上午 11:00时, 尽可能控制在相同时间段及相同的部位进行测定, 且处理前棉株叶龄、长势一致, 保证棉株未受水肥等逆境胁迫,以更准确地测定棉花光合机构对气温骤降为障碍性冷害的动态光合生理响应, 每个指标重复测定8~10株。
1.3 叶绿素荧光及P700测定
选取棉株主茎倒四叶, 采用 Dual PAM-100荧光仪(Walz, Germany)同步测定PSII和PSI。测定前, 将整株棉花进行充足的暗适应(30 min), 并将测定仪器放于气候室以保证叶片温度在测定过程中不发生变化。测定过程中避免杂光的干扰, 首先测定最小荧光产量(Fo)、最大荧光产量(Fm)和最大 P700信号(Pm), 随后打开光化光(Al), 强度为 1030 μmol photons m–2s–1, 待荧光信号稳定后(4~5 min), 打开饱和脉冲光(SP), 强度为10 000 μmol photons m–2s–1, 时间为 300 ms, 测定任意时间的实际荧光产量(Fs)、光适应状态下的最大荧光产量(Fm′)和光下最大P700信号(Pm′)。按 PAM-100使用说明并参考 Kramer等[35]文献, 分析PSII和PSI互补性量子产量及环式电子传递量子产值, 相关参数包括 PSII有效光化学量子产量[Y(II)]、PSII非调节性能量耗散[Y(NO)]、调节性能量耗散[Y(NPQ)]、PSI受体侧限制[Y(NA)]、PSI供体侧限制[Y(ND)]、PSI有效光化学量子产量[Y(I)]及环式电子传递流引起的量子产值[Y(CEF)]等。Y(II) = (Fm′–Fs)/Fm′[36], Y(NO) = Fs/Fm, Y(NPQ) = 1–Y(II) –Y(NO)[35]
Y(NA) = (Pm–Pm′)/Pm, Y(ND) = 1–P700red, Y(I) = 1–Y(ND) –Y(NA)[37]
Y(CEF) = Y(I) –Y(II)[38-40]
计算 Y(CEF)/Y(II)[40]分析低温胁迫下环式电子传递量子产值与线性电子传递速率比率的变化。
1.4 数据处理
采用Microsoft Excel 2013处理数据, 通过SPSS 16.0统计软件进行单因素方差分析(One-Way ANOVA)和Duncan’s法进行差异显著性检验(α=0.05), 采用Origin 9.0作图及线性拟合(P<0.05)。
2 结果与分析
2.1 低温对棉花PSII能量分配的影响
Fv/Fm被用来反映植物PSII的最大光化学效率, 其值降低通常反映PSII原初光化学活性的降低。图1显示, 较对照相比, 低温处理显著降低了棉花叶片 PSII最大光化学量子产量(Fv/Fm), 且处理后 5 d Fv/Fm降至最低值(0.7456), 处理9 d后Fv/Fm降低了0.145 (图1-A)。显然, 低温严重抑制了棉花叶片 PSII反应中心活性并由此引起PSII光抑制。Fv′/Fm′为光适应状态下(1030 μmol photons m–2s–1) PSII最大光化学量子产量, 表示开放的PSII反应中心所捕获的光能效率; qP为光化学猝灭系数, 反映PSII反应中心的开放程度。随处理时间的延长, 低温均引起Fv′/Fm′和qp显著下降, Fv′/Fm′于处理后第5 d达最低, 继续低温处理却引起Fv′/Fm′和Fv/Fm上升, 恢复正常生长温度5 d后, PSII最大光化学量子产值恢复至处理前水平, 但qP未恢复至处理前水平(图1-B)。[Y(II)]表示PSII有效光化学量子产量, 是 Fv′/Fm′和 qP共同作用的结果。低温处理引起棉花叶片 PSII有效光化学量子产量[Y(II)]显著下降,处理9 d后, 较处理前, [Y(II)]降低了34%, 恢复正常生长温度5 d后, 其值恢复至处理前的74.4% (图3-A)。恢复正常温度1 d后, qP显著升高(图2-B)。由此表明, 低温导致棉花叶片 PSII反应中心关闭及捕获光能效率下降进而抑制了棉花叶片通过PSII的线性电子传递流。
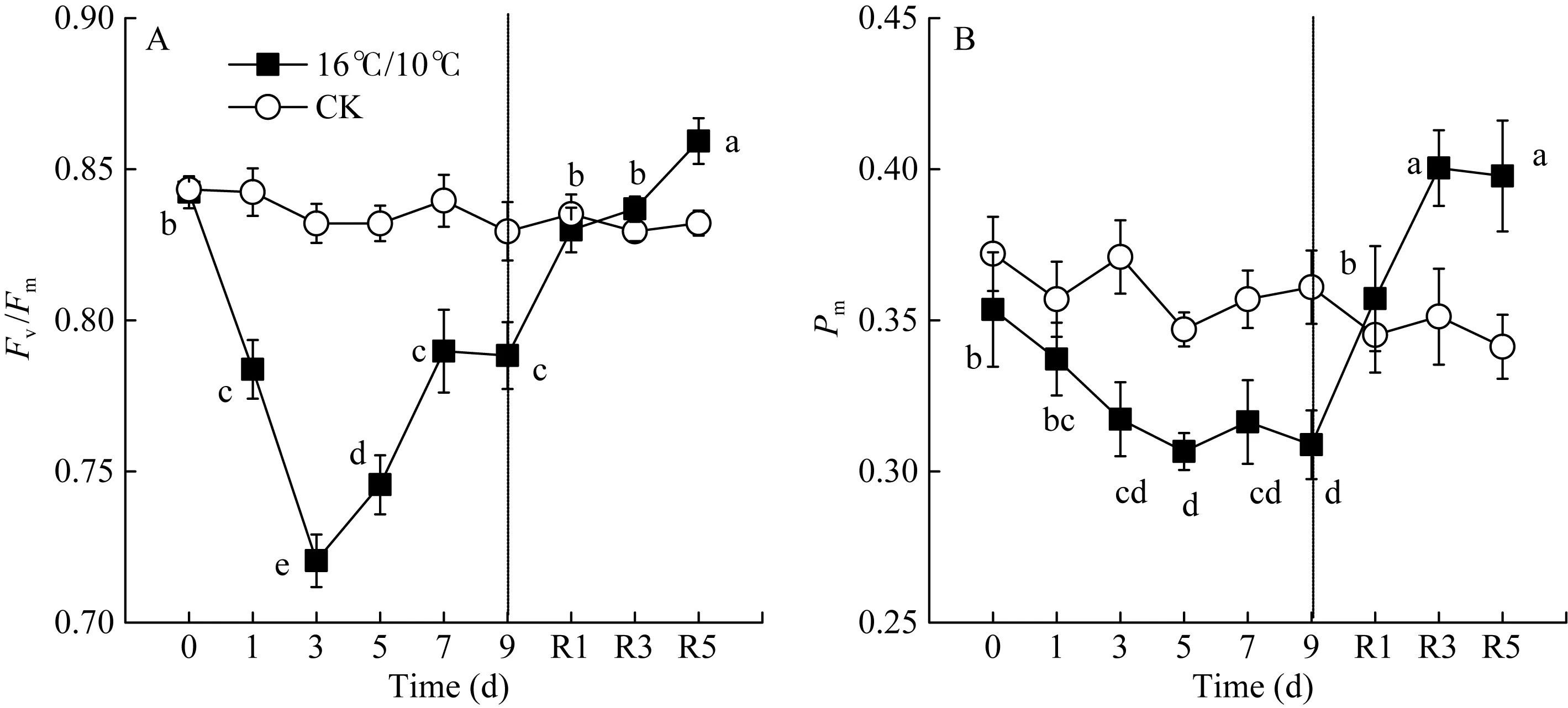
图1 低温对棉花花铃期叶片PSII最大光化学量子产量(Fv/Fm)和最大光氧化态P700含量(Pm)的影响Fig. 1 Changes in the maximum quantum yield of PSII after dark adaption (Fv/Fm) and maximum photo-oxidiable P700 contents (Pm) in cotton leaf at boll stage under low temperatureR1、R3和R5分别表示恢复后1、3和5 d。不同小写字母表示不同处理时间存在显著差异(P < 0.05)。R1, R3, and R5 refer to 1, 3, and 5 days after recovery. The different letters indicate significance at P < 0.05 between different treatment time.
[Y(NPQ)]表示PSII调节性能量耗散的量子产量, 反映叶片通过调节性的非光化学猝灭机制耗散为热能量份额的高低, 而[Y(NO)]与植物光损伤程度有关。研究结果显示, 低温引起棉花叶片调节性能量耗散[Y(NPQ)]、非调节性能量耗散[Y(NO)]量子产值显著升高, 恢复正常生长温度 1 d后, 引起[Y(NO)]和[Y(NPQ)]显著下降, 直至恢复 5 d后, [Y(NO)]恢复至处理前水平, 而[Y(NPQ)]仍显著高于对照(图3)。由此表明, 在棉花花铃期, 低温引起棉花叶片PSII严重的光损伤, 并通过维持较高的调节性能量热耗散, 保护和修复由于低温造成的PSII光氧化损伤。
2.2 低温对棉花叶片PSI氧化还原状态的影响
[Y(ND)]为PSI供体侧限制引起的非光化学量子产量,也表示氧化态 P700占全部 P700的比例。低温引起棉花叶片 PSI供体侧限制[Y(ND)]显著升高, 恢复正常生长温度5 d后, [Y(ND)]仍维持较高水平, 较处理前相比(16.9%), [Y(ND)]上升至 38.85%。由低温引起棉花叶片氧化态P700(P700+)比例升高与处于还原态的PSII电子受体(QA–)积累比例呈显著线性正相关(图 6-A)。[Y(NA)]表示由于PSI受体侧限制而使 P700难以被饱和光氧化的比例, 即PSI受体侧限制引起的非光化学量子产量。低温处理引起棉花叶片PSI受体侧限制[Y(NA)]持续降低, 9 d后较处理前(0.2796)降低了82.6% (图4-C)。Pm表示叶片所能达到的最大光氧化P700含量即有效的PSI复合体含量, 是反映PSI活性的有力指标。图1数据显示, 低温处理5 d内并没有引起有效的PSI复合体含量(Pm)的显著性变化, 恢复正常生长温度后, Pm显著上升, 且在恢复5 d后达最大值(图1-B)。[Y(I)]表示PSI有效光化学量子产量, 低温处理3 d内, 并没有显著变化, 恢复正常生长温度后, PSI有效光化学量子产量[Y(I)]高于对照。这表明, 低温并没有引起棉花叶片发生PSI光抑制, 而可能通过PSII反应中心的关闭和线性电子传递流的抑制而保护PSI。
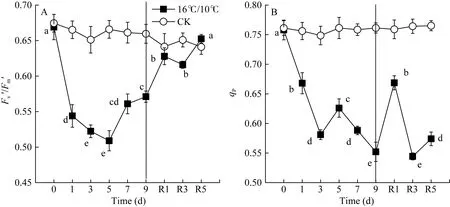
图2 低温对棉花花铃期叶片光适应状态下PSII最大光化学量子产量(Fv′/Fm′)和光化学猝灭系数(qP)的影响Fig. 2 Effects of low temperature on Fv′/Fm′ and qPin cotton leaves at boll stage

图3 低温对棉花花铃期叶片Y(II)、Y(NPQ)、Y(NO)和ETRPSII的影响Fig. 3 Effects of low temperature on Y(II), Y(NPQ), Y(NO), and ETRPSIIin cotton leaf at boll stage
2.3 低温对棉花叶片光合机构环式电子传递流的影响
图 5显示, 低温处理造成环式电子传递量子产值[Y(CEF)]显著上升, 处理9 d后, 由处理前的5.1%上升至23.8%, 恢复正常生长温度 5 d后, 仍然保持较高的[Y(CEF)]。此外, 低温促进了环式电子传递量子产值, 并降低了PSII有效光化学量子产值[Y(II)], 因而显著影响了[Y(CEF)/Y(II)]比率, 引起[Y(CEF)/Y(II)]显著上升, 在低温处理后5 d内, 由处理前的10.5%上升至67.5%, 随后保持稳定水平, 恢复正常生长温度 1 d后, 引起[Y(CEF)/ Y(II)]快速下降, 随后保持稳定。由此表明, 低温处理后[Y(CEF)/Y(II)]持续上升主要是由于低温引起环式电子传递流量子产值[Y(CEF)]上升和光化学猝灭系数(qP)持续降低(图 2-B)。结果也显示, 环式电子传递量子产值[Y(I)-Y(II)]与非光化学热耗散(NPQ)、调节性热耗散比例[Y(NPQ)]呈显著正相关性。这些数据表明, 低温显著增强了棉花叶片环式电子传递流, 并激活了非光化学热耗散(NPQ)途径, 从而保护棉花光合机构免受低温导致光合作用降低发生过剩光能的损伤。
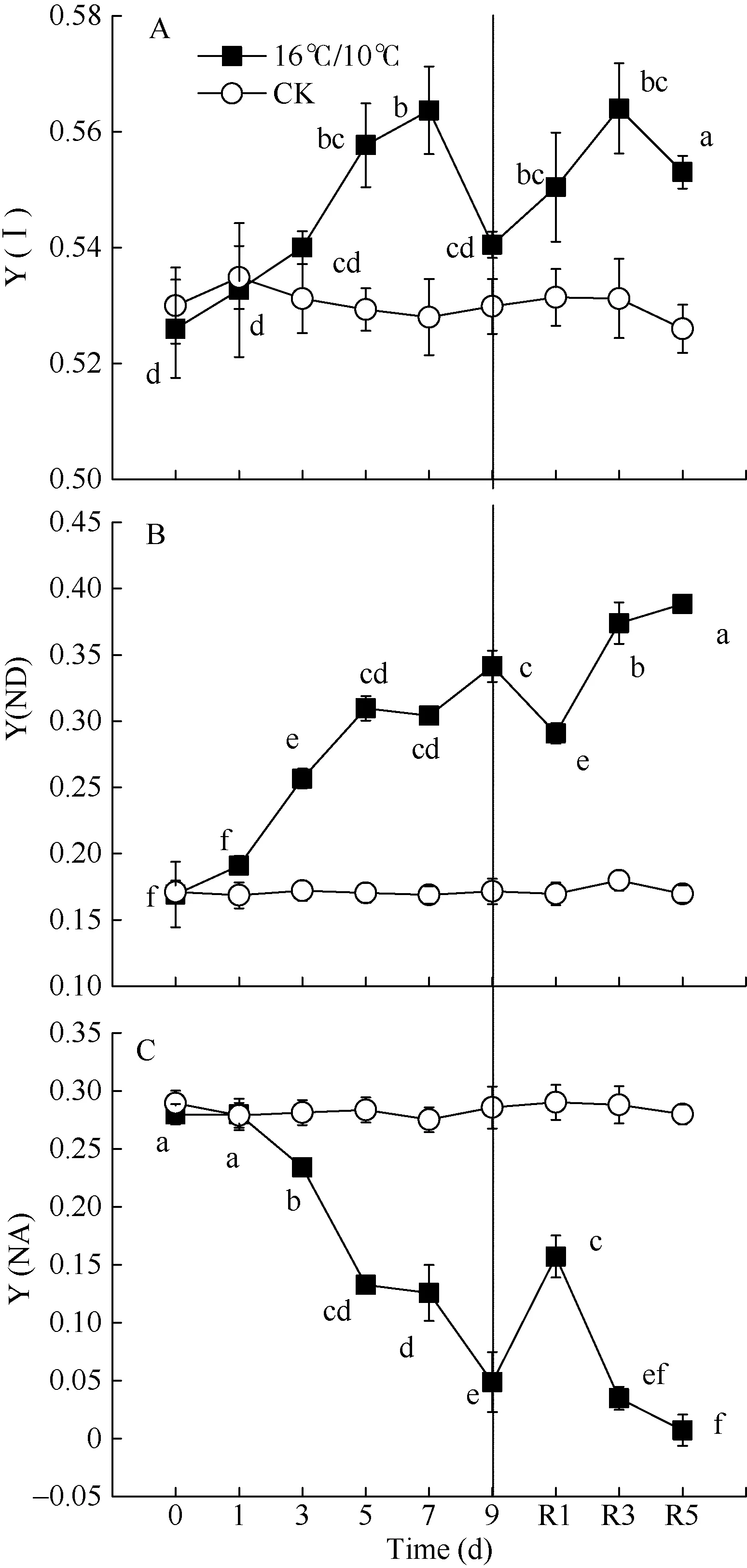
图4 低温对棉花花铃期叶片光系统I (PSI)氧化还原状态的影响Fig. 4 Effects of low temperature on the redox state of P700 in cotton leaf at boll stage
3 讨论
3.1 棉花叶片PSII对低温的敏感性
前人研究表明, 棉花经低温处理后, 降低了线性电子传递和二氧化碳固定能力, 并最终导致 PSII反应中心过剩激发能的积累[41-42], 诱导了棉花叶片光合机构 PSII严重的光抑制, 并抑制了光损伤修复[9]。过剩激发能导致单线态氧和其他活性氧的产生并破坏 PSII[25]。本研究结果显示, 棉花经低温处理后的 9 d内, 与对照相比, 引起叶片光合机构 Fv/Fm、Fv′/Fm′、qP、ETRPSII及[Y(II)]的持续降低(图1、图2和图 3)。低温显著降低了光合电子传递链中电子自PSII分配到P700+的传递速率, 可能是由于质醌(PQ)或质体蓝素(PC)的扩散受到抑制而影响了电子向PSI的传递, 也可能是位于细胞色素 b6/F复合体上泛醌(PQH2)的氧化受到低温抑制引起了 PSII有效光化学量子产值[Y(II)]的持续降低。恢复正常生长温度后, qP并未恢复至处理前水平(图2), 表明低温引起PSII有效光化学量子产值[Y(II)]下降主要是PSII反应中心的关闭引起。研究结果也显示, 随低温处理时间的延长, PSII调节性能量耗散量子产量[Y(NPQ)]和非调节性能量耗散量子产量[Y(NO)]显著升高(图3), 这表明低温引起棉花叶片光合作用降低, PSII发生严重的光损伤, 但能够通过调节性的非光化学能量耗散机制耗散过剩的激发能, 减轻活性氧过量对光合机构的破坏。即使恢复正常生长温度5 d后, 棉花仍然保持高于处理前和对照水平的非光化学热耗散(NPQ)和调节性热耗散比例[Y(NPQ)], 而PSII有效光化学量子产值[Y(II)]和PSII电子传递速率(ETRPSII)并没有完全恢复至处理前水平(图 3)。这表明棉花经低温处理后, 尽管 PSII最大光化学量子产值(Fv/Fm)及能量捕获效率(Fv′/Fm′)能恢复至处理前(图1和图2), 而PSII有效光化学量子产值[Y(II)]难以恢复, 这可能是由于低温引起部分PSII反应中心的关闭及PSII反应中心活性的下降。此外,低温处理后具有较高的 NPQ和[Y(NPQ)]值, 表明棉花较高的调节性非光化学热耗散是其免遭过剩激发能对 PSII光损伤的关键保护机制。
3.2 棉花叶片PSI对低温的敏感性
前人研究表明, PSI光抑制是由过剩激发电子在 PSII向PSI传递过程中产生大量羟基自由基的氧化造成的[5,43]。PSII向PSI传递的电子能够被下游的电子库消耗, 如二氧化碳的固定。然而, 低温降低了二氧化碳的同化速率, 过量的激发能造成PSI受体侧的过度还原和还原力NADPH的过量积累, 导致羟基自由基大量产生[44-45]。这可能通过抑制线性电子传递流, 进而保护PSI免遭光抑制的损伤[5,23,45]。本研究结果显示, 低温导致棉花 PSII反应中心关闭及抑制PSII氧化还原能力(图1、图2和图3), 也可能对PSII造成了严重的光损伤(图 3-C), 从而抑制了光合作用过程中自PSII向PSI的线性电子传递流, PSI得以保护。
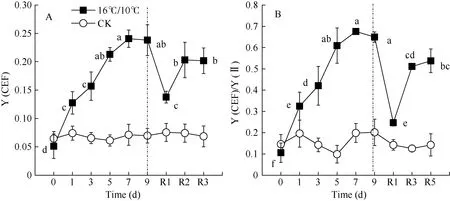
图5 低温对棉花花铃期叶片环式电子传递量子产量[Y(CEF)]和Y(CEF)/Y(II)的影响Fig. 5 Effects of low temperature on Y(CEF) and Y(CEF)/Y(II) in cotton lea at boll stage

图6 棉花经低温处理后环式电子传递量子产值[Y(CEF)]分别与非光化学热耗散(NPQ) (B)、PSI供体侧限制[Y(ND)] (C)和调节性能量耗散[Y(NPQ)] (D)间的相关性Fig. 6 Correlation of the quantum yield of cyclic electron flow [Y(CEF)] with non-photochemical quenching (NPQ) (B), donor side limitation of PSI[Y(ND)] (C), and regulated heat dissipation [Y(NPQ)] (D), respectively, in cotton under low temperature
PSI受体侧过度还原是羟基自由基产生的先决条件[46]。[Y(NA)]表示PSI受体侧处于还原态的电子载体难以被饱和脉冲光氧化的比例, 可以作为PSI光抑制的指标[47]。本研究表明, 棉花随低温处理时间的延长 PSI受体侧限制[Y(NA)]持续降低, 这与抑制线性电子传递流而导致P700+比例[Y(ND)]的显著增加有关(图4)。Pm表示有活性的PSI复合体含量, 也是反映PSI是否受环境损伤及对环境胁迫敏感性的有力指标[48]。本研究表明, 低温并未引起棉花叶片 Pm显著下降, 恢复正常生长温度后, Pm显著高于处理前和对照水平(图 1)。说明, 低温并没有引起棉花叶片PSI活性显著降低, 与PSII相比, 棉花叶片PSI对低温不敏感, 主要是由棉花叶片PSI保护机制决定的。然而前人对一些冷敏感植物如黄瓜[15]、马铃薯[5]、番茄[34]、拟南芥[16]的研究表明, 较PSII相比, 低温处理后PSI优先被损伤且很长时间不易恢复, 对低温更加敏感, 认为这是羟基自由基的氧化积累造成的[46,49]。而棉花叶片经短期和长期低温处理后, 未表现出较高的 PSI受体侧限制[Y(NA)]及低的有效 PSI复合体含量(Pm), 进一步表明棉花叶片较其他冷敏感植物对低温具有更强的耐受性。前人研究表明, 低温下PSI光抑制程度与植物所处生长环境及处理期间光照强度密切相关[1-2,11]。生长在高光强下的热带树木[40]和园艺类植物墨兰[48]突遇短期或长期低温后,较PSII相比, PSI表现出更强的耐冷性, 这与本研究中棉花PSII和PSI对低温的响应特征较为一致。本试验中棉花处理前一直处在高温高光强(白天最高温度达 35°C左右, 极端高温有时达40°C左右, 光强达1500~2000 μmol photons m–2s–1)的外界自然环境中, 因而更准确地表现出棉花对短期和长期低温后光合机构的动态性变化响应,这种类似的生理响应特征可能与棉花所处生长环境的高光强及温度有关。此外, 有研究显示, 低温伴随着弱光胁迫往往会加重植物PSI光抑制, 过高的光照强度反而减弱由低温引起的PSI光抑制程度[47,50]。相比而言, 本研究仅探讨了白天低温适光(600 μmol photons m–2s–1)条件下,低温对棉花光合机构的敏感性差异, 而在极端低温处理并伴随着弱光(<100 μmol photons m–2s–1)或强光(1500~2000 μmol photons m–2s–1)条件下, 棉花叶片光合机构PSI对低温的敏感性是否会有所改变, 弱光下低温是否会加重棉花叶片PSI光抑制, 低温高光强是否会加重PSII光抑制, 阻断或抑制线性电子传递流而减缓或免遭PSI光抑制,有必要进一步研究。
3.3 环式电子传递是保护低温下 PSI、PSII免遭光抑制的重要机制
棉花经16°C/10°C低温胁迫处理时, 随处理时间的延长, 环式电子传递量子产值[Y(CEF)]及其与 PSII有效光化学量子产值比率[Y(CEF)/Y(II)]持续升高(图 5), 即使恢复正常生长温度, 二者仍显著高于对照和处理前水平。表明低温处理显著增强了棉花环式电子传递流。在正常光温条件下, 棉花叶片光合机构吸收的光能通过光合作用正常耗散, 较少的过剩激发能不足以引起PSII的光抑制。而低温胁迫引起棉花气孔关闭, 净光合速率显著降低(气体交换数据未显示), PSII产生过剩的激发能, 从而增加了光合机构光抑制的可能性。然而, 棉花也能通过调节性能量耗散在PSII天线蛋白复合体上将激发能无损耗散为热能,这一过程依赖于跨类囊体膜质子梯度(ΔPH)。环式电子传递能够通过将电子从 PSI传递至 PQ, 建立较高的跨类囊体膜质子梯度[18,51], 保证了调节性能量耗散途径的顺利进行。
本研究结果显示, 低温处理导致棉花叶片环式电子传递量子产值[Y(CEF)]显著升高的同时, 也伴随着非光化学热耗散(NPQ)和调节性非光化学热耗散量子产值[Y(NPQ)]显著升高(图 3), 且二者均与环式电子传递量子效率[Y(CEF)]有着显著线性正相关关系(图6)。这表明, 低温引起棉花叶片环式电子传递流的响应并通过产生较高的跨膜质子梯度(ΔPH)激活NPQ途径, 耗散过多的激发能,减轻更多活性氧(ROS)对光合机构的破坏[37,40,48]。此外,研究表明环式电子流产生的 ΔPH不仅增加 ATP的合成,平衡来源于线性电子传递产生的ATP和NADPH比率, 促进 P700的氧化进而阻止 PSI受体侧的过度还原[21,40,48],而且可以通过保护放氧复合体(OEC)的活性而抑制 PSII的光损伤[19]。本研究结果表明, 低温显著增加了氧化态P700(P700+)比例[Y(ND)], 且[Y(ND)]与环式电子传递量子产值[Y(CEF)]呈显著线性正相关。这表明, 环式电子传递流的响应通过激活更强的非光化学热耗散(NPQ), 增加P700+比例, 从而阻止了光合电子传递链的过度还原[48]。低温显著降低了PSI受体侧限制[Y(NA)](图4), 则主要是由于环式电子传递流作用的结果。因而, 低温引起棉花叶片环式电子传递流的响应, 保护了PSII和PSI免遭光抑制损伤。在一些冷敏感植物, 如拟南芥[19]、黄瓜[12]、番茄[34]等研究报道中, 低温光胁迫显著影响了环式电子传递流(CEF)。然而也有研究表明, 烟草经低温光胁迫处理后, 环式电子传递流的NDH-途径并没有起到任何保护作用[52]。本文尽管没有测定NDH-途径对光合机构的保护性作用及棉花是否真正响应更高的跨膜质子梯度(ΔPH), 并通过调节跨膜电势而仍然维持高的跨膜质子动力势(pmf), 保护光合机构免遭光抑制损伤[53], 但根据前人的研究报道[29,40,51],能够推测低温胁迫下的环式电子传递流在保护棉花光合机构光抑制中起着重要的作用。
[1] 李新国, 段伟, 孟庆伟, 邹琦. PSI的低温光抑制. 植物生理学通讯, 2002, 38: 375–381
Li X G, Duan W, Meng Q W, Zou Q. PSI photoinhibition under low temperature. Plant Physiol Commun, 2002, 38: 375–381 (in Chinese with English abstract)
[2] 张子山, 张立涛, 高辉远, 贾裕娇, 部建雯, 孟庆伟. 不同光强与低温交叉胁迫下黄瓜PSI与PSII的光抑制研究. 中国农业科学, 2009, 42: 4288–4293
Zhang Z S, Zhang L T, Gao H Y, Jia Y J, Bu J W, Meng Q W. Research of the photoinhibition of PSI and PSII in leaves of cucumber under chilling stress combined with different light intensities. Sci Agric Sin, 2009, 42: 4288–4293 (in Chinese with English abstract)
[3] Prasil O, Adir N, Ohad I. Dynamics of photosystem II, mechanism of photoinhibition and recovery process. Top Photosynth, 1992, 11: 295–348
[4] Aro E M, Virgin I, Andersson B. Photoinhibition of photosystem II. Inactivation, protein damage and turnover. BBA-Bioenergetics, 1993, 1143: 113–134
[5] Havaux M, Davaud A. Photoinhibition of photosynthesis in chilled potato leaves is not correlated with a loss of photosystem II activity. Photosynth Res, 1994, 40: 75–92
[6] Sonoike K, Terashima I. Mechanism of photosystem I photoinhibition in leaves of Cucumis sativus L. Planta, 1994, 194: 287–293
[7] 孙山, 张立涛, 王家喜, 王少敏, 高华君, 高辉远. 低温弱光胁迫对日光温室栽培杏树光系统功能的影响. 应用生态学报, 2008, 19: 512–516
Sun S, Zhang L T, Wang J X, Wang S M, Gao H J, Gao H Y.Effects of low temperature and weak light on the functions of photosystem in Prunusarme. Chin J Appl Ecol, 2008, 19: 512–516 (in Chinese with English abstract)
[8] Sonoike K. Photoinhibition of photosystem I: its physiological significance in the chilling sensitivity of plants. Plant Cell Physiol, 1996, 37: 239–247
[9] Murata N, Takahashi S, Nishiyama Y, Allakhverdiev S I. Photoinhibition of photosystem II under environmental stress. Biochim Biophys Acta: Bioenergetics, 2007, 1767: 414–421
[10] Takahashi S, Murata N. How do environmental stresses accelerate photoinhibition? Trends Plant Sci, 2008, 13: 178–182
[11] Sonoike K. Photoinhibition of photosystem I. Physiol Plant, 2011, 142: 56–64
[12] Zhang Z S, Jia Y, Gao H Y, Zhang L, Li H, Meng Q W. Characterization of PSI recovery after chilling-induced photoinhibition in cucumber (Cucumis sativus L.) leaves. Planta, 2011, 234: 883–889
[13] Golbeck J H. Structure, function and organization of the photosystem I reaction center complex. Biochim Biophys Acta: Rev Bioenergetics, 1987, 895: 167–204
[14] Mi H, Klughammer C, Schreiber U. Light-induced dynamic changes of NADPH fluorescence in synechocystis PCC 6803 and its ndhB-defective mutant M55. Plant Cell Physiol, 2000, 41: 1129–1135
[15] Sonoike K. The different roles of chilling temperatures in the photoinhibition of photosystem I and photosystem II. J Photoch Photobio B, 1999, 48: 136–141
[16] Zhang S, Scheller H V. Photoinhibition of photosystem I at chilling temperature and subsequent recovery in Arabidopsis thaliana. Plant Cell Physiol, 2004, 45: 1595–1602
[17] Kim S J, Lee C H, Hope A B, Chow W S. Inhibition of photosystems I and II and enhanced back flow of photosystem I electrons in cucumber leaf discs chilled in the light. Plant Cell Physiol, 2001, 42: 842–848
[18] Munekage Y, Hojo M, Meurer J, Endo T, Tasaka M, Shikanai T. PGR5 is involved in cyclic electron flow around photosystem I and is essential for photoprotection in Arabidopsis. Cell, 2002, 110: 361–371
[19] Takahashi S, Milward S E, Fan D Y, Chow W S, Badger M R. How does cyclic electron flow alleviate photoinhibition in Arabidopsis? Plant Physiol, 2009, 149: 1560–1567
[20] Nuijs A M, Shuvalov V A, Van Gorkom H J, Plijter J J, Duysens L N. Picosecond absorbance difference spectroscopy on the primary reactions and the antenna-excited states in photosystem I particles. Biochim Biophys Acta: Bioenergetics, 1986, 850: 310–318
[21] Shikanai T. Cyclic electron transport around photosystem I: genetic approaches. Annu Rev Plant Biol, 2007, 58: 199–217
[22] Satoh K. Mechanism of photoinactivation in photosynthetic systems I: the dark reaction in photoinactivation. Plant Cell Physiol, 1970, 11: 15–27
[23] Sonoike K. Selective photoinhibition of photosystem I in isolated thylakoid membranes from cucumber and spinach. Plant Cell Physiol, 1995, 36: 825–830
[24] Kudoh H, Sonoike K. Irreversible damage to photosystem I by chilling in the light: cause of the degradation of chlorophyll after returning to normal growth temperature. Planta, 2002, 215: 541–548
[25] Niyogi K K. Safety valves for photosynthesis. Curr Opin Plant Biol, 2000, 3: 455–460
[26] Asada K. The water-water cycle in chloroplasts: scavenging of active oxygens and dissipation of excess photons. Annu Rev Plant Biol, 1999, 50: 601–639
[27] Miyake C, Shinzaki Y, Miyata M, Tomizawa K I. Enhancement of cyclic electron flow around PSI at high light and its contribution to the induction of non-photochemical quenching of Chl fluorescence in intact leaves of tobacco plants. Plant Cell Physiol, 2004, 45, 1426–1433
[28] 黄伟, 张石宝, 曹坤芳. 高等植物环式电子传递的生理作用.植物科学学报, 2012, 30: 100–106
Huang W, Zhang S B, Cao K F. Physiological role of cyclic electron flow in higher plants. Plant Sci J, 2012, 30: 100–106 (in Chinese with English abstract)
[29] Yamori W, Shikanai T. Physiological functions of cyclic electron transport around photosystem I in sustaining photosynthesis and plant growth. Annu Rev Plant Biol, 2016, 67: 81–106
[30] 邹陈, 陈冬花, 吉春容, 杨举芳, 尹育红, 李新建. 障碍型冷害对石河子棉区花铃期棉花生长的影响研究. 中国农学通报, 2012, 12: 54–59
Zou C, Chen D H, Ji C R, Yang J F, Yin Y H, Li X J. Experiments and studies about effect of obstacle cold disaster on cotton during the flowering and boll stages in the cotton region of Shihezi. Chin Agric Bull, 2012, 12: 54–59 (in Chinese with English abstract)
[31] 刘鹏, 孟庆伟, 赵世杰. 冷敏感植物的低温光抑制及其生化保护机制. 植物生理学通讯, 2001, 37: 76–82
Liu P, Meng Q W, Zhao S J. Chilling–induced photoinhibition and biochemical protective mechanism of chilling-sensitive plants. Plant Physiol Commun, 2001, 37: 76–82 (in Chinese with English abstract)
[32] 张旺锋, 王振林, 余松烈, 李少昆, 曹连莆, 王登伟. 氮肥对新疆高产棉花群体光合性能和产量形成的影响. 作物学报, 2002, 28, 789–796
Zhang W F, Wang Z L, Yu S L, Li S K, Cao L P, Wang D W. Effect of under–mulch–drip irrigation on canopy apparent photosynthesis, canopy structure and yield formation in high yield cotton of Xinjiang. Acta Agron Sin, 2002, 28: 789–796 (in Chinese with English abstract)
[33] 武辉, 戴海芳, 张巨松, 焦晓玲, 刘翠, 石俊毅, 范志超. 棉花幼苗叶片光合特性对低温胁迫及恢复处理的响应. 植物生态学报, 2014, 38: 1124–1134
Wu H, Dai H F, Zhang J S, Jiao X L, Liu C, Shi J Y, Fan Z C. Responses of photosynthetic characteristics to low temperature stress and recovery treatment in cotton seedling leaves. Chin J Plant Ecol, 2014, 38: 1124–1134 (in Chinese with English abstract)
[34] Liu Y F, Qi M F, Li T L. Photosynthesis, photoinhibition, and antioxidant system in tomato leaves stressed by low night temperature and their subsequent recovery. Plant Sci, 2012, 196: 8–17
[35] Kramer D M, Johnson G, KIIrats O, Edwards G E. New fluorescence parameters for the determination of QA redox state and excitation energy fluxes. Photosynth Res, 2004, 79: 209–218
[36] Genty B, Briantais J M, Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenchingof chlorophyll fluorescence. Biochim Biophys Acta: Gen Subjects, 1989, 990: 87–92
[37] Huang W, Yang S J, Zhang S B, Zhang J L, Cao K F. Cyclic electron Flow plays an important role in photoprotection for the resurrection plant Paraboea rufescens under drought stress. Planta, 2012, 235: 819–828
[38] Miyake C, Horiguchi S, Makino A, Shinzaki Y, Yamamoto H, Tomizawa K I. Effects of light intensity on cyclic electron Flow around PSI and its relationship to non-photochemical quenching of Chl fluorescence in tobacco leaves. Plant Cell Physiol, 2005, 46: 1819–1830
[39] Fan D Y, Hope A B, Jia H, Chow W S. Separation of light-induced linear, cyclic and stroma-sourced electron fluxes to P700+in cucumber leaf discs after pre-illumination at a chilling temperature. Plant Cell Physiol, 2008, 49: 901–911
[40] Huang W, Zhang S B, Cao K F. Cyclic electron flow plays an important role in photoprotection of tropical trees illuminated at temporal chilling temperature. Plant Cell Physiol, 2011, 52: 297–305
[41] Clarke J E, Johnson G N. In vivo temperature dependence of cyclic and pseudocyclic electron transport in barley. Planta, 2001, 212: 808–816
[42] Hendrickson L, Ball M C, Osmond C B, Furbank R T, Chow W S. Assessment of photoprotection mechanisms of grapevines at low temperature. Funct Plant Biol, 2003, 30: 631–642
[43] Kudoh H, Sonoike K. Irreversible damage to photosystem I by chilling in the light: cause of the degradation of chlorophyll after returning to normal growth temperature. Planta, 2002, 215: 541–548
[44] Wise R R. Chilling-enhanced photooxidation: the production, action and study of reactive oxygen species produced during chilling in the light. Photosynth Res, 1995, 45: 79–97
[45] Kudoh H, Sonoike K. Dark-chilling pretreatment protects PSI from light-chilling damage. J Photosci, 2002, 9: 59–62
[46] Sonoike K. Degradation of psaB gene product, the reaction center subunit of photosystem I, is caused during photoinhibition of photosystemI: possible involvement of active oxygen species. Plant Sci, 1996, 115: 157–164
[47] Kim S J, Lee C H, Hope A B, Chow W S. Photosystem I acceptor side limitation is a prerequisite for the reversible decrease in the maximum extent of P700 oxidation after short-term chilling in the light in four plant species with different chilling sensitivities. Physiol Plant, 2005, 123: 100–107
[48] Li J W, Zhang S B. Differences in the responses of photosystems I and II in Cymbidium sinense and C. tracyanum to long-term chilling stress. Front Plant Sci, 2015, 6: 1–10
[49] Kintake S. Photoinhibition and Protection of Photosystem I: Photosystem I. Springer Netherlands, 2007. pp 657–668
[50] 张子山, 张立涛, 高辉远, 贾裕娇, 部建雯, 孟庆伟. 不同光强与低温交叉胁迫下黄瓜PSI与PSII的光抑制研究. 中国农业科学, 2009, 42: 4288–4293
Zhang Z S, Zhang L T, Gao H Y, Jia Y J, Bu J W, Meng Q W. Research of the photoinhibition of PSI and PSII in leaves of cucumber under chilling stress combined with different light intensities. Sci Agric Sin, 2009, 42: 4288–4293 (in Chinese with English abstract)
[51] Yamori W, Shikanai T. Physiological functions of cyclic electron transport around photosystem I in sustaining photosynthesis and plant growth. Annu Rev Plant Biol, 2016, 67: 81–106
[52] Barth C, Krause H G. Study of tobacco transformants to assess the role of chloroplastic NAD(P)H dehydrogenase in photoprotection of photosystems I and II. Planta, 2002, 216: 273–279
[53] Zivcak M, Kalaji H M, Shao H B, Olsovska K, Brestic M. Photosynthetic proton and electron transport in wheat leaves under prolonged moderate drought stress. J Photoch Photobiol B, 2014, 137: 107–115
Effects of Low Temperature on PSI and PSII Photoinhibition in Cotton Leaf at Boll Stage
XIAO Fei1, YANG Yan-Long2, WANG Ya-Ting2, MA Hui2, and ZHANG Wang-Feng2,*
1College of Life Science, Shihezi University, Shihezi 832003, China;2College of Agriculture, Shihezi University / Key Laboratory of Oasis Ecology Agriculture of Xinjiang Production and Construction Corps, Shihezi 832003, China
Cotton (Gossypium hirsutum L.) variety Xinluzao 45 was grown in pots under low temperature until bolling stage and the seedings were moved in phytotron in northern Xinjiang. Chl fluorescence and P700+absorbance signal were determined simultaneously by Dual-PAM-100. The treatment was day/night temperature of 16°C/10°C with a suitable temperature condition (30°C/18°C) as control. The light-adapted maximum quantum yield of PSII (Fv′/Fm′), photochemical quenching coefficient (qP) and effective quantum yield of PSII [Y(II)] decreased significantly under low temperature stress. Low temperature significantly increased non-photochemical quantum yield of PSI caused by donor side limitation [Y(ND)]. The yield of regulated energy dissipation [Y(NPQ)] and non-regulated energy dissipation of PSII [Y(NO)] were significantly increased, including reversible photoinhibition in cotton leaf. Compared with control, low temperature stress significantly decreased the acceptor side limitation of PSI [Y(NA)] and increased donor side limitation of PSI [Y(ND)], while effective PSI complex content (Pm) was not significantly decreased, suggesting that PSI in cotton leaf is insensitive to low temperature compared with PSII. The quantum yield of cyclic electron flow [Y(CEF)] and the ratio of [Y(CEF)] to the effective quantum yield of PSII [Y(CEF)/Y(II)] were enhanced by low temperature stress in cotton suggesting that stimulation of cyclic electron flow plays an important role in protecting PSI and PSII from photoinhibition caused by low temperature stress in cotton. Furthermore, the non-photochemical quenching (NPQ) and regulated heat dissipation [Y(NPQ)] had significantly positive correlation with the quantum yield of cyclic electron flow[Y(CEF)], indicating that the strong excess excitation energy due to the overclosure of PSII reaction center results in reversible photoinhibition of PSII under low temperature stress. In conclusion, the strong stimulation of cyclic electron flow and regulated heat dissipation powerfully prevent PSII and PSI of cotton from photoinhibition and photodamage induced by low temperature stress, which may be the main mechanism of the insusceptibility of PSI in cotton to low temperature stress.
Cotton; Low temperature; Photoinhibition; Photosynthesis; Cyclic electron transport flow
(
): 2017-01-10; Accepted(接受日期): 2017-05-10; Published online(网络出版日期): 2017-05-25.
10.3724/SP.J.1006.2017.01401
本研究由国家自然科学基金项目(U1203283)资助。
This study was supported by the National Natural Science Foundation of China (U1203283).
*通讯作者(Corresponding author): 张旺锋, E-mail: zhwf_agr@shzu.edu.cn, Tel: 0993-2057326
联系方式: E-mail: 15699321528@163.com, Tel: 15699321528
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170525.1021.004.html
