基因检测在急性冠脉综合征患者PCI术后个体化抗血小板治疗中的应用
2017-09-07徐金军咸宁市中心医院湖北科技学院附属第一医院药剂科湖北咸宁437100南方医科大学南方医院药学部广州510515
徐金军,郑 萍(1.咸宁市中心医院/湖北科技学院附属第一医院药剂科,湖北咸宁 437100;2.南方医科大学南方医院药学部,广州 510515)
基因检测在急性冠脉综合征患者PCI术后个体化抗血小板治疗中的应用
徐金军1*,郑 萍2#(1.咸宁市中心医院/湖北科技学院附属第一医院药剂科,湖北咸宁 437100;2.南方医科大学南方医院药学部,广州 510515)
目的:探讨基因检测在急性冠脉综合征(ACS)患者经皮冠状动脉介入治疗(PCI)术后氯吡格雷个体化抗血小板治疗中的应用价值。方法:临床药师参与3例ACS患者PCI术后抗血小板治疗,综合分析其病变复杂程度、支架长度及数量、并发症、吸烟史等发生支架内血栓的危险因素,建议行氯吡格雷相关基因[细胞色素P450(CYP)2C19、对氧磷酶1(PON1)、三磷酸腺苷结合盒亚家族B成员1(ACBC1)等]检测,并根据检测结果分别提出更换其他类别的抗血小板药、维持原治疗方案并增加监测强度等建议。结果:医师采纳临床药师建议。综合基因检测结果及患者临床因素优化抗血小板治疗方案后,3例患者病情稳定,均带药出院。结论:基因检测可为ACS患者PCI术后个体化抗血小板治疗方案的制订提供依据,可作为临床药师开展药学服务的切入点之一。临床药师在进行基因检测时,应对ACS患者进行血栓风险评估,选择适宜的检测人群;同时应在基因检测的基础上,综合评估患者的用药依从性、支架内血栓风险、药物疗效及不良反应等临床因素和循证药学证据,优化抗血小板治疗方案,以保证用药的安全、有效。
氯吡格雷;急性冠脉综合征;经皮冠状动脉介入治疗;基因检测;临床药师;抗血小板治疗
目前,以经皮冠状动脉介入治疗(PCI)为代表的血运重建已成为急性冠脉综合征(ACS)患者最重要的治疗手段。阿司匹林联合血小板P2Y12受体阻滞药抗血小板治疗是PCI术后预防支架内血栓以及ACS二级预防的常规措施[1]。PCI能显著减少临床心血管事件的发生,然而由于患者用药依从性、药物相互作用、冠心病危险因素和基因变异等个体差异,导致患者PCI术后主要心血管不良事件仍时有发生[2]。其中,经氯吡格雷抗血小板治疗后血小板高反应性(HPR)是PCI术后抗血小板治疗失败的重要原因,约16%~50%接受氯吡格雷治疗的患者存在HPR,且HPR患者不良心血管事件的发生风险显著增加[3-4]。已有研究表明,氯吡格雷代谢酶基因多态性在氯吡格雷抗血小板治疗反应多样性中具有决定性的作用[5]。本文通过介绍临床药师参与ACS患者PCI术后抗血小板治疗,探讨基因检测在个体化抗血小板治疗中的应用,为抗血板治疗的临床个体化、合理用药提供参考。
1 病例1
1.1 病例资料
患者男性,46岁,身高165 cm,体质量71 kg。因“间断胸闷10 d”于2016年1月8日入院(南方医科大学南方医院,以下简称“我院”)。3 d前患者于当地医院就诊,心电图示Ⅱ、Ⅲ、aVF可见异常Q波,ST段轻度抬高,超敏肌钙蛋白0.223 μg/L;给予阿司匹林、氯吡格雷、瑞舒伐他汀和单硝酸异山梨酯对症治疗,患者胸闷症状好转,为求进一步治疗至我院。既往无高血压、糖尿病病史;吸烟史20余年,平均20支/d;有糖尿病、脑血栓等家族史。
入院查体:体温36.3℃,血压118/74 mmHg(1 mmHg=0.133 kPa);心率69次/min,律齐,各瓣膜听诊区未闻及病理性杂音;心电图未见异常;实验室检查示低密度脂蛋白胆固醇(LDL-C)3.49 mmol/L。
入院诊断:不稳定型心绞痛。
1.2 治疗过程
入院后,给予阿司匹林肠溶片0.1 g,po,qd+硫酸氢氯吡格雷片75 mg,po,qd抗血小板,并予阿托伐他汀钙片20 mg,po,qn+单硝酸异山梨酯缓释胶囊50 mg,po,qd+盐酸曲美他嗪片20 mg,po,tid+泮托拉唑钠肠溶片40 mg,po,qd等常规治疗,患者未再发生胸闷。1月19日,行冠脉造影+经皮腔内冠状动脉成形术(PTCA)+ PCI。冠脉造影示冠脉分布呈均衡型,左主干(LM)末端95%狭窄;左前降支(LAD)起始部90%狭窄,心肌梗死溶栓治疗(TIMI)血流分级2级;左回旋支(LCX)起始部90%狭窄,TIMI血流分级2级;右冠状动脉(RCA)未见明显狭窄,TIMI血流分级3级。术中在LM末端至LAD近端植入3.0 mm×18 mm Firebird支架,LM末端至LCX近端植入3.0 mm×13 mm Firebird支架,LAD近端中远端植入3.0 mm×23 mm Firebird支架。术后继续给予同等剂量的阿司匹林+氯吡格雷+阿托伐他汀钙对症治疗。由于该患者存在发生支架内血栓的高危因素,临床药师建议行氯吡格雷相关基因检测。1月25日,基因检测结果示该患者基因型为细胞色素P450(CYP)2C19*2 GA、对氧磷酶1(PON1)GA、三磷酸腺苷结合盒亚家族B成员1(ABCB1)TT型,详见表1。临床药师建议将氯吡格雷更换为替格瑞洛片90 mg,po,bid。医师采纳临床药师建议。患者病情平稳,于2 d后带药出院。

表1 病例1氯吡格雷相关基因的检测结果Tab 1 Results of genetic testing of clopidogrel in case 1
2 病例2
2.1 病例资料
患者男性,61岁,身高172 cm,体质量80 kg。因“胸痛3年余,PCI术后1年余,再发疼痛8 h”于2016年3月27日入院。患者2012年出现心前区疼痛,给予药物治疗;2014年11月行PCI,提示“左主干及三支病变”,在RCA中端闭塞段植入3.0 mm×38 mm PROMUS Element Long支架1枚;2014年12月再于LAD中远端至近端跨LM串联植入支架3枚,术后继续行冠心病二级预防治疗。8 h前患者出现心前区针刺样疼痛,且呈持续性加重,休息后无明显好转,为求进一步治疗至我院。既住高血压病史5年,最高血压170/110 mmHg,未规律诊治;2型糖尿病病史2年;吸烟史30余年,平均20支/d。
入院查体:体温36.5℃,血压110/72 mmHg;心率60次/min,律齐,各瓣膜听诊区未闻及病理性杂音;心电图示窦性心律;实验室检查示糖化血红蛋白(HbA1c)6.2%,三酰甘油3.27 mmol/L;其余未见明显异常。
入院诊断:(1)冠状动脉粥样硬化性心脏病,不稳定型心绞痛,PCI术后;(2)高血压3级,极高危;(3)2型糖尿病。
2.2 治疗过程
入院后,给予阿司匹林肠溶片0.1 g,po,qd+硫酸氢氯吡格雷片75 mg,po,qd,并予瑞舒伐他汀钙片20 mg,po,qd+单硝酸异山梨酯缓释胶囊50 mg,po,qd+替米沙坦片80 mg,po,qd+琥珀酸美托洛尔缓释片47.5 mg,po,qd+阿卡波糖片50 mg,po,tid等常规治疗。第2天行冠脉造影术+PTCA+PCI。冠脉造影示冠脉分布呈左优势型,LM原支架与LAD原支架内均未见明显狭窄,TIMI血流分级3级;LCX开口50%狭窄,近端80%狭窄,远端两支大钝缘支(OM)完全闭塞,TIMI血流分级0~1级;RCA近端动脉硬化长病变,约60%狭窄,中远端原支架内未见明显狭窄,远端动脉硬化,TIMI血流分级3级。术中于LCX远端至开口顺序植入2.5 mm×33 mm、3.0 mm×18 mm Firebird支架,两支架重叠2 mm。术后继续行抗血小板治疗。3月31日,基因检测结果示该患者为CYP2C19*3 GA、PON1 GA型,详见表2。临床药师综合考虑患者用药依从性及相关危险因素,建议维持原治疗方案,并增加监测强度,必要时可将氯吡格雷增加至150 mg,po,qd或改用三联抗血小板治疗方案。医师采纳前者,维持原治疗方案。患者术后未再发生胸痛,于2 d后带药出院。
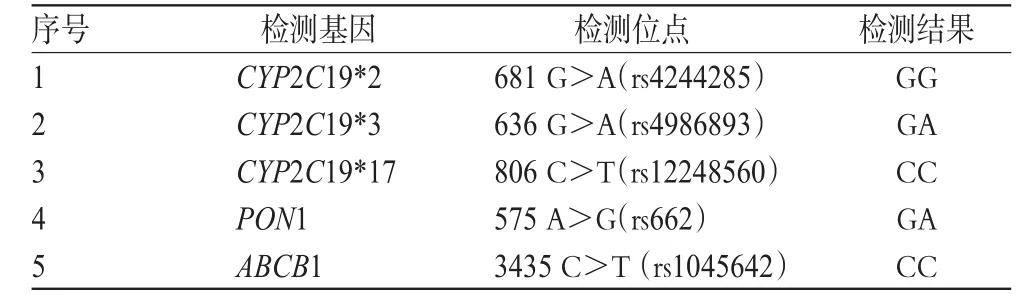
表2 病例2氯吡格雷相关基因的检测结果Tab 2 Results of genetic testing of clopidogrel in case 2
3 病例3
3.1 病例资料
患者男性,58岁,身高169 cm,体质量69 kg。因“胸痛7年,胸闷、心悸9 d”于2016年1月14日入院。患者7年前诊断为“急性心肌梗死”,行溶栓治疗,此后无类似症状发作。9 d前患者无明显诱因出现胸前区、剑突下闷痛,发作时感心悸,为进一步诊断及治疗至我院。既往高血压病史7年,最高血压170/95 mmHg,血压控制情况不详;否认糖尿病史;吸烟史30余年,平均10支/d,已戒烟7年。
入院查体:体温36.5℃,血压139/76 mmHg;心率59次/min,律齐,各瓣膜听诊区未闻及病理性杂音;心电图示窦性心律,ST-T改变;实验室检查示尿酸453 μmol/L,血肌酐133 μmol/L,三酰甘油2.20 mmol/L;血管彩超示双侧颈动脉硬化伴多发斑块形成,双侧椎动脉血流阻力增高。
入院诊断:(1)冠状动脉粥样硬化性心脏病,不稳定型心绞痛,陈旧性心肌梗死,心功能Ⅰ级;(2)高血压2级,极高危;(3)双侧颈动脉硬化伴多发斑块形成;(4)左侧椎动脉狭窄;(5)痛风(缓解期)。
3.2 治疗过程
入院后查LDL-C 3.49 mmol/L。给予阿司匹林肠溶片0.1 g,po,qd+硫酸氢氯吡格雷片75 mg,po,qd抗血小板,并予替米沙坦片80 mg,po,qd+阿托伐他汀钙片20 mg,po,qd等常规治疗。1月16日,患者再次出现胸前区闷痛,予硝酸甘油片0.5 mg含服后缓解。1月19日行冠脉造影+PTCA+PCI。冠脉造影示冠脉分布呈左优势型,LM未见狭窄,LAD近中端动脉硬化,管腔30%狭窄,TIMI血流分级3级;LCX未见明显狭窄,TIMI血流分级3级;RCA全程弥散性病变、中端发出粗大锐缘支后管腔闭塞,TIMI血流分级0级,可见间隔支、对角支向右冠发出3级侧支循环。术中在RCA锐缘支开通后植入2.5 mm×18 mm、2.75 mm×33 mm、3.0 mm×38 mm Promus Elemen支架3枚。术后继续给予同等剂量的阿司匹林+氯吡格雷抗血小板治疗。1月21日,基因检测结果示该患者为CYP2C19*2 GA、PON1 GA、ABCB1 TT型,详见表3。临床药师综合考虑患者PCI结果、血栓危险因素,与医师达成共识,维持原抗血小板治疗方案。患者术后病情平稳,于2 d后带药出院。
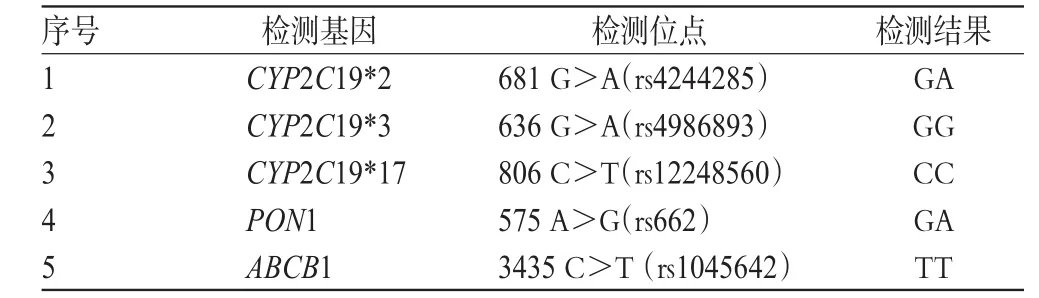
表3 病例3氯吡格雷相关基因的检测结果Tab 3 Results of genetic testing of clopidogrel in case 3
4 分析与讨论
4.1 氯吡格雷相关基因检测的必要性
氯吡格雷为前体药物,其在小肠的吸收受ABCB1基因编码的质子泵P糖蛋白(P-gp)调控,85%的药物经酯酶水解失活,15%代谢为活性化合物,发挥抗血小板作用[6]。氯吡格雷活化主要受肝药酶系调控,经两步催化代谢为硫醇活性化合物,其中CPY2C19酶参与了该过程,并发挥了主要作用[7]。近年来,相关研究还发现氯吡格雷第二步水解活化过程主要由PON1酶催化完成[8]。因此,参与编码氯吡格雷代谢酶的基因变异对氯吡格雷药动学和药效学均具有重要影响,是其抗血小板治疗反应多样性最重要的影响因素。氯吡格雷药动学、药效学通路上的基因多态性与PCI术后患者发生氯吡格雷抵抗及心血管事件密切相关[9]。故开展氯吡格雷相关基因检测可为个体化抗血小板治疗提供有力的参考。
4.2 氯吡格雷基因检测的目标人群
现有研究结果表明,氯吡格雷抗血小板作用对绝大多数患者是敏感的,患者PCI术后发生HPR的概率约为20%[4]。基因检测具有一定的选择性,对PCI术后存在血栓高危因素的患者以及PCI术后发生缺血事件的患者进行基因检测意义更大,目前暂不推荐常规进行。因此,在临床开展氯吡格雷相关基因检测,需甄选出适宜人群。
Meta分析表明,冠脉病变复杂程度、支架长度和数量、ACS、糖尿病、吸烟与否和分叉/开口处病变等因素均是支架内血栓风险的独立预测因子,这类患者发生支架内血栓的风险明显升高[10]。此外,支架早期血栓与CYP2C19基因多态性密切相关[2],对于拟行PCI且伴有高危血栓风险的患者,应在抗血小板治疗时尽早进行基因检测。因此,临床药师在开展个体化治疗时,应首先对患者进行危险分层,把握时机,有针对性地进行基因检测,才能使患者最终获益。病例1和病例3均表现为LM病变、多支病变,病例2则发生了PCI术后心肌缺血事件,上述3例患者植入支架数均超过了3枚,且有吸烟史,均具有PCI术后发生支架内血栓的独立危险因素。因此,这3例患者是PCI术后需要密切关注抗血小板治疗效果的人群,建议对其进行相关基因的检测。
4.3 氯吡格雷相关基因的检测项目
氯吡格雷药物代谢酶基因变异在不同种族中的发生率差别较大,不同的基因变异对于氯吡格雷药动学和药效学的影响也存在差异[5]。目前,发现与氯吡格雷抗血小板作用关联性较大的基因主要包括CYP2C19、ABCB1、PON1;研究最多的是CYP2C19基因,特别是CYP2C19*2。现已发现的CYP2C19有27个等位基因,在不同的种族中分布频率较高且较稳定的主要是CYP2C19*1、*2、*3和*17,其中CYP2C19*2、*3和*17在我国人群中的分布频率分别为24%~25%、2%~3%和1.2%~3%[11-12]。CYP2C19*1是维持氯吡格雷正常代谢功能的等位基因,而*2~*8为代谢功能缺失型等位基因,*17为功能增强型等位基因(主要与出血事件有关)。根据CYP2C19不同基因型可分为超快代谢型(UM,携带1~2个功能增强型等位基因)、正常代谢型(EM)、中间代谢型(IM,携带1个功能缺失型等位基因)和慢代谢型(PM,携带2个功能缺失型等位基因)。一项大型临床研究结果显示,CYP2C19基因型与冠心病患者(尤其是PCI术后患者)心血管不良事件的发生密切相关[9],CYP2C19功能缺失型等位基因是ACS患者PCI术后发生缺血事件的独立危险因素[13]。2010年,美国FDA对氯吡格雷说明书进行了第3次修订,并发布黑框警告,提出可以对患者CYP2C19基因型进行检测,分析患者氯吡格雷代谢特征,对于代谢不良者,可考虑更换抗血小板药物或增加氯吡格雷的剂量。
ABCB1 3435 C>T基因变异直接影响小肠P-gp的表达,从而影响氯吡格雷在小肠的吸收。目前,虽然没有充足的证据支持ABCB1基因型是PCI术后患者发生心血管事件的独立危险因素,但是其高表达仍与PCI术后患者发生心血管不良事件密切相关[9]。PON1酶活性对氯吡格雷活性代谢物的生成速率具有重要影响,然而PON1 Q192R(rs662,575A>G)基因多态性与氯吡格雷药效学的相关性仍存有争议[14],尚需要更大样本量的前瞻性研究予以证实。
在判断患者氯吡格雷代谢型时,若仅考察CYP2C19*2、CYP2C19*3和PON1 3个基因的多态性,有可能将部分IM型判定为PM型,同时也无法判断常规剂量氯吡格雷所导致的出血风险[15]。而同时考察CYP2C19* 2、CYP2C19*3、CYP2C19*17和PON1等多个位点时,则可准确判断氯吡格雷代谢型,并有助于判断出血(尤其是脑出血)的风险[16]。因此,临床药师对上述3例患者的CYP2C19*2、CYP2C19*3、CYP2C19*17、ABCB1和PON1等基因多态性进行了检测。
4.4 氯吡格雷基因导向的个体化给药
大量证据表明,氯吡格雷基因多态性(特别是CYP2C19等位基因多态性)与其活性代谢物水平、抗血小板治疗效果及临床终点(尤其是支架内血栓的发生)密切相关[2,17]。对于携带CYP2C19功能缺失型等位基因的患者,国内外指南大多推荐增加氯吡格雷剂量或选用新型P2Y12受体阻滞药替代。同时需注意,导致HPR的除了基因多态性之外,还与患者的临床因素密切相关,基因型并不等同于血小板反应性,也不完全等同于缺血事件。有文献报道,基因型在氯吡格雷抗血小板治疗反应个体差异中所起的作用约为2%~12%[18-19]。因此,以基因为导向的个体化给药,还必须充分考虑患者的临床因素。
病例1和病例3的基因检测结果完全相同,均携带CYP2C19*2杂合子等位基因,属于IM型。对于该型患者而言,可以通过调整剂量或使用新型P2Y12受体阻滞药来优化抗血小板治疗效果,但氯吡格雷有效剂量仍存在较大的个体差异[20];病例1和病例3均存在ABCB1基因突变,提示氯吡格雷可能在其小肠内吸收较弱。有文献报道提示,同时携带CYP2C19功能缺失型等位基因和ABCB1 TT基因型的患者,PCI术后15个月内主要终点事件的累计发生率约为非携带者的2倍[13]。此外,这2例患者均为PON1杂合突变型,提示氯吡格雷经PON1酶生物活化水平有所减弱[8]。病例1和病例3的基因检测结果显示,两者的危险分层相同。病例1的危险因素包括超重(BMI>25 kg/cm2)、吸烟史、家族史。临床药师考虑到患者无高血压、糖尿病、高血脂等危险因素,但其为中年首次发病、冠脉病变严重,且为LM、LAD和LCX分叉处血管病变,同时置入3枚支架,具备多个独立危险因素,发生支架内血栓的风险明显增高[10]。经与医师协商后最终选用较氯吡格雷作用更强且不受基因多态性影响的非前体药物替格瑞洛联合阿司匹林抗血小板治疗[21]。病例3的主要危险因素为高血压、吸烟史、高龄,冠脉病变表现为单支,且置入支架的病变血管为右冠锐缘支,故患者发生支架内血栓的危险因素相对较少,发生支架内血栓的风险相对较低。综合以上因素,临床药师与医师达成一致,维持该患者PCI术后抗血小板治疗方案,加强降压治疗和降脂治疗等二级预防措施,并嘱其3~6个月后复查冠脉造影。
病例2携带CYP2C19*3杂合子功能缺失等位基因和PON1突变杂合子,属于IM型,ABCB1基因提示肠道吸收功能正常。该患者存在高血压、糖尿病和吸烟史等多种危险因素,且有PCI史,但未见之前支架内狭窄和血栓,冠脉病变表现为左主干及三支病变,共置入6枚支架。评估该患者用药依从性不佳,临床药师考虑到PCI术后1年余再发生心血管事件与上述危险因素控制不佳的关系较大、氯吡格雷超大剂量的出血风险及患者经济情况等因素,与医师协商后暂维持原治疗方案,并增加监测强度,必要时增加氯吡格雷剂量至150 mg,po,qd或改用西洛他唑+阿司匹林+氯吡格雷三联抗血小板治疗方案[22],以获得更好的治疗效果。
5 结语
阿司匹林联合氯吡格雷是目前大多数指南推荐的PCI术后标准抗血小板疗法,可显著降低ACS患者PCI术后发生不良心血管事件的风险。但由于患者遗传因素、临床因素等个体差异导致氯吡格雷抗血小板治疗反应性降低,血栓事件仍时有发生。基因检测可为ACS患者PCI术后制订个体化的抗血小板治疗方案提供依据,是临床药师开展个体化药学服务的工作切入点之一。临床药师在开展基因检测时,应首先对患者进行血栓风险评估,选择适宜的基因检测人群。但基因检测只是临床决策的依据之一,临床药师应在基因检测的基础上,综合评估患者并存的心血管危险因素、用药依从性、药物疗效及不良反应、支架内血栓风险等临床因素和循证药学证据,优化抗血小板治疗方案,以期获得更好的治疗效果,同时减少不良反应的发生,以保证用药的安全、有效。
[1] Amsterdam EA,Wenger NK,Brindis RG,et al.2014 AHA/ACC guideline for the management of patients with non-ST-elevation acute coronary syndromes:executive summary:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].Circulation,2014,130(25):2354-2394.
[2] Mega JL,Simon T,Collet JP,et al.Reduced-function CYP2C19 genotype and risk of adverse clinical outcomes among patients treated with clopidogrel predominantly for PCI:a meta-analysis[J].JAMA,2010,304(16):1821-1830.
[3] Mallouk N,Labruyère C,Reny JL,et al.Prevalence of poor biological response to clopidogrel:a systematic review[J].Thromb Haemost,2012,107(3):494-506.
[4] Snoep JD,Hovens MM,Eikenboom JC,et al.Clopidogrel nonresponsiveness in patients undergoing percutaneous coronary intervention with stenting:a systematic review and meta-analysis[J].Am Heart J,2007,154(2):221-231.
[5] Freedman JE,Hylek EM.Clopidogrel,genetics,and drug responsiveness[J].N Engl J Med,2009,360(4):411-413.
[6] Taubert D,von Beckerath N,Grimberg G,et al.Impact of P-glycoprotein on clopidogrel absorption[J].Clin Pharmacol Ther,2006,80(5):486-501.
[7] Kazui M,Nishiya Y,Ishizuka T,et al.Identification of the human cytochrome P450enzymes involved in the two oxidative steps in the bioactivation of clopidogrel to its pharmacologically active metabolite[J].Drug Metab Dispos,2010,38(1):92-99.
[8] Bouman HJ,Schömig E,van Werkum JW,et al.Paraoxonase-1 is a major determinant of clopidogrel efficacy[J]. Nat Med,2011,17(1):110-116.
[9] Simon T,Verstuyft C,Mary-Krause M,et al.Genetic determinants of response to clopidogrel and cardiovascular events[J].N Engl J Med,2009,360(4):363-375.
[10] D’Ascenzo F,Bollati M,Clementi F,et al.Incidence and predictors of coronary stent thrombosis:evidence from an international collaborative meta-analysis including 30 studies,221 066 patients,and 4 276 thromboses[J].Int J Cardiol,2013,167(2):575-584.
[11] Chen L,Qin S,Xie J,et al.Genetic polymorphism analysis of CYP2C19 in Chinese Han populations from different geographic areas of mainland China[J].Pharmacogenomics,2008,9(6):691-702.
[12] Zhou Q,Yu XM,Lin HB,et al.Genetic polymorphism,linkage disequilibrium,haplotype structure and novel allele analysis of CYP2C19 and CYP2D6 in Han Chinese [J].Pharmacogenomics J,2009,9(6):380-394.
[13] Mega JL,Close SL,Wiviott SD,et al.Genetic variants in ABCB1 and CYP2C19 and cardiovascular outcomes after treatment with clopidogrel and prasugrel in the TRITONTIMI 38 trial:a pharmacogenetic analysis[J].Lancet,2010,376(9749):1312-1319.
[14] Mega JL,Close SL,Wiviott SD,et al.PON1 Q192R genetic variant and response to clopidogrel and prasugrel:pharmacokinetics,pharmacodynamics,and a meta-analysis of clinical outcomes[J].J Thromb Thrombolysis,2016,41(3):374-383.
[15] Scott SA,Sangkuhl K,Stein CM,et al.Clinical Pharmacogenetics Implementation Consortium guidelines for CYP2C19 genotype and clopidogrel therapy:2013 update [J].Clin Pharmacol Ther,2013,94(3):317-323.
[16] Sibbing D,Koch W,Gebhard D,et al.Cytochrome 2C19* 17 allelic variant,platelet aggregation,bleeding events,and stent thrombosis in clopidogrel-treated patients with coronary stent placement[J].Circulation,2010,121(4):512-518.
[17] Mega JL,Close SL,Wiviott SD,et al.Cytochrome P450polymorphisms and response to clopidogrel[J].N Engl J Med,2009,360(4):354-362.
[18] Shuldiner AR,O’Connell JR,Bliden KP,et al.Association of cytochrome P4502C19 genotype with the antiplatelet effect and clinical efficacy of clopidogrel therapy[J].JAMA,2009,302(8):849-857.
[19] Hochholzer W,Trenk D,Fromm MF,et al.Impact of cytochrome P4502C19 loss-of-function polymorphism and of major demographic characteristics on residual platelet function after loading and maintenance treatment with clopidogrel in patients undergoing elective coronary stent placement[J].J Am Coll Cardiol,2010,55(22):2427-2434.
[20] Mega JL,Hochholzer W,FrelingerAL,et al.Dosing clopidogrel based on CYP2C19 genotype and the effect on platelet reactivity in patients with stable cardiovascular disease[J].JAMA,2011,306(20):2221-2228.
[21] Wallentin L,James S,Storey RF,et al.Effect of CYP2C-19 and ABCB1 single nucleotide polymorphisms on outcomes of treatment with ticagrelor versus clopidogrel for acute coronary syndromes:a genetic substudy of the PLATO trial[J].Lancet,2010,376(9749):1320-1328.
[22] Jeong YH,Lee W,Choi BR,et al.Randomized comparison of adjunctive cilostazol versus high main-tenance dose clopidogrel in patients with high post-treatment platelet reactivity:results of the ACCEL-RESISTANCE(adjunctive cilostazol versus high maintenance dose clopidogrel in patients with clopidogrel resistance)randomized study[J].J Am Coll Cardiol,2009,53(13):1101-1109.
(编辑:张元媛)
Application of Genetic Testing in Individualized Antiplatelet Therapy for Acute Coronary Syndrome Patients after Percutaneous Coronary Intervention
XU Jinjun1,ZHENG Ping2(1.Dept.of Pharmacy,Xianning Central Hospital/the First Affiliated Hospital of Hubei University of Science and Technology,Hubei Xianning 437100,China;2.Dept.of Pharmacy,Nanfang Hospital of Southern Medical University,Guangzhou 510515,China)
OBJECTIVE:To investigate the value of genetic testing in clopidogrel individualized antiplatelet therapy for acute coronary syndrome(ACS)patients after percutaneous coronary intervention(PCI).METHODS:Clinical pharmacists participated in therapy for 3 ACS patients after PCI,and analyzed risk factors of stent thrombosis as the degree of lesion complexity,length and number of stents,complication,smoking history,etc.Clinical pharmacists suggested conducting clopidogrel genetic testing(CYP2C19,PON1,ACBC1),and suggested replacing antiplatelet agents,maintaining original plan and strengthening monitoring according to the results of genetic testing.RESULTS:The physicians adopted the suggestions of clinical pharmacists.After optimizing antiplatelet therapy according to the results of genetic testing and clinical factors,3 patients were stable and discharged from hospital with drugs.CONCLUSIONS:Genetic testing can provide evidence for the formulation of individualized antiplatelet therapy in ACS patients after PCI,and can be regarded as one of the breakthrough points for clinical pharmacists to carry out pharmaceutical care.In conducting genetic testing,clinical pharmacists should evaluate the risk of thrombosis in ACS patients and select the appropriate population for testing.At the same time,the clinical factors as medication compliance,stent thrombosis risk,therapeutic efficacy,ADR,and evidence-based pharmaceutical evidence should be comprehensively evaluated on the basis of genetic testing,and antiplatelet therapy plan should be optimized so as to guarantee the safety and effectiveness of drug use.
Clopidogrel;Acute coronary syndrome;Percutaneous coronary intervention;Genetic testing;Clinical pharmacists;Antiplatelet therapy
R973+.2
A
1001-0408(2017)23-3285-05
2016-09-01
2017-05-23)
*主管药师,硕士。研究方向:医院药学。电话:0715-8896013。E-mail:xu619@sina.com
#通信作者:副主任药师。研究方向:临床药学。电话:020-61641114。E-mail:zpm321@126.com
DOI10.6039/j.issn.1001-0408.2017.23.33
