环状RNA CircHIPK3通过miR-379调控IGF1表达促进非小细胞肺癌细胞系NCI-H1299与NCI-H2170的细胞增殖
2017-09-06田芳王云肖哲朱学军
田芳 王云 肖哲 朱学军
肺癌是世界上发病率和死亡率较高的肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)的发病人数约占肺癌的85%[1,2]。虽然对NSCLC的相关治疗已经取得了一定程度的进展,但是肺癌的5年生存率依然低于15%[3,4]。因此,研究其分子机制及发现新的治疗靶点对肺癌治疗至关重要。
环状RNA(circular RNA, circRNA)是一类广泛存在于哺乳动物体内的非编码RNA,主要参与生物体内基因调控[5-7]。CircRNA大部分来源于基因的外显子区域,也有少部分由内含子剪接形成[8,9]。与长链非编码RNA(long noncoding RNA, lncRNA)及microRNA(miRNA)不同之处在于,它们不具备5’端和3’端结构,而是由共价闭合的环状结构形成[10]。CircRNA广泛地参与到人类的生理和病理调控的过程中。环状RNA可以通过:①作为miRNA“海绵体”(miRNA sponge);②与蛋白结合互作;③和翻译成多肽等多种的方式发挥功能,在肿瘤研究中,环状RNA作为miRNA“海绵体”调控下游靶基因的机制已经被广泛报道[11-13]。目前发现多个环状RNA自身包含至少一个miRNA结合位点,因此,其可以作为RNA的“海绵体”吸附miRNA,从而通过竞争性内源RNAs(competing endogenous RNA, ceRNAs)的机制调控被miRNA抑制的下游靶基因的表达[11]。竞争性内源RNAs理论在2010年由Pandolfi等提出,研究发现在细胞中的长链非编码RNA、假基因RNA和环状RNA与编码蛋白的mRNA包含共同的可以被miRNA结合的位点,通过诱饵或“海绵”吸附的机制竞争性的结合miRNA,导致这些不同类型的RNA之间形成相互调控的网络,在细胞的各个生理过程中发挥重要的功能[14]。在现有研究[15]报道中,环状RNA ciRS-7和circFOXO3等都可以通过ceRNA的机制调控肿瘤细胞的发生与发展。环状RNA HIPK3(circular RNA HIPK3, circHIPK3)在肝、脑、肺中高表达,其主要起源于基因HIPK3的第二个外显子。HIPK3起源的环状RNA有3种剪接体,分别为circHIPK3、circHIPK3.1和circHIPK3.2。但是只有circHIPK3丰度较高,并且在细胞中具有显著的功能。研究发现circHIPK3可以结合多个miRNA,包括miR-124和miR-379等。在肝癌中,circHIPK3可以作为“海绵体”吸附miR-124,通过ceRNA机制上调miR-124下游靶基因IL6R和DXL2,从而促进肝癌细胞的增殖[16]。但NSCLC中环状RNA HIPK3的表达及调控机制尚未明晰。
此外,miR-379是抑制肿瘤细胞增殖的一类miRNA。在NSCLC中,miR-379可以增加肿瘤细胞对顺铂的敏感性,增强顺铂的杀伤能力[17]。研究表明在血管平滑肌细胞中,miR-379可以通过调控类胰岛素样生长因子(insulin like growth factor, IGF1)从而达到抑制了细胞增殖、侵袭与转移的作用。IGF1在前列腺癌、乳腺癌、肺癌等多种肿瘤细胞中高表达,促进肿瘤细胞的增殖[18]。本研究中,主要报道了circHIPK3在NSCLC细胞系NCI-H1299和NCI-H2170中的功能,并初步提出circHIPK3可以通过miR-379/IGF1促进NSCLC细胞系NCI-H1299和NCI-H2170细胞增殖的机制,希望能为NSCLC治疗提供了一个新的治疗靶点。
1 材料与方法
1.1 材料 NCI-H1299和NCI-H2170细胞株(购自ATCC细胞库);BCA蛋白含量检测试剂盒(购自北京全式金有限责任公司);RPMI-1640、高糖DMEM、胰酶(购自美国GIBCO公司);荧光定量Real-Time PCR试剂盒、点突变试剂盒(购自南京诺唯赞公司);RNA提取试剂Trizol、逆转录试剂盒、Lipo2000、DMSO、DEPC水(购自美国Invitrogen公司);引物(购于上海生物工程公司),IGF1多克隆兔抗(购于美国Abcam公司);山羊抗兔β-actin单克隆抗体、HRP标记的羊抗兔IgG、双萤光素酶报告基因检测试剂盒(购自南京碧云天公司);PVDF膜(购自美国Bio-Rad公司);ECL化学发光试剂盒(购自美国PS公司);核质分离试剂盒(购于美国Ambion公司);miR-379 mimics、miR-379 mimics control、miR-379 inhibitor和miR-379 inhibitor control(购自广州锐博公司);CCK-8试剂(购自日本同仁化学研究所);ModulusTM单管型多功能检测仪(购自美国Promega公司);IGF1 ELISA检测试剂盒(购于美国Life公司)。
1.2 方法
1.2.1 细胞培养 NCI-H1299和NCI-H2170细胞系的培养液成份为10%胎牛血清和RPMI-1640培养基,培养液含青霉素/链霉素100 U/mL。细胞培养于37oC、含5%CO2培养箱中,0.25%的胰酶常规消化,选择生长较好的对数期进行实验。
1.2.2 质粒构建及细胞转染 环状RNA过表达载体pLCDH-circRNA购广州自吉赛生物公司,序列circHIPK3(hsa_circ_0000284)来自数据库cirBase。用Fast pfu扩增circHIPK3序列,克隆构建过表达质粒pLCDH-circHIPK3。circHIPK3序列片段插入荧光素酶报告基因下游,构建包含circHIPK3的报告基因质粒pGL3-circHIPK3。采用点突变试剂盒突变circHIPK3与miR-379结合位点。pLCDH-circHIPK3慢病毒转染法感染细胞,48 h后以1 μg/mL浓度的嘌呤霉素筛选细胞株,鉴定稳转细胞系。实验组均设3个复孔。干扰siRNA购自锐博生物公司。除过表达外,其余质粒和siRNA通过脂质体法转入NCI-H1299或NCI-H2170细胞中,通过GFP荧光检测转染效率,所有质粒都通过测序鉴定。
1.2.3 核质分离实验及RNase R消化线性RNA实验 将NCI-H1299和NCI-H2170细胞分别以2×105个/孔铺入6孔板各3个孔,当细胞处于80%融合度时用0.25%的胰酶消化细胞,2,000 g离心2 min,根据核质分离试剂盒步骤,分别回收胞质和胞核RNA,nano 2000测定含量,储存待用。将RNA分为RNase消化组和非消化组两组,准备10×Reaction Buffer配制10 μL总反应体系,用于消化线性RNA,每1 μg RNA用1 U(1个单位)的RNase消化,37oC 10 min。随后用苯酚/氯仿、乙醇沉淀法提取消化产物,逆转录为cDNA,通过实时荧光定量PCR法检测circHIPK3在核质中的表达,实验共重复三次。
1.2.4 实时荧光定量PCR检测RNA表达水平 抽提样品RNA,经浓度和纯度测定后,逆转录合成cDNA样品,以β-actin为内参。将SYBR Green预混液、模板、上/下游引物、ddH2O配制成PCR反应溶液,置于Real-time PCR仪上进行PCR扩增反应。反应条件为:95oC 2 min预变性,然后按95oC 1 min,60oC 1 min,72oC 1 min,共40个循环,最后72oC 7 min延伸。结果通过2-△△CT法分析基因相对表达量。PCR引物序列见表1。
1.2.5 CCK-8检测细胞增殖实验 NCI-H1299和NCI-H2170细胞增殖检测实验主要通过CCK-8试剂盒完成。实验分为对照组和处理(过表达和敲低)组,采用96孔板中,每个孔铺大约1×103个细胞,培养5 d。加入CCK-8后,37oC孵育2 h,检测OD450的值。
1.2.6 平板克隆形成实验 实验分为对照组和NCI-H2170 circHIPK3沉默组,对照组和NCI-H1299 circHIPK3过表达组,每组按每孔接种约5×102个细胞于6孔板中,37oC培养两周后,用结晶紫染色计数,每个实验重复3个孔。
1.2.7 双荧光素报告基因实验 实验分为6组:pGL-3空质粒组、pGL-3-circHIPK3组、circHIPK3突变组、circHIPK3 siRNA组、miR-379 inhibitor组及miR-379 inhibitor control组。每组中都转染海肾萤光素酶内参质粒和miR-379 mimics。转染24 h后吸尽细胞培养液,根据试剂盒要求加入适量裂解液充分裂解细胞。10,000 g离心5 min后,取裂解液上清100 μL用于测定。以海肾萤光素酶为内参,用萤火虫萤光素酶测定得到的RLU值除以海肾萤光素酶测定得到的RLU值。根据得到的比值来比较不同样品目的报告基因的激活程度。
1.2.8 Western blot检测蛋白表达水平 在收集的蛋白样品中加入适量浓缩的蛋白上样缓冲液,100oC沸水浴加热3 min-5 min,以充分变性蛋白。经过跑胶、转膜、封闭、一抗、二抗及显影液孵育后,于Bio-Rad公司化学发光成像仪显影成像。

表 1 PCR引物序列Tab 1 The PCR primers sequence
1.2.9 IGF1 ELISA检测 将NCI-H1299细胞分为转染miR-379 mimics control和过表达miR-379 mimics、miR-379 inhibitor control及miR-379 inhibitor两组,以1 mL培养基重悬2×105个细胞为一孔,加入24孔板,每组做3个复孔。细胞培养72 h后,采用无菌管收集上清于3,000 g离心20 min。根据试剂盒说明,用纯化的IGF1抗体4oC包被96孔酶标板,并放置过夜。第2天封闭过后,往包被单抗的微孔中依次加入100 μL不同倍比稀释度的细胞上清,并加入用细胞培养基梯度稀释的对照样品,37oC孵育2 h。PBST洗涤5次,加入100 μL稀释后的HRP标记的二抗,37oC孵育1 h。PBST再次洗涤,显色剂显色20 min后终止反应,用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中人IGF1浓度,结果以差异倍数显示。
1.3 统计学方法 数据通过Graphad Prism软件作图和统计,以均数±标准差(Mean±SD)表示。实验均采用两独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 鉴定circHIPK3在NSCLC细胞系中的表达 首先分别以细胞NCI-H1299的基因组DNA(gDNA)和cDNA作为模板,通过PCR技术扩增circHIPK3包含成环位点(back spliced junction)的片段, 结果表明模板为cDNA组的PCR产物出现约100 bp的目的条带,并且基因组DNA不能非特性扩增circHIPK3(图1A)。Sanger测序结果验证了成环位点序列(图1B)。利用RNase R消化细胞NCI-H1299的RNA,qRTPCR结果显示RNase R处理前后,circHIPK3表达水平无明显变化,但是线性mHIPK3表达水平却显著降低(图1C,P<0.01)。进一步通过细胞核质分离实验证明circHIPK3主要存在于NCI-H1299和NCI-H2170的细胞质(图1D)。
2.2 过量表达circHIPK3促进NCI-H1299细胞的增殖 我们首先在NSCLC细胞系H1299、H827、H1975、H2170、H520、H1650中均检测到circHIPK3的表达,发现NCI-H2170表达量最高,NCI-H1299表达量最低(图2A)。在NCI-H1299细胞系中稳定转染circHIPK3,circHIPK3表达水平显著上调,mHIPK3无明显变化(图2B-图2C)。CCK-8实验结果显示实验组circHIPK3稳定表达株的OD450明显高于对照组(图2D, P<0.01),且其在平板克隆形成实验中的克隆数目多于对照组(图2E-图2F,P<0.01)。
2.3 沉默circHIPK3抑制NCI-H2170细胞系的增殖 我们订购了三条siRNA干扰circHIPK3的表达,其中si-circHIPK3-2有明显的干扰抑制效果(图3A)。干扰circHIPK3实验组的OD450显著低于对照组(图3B,P<0.01)。克隆形成数目也明显低于对照组(图3C-图3D,P<0.01)。
2.4 circHIPK3作为“海绵体”吸附miR-379 我们将circHIPK3的序列插入荧光素酶报告基因载体pGL3 promoter-luc单位的下游,与miR-379 mimics及内参质粒共转入293T和NCI-H1299细胞中后,相对于载体对照组(EV),实验组circHIPK3的荧光强度显著降低。突变circHIPK3与miR-379的结合位点,将突变质粒Luc-circHIPK3 mutant(mut-circ)与miR-379 mimics共转入293T和NCI-H1299中,荧光信号没有发生明显改变。此外,将si-circHIPK3(si-circ)、miR-inhibitor(miR-in)、Inhibitor control(IC)与miR-379 mimics共转入293T和NCI-H1299中,荧光强度也没有显著降低(图4A-图4B)。以上数据表明circHIPK3可以与miR-379结合,作为“海绵体”吸附miR-379。此外,我们同样验证了miR-379与IGF1 3’UTR的结合,双荧光素酶报告基因结果显示,miR-379可以与IGF1 3’UTR直接结合(图4C-图4D)。
2.5 circHIPK3通过circHIPK3/miR-379促进细胞增殖 在NCI-H1299中转入miR-379 mimics后,IGF1表达水平降低,转入miR-379 inhibitor发现IGF1表达水平上调(图5A-图5B,图5E,P<0.05)。在NCI-H2170中干扰抑制circHIPK3,发现IGF1表达量明显下调(图5C,图5E,P<0.05)。在过表达circHIPK3的NCI-H1299的细胞系中转入miR-379 mimics后,能部分下调IGF1的表达水平,同时能部分回复对细胞增殖的影响(图5D,图5F,P<0.05)。因此,在NCI-H1299和NCI-H2170中,circHIPK3通过miR-379调控IGF1表达促进细胞增殖。
3 讨论
越来越多的研究显示环状RNA在疾病的发生与发展中起着重要的作用。但是,目前只有CDR1as和circFOXO3研究的较为透彻。circHIPK3是另一个崭露头角的环状RNA,受到人们越来越多的重视。在正常细胞内,其表达丰度与其线性RNA相当,甚至更高。在肿瘤研究中发现,circHIPK3可以促进肝癌的增殖[16]。在本文中,我们主要报道了针对circHIPK3在NCI-H1299和NCI-H2170中的功能与初步的机制研究结果。过量表达的circHIPK3同样可以促进NSCLC细胞的增殖,此外,我们的研究更进一步发现,在NSCLC细胞系中,circHIPK3的促进增殖能力可以通过circHIPK3/miR-379发挥,目前研究发现 circHIPK3可以与多种miRNA结合,起到miRNA“海绵体”的作用。在肝癌中,circHIPK3可以吸附miR-124,从而调节miR-124的靶基因IL6R和DLX2,促进细胞增殖[16]。但是在NSCLC中,circHIPK3同样可以通过吸附miR-379。文献[18]报道发现,miRNA-379能够抑制IGF1的表达水平,我们猜测在NSCLC细胞系circHIPK3可能通过吸附miRNA-379促进IGF1的表达,从而影响细胞增殖。Western blot和ELISA证实,过量表达miRNA-379,IGF1的蛋白水平下调。干扰抑制miRNA-379可以上调IGF1的蛋白表达水平。过量表达circHIPK3可以促进IGF1的表达,但是干扰抑制circHIPK3却可以抑制IGF1的蛋白水平。双荧光光素酶报告基因实验表明,miR-379分别可以和circHIPK3及IGF1 mRNA直接结合。在稳转circHIPK3的NCI-H1299细胞系转入miR-379可以挽救circHIPK3过量表达的表型。至此,我们提出circHIPK3在NSCLC细胞系H1299和H2170中促进增殖的机制是通过circHIPK3/miRNA-379实现的。

图1 CircHIPK3在NSCLC细胞系中的鉴定。A:分别以基因组DNA和cDNA为模板,PCR扩增circHIPK3成环位点附近100 bp序列,白色矩形框表示目的条带区域;B:circHIPK3成环示意图及测序结果,红色箭头表示divergent primers,竖短黑线示意成环位点;C:RNase R消化后的mHIPK3和circHIPK3的丰度检测;D:circHIPK3在细胞核中与细胞质中的含量比较。**:与对照组相比,P<0.01。Fig 1 Identification of circHIPK3 in NSCLC cell lines. A: CircHIPK3 sequence about 100 bp around back splied junction was analyzed by PCR, and the white rectangle indicated DNA bands; B: Schematic diagram of circular point. Red arrows represented divergent primers, and vertical short black line indicated circular point; C: The levels of circHIPK3 and mHIPK3 were analyzed after RNase R digestion; D: Expression of circHIPK3 in both nuclear and cytoplasmic fractions were measured by qRT-PCR. **: compared with the control, P<0.01.
在细胞系中,我们发现circHIPK3在NCI-H2170高表达,在NCI-H1299低表达。所以,我们选择在NCI-H1299中稳定过表达circHIPK3,在NCI-H2170中干扰抑制circHIPK3。值得注意的是,环状RNA过表达的关键步骤在于成环,我们选用商业化的质粒去过表达circHIPK3,利用Real-time PCR的方法检验circHIPK3的表达量,希望能确定过表达的真实性。因为目前相关体外成环技术并不成熟,成环过程中会形成小部分错误成环的RNA,虽然本研究并没有检验错误成环的影响,但是通过干扰circHIPK3发现细胞的表型与过表达相反,证实细胞增殖的变化确实由circHIPK3的表达量变化引起。为了进一步研究circHIPK3调控NSCLC增殖的分子机制,本研究利用双荧光酶活性实验证明了circHIPK3和miR-379是直接结合,通过文献报道发现,miR-379可以直接结合靶基因IGF1的mRNA,抑制IGF1表达水平,从而抑制细胞增殖[18]。我们过表达miR-379后,IGF1的表达水平明显下调,说明miR-379在NSCLC细胞中同样可以结合IGF1的mRNA,抑制IGF1表达水平。过表达circHIPK3发现IGF1表达量上调,反之亦然,这就更加确定circHIPK3是可以调控IGF1的上游RNA。虽然文献报道,IGF1是一种重要的细胞生长和分化的调控因子,但是关于IGF1与细胞增殖的关系,本文主要参考相关文献报道,实验上并未做深入探讨,这也是本文的不足之处[19-21]。此外,本研究并未进一步证实circHIPK3的调控关系是否能在更多种的细胞系中重复,这一点也是今后研究的重要内容。
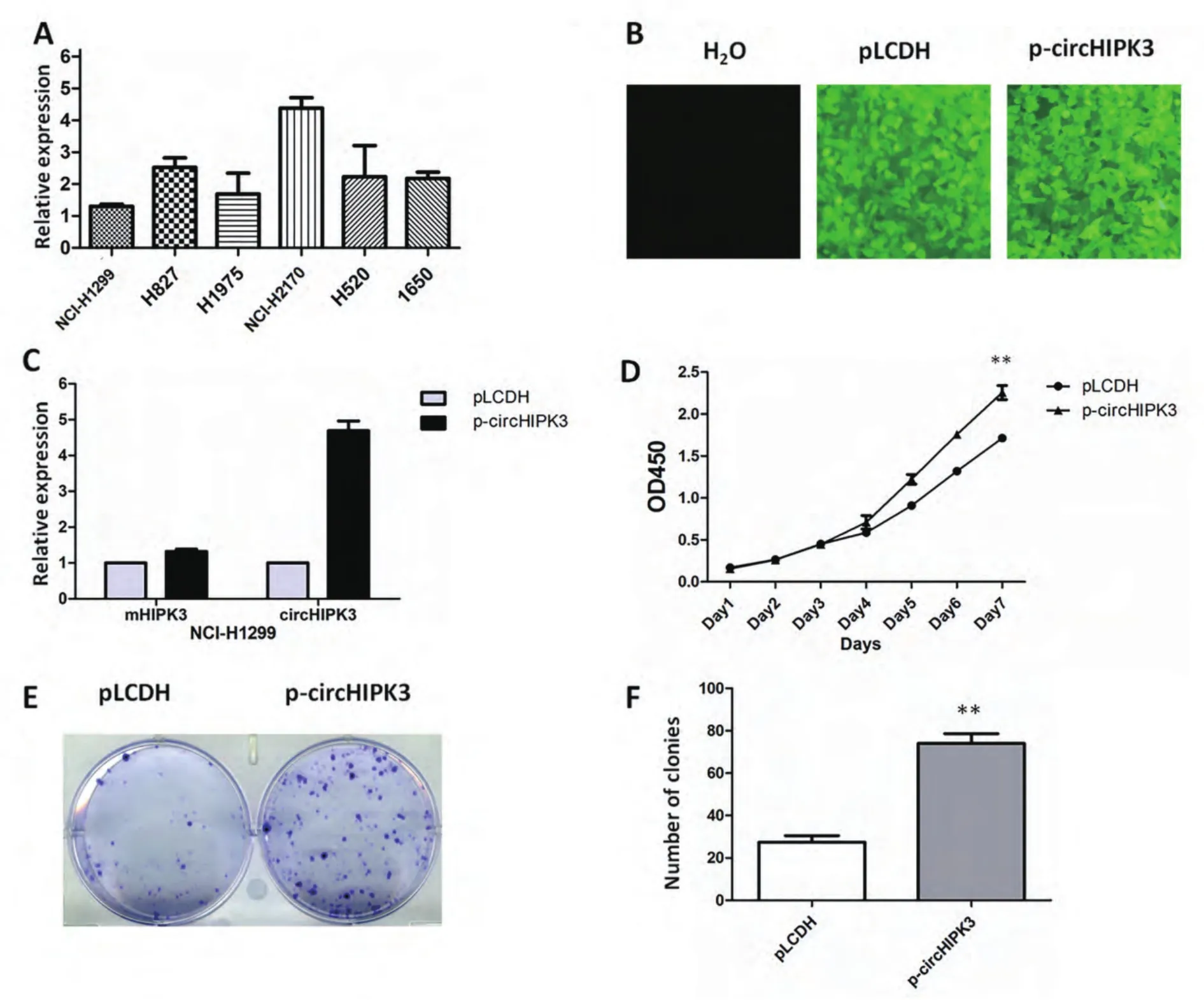
图2 过量表达circHIPK3促进NCI-H1299细胞增殖。A:circHIPK3在6株NSCLC细胞系中的表达量;B:稳定转染对照空质粒pLDCH和circHIPK后,NCI-H1299细胞表达载体携带的绿色荧光蛋白标记;C:过表达circHIPK后,细胞中circHIPK3及mHIPK3表达水平检测;D:CCK-8试验检测细胞增殖;E:平板克隆形成实验检测细胞增殖;F:克隆形成数目统计;**:与对照组相比,P<0.01。Fig 2 Overexpression of circHIPK3 promoted NCI-H1299 cells proliferation. A: The expression level of circHIPK3 in 6 kinds of NSCLC cell lines; B:The green fluorescent protein (GFP) indicated the successful and stable establishment of pLDCH/p-circHIPK3 NCI-H1299 cell line; C: Detection of circHIPK3 and mHIPK3 expression levels in NCI-H1299; D: The cell growth rate was measured by CCK-8 assay; E: Cell proliferation was assessed by colony formation assay; F: Statistics analysis of colony formation assay; **: compared with the control, P<0.01.

图3 沉默circHIPK3抑制NCI-H2170细胞系的增殖。A:cirHIPK3 siRNA敲降效果检测;B:CCK-8实验检测circHIPK3沉默后对细胞增殖的影响;C:平板克隆形成实验检测circHIPK3沉默后对细胞增殖的影响;D:克隆形成数目统计;**:与对照组相比,P<0.01。Fig 3 Silencing circHIPK3 inhibited NCI-H2170 cell proliferation. A: The knockdown efficiency of cirHIPK3 siRNAs; B: Cell proliferation was evaluated by CCK-8 assay; C: Cell proliferation was detected by colony formation assay; D: Statistics of colony formation assay; **:compared with the control, P<0.01.

图4 CircHIPK3作为“海绵体”吸附miR-379。A:荧光素酶报告基因实验检测miR-379分别和载体对照组EV、circHIPK3过表达组(circ)、circHIPK3敲低组(si-circ)、突变质粒Luc-circHIPK3组(mut-circ)、miR-inhibitor组(miR-in)及Inhibitor control组(IC)共转入293T细胞中的荧光素酶的相对荧光强度;B:荧光素酶报告基因实验检测miR-379分别和EV、circ、si-circ、mut-circ、miR-in及IC共转入NCI-H1299细胞中的荧光素酶的相对荧光强度;C:转入miR-379 mimics和IGF1 3’UTR后,293T细胞中荧光素酶的相对荧光强度检测;D:转入miR-379 mimics和IGF1 3’UTR后,NCI-H1299细胞中的荧光素酶相对荧光强度。*:与对照组相比,P<0.05。**:与对照组相比,P<0.01。Fig 4 CircHIPK3 could sequester miR-379. A: Luciferase relative activity of miR-379 in EV, circ, si-circ, mut-circ, miR-in and IC treated 293T cells; B:Luciferase relative activity of miR-379 in EV, circ, si-circ, mut-circ, miR-in and IC treated NCI-H1299 cells; C: Luciferase relative activity of miR-379 with IGF1 3’UTR in 293T cells; D: Luciferase relative activity of miR-379 with IGF1 3’UTR in NCI-H1299 cells. *: compared with the control, P<0.05.**: compared with the control, P<0.01.

图5 CircHIPK3通过circHIPK3/ miR-379通路促进细胞增殖。A:转入miR-379 mimics后,Western blot检测NCI-H1299细胞内IGF1的表达水平;B:转入miR-379 inhibitor后,Western blot检测NCI-H1299细胞内IGF1的表达水平;C:敲低circHIPK3后,Western blot检测NCI-H2170细胞内IGF1的表达水平;D:分别转染:对照pLCDH、p-circHIPK3、p-circHIPK3+miR-379 mimics共同处理组质粒后,Western blot检测NCI-H1299细胞内IGF1的表达水平;E:细胞培养72 h后,ELISA法检测细胞上清IGF1的量;F:CCK-8实验检测空载质粒pLCDH、p-circHIPK3、p-circHIPK3+miR-379 mimics共同处理组三个组别对细胞增殖的影响。*:与对照组相比,P<0.05。Fig 5 CircHIPK3 promoted NSCLC cell proliferation through circHIPK3/miR-379 pathway. A: The effects of miR-379 mimics on the expression levels of IGF1 in NCI-H1299; B: The effects of miR-379 inhibitor on the expression levels of IGF1 in NCI-H1299; C: The effects of si-circHIPK3 on the expression levels of IGF1 in NCI-H2170; D: The effects of the pLCDH, p-circHIPK3, the group of circHIPK3 combined with miR-379 mimics on the expression levels of IGF1 in H1299; E: Detection of the expression levels of IGF1 by ELISA after culturing for 72 h; F: The cell growth effects of circHIPK3 and the group of circHIPK3 combined with miR-379 mimics on NCI-H1299. *: compared with the control, P<0.05.
综上所述,本研究表明circHIPK3能够促进NSCLC细胞的增殖,circHIPK3通过miR-379调控IGF1表达是促进NSCLC细胞的增殖的机制。在后续的研究中,我们将更加深入地探讨机制,为NSCLC的治疗提供新的思路。
