新生儿缺氧缺血性脑损伤的磁共振成像波谱分析*
2017-09-04刘兵杜乃熠张钊赵树军康志雷
刘兵,杜乃熠,张钊,赵树军,康志雷
(哈励逊国际和平医院 核磁共振室,河北 衡水 053000)
新生儿缺氧缺血性脑损伤的磁共振成像波谱分析*
刘兵,杜乃熠,张钊,赵树军,康志雷
(哈励逊国际和平医院 核磁共振室,河北 衡水 053000)
目的探讨新生儿缺氧缺血性脑损伤的磁共振成像波谱(MRS)分析。方法选取2013年9月-2016年9月该院确诊治疗的缺氧缺血性脑损伤新生患儿180例,依据病情严重程度分为轻度组(n=90)、中度组(n=50)及重度组(n=40),随访28 d,依据预后结果分为生存组(n=150)和死亡组(n=30),所有新生患儿均给予基于磁共振成像(MRI)的MRS检测氨酸及谷氨酞复合物α峰(CLx-α)、N-乙酰天门冬氨酸(NAA)、胆碱(Cho)、肌酸(Cr)及乳酸(Lac),采用受试者工作特征(ROC)曲线分析CLx-α/Cr值和Lac/Cr值对新生患儿预后的预测效能,统计分析所有新生患儿MRS检测结果情况。结果在NAA/Cr和NAA/Cho值方面,3组差异有统计学意义(P<0.05)轻度组患儿高于中度组,中度组患儿高于重度组,在CLx-α/Cr和Lac/Cr值方面,3组差异有统计学意义(P<0.05)。轻度组患儿低于中度组,中度组患儿低于重度组,差异有统计学意义(P<0.05);生存组患儿CLx-α/Cr和Lac/Cr值低于死亡组,差异有统计学意义(P<0.05);ROC曲线分析结果显示,CLx-α/Cr值以1.35为临界值时预测患儿死亡预后的敏感性、特异性及准确性分别为86.67%、90.00%及89.44%,Lac/Cr以1.35为临界值时预测患儿死亡预后的敏感性、特异性及准确性分别为83.33%、88.00%及87.22%,两者联合时预测患儿死亡预后的敏感性、特异性及准确性分别为93.33%、97.33%及97.78%,两者联合时预测患儿死亡预后的特异性、准确性高于单独CLx-α/Cr和Lac/Cr值时预测,差异有统计学意义(P<0.05)。结论MRS技术可有效无创检查缺氧缺血性脑损伤新生患儿脑代谢转变情况,有利于评估病情的严重程度,且联合CLxα/Cr、Lac/Cr值可预测患儿预后,值得临床作进一步推广。
新生儿;缺氧缺血性脑损伤;磁共振成像波谱;病情;预后
缺氧缺血性脑损伤是新生儿常见的疾病之一,由脑缺氧或缺血引起脑组织损伤所致,可导致嗜睡、肌张力减低及呼吸困难等症状,严重者可导致死亡的发生,故如何有效评估患儿的病情对指导临床治疗和预后转归具有重要的临床意义[1]。有研究表明,磁共振成像波谱(magnetic resonance imaging spectroscopy,MRS)是一种新型的影像学技术,由磁共振成像(magnetic resonance imaging,MRI)改进并发展而成,具有定量检测组织中多种生化指标水平的作用,有利于进一步了解和评估疾病的生理和病理变化[2-3]。本研究通过给予缺氧缺血性脑损伤新生患儿MRS检测,探讨其对评估患儿病情和预测患儿预后中的影响。
1 资料与方法
1.1 一般资料
1.1.1 临床资料 选取2013年9月-2016年9月本院确诊治疗的缺氧缺血性脑损伤新生患儿180例,依据病情严重程度分为轻度组(n=90)、中度组(n=50)及重度组(n=40)。轻度组:男50例,女40例;日龄1~7d,平均(3.32±1.25)d;胎龄33~41周,平均(38.89±3.21)周;出生体重2 628~4 142 g,平均(36 453.28±320.12)g。中度组:男28例,女22例。日龄1~7d,平均(3.39±1.30)d;胎龄33~41周,平均(38.22±3.14)周;出生体重2 608~4 162g,平均(3 643.48±321.87)g。重度组:男24例,女16例;日龄1~7d,平均(3.36±1.27)d;胎龄33~41周,平均(38.75±3.18)周;出生体重2 611~4 157 g,平均(3 654.31±324.18)g。本研究已经通过本院伦理委员会审批,所有患儿资料均收集完整且来源真实可靠,依据随访28 d的预后结果分为生存组(n=150)和死亡组(n=30),所有患儿在日胎龄、性别及出生体重等资料比较差异无统计学意义(P>0.05),具有可比性。
1.1.2 纳入与排除标准 纳入标准:①符合缺氧缺血性脑损伤的诊断标准[4];②患儿家属签署知情同意书;③非外伤或其他原因导致的脑损伤。排除标准:①伴有心、肝及肾等严重性疾病;②有血液系统严重性疾病、先天代谢性疾病及畸形等疾病;③父母有精神病病史、拒绝或中途退出参与本次研究者。
1.1.3 病情严重程度分组标准 根据Lac/NAA比值进行分组,比值为0.5~1.0为轻度组,比值为1.0~2.0为中度组,比值>2.0为重度组。
1.2 方法
所有患儿喂服50mg/kg的10%水合氯醛,在睡眠安静状态下先采用标准正交头部8通道线圈通过Signa ExciteⅡ3.0T超导型MRI扫描仪(美国GE公司)进行MRI检测,常规行矢状面及轴面扫描,层厚4mm,层距0.5mm,扫描序列包括T1加权成像(T1WI,TR 500 ms,TE 15 ms)、T2加权成像(T2WI,TR 5 100 ms,TE 130 ms)及磁共振弥散加权成像(DWI,TR 9 602 ms,TE 114 ms),完毕后常规保存图像、换头颅专用单通道正交线圈行MRS检查,于轴面T2WI基底节层面定位后将兴趣区跨中线定位为双侧基底核区(包括双侧基底节及部分丘脑在内等16个像素范围),层厚20mm、前后径及左右径均为30mm,波谱脉冲序列为点解析频谱(PRESS)序列,采集方式为二维多体素(MV)技术,参数为TR 1 500 ms、TE 144 ms、容积块厚15~20mm、视野(FOV)24cm×244cm、相位12、扫描重复次数128次及激励次数(NEX)2次。
1.3 指标观察
统计分析所有新生患儿MRS检测结果情况,即代谢物包括氨酸及谷氨酞复合物a峰(CLx-a)、N-乙酰天门冬氨酸(NAA)、胆碱(Cho)、肌酸(Cr)及乳酸(Lac),代谢物在其配套的GE AW4.6处理工作站中Functool软件进行分析,先选中一侧的体素使之激活变为绿色,此时波谱图像所显示的即为该体素的波谱曲线图,在工作站中处理并计算NAA/Cr、NAA/ Cho、CLx-a/Cr、Lac/Cr值。
1.4 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,计数资料以率(%)表示,比较用χ2检验,比较用t检验或方差分析,两两比较用LSD-t检验,采用ROC曲线分析CLx-a/Cr值和Lac/Cr值对新生患儿预后的预测效能,P<0.05为差异有统计学意义。
2 结果
2.1 3组患儿NAA/Cr、NAA/Cho、CLx-α/Cr及Lac/Cr值比较和MRS检查征象
在NAA/Cr和NAA/Cho值方面,轻度组患儿高于中度组,中度组患儿高于重度组,在CLx-α/Cr和Lac/ Cr值方面,轻度组患儿低于中度组,中度组患儿低于重度组,差异有统计学意义(P<0.05)。见表1和图1。
2.2 两组患儿CLx-α/Cr和Lac/Cr值比较
生存组患儿CLx-α/Cr和Lac/Cr值,经t检验,差异有统计学意义(P<0.05),生存组患儿CLx-α/ Cr和Lac/Cr值均低于死亡组。见表2。
2.3 不同方法预测患儿死亡预后的ROC曲线分析
ROC曲线分析结果显示,CLx-α/Cr值以1.35为临界值时,综合考虑,具有较高的敏感性、特异性及准确性,因此确定阈值为1.35。有4例死亡者漏诊,有15例生存组误诊,其预测患儿死亡预后的敏感性、特异性及准确性分别为86.67%(26/30)、90.00%(135/150)和89.44%(161/180),Lac/Cr以1.35为临界值时,有5例死亡者漏诊,有18例生存组误诊,其预测患儿死亡预后的敏感性、特异性及准确性分别为83.33%(25/30)、88.00%(132/150)及87.22%(157/ 180),两者联合时,有2例死亡者漏诊,有4例生存组误诊,其预测患儿死亡预后的敏感性、特异性及准确性分别为 93.33%(28/30)、97.33%(146/150)和97.78%(176/180)。见图2。
表1 3组患儿NAA/Cr、NAA/Cho、CLx-α/Cr及Lac/Cr值比较 (±s)
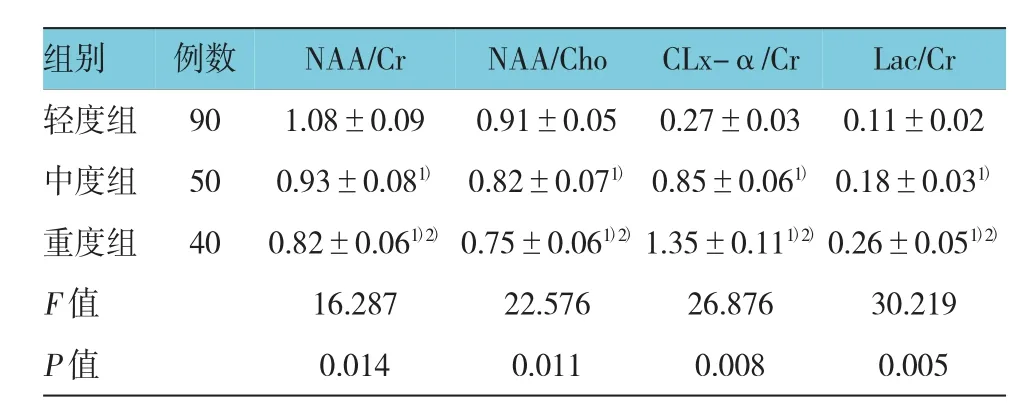
表1 3组患儿NAA/Cr、NAA/Cho、CLx-α/Cr及Lac/Cr值比较 (±s)
注:1)与轻度组比较,P<0.05;2)与重度组比较,P<0.05
组别Lac/Cr轻度组 90 1.08±0.09 0.91±0.05 0.27±0.03 0.11±0.02中度组 50 0.93±0.081)0.82±0.071)0.85±0.061)0.18±0.031)重度组 40 0.82±0.061)2)0.75±0.061)2)1.35±0.111)2)0.26±0.051)2)F值 16.287 22.576 26.876 30.219 P值 0.014 0.011 0.008 0.005例数NAA/CrNAA/ChoCLx-α/Cr

图1 缺氧缺血性脑损伤新生患儿的苍白球区的MRS图像

表2 两组患儿CLx-α/Cr和Lac/Cr值比较
2.4 不同方法预测患儿死亡预后的敏感性、特异性及准确性比较
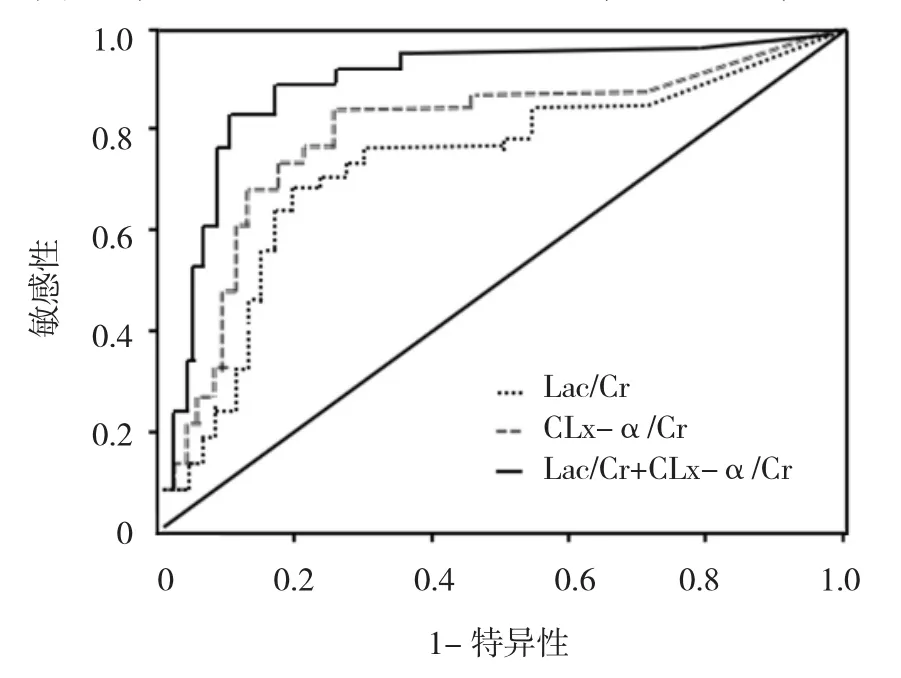
图2 不同方法预测患儿死亡预后的ROC曲线图
两者联合时预测患儿死亡预后的特异性、准确性高于单独CLx-α/Cr和Lac/Cr值时预测,差异有统计学意义(P<0.05),但3者预测患儿死亡预后的敏感性基本相同,且两者单独预测时特异性、准确性基本相同,差异无统计学意义(P>0.05)。见表3。

表3 不同方法预测患儿死亡预后的敏感性、特异性及准确性比较 (n=180,%)
3 讨论
缺氧缺血性脑损伤是围生期中常见的一种神经系统疾病,重度者易出现昏迷、肌张力松软或惊厥频繁等症状,若未能及时救治,可导致昏迷和中枢性呼吸衰竭,甚至死亡,严重危害患儿的身体健康[5-7]。有研究显示,缺氧缺血性脑损伤新生患儿由于脑部处于较为严重的缺氧缺血状态,可导致脑内代谢紊乱的发生,如能量代谢障碍、细胞内酸中毒等,从而导致脑组织损伤的发生[8-10]。而GUCUYENER等[11-13]研究表明,Lac是机体内常见的代谢产物之一,在组织缺氧缺血时可使氧化磷酸化不足导致无氧糖酵解增加而使其大量分泌,Cr也是一种代谢的标志物,可辅助性为肌肉和神经细胞提供能量。有研究表明,Cho是一种细胞膜转换的标志物,可反映细胞的增殖能力,CLx-α是脑内最主要的兴奋性神经递质之一,具有调节和维持脑功能的作用,NAA则是在轴突髓鞘形成过程中脂肪酸合成时乙酰基的一种供体,上述指标均可有效反映脑组织细胞的功能状态[14-16]。此外,有研究表明,MRS是一种在MRI基础上开发的新型的检测技术,可在无创条件下活体定量测量脑组织的代谢、生化及化合物等情况,有利于协助医师了解和评估疾病的病变情况[17-18]。
本研究通过给予缺氧缺血性脑损伤新生患儿MRS检测,发现在NAA/Cr和NAA/Cho值方面,轻度组患儿高于中度组,中度组患儿高于重度组,在CLxα/Cr和Lac/Cr值方面,轻度组患儿低于中度组,中度组患儿低于重度组,表明MRS技术检测上述指标水平与患儿病情的严重程度有关。这可能是由于脑缺氧缺血可导致细胞代谢的改变,使氧化磷酸化不足导致无氧糖酵解增加而使Lac大量分泌,随着Lac浓度上升,可引起脑细胞酸性中毒,毒性作用通过损伤机体脑组织而阻滞其沉积部位脑组织发育,表现为NAA的水平下降,同时其毒性作用还可能会影响脑神经组织对血氧的利用效率,影响脑神经细胞的新陈代谢,表现为Cr水平紊乱及影响脑内细胞膜、鞘磷脂的转换导致Cho水平下降,从而导致脑组织的损伤;且可能由于细胞的新陈代谢受碍,使能量衰竭,导致突触前神经元释放大量的谷氨酸,并使谷氨酸回摄取受阻和胶质细胞摄取的谷氨酸积聚在细胞内,进行影响谷氨酸-谷氨酰胺循环,导致细胞外间隙及胶质细胞内谷氨酸浓度升高并且伴随着神经元内谷氨酸浓度下降,从而使过量兴奋性氨基酸的兴奋作用加速已缺血缺氧的脑细胞的坏死、溶解以及凋亡。因此,MRS检查可通过分析上述指标水平变化反映脑组织细胞的代谢状况,且上述指标水平变化更明显者,其上述生理病理作用更为严重,提示其病情也越严重。
此外,本研究还发现,生存组患儿CLx-α/Cr和Lac/Cr值低于死亡组,ROC曲线分析结果显示,CLx-α/Cr值以1.35为临界值,Lac/Cr以1.35为临界值,两者联合时预测患儿死亡预后的特异性、准确度高于单独CLx-α/Cr和Lac/Cr值时预测,表明联合CLx-α/Cr、Lac/Cr值可预测患儿预后。这可能是由于上述指标水平高者,提示其脑组织的代谢仍处于较为严重的缺氧缺血状态,其后期神经恢复更易出现再次损伤,导致预后不良。而单独Lac/Cr值检测时,可能由于部分患儿脂质峰增高,导致Lac峰检测受干扰,使Lac/Cr值处于高水平,导致误诊漏诊的发生;同时单独CLx-α/Cr检测时,可能由于后期脑组织再灌注后血流和血氧的恢复,使脑神经细胞的新陈代谢逐渐恢复,但氧自由基增多、钙超载及钙内流等作用,仍刺激突触前神经元释放大量兴奋性氨基酸,导致误诊漏诊的发生。而两者联合检测时,可弥补各自的不足,从而提高预测的效能。
综上所述,MRS技术可有效无创检查缺氧缺血性脑损伤新生患儿脑代谢转变情况,有利于评估病情的严重程度,且联合CLx-α/Cr、Lac/Cr值可预测患儿预后,值得临床作进一步推广。
[1]张健,郑洪,刘光辉,等.新生儿胆红素脑病的早期诊断及神经损伤的综合评价[J].中国妇幼健康研究,2014,25(2):184-186.
[2]林碧云,张鹏,程国强,等.大于35周胎龄新生儿缺氧缺血性脑病远期预后评价体系荟萃分析[J].中华医学杂志,2014,94(2):115-121.
[3]周红,陈东.磁共振成像在胆红素脑病中的应用[J].临床放射学杂志,2015,34(1):151-154.
[4]王金英.新生儿胆红素脑病磁共振成像及磁共振波谱的特征分析[J].医学综述,2016,22(11):2262-2264.
[5]CECE H,ABUHANDAN M,CAKMAK A,et al.Diffusion-weighted imaging of patients with neonatal bilirubin encephalopathy[J]. Jpn J Radiol,2013,31(3):179-185.
[6]陈镜聪,曾裕镜,黄柏锋,等.新生儿胆红素脑病的MRI影像特征[J].海南医学,2014,25(23):3479-3480.
[7]伍彩云,刘国瑞,郭天畅,等.新生儿缺氧缺血性脑病的常规MRI和DWI表现及其与预后的相关性研究[J].实用放射学杂志,2014, 30(1):103-107.
[8]蒙丹华,潘新年.新生儿急性胆红素脑病早期诊断的研究进展[J].中国小儿急救医学,2015,22(5):344-347.
[9]陈立平,柏天军,庞善军,等.磁共振成像和磁共振波谱对新生儿缺氧缺血性脑病预后的早期诊断价值及预后评估[J].中国妇幼保健,2016,31(16):3407-3409.
[10]苗重昌,陈迎良,张永刚,等.磁共振多模态技术对新生儿缺氧缺血性脑病诊断价值的探讨[J].井冈山大学学报:自然科学版, 2014,35(5):83-87.
[11]GUCUYENER K,BEKEN S,ERGENEKON E,et al.Use of amplitude-in-tegrated electroencephalography (aEEG)and near infrared spec-troscopy findings in neonates with asphyxia during selective head cooling[J].Brain Dev,2012,34(4):280-286.
[12]王国莉.商品大米中Cd、Pb、Cr的污染状况及健康风险评价[J].基因组学与应用生物学,2012,31(3):295-302.
[13]GOERGEN S K,ANG H,WONG F,et al.Early MRI in term infants with perinatal HIE brain injury:interobserver agreement and MRI predictors of outcome at 2 years[J].Clinical Radiology, 2014,69(1):72-81.
[14]李金成,席艳丽.1H-MRS对新生儿急性胆红素脑病和缺氧缺血性脑病的鉴别诊断价值[J].中国妇幼保健,2015,30(28):4912-4913.
[15]CAVALLERI F,LUGLI L,PUGLIESE M,et al.Prognostic value of diffusion-weighted imaging summation scores or apparent diffusion coefficient maps in new borns with hypoxic-ischemic encephalopathy[J].Pediatr Radiol,2014,44(9):1141-1154.
[16]杜奕,李艳,陈志强,等.磁共振波谱诊断新生儿缺氧缺血性脑病的临床价值[J].宁夏医科大学学报,2014,36(5):529-532.
[17]杨蓓,金朝林,张树桐,等.弥散加权成像及1H磁共振波谱在新生儿缺氧缺血性脑病中的价值[J].中国妇幼保健,2014,29(32): 5327-5329.
[18]ANCORA G,TESTA C,GRANDI S,et al.Prognostic value of brain proton MR spectroscopy and diffusion tensor imaging in newbo-rnswith hypoxic-ischemic encephalopathy treated by brain cooling[J].Neuroradiology,2013,55(8):1017-1025.
Analysis of magnetic resonance imaging spectrum in neonates with hypoxic ischemic brain damage*
Bing Liu,Nai-yi Du,Zhao Zhang,Shu-jun Zhao,Zhi-lei Kang
(Department of Nuclear Magnetic Resonanc Hercules International Peace Hospital, Hengshui,Hebei 053000)
ObjectiveTo discuss the application of magnetic resonance imaging spectrum (MRS)in neonatal hypoxic ischemic brain damage.MethodsTotally 180 children administrated in our hospital form September 2013 to September 2016 with diagnosis of neonatal hypoxic ischemic brain damage were selected. The patients were divided into mild group(n=90),moderate group(n=50)and severe group(n=40)based on the severity.Also the patients were divided into survival group (n=150)and death group (n=30)based on 28-day observation.Allnewborns
magnetic resonance spectroscopy ofglycine and pancreatic phthalein compounds(CLx-α),N-acetyl aspartate(NAA),choline(Cho),creatine(Cr)and lactic acid(Lac). ROC curve analyses of CLx-α/Cr and Lac/Cr values were performed to predict the prognosis of newborn children.ResultsIn theaspectofNAA/Crand NAA/Chovalues,children from themild group had dramatically higher levels than those of the moderate group;so did the newborns from the moderate group when compared to those from the severe group.In terms of CLx-α/Cr and Lac/Cr values,the children fromthe mild group had significantly lower levels than those of the moderate group;so did the newborns from the moderate group when compared to those from the severe group (P<0.05).The children from the survival group experienced markedly lower levels of CLx-α/Cr and Lac/Cr when compared to those in the deceased group (P<0.05).ROC curve analysis results showed that with the cutting edge of CLx-α/Cr value as 1.35, the sensitivity,specificity and accuracy to predict the death of children were 86.67%,90.00%and 89.44% respectively.With the cutting edge of Lac/Cr as 1.35,the sensitivity,specificity and accuracy to predict the death of children were 83.33%,88.00%and 87.22%respectively.Synergistic efficacy of CLx-α/Cr and Lac/Cr to predict the death was significantly higher (P<0.05),with the sensitivity,specificity and accuracy as 93.33%,97.33%and 97.78%respectively.ConclusionsMRS technique can noninvasively monitor metabolic changes in the patients with hypoxic ischemic brain damage.Application of CLx-α/Cr combined with Lac/Cr can predict prognosis of children,it's worth further clinical promotion.
newborn;hypoxic-ischemic brain damage;magnetic resonance imaging spectroscopy;condition; prognosis
R722.19
A
10.3969/j.issn.1005-8982.2017.18.023
1005-8982(2017)18-0110-05
2016-12-26
河北省指令性课题计划(No:ZL20140001)
康志雷,Tel:15631891998/15632858889
