储氢材料及研究进展
2017-09-03静赵东江王立民
林 静赵东江王立民
(1.中国科学院长春应用化学研究所稀土资源利用国家重点实验室 吉林长春 130022;2.绥化学院食品与制药工程学院 黑龙江绥化 152061)
本刊特约
储氢材料及研究进展
林 静1赵东江2王立民1
(1.中国科学院长春应用化学研究所稀土资源利用国家重点实验室 吉林长春 130022;2.绥化学院食品与制药工程学院 黑龙江绥化 152061)
氢是一种清洁高效的可再生能源,氢能的利用对“氢经济”的发展至为重要,研究和开发高储氢性能且有规模应用前景的储氢材料是氢能高效利用的前提条件。文章主要介绍了近年国内外在物理储氢和化学储氢两大类材料所取得的新进展,包括多种储氢材料的结构特点与储氢性能,以及储氢材料的应用和发展趋势。
物理储氢;化学储氢;PCT;储氢容量
氢能量密度高,可以实现大规模储存,易于实现氢电、氢热转换、无污染,因此氢能是优质能源,氢能的利用首先必须解决氢的制取、储存与输运以及氢能转换等关键技术。发展高性能储氢材料是解决氢的储存与输运的重要途径,至今,一些储氢材料已经得到开发,有力的推动了氢能的利用。氢气储存方式主要分为物理方法和化学方法,其中物理储氢材料包括碳纳米管材料、介孔材料和金属有机框架材料等。在这一类储氢材料中含多孔结构,氢以分子状态吸附在孔材料表面而实现储氢。基于化学机制的储氢材料有金属氢化物、配位氢化物和化学氢化物等材料,氢以原子或离子形式与其他元素结合而实现储氢。本文主要介绍了近年来发现的具有高性能的储氢材料及其研究进展,以及储氢材料的应用与发展趋势。
一、物理储氢
物理吸附机制的储氢材料与氢之间的相互作用较弱,吸氢一般需要极低的温度和高的压力,常温下可逆质量储氢密度较小,目前发现的主要物理储氢材料如下。
(一)碳纳米管。1997年,A.C.Dillon等指出单壁碳纳米管具有储氢性能,由于其壁很薄,管很细,可能在管中凝聚氢,从而达到高效储氢的效果,计算其储氢容量为5wt.%~10wt.%[1],引发了人们对碳纳米管储氢性能的研究。1999年,成会明等在碳纳米管的储氢研究上取得突破进展,在室温、10MPa条件下,单壁碳纳米管的储氢量达到了4.2wt.%[2]。随后,B.Panella等分析了不同比表面积的碳纳米管的储氢性能,发现储氢容量与比表面积成正比,其极限质量储氢密度等同于在碳纳米管表面铺满一层液氢[3]。B.Assfour等发现,通过控制纳米管的堆垛方式可以提高其储氢性能[4]。碳纳米管还可以作为添加剂来改善氢在材料中输运的能力,张海燕等将碳纳米管添加到LaNi5合金中,提高了合金的电化学倍率放电性能[5]。姚向东等发现,碳纳米管和VTi合金复合对镁金属具有优异的催化吸氢性能,因为碳纳米管分布在镁晶粒的晶界上,所以提高了氢扩散速率[6]。王立民等将碳纳米管与Ti-V-Ni准晶复合,提高了合金的综合储氢性能[7]。以上研究都是利用碳纳米管具有的纳米尺度中空孔道以及高活性等,从而显示良好的储氢性能。
(二)介孔材料。利用介孔材料的中空特点,可将储氢材料装载到纳米孔道中,从而限制材料的团聚,提高其稳定性,实现对储氢材料的纳米限域,功能化限域方法为改善材料的储氢性能提供了新思路。孙大林等将NaAlH4装载到介孔碳的纳米孔道中,提高了其可逆性与稳定性[8]。A.F.Gross等将LiBH4嵌入纳米多孔碳中,有效降低了放氢活化能与放氢温度,提高了放氢速率[9]。
(三)金属有机框架材料。金属有机框架(MOFs)因其具有高的孔隙率、表面积和化学稳定性而引起了科学家的广泛兴趣。2003年,O.M.Yaghi等报道了一种MOF—Zn4O(BDC)3的储氢性能,该材料在-195.2℃、中等压力条件下质量储氢密度为4.5wt.%[10]。MOF-5在298K,2MPa条件下的吸氢量为1.0wt.%,改变MOF-5中的有机联结体,得到的系列具有相同拓扑结构的多孔聚合物,储氢性能得到明显提高,其中IRMOF-13储氢量最高,是MOF-5的两倍[11,12]。MOF-177孔径为1.09~1.18nm,是目前已知储氢量最大的MOF类化合物[13]。K.L.Mulfort等选取混合配体的MOFs改性,将锂单质氧化为锂离子并与骨架成键,显著提高了配合物在液氮温度下的储氢量[14]。孙立贤等将贵金属/活性炭掺杂MOFs,材料的室温储氢量从0.37wt.%提高到了1.14wt.%[15]。
以上的研究表明,MOFs作为可望获得应用的新型储氢多孔材料,显示出值得期待的前景,但MOFs的储氢机理、结构与储氢性能关系以及配体官能团影响机理等尚未清晰,同时MOFs在常温常压下的储氢性能尚待提高,这些问题的解决将会对MOFs在储氢领域的实用化起到关键作用。
二、化学储氢
金属氢化物的吸/放氢热力学可以用压力—成分—温度(P-C-T)曲线表征(图1)。温度不变时,从零点开始,随着氢气压力增加,氢溶于金属,形成含氢固溶体α相,合金结构不变,A点对应氢在金属中的极限溶解度。当氢含量增加,开始生成金属氢化物β相,AB段平台代表α相和β相共存区域,即平台区,相应的恒定平衡压力即为平台压。B点后,α相全部转变为β相,继续升高氢压,氢可以继续固溶进入β相,也有可能形成新的氢化物和新的平台区。升高温度,平衡氢压随之升高。滞后是金属或合金吸/放氢过程中的平衡氢压差,吸氢等温曲线总是高于放氢等温曲线。P-C-T曲线是衡量材料储氢性能的重要依据,反应了材料吸/放氢反应的可逆储氢容量、平衡氢压、平台斜率和滞后效应,反应焓是表征氢化物热稳定性的首要判据,反应焓越负,氢化物越稳定。
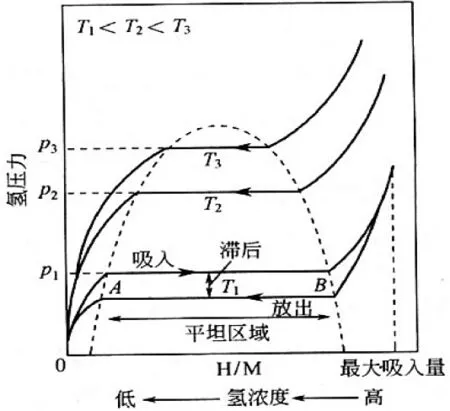
图1 理想的压力-组成等温线。
(一)金属氢化物。金属氢化物中,氢以金属键与金属结合。多数情况下,金属储氢材料是金属间化合物或多元合金,即储氢合金。储氢合金是由与氢结合能为负的金属元素(A元素)和与氢结合能为正的金属元素(B元素)构成,主要包含 AB5型、AB2型、AB3型、AB型、V基固溶体、Mg基合金以及其他合金。目前,AB5型和AB2型合金已经成功商业化应用。AB5合金的电化学储氢容量约330mAhg-1[16]。AB2型合金主要以TiCr2、TiMn为代表,电化学容量可达到360 mAh g-1,但该类合金不易活化[17]。AB3型合金以LaMg2Ni8合金为代表,理论储氢容量超过400mAhg-1,可以通过元素替代发展系列不同组分的AB3型合金并且性能优异,有望取代AB5型合金[18]。AB型合金主要以TiFe合金为代表,该类合金成本较低、容量较高,但循环寿命较差,而且该合金会发生歧化反应分解为TiH2和TiFe2从而导致储氢性能下降[19,20]。V基固溶体合金主要有V-Ti系、V-Ti-Cr系和V-Ti-Mn系。V基固溶体合金吸氢时形成VH和VH2,VH过于稳定,吸氢后很难放出氢,仅有VH2可以在适当条件下放氢,储氢量约为2wt.%。V基固溶体储氢合金应用在镍氢电池中时,V元素在电解质中的溶解问题比较突出,导致电池循环稳定性较差[21,22]。Mg基储氢合金吸氢后生成MgH2,MgH2的理论储氢密度为7.6wt.%,但稳定性太强,氢难以放出,如何改善其可逆吸放氢性能还需大量工作[23]。近年,在储氢合金中引入准晶结构是相关领域的一个新方向。王立民等采用快速冷凝、机械合金化、热处理等方法成功制备了系列Ti基准晶合金,并在其储氢性能研究方面获得了一些新进展[24-31]。例如,研究了Ti45Zr35Ni17Cu3准晶粉末作为镍氢二次电池负极材料的高温电化学及动力学性能,当温度在343K时,该准晶的最大放电容量为329mAhg-1[27];设计制备了(Ti1-xVx)2Ni(x=0.05-0.3)和Ti1.6V0.4Ni1-xCox(x=0.02-0.1)系列准晶材料,并研究了其电化学储氢性能。结果表明,准晶合金电极的放电容量随V含量的增加而提高,最大放电容量达278 mAh g-1,适量Co的添加可以改善材料的电化学循环稳定性[25,26];在Ti-V-Ni准晶材料中复合添加金属Mg,最大放电容量达到282 mAh g-1以上[31]。此外,还研究了碳材料(石墨烯、碳纳米管等)对Ti-V-Ni系准晶电化学储氢性能的影响。如利用机械合金化的方法将石墨烯与Ti-V-Ni准晶复合,含10wt%石墨烯的复合材料的循环稳定性和倍率性能都有所提高[32]。但是,至今Ti基准晶及其复相材料的电化学储氢容量优势不明显,同时,准晶结构在吸放氢过程中的晶格畸变使合金局部原子结构恢复受到阻碍,材料易粉化。此外,还存在材料表面氧化以及活性物质在碱性电解质溶液中的溶出等问题,导致Ti基准晶在吸放氢循环过程中的容量衰减问题突出、可逆性较差。
(二)配位氢化物。配位氢化物由第IIIA或VA主族元素与氢原子以共价键结合,再与金属离子以离子键结合所形成的氢化物,部分氢化物的储氢密度和含氢量如表1。1997年,B.Bogdanovi等发现掺Ti(OnBu)4催化的NaAlH4可以在较温和的条件下可逆吸/放氢,从而引起了配位氢化物在储氢领域的研究热点[33]。金属配位氢化物中氢的含量很高,其中NaAlH4和Li4BN3H10的理论储氢容量分别为7.47wt.%和9.60wt.%,而LiBH4的理论储氢容量更是高达18.5wt.%[34]。虽然金属配位氢化物体系具有较高的理论储氢容量,但作为储氢材料该体系仍存在以下几点问题:如较差的可逆吸放氢性能、较高的放氢温度(LiBH4初始放氢温度300℃)、动力学性能差、含氮的储氢材料放氢过程中常伴随着NH3的释放等。从目前的研究结果来看,金属配位氢化物虽然在单位储氢量上可以达到应用要求的目标,但存在脱加氢温度过高和动力学性能较差的问题,离实际应用还有一定的距离。
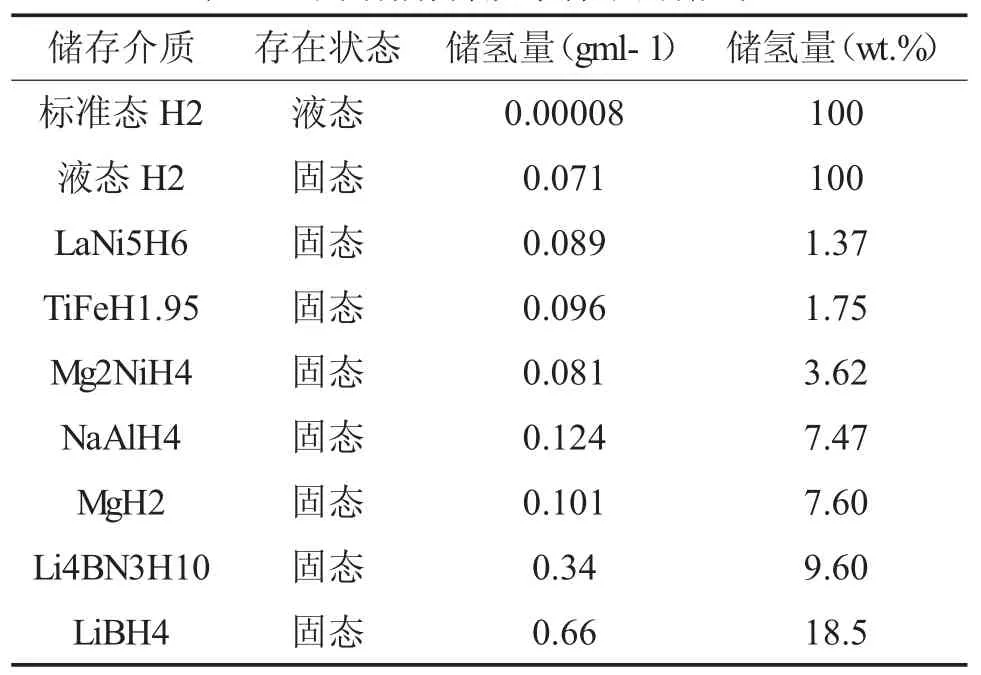
表1 不同储存介质条件下的储氢量
(三)化学氢化物。化学氢化物是近十几年兴起的新一类储氢材料,指通过化学反应实现放氢的含氢化物,其中含N体系的化学氢化物研究的最为广泛。陈萍等[35]首先报道了Li3Ni-H体系,理论储氢量为10.5wt.%,实验中获得的储氢量约为7wt.%,但该体系吸/放氢平台较低,放氢温度偏高。潘洪革等采用机械力驱动的物理气相沉积法制备无负载Mg(AlH4)2纳米棒和LiBH4纳米带,显著降低了材料的放氢温度,提高了吸放氢可逆性,同时材料的形貌在吸放氢循环过程中保持良好[36]。
总之,化学氢化物的可逆性较差,如何提高其可逆性是该体系储氢材料的重要问题。
三、储氢材料应用
储氢材料的应用领域广泛,主要是Ni-MH二次电池负极材料和储氢装置(储氢罐)填充材料。Ni-MH二次电池具有能量密度高、循环寿命长、工作温度范围宽、绿色环保和安全性能好等优点,已在便携式电子设备、电动工具、混合电动车等领域广泛应用。从技术发展水平角度看,在现有的动力电池中,Ni-MH二次电池的综合性能优势最明显。Ni-MH二次电池的广泛应用被认为是储氢材料应用中最巨大、最有经济价值的突破。
储氢材料在储氢罐及氢燃料电池上也有应用,氢燃料电池是通过电化学反应将氢能直接转化为电能的装置,产物是水,具有能量转换效率高、低排放、环境友好等优点。金属氢化物的储氢罐可以用作氢燃料电池的氢源,这种储氢罐具有体积储氢密度高、安全性能好等特点,可获得高纯度的氢。比如,MnNi4.5Al0.5合金储氢系统,与15MPa高压氢气瓶相比,在相同储氢量下其容器压力可降到1MPa以下,而容器体积仅为高压气瓶的1/4,提高了氢气使用的安全性。
近年,储氢材料可应用在锂离子电池中,即试图将氢化物应用在固体电解质中以取代有机电解质,Matsuo等发现LiBH4在110℃时可以成为锂离子良导体[37]。Maekawa等通过添加金属卤化物来抑制LiBH4的相转变,从而提高其导电特性[38]。Takahashi等研究进一步证实了LiBH4用于全固态电池固体电解质的可行性[39]。Oumellal等利用MgH2储氢材料与Li组成锂离子电池,MgH2电极的0.5V电压下的电化学容量为1480mAhg-1[40]。
储氢材料具有氢同位素效应,在吸氕、氘、氚的平衡压和吸附量上存在一定差异,即为热力学同位素效应,三者在储氢材料中的扩散和吸收速度方面的差异即为动力学同位素效应,有研究表明,Ti-Mo、La-Ni及V基合金的氢同位素效应比较明显,在氢同位素分离方面具有潜在的应用价值。此外,储氢材料还可以应用在氢气压缩与氢气提纯、氢气回收与纯化、相变储热、催化反应等领域。
四、总结与展望
目前,储氢材料研究已经取得了很大进展,例如在纳米调控、多相复合、催化及表面修饰等性能优化及理论研究方面取得了飞跃式发展,但氢能要实现真正大规模的应用,还需要储氢材料满足多方面的要求,面临的问题和挑战还有很多。例如,大多数储氢材料大规模生产制备上还存在一些技术壁垒,还不能满足车载系统的需求,成本需要进一步降低,新储氢材料体系的研究及理论积累不足等。总之,随着储氢材料研究开发的深入,不仅能够促进学科间融合,还能为新材料的发展提供应用价值,从而开拓出更广阔的应用前景。
[1]A.C. Dillon, K.M. Jones, T.A. Bekkedahl, et al. Storage of hydrogen in single- walled carbon nanotubes[J]. Nature, 1997, 386,377- 379.
[2]C. Liu, Y.Y. Fan, M. Liu, et al. Hydrogen storage in single- walled carbon nanotubes at room temperature [J]. Science,1999, 286:1127- 1129.
[3] B. Panella, M. hirscher, S. Roth. Hydrogen adsorption indifferentcarbon nanostructures[J].Carbon, 2005, 43:2209- 2214
[4]B.Assfour,S.Leoni,G.Seifert,et al.Packings of carbon nanotubes-new materials for hydrogen storage[J].Adv.Mater.,2011,23:1237-1241.
[5]H.Y.Zhang,Y.T.Chen,Q.F.Zhu,et al.The effects of carbon nanotubes on the hydrogen storage performance ofthe alloy electrode for high-power Ni-MH batteries[J].Int.J.Hydrogen Energy,2008,33:6704-6709.
[6]X.D.Yao,C.Z.Wu,A.J.Du,et al.Metallic and carbon nanotube-catalyzedcouplingofhydrogenationinmagnesium[J].J.Am.Chem.Soc.,2007,129:15650-15654.
[7]J.Lin,L.S.Sun,F.Liang,etal.EffectofMWNTs-addition on cathodic performance of Ti-V-Ni composites for Ni-MH batteries[J].Int.J.HydrogenEnergy,2016,41:9471-9475.
[8]Y.T.Li,G.Zhou,F.Fang,et al.De/re-hydrogenation features of NaAlH4confined exclusively in nanopores[J].Acta Materialia,2011,59:1829-1838.
[9]A.F.Gross,J.J.Vajo,S.L.Van-Atta,et al.Enhanced hydrogen storage kinetics ofLiBH4in nanoporous carbon scaffolds[J].J.Phys.Chem.C.,2008,112,5651-5657.
[10]N.L.Rosi,J.Echert,M.Eddaoudi,etal.Hydrogenstorage inmicroporousmetal-organicframeworks[J].Science,2003,300:1127-1129.
[11]A.G.Wong-Foy,A.J.Matzger,O.M.Yaghi.Exceptional H2saturation uptake in microporous metal-organic frameworks[J].J.Am.Chem.Soc.,2006,128:3494-3495.
[12]J.L.C.Rowsell,A.R.Millward,K.S.Park,etal.Hydrogen sorption in functionalized metal-organic frameworks[J].J.Am.Chem.Soc.,2004,126:5666-5667.
[13]H.K.Chae,D.Y.Siberio-Pérez,J.Kim,etal.Aroute to high surface area,porosity and inclusion of large molecules in crystals[J].Nature,2004,427:523-527.
[14]K.L.Mulfort,J.T.Hupp.Chemicalreductionofmetalorganic framework materials as a method to enhance gas uptake and binding[J].J.Am.Chem.Soc.,2007,129:9604-9605.
[15]Y.Y.Liu,J.L.Zeng,J.Zhang,et al.Improved hydrogen storage in the modified metal-organic frameworks by hydrogen spillovereffect[J].Int.J.HydrogenEnergy,2007,32:4005-4010.
[16]H.F.Bittner,C.C.Bdcock.Electrochemical utilization of metalhydrides[J].J.Electrochem.Soc.,1983,130:193C-198C.
[17]Y.F.Liu,H.G.Pan,M.X.Gao,et al.Advanced hydrogen storagealloysforNi/MHrechargeablebatteries[J].J.Mater.Chem.,2011,21:4743-4755.
[18]Y.F.Liu,H.G.Pan,M.X.Gao,et al.DegradationMechanismofthe La-Mg-Ni-Based Metal Hydride Electrode La 0.7Mg0.3Ni3.4Mn0.1[J].J.Electrochem.Soc.2005,152:A1089-A1095.
[19]E.D.Koultoukis,S.S.Makridis,L.Röntzsch,et al.Structural,microchemistry,andhydrogenationpropertiesofTiMn0.4Fe0.2V0.4,TiMn0.1Fe0.2V0.7and Ti0.4Zr0.6Mn0.4Fe0.2V0.4metalhydrides[J].J.NanosciNanotech,2012,12:4688-4696.
[20]M.Bououdina,D.Fruchart,S.Jacquet,et al.Effect of nickel alloying by using ball milling on the hydrogen absorption propertiesofTiFe[J].Int.J.HydrogenEnergy,1999,24:885-890.
[21]C.Iwakura,W.K.Choi,R.Miyauchi,etal.Electrochemical and structural characterization of Ti-V-Ni hydrogen storage alloyswithBCC[J].J.Electrochem.Soc.,2000,147:2503-2506.
[22]M.Tsukahara,K.Takahashi,T.Mishima,et al.Vanadium-based solid solution alloys with three-dimensional network structure for high capacitymetal hydride electrodes[J].J.AlloyCompd.,1997,253-254:583-286.
[23]P.Vermeulen,R.A.H.Niessen,P.H.L.Notten.Hydrogen storage in metastable MgyTi(1-y)thin films[J].Electrochem.Commun.,2006,8:27-32.
[24]B.Z.Liu,Y.M.Wu,L.Wang.Kineticandelectrochemical properties oficosahedral quasicrystalline Ti45Zr35Ni17Cu3powder[J].Int.J.HydrogenEnergy,2006,31:1394-1400.
[25]W.Hu,J.L.Wang,L.D.Wang,et al.Electrochemical hydrogen storage in(Ti1-xVx)2Ni(x=0.05-0.3)alloys comprising icosahedralquasicrystallinephase[J].Electrochim.Acta,2009,54:2770-2773.
[26]W.Hu,X.D.Niu,M.Watada,et al.Electrochemical hydrogenstorageinTi1.6V0.4Ni1-xCoxicosahedralquasicrystallineAlloys[J].ChemPhysChem,2010,11:295-300.
[27]W.Q.Liu,S.S.Zhang,L.M.Wang,Ti1.4V0.6Niquasicrystal and its composites with xV18Ti15Zr18Ni29Cr5Co7Mn alloy used as negative electrode materials for the nickel-metal hydride(Ni-MH)secondarybatteries[J].MaterialsLetters,2012,79:122-124.
[28]Y.Z.Wang,M.S.Zhao,L.M.Wang.EffectofLa-Mg-based alloyadditiononstructureandelectrochemicalcharacteristicsofTi0.1Zr0.15V0.35Cr0.10Ni0.30hydrogen storage alloy [J].Int.J.Hydrogen Energy,2009,34:2646-2653.
[29]W.Q.Liu,X.L.Wang,W.Hu,et al.Electrochemical performance of TiVNi-Quasicrystal and AB3-Type hydrogen storagealloycompositematerials[J].Int.J.HydrogenEnergy,2011,36:616-620.
[30]W.Q.Liu,F.Liang,S.S.Zhang,et al.Electrochemical properties of Ti-based quasicrystal and ZrV2laves phase alloy composite materials as negative electrode for Ni-MH secondly batteries[J].J.Non-CrystSolids,2012,358:1846-1849.
[31]J.Lin,F.Liang,Y.M.Wu,et al.Hydrogen storage properties ofTi1.4V0.6Ni+xMg(x=1-3,wt.%)alloys[J].Int.J.HydrogenEnergy,2014,39:3313-3319.
[32]J.Lin,C.Lu,L.S.Sun,etal.Ti-V-Niwithgraphenemixingicosahedral quasicrystalline composites:Preparation,structure and its application in Ni-MH rechargeable batteries[J].Int.J.HydrogenEnergy,2016,41:1098-1103.
[33]B.Bogdanovic,M.Schwickardi.Ti-doped alkali metal aluminiumhydrides as potential novel reversible hydrogen storage materials[J].J.AlloyCompd.,1997,253-254:1-9.
[34]J.J.Vajo,S.L.Skeith,F.Mertens.Reversible storage of hydrogen in destabilized LiBH4[J].J.Phys.Chem.B,2005,109:3719-3722.
[35]P.Chen,Z.Xiong,J.Luo,et al.Interaction of hydrogen withmetalnitridesandimides[J].Nature,2002,420:302-304.
[36]Y.P.Pang,Y.F.Liu,M.X.Gao,etal.A mechanical-force-driven physical vapour deposition approach to fabricating complex hydride nanostructures [J]. Nature Communications,2014,5:3519-3527.
[37]M.Matsuo,Y.Nakamori,S.Orimo,etal.Lithiumsuperionic conduction in lithium borohydride accompanied by structural transition[J].Appl.Phys.Lett.,2007,91:224103.
[38]H.Maekawa,M.Matsuo,H.Takamura,et al.Halide-stabilized LiBH4,a room-temperature lithium fast-ion conductor[J].J.Am.Chem.Soc.,2009,131:894-895.
[39]K.Takahashi,K.Hattori,T.Yamazaki,etal.All-solidstate lithium battery with LiBH4solid electrolyte[J].J.Power Sources,2013,226:61-64.
[40]Y.Oumellal,A.Rougier,G.A.Nazri,etal.Metalhydrides forlithium-ionbatteries[J].Nat.Mater.2008,7:916-921.
[责任编辑 郑丽娟]
TG139
A
2095-0438(2017)08-0141-05
2017-04-29
林静(1986-),女,中国科学院长春应用化学研究所助理研究员,博士研究生,研究方向:储氢材料及镍氢电池;赵东江(1965-),男,绥化学院食品与制药工程学院教授,博士,研究方向:储氢材料,燃料电池催化剂;王立民(1962-),男,中国科学院长春应用化学研究所研究员,博士生导师,研究方向:储氢材料,电池材料,功能复合材料。
国家自然科学基金资助项目(21373198)。
