水样中大肠菌数定量PCR检测实验设计
2017-09-03付小花乐毅全唐贤春
付小花, 张 娴, 乐毅全, 唐贤春, 王 磊
(1. 同济大学 环境科学与工程学院, 上海 200092;2. 同济大学 污染控制与资源化研究国家重点实验室,上海 200092)
水样中大肠菌数定量PCR检测实验设计
付小花1,2, 张 娴1,2, 乐毅全1,2, 唐贤春1,2, 王 磊1,2
(1. 同济大学 环境科学与工程学院, 上海 200092;2. 同济大学 污染控制与资源化研究国家重点实验室,上海 200092)
为不断完善环境微生物学实验课程建设,培养学生的实际样品分析能力,设计了一套检测水样中大肠菌数的实时荧光定量PCR(pdymerase chain reaction)实验。教学实践表明,实验方案切实可行,学生完成情况良好,学生了解并践行了实时荧光定量PCR技术检测环境样品中的大肠菌数的方法,切身体会到新实验技术的简便性与灵敏性,提升了学生的学习兴趣与创新能力。
环境微生物学实验; 实时荧光定量PCR; 大肠菌数
大肠菌数常被用来作为水体受粪便污染情况的指标。大肠菌数的传统检测方法主要是多管发酵法和滤膜法[1]。环境微生物实验是我院环境工程、市政工程和环境科学专业本科生的必修专业课,实验教学中采用多管发酵法检测水样中大肠菌数,具体是将水样进行系列梯度稀释,分别接种到含有乳糖蛋白胨培养液的发酵管中,37 ℃培养 24 h,观察产酸、产气情况,阳性样本的确定需要进一步的定性实验,此法检测样品的优势是仪器设备简单,缺点是费时费力。
实时荧光定量PCR(pdymerase chain reaction)技术是20世纪90年代兴起的分子生物学实验技术,是在PCR反应体系中加入荧光基团,利用荧光信号的累积实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。该方法具有快速、灵敏、特异性高、重复性好等优点,近年来在水体中的肠道病原菌定量检测中被广泛使用[2-3]。Sharma 和Dean-Nystrom 建立了定量PCR检测产志贺毒素大肠杆菌的方法[4],张崇淼等人建立了水环境中多种肠道病毒的实时荧光定量PCR检测方法[5]。 为丰富实验的教学内容,进一步加强和完善学科建设,在环境微生物学实验教学中引入定量PCR技术。
1 主要仪器
定量PCR仪(ABI 7500),台式高速离心机(Thermo Hearus Pico17),单道可调微量移液器(Gilson),PCR仪(ABI Veritti 96 well),超微量紫外/可见分光光度计(NanoDrop2000),恒温摇床,隔水式恒温培养箱。
2 实验材料的准备与实验方案的设定
2.1 定量方法及定量引物的选择
实时荧光定量PCR根据定量方法的不同分为绝对定量和相对定量,绝对定量是测定目的基因在样本中的分子数目,通常用拷贝数表示;相对定量是测定目的基因在2个或多个样本中的含量的相对比例,但并不知道它们在每个样本中的实际拷贝数。对于样品中的大肠菌群需要知道的是样品中大肠菌群的绝对数量,所以选择使用绝对定量法检测。绝对定量实验需要已知拷贝数的绝对标准品,需做标准曲线。
实时荧光定量PCR根据定量检测方法的不同分为探针法和染料法。探针需要公司合成,相对而言成本较高,而且探针设计困难。染料法对DNA模板没有选择性,使用方便,灵敏度高,价格便宜,适用性广,实验教学选用这种方法较为合适。目前定量PCR中主要使用的染料是SYBR Green I,SYBR Green I 是一种可以与所有双链DNA双螺旋小沟区域结合的具有绿色激发波长的染料。当它与DNA双链结合后,荧光信号增强为原来的20倍以上;双链DNA解链时,染料从DNA上释放出来,荧光信号急剧减弱[6],荧光信号的强度与双链DNA分子数量相关,因此根据延伸后的荧光强度可以实时监测PCR的进程。
由于SYBR Green I 可以与所有的双链DNA分子结合,所以反应中若存在目的片段以外的双链DNA,比如非特异性扩增产物、引物二聚体等,会对定量的结果产生影响,产生假阳性或使定量结果偏高[7]。选择合适的引物,尽量避免非特异性扩增和引物二聚体对SYBR Green I 法的定量准确性非常重要。通过文献阅读和实验比较,选择扩增大肠菌群的fepE基因的引物[8],具体序列为E1: 5′-TGTTCAGTGGCAAGAGTT-3′ 和E2: 5′-TAATCGATATACCCGCTC-3′, 目的产物大小为353bp。
2.2 水样采集与DNA提取
用采样器采集校园河水,考虑到定量PCR测定的大肠菌群数据要与多管发酵的结果相比较,因而采样时间、地点与多管发酵样品的时间、地点相同。采集的河水样品,立即用0.22 μm滤膜加压过滤,将微生物截留在滤膜上,然后用Mo Bio公司的Ultra clean soil Kit试剂盒提取DNA,滤膜剪碎放入研磨管中,按操作说明提取DNA。
2.3 标准品的制备
绝对定量的标准品可以使用已知拷贝数的基因组、PCR产物或质粒,研究表明质粒稳定性好,经反复冻融或长时间储存,不易降解,稳定性优于基因组DNA或PCR产物[9]。学生实验课时间较长,标准品稳定性好有利于教师的实验准备工作;并且质粒提取方便,产量高,易于储存,这将大大减少实验的准备工作,因此选用质粒作为本实验的标准品。
用 E1和E2扩增大肠杆菌Top10菌株DNA,电泳图见图1。从图中可以看出E1和E2扩增产物大小约350左右,与目的片段大小一致,条带清晰,无其他杂带,无模板对照没有特异性条带,说明PCR扩增成功。PCR产物纯化后连接pMD18T载体,转化大肠杆菌感受态细胞,涂布于含60 mg/L氨苄青霉素的LB固体平板上,37 ℃倒置过夜培养。从转化平板随机挑取7个单菌落于含60 mg/L氨苄青霉素的LB液体中培养4~6 h,M13引物(M13F:5’-CGCCAGGGTTTTCCCAGTCACGAC-3’和M13R: 5’-AGCGGATAACAATTTCACACAGGA-3’ ) PCR鉴定转化子(见图2)。从图2中可以看出,PCR扩增产物大小与插入片段大小一致,说明这些转化子中均插入了目的片段。选择条带大小与目的片段大小一致的转化子测序,测序结果去除载体序列后,在NCBI网站上用BLAST比对,比对正确的转化子菌种保存备用。

图1 E1和E2扩增产物电泳图
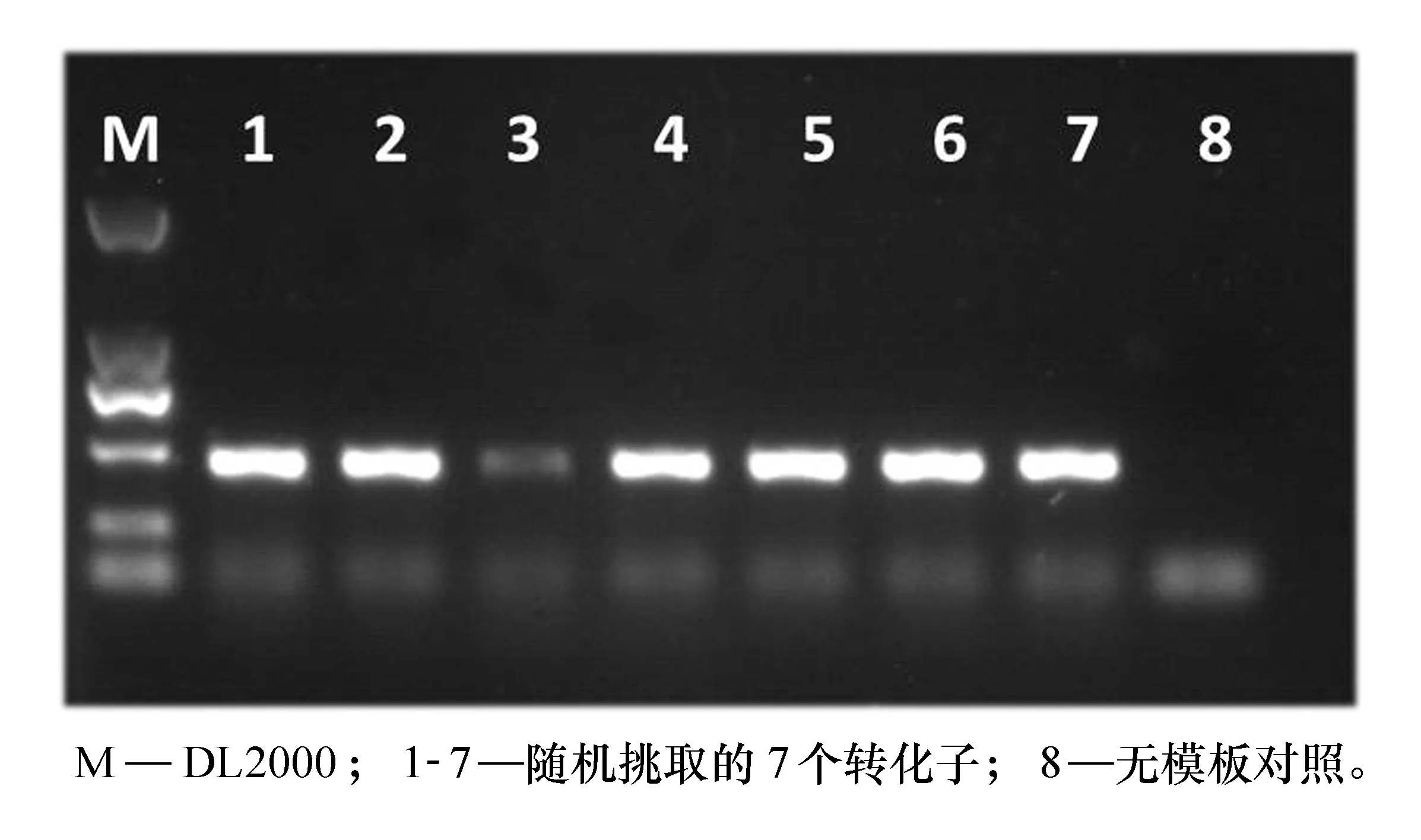
图2 转化子鉴定琼脂糖电泳图
将比对结果正确的转化子菌液20 μL接入含60 mg/L氨苄青霉素的3 mL液体LB培养基的无菌试管中,37 ℃、160 r/min振荡培养16 h,用AXYGEN质粒小抽试剂盒按操作说明提取质粒,用NanoDrop2000测定质粒浓度,并根据下式换算为拷贝数浓度[10]:
(1)
经计算,提取的质粒浓度为3.1×1010copy/μL。
2.4 反应体系与实验程序的确定
为了节约实验经费,并保证实验结果的稳定性,采用20 μL PCR反应体系,其中含有灭菌水8 μL,上下
游引物(10 μmol/L)各0.5 μL,模板2 μL,SYBR Mix (2×)10 μL。为了保证扩增效率,实验采用三步法,具体程序为95 ℃、5 min(预变性),95 ℃、15 s,55℃、30 s,72℃、34 s(采集荧光信号),40个循环,融解曲线分析 60~95 ℃。
2.5 标准曲线的制作
将上述已知浓度的质粒先稀释为1010copy/μL,再按10倍稀释,以浓度为102~108copy/μL的质粒作为标准样品,制作定量标准曲线。理想的标准曲线:基线平整,相关系数有R2≥0.98,扩增效率在0.9~1.1之间,越接近于1越好[11]。图3(a)是E1和E2定量大肠菌群的扩增曲线(ΔRn为样品荧光信号值与空白对照的差值),从曲线中可以看出,标线的基线平整,指数范围大,平台期汇于一起。图3(b)为标准曲线,由标准曲线可以得到扩增效率为93.941%,R2=0.999,符合理想标准曲线的要求,结合融解曲线分析知定量准确。
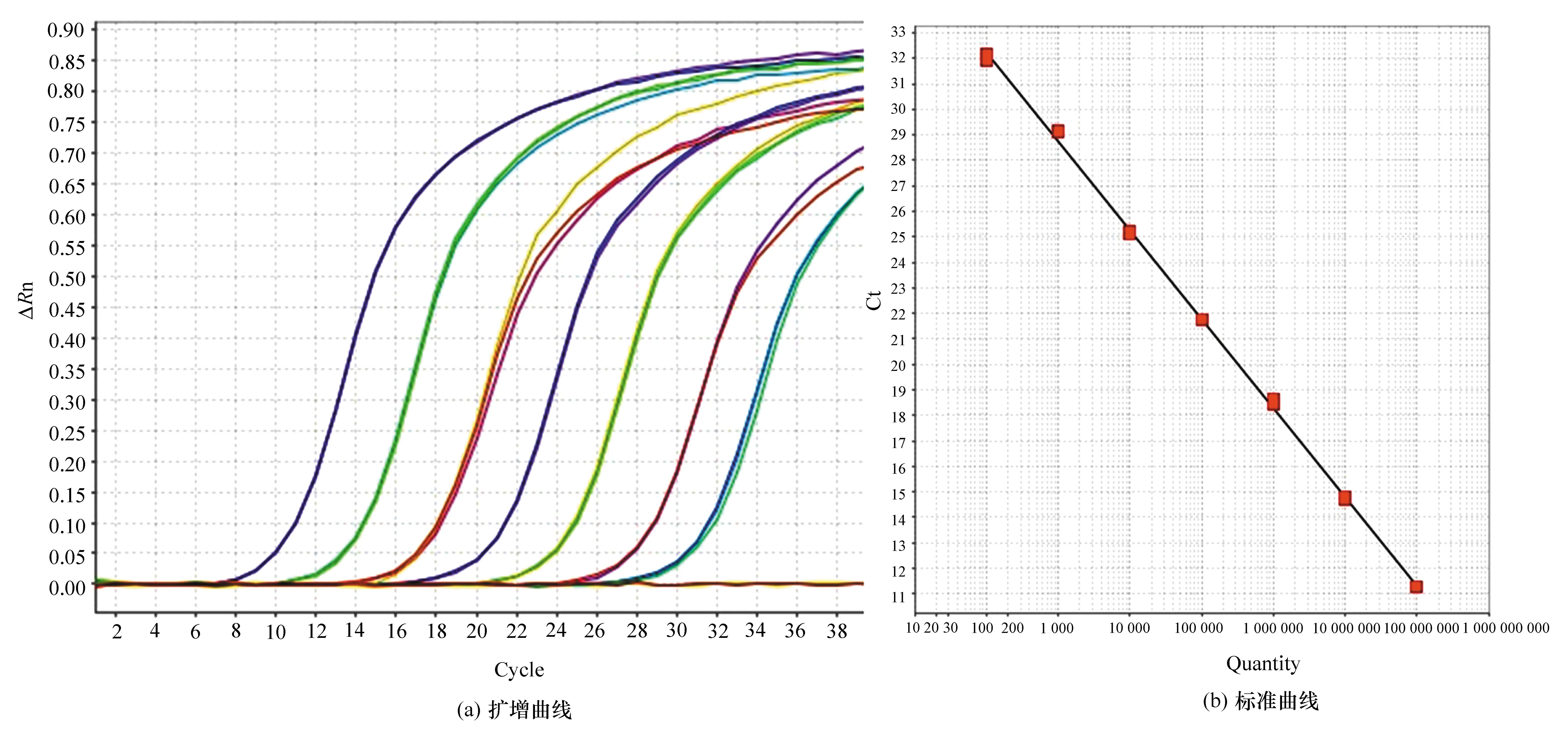
图3 定量大肠菌数的标准曲线
3 教学实践
3.1 教学实践的开展
由实验教师带领部分学生准备如下实验材料:107copy/μL的标准质粒,水样总DNA浓度为10 μmol/L的引物E1和E2,SYBR mix,无菌水,无菌离心管(1.5 mL,0.2 mL),无菌Tip头,一次性手套,0.2 mL的光学PCR管等。学生2人一组,每组一套实验用品(上述材料和一套单道可调微量移液器)。
实验开始前,教师先对定量PCR原理及操作过程作简单介绍,详细讲解实验过程中的注意事项,如标准品稀释,操作中为了保持平行样之间完全平行的两次扩增体系的分装等。实验中以学生自主操作,教师巡视指导为主要教学方法。PCR体系配制完成后,指导学生将样品放入定量PCR仪,并进行软件编程,待仪器运行结束,指导学生进行结果分析,并引导学生查询资料,了解实验结果中出现的各种问题的成因。
3.2 实验结果
综合全班的结果看,实验结果尚可:从融解曲线知操作过程几乎没有引入污染物,多数组别的标准曲线可用。水样中大肠菌数定量结果全班平均为8 500 copy/L,同样的样品,多管发酵法测得的大肠杆菌数为2 300 个/L,PCR的定量结果比多管发酵结果高,定量结果可能有高估的情况,但这只是一次实验的结果,要多次实验后才能下结论。
3.3 教学效果评估
该实验为探索性综合实验,以本科生为主体,从课程建设和本科生培养的角度考虑,此实验教学是成功的,不仅丰富了本科实验教学内容,还培养了学生的监测能力。实验中,学生了解并践行了现代分子生物实验技术检测环境微生物,切身体会到新实验技术的简便性与灵敏性。经过实验准备、实验操作、结果分析及资料查询、实验报告撰写等,使学生得到系统锻炼,培养了学生的独立思考能力、实验操作能力和分析能力[12],充分调动了学生的积极性,有利于学生树立严谨的科学思维和态度,提升其创新能力。
4 结语
环境微生物学实验是一门实践性和应用性很强的课程。通过实验教学,培养学生探索精神和实践能力。随着科学技术的发展和学科建设的要求,对实验教学内容适当调整,以满足创新人才的培养需求,是实验课程建设的重要内容。本文从教学实验角度考虑,设计了用于检测大肠菌数的定量PCR实验,使学生有机会在实验课堂上学习荧光定量操作技术,开拓了学生的视野,激发了学生对环境微生物学的学习兴趣,提升了学生参与实验和科研的积极性和主动性,取得了良好的教学效果。
References)
[1] 冯青英, 刘娟, 杨大卫. 粪大肠菌群多管发酵测定法的改进研究[J]. 中国环境监测, 2009, 25(6):43-45.
[2] 汤海峰, 姜丹, 孟令军, 等. 荧光定量法分析液体发酵中杂菌污染的实验设计[J]. 实验技术与管理, 2016, 33(6):50-54.
[3] 易鑫, 李娟, 黄京, 等. 北京市4 种不同污水处理系统中病原菌变化研究[J].环境科学学报,2015, 35(6):1759-1767.
[4] Sharma V K, Dean-Nystrom E A.Detection of enterohemorrhagic Escherichia coli O157:H7 by using a multiplex real-time PCR assay for genes encoding intimin and Shiga toxins [J]. Veterinary Microbiology, 2003, 93: 247-260.
[5] 张崇淼, 刘永军, 王晓昌, 等. 逆转录-聚合酶链反应(RT-PCR)技术同时检测水中多种肠道病毒[J].环境科学研究, 2007, 28(7):137-141.
[6] Zhou H, Lin S Y, Nie Y C, et al. Surface-enhanced resonance Raman scattering (SERRS) simulates PCR for sensitive DNA detection [J].The Society of Chemistry, 2015,140(8):7518-7521.
[7] 欧阳松应, 杨冬, 欧阳红生, 等. 实时荧光定量PCR 技术及其应用[J]. 生命的化学, 2004, 24(1):74-76.
[8] Zhang C M, Wang X C. Distribution of Enteric Pathogens in Wastewater Secondary Effluent and Safety Analysis for Urban Water Reuse[J]. Human and Ecological Risk Assessment: An International Journal, 2014, 20(3):797-806.
[9] Dhanasekaran S, Doherty T M, Kenneth J, et al. Comparison of different standards for real-time PCR-based absolute quantification [J]. Journal of Immunological Methods,2010,354:34-39.
[10] Fu X H, Wang L, Nie M, et al. Potential ecological risks of thermaltreated waste recombination DNA discharged into an aquatic environment[J]. Journal of Environmental Science and Health Part A, 2011,46(14):1640-1647.
[11] 顾卿, 许艳丽, 魏巍, 等. 土壤细菌群落密度实时荧光定量PCR 检测体系的建立[J]. 土壤与作物, 2012,1(2):117-120.
[12] 靳溪, 薛秀花, 李洁, 等. 实时荧光定量PCR技术在发育生物学实验[J]. 实验室研究与探索, 2014,33(7):214-217.
Design of experiment for quantitative PCR detection of coliform bacteria number in water sample
Fu Xiaohua1,2, Zhang Xian1,2, Le Yiquan1,2, Tang Xianchun1,2, Wang Lei1,2
(1. School of Environmental Science and Engineering, Tongji University, Shanghai 200092, China;2. State Key Laboratory of Pollution Control and Resource Reuse, Tongji University, Shanghai 200092, China)
In order to continuously improve the construction of Environmental Microbiology Experiment course and cultivate the students’ ability to analyze the actual samples, an experimental system is designed for a real-time fluorescence quantitative PCR (pdymerase chain reaction) detection of the coliform bacteria number in the water sample. The teaching practice shows that the experimental scheme is feasible, and the students carry out the experiment well. They acquire the knowledge about the coilform bacteria in the environmental samples detected by the real-time fluorescent quantitative PCR technology, and experience the simplicity and sensitivity of the new experimental technology by themselves, which can improve their learning interest and innovative ability.
environmental microbiology experiment; real-time fluorescent quantitative PCR; coliform bacteria number
10.16791/j.cnki.sjg.2017.08.015
2017-02-26
国家自然科学基金资助项目(21577101);同济大学第十一期实验教学改革项目
付小花(1978—),女,安徽定远,硕士,助理研究员,主要从事分子生物实验技术教学及环境微生物相关研究工作.E-mail:xiaohuafu@tongji.edu.cn
X832;G642.423
A
1002-4956(2017)08-0056-04
