二甲亚砜法破壁条件对法夫酵母虾青素提取效果的影响
2017-09-03董丛丛杨远帆黄高凌蔡慧农杜希萍
黄 莹,王 凯,董丛丛,倪 辉,2,3,4,杨远帆,2,3,4,黄高凌,2,3,4,蔡慧农,2,3,4,杜希萍,2,3,4,*
(1.集美大学食品与生物工程学院,福建厦门 361021; 2.福建省食品微生物与酶工程重点实验室,福建厦门 361021; 3. 厦门市食品与生物工程技术研究中心,福建厦门 361021; 4. 厦门南方海洋研究中心海藻资源化利用与深加工重点实验室,福建厦门 361021)
二甲亚砜法破壁条件对法夫酵母虾青素提取效果的影响
黄 莹1,王 凯1,董丛丛1,倪 辉1,2,3,4,杨远帆1,2,3,4,黄高凌1,2,3,4,蔡慧农1,2,3,4,杜希萍1,2,3,4,*
(1.集美大学食品与生物工程学院,福建厦门 361021; 2.福建省食品微生物与酶工程重点实验室,福建厦门 361021; 3. 厦门市食品与生物工程技术研究中心,福建厦门 361021; 4. 厦门南方海洋研究中心海藻资源化利用与深加工重点实验室,福建厦门 361021)
为了评价二甲亚砜(DMSO)法破壁在法夫酵母虾青素提取中的应用价值,研究了提取溶剂、DMSO用量、破壁温度、料液比、浸提时间、浸提次数6个条件因子对破壁后法夫酵母虾青素提取的影响,并对破壁条件进行了优化。实验结果表明:丙酮为最理想的提取溶剂;各主要因素破壁温度、料液比和浸提时间对虾青素的提取量影响依次减小,单因素及正交实验得到法夫酵母中虾青素提取的最佳条件为:以丙酮为提取溶剂、DMSO用量1∶1.5、浸提2次、破壁温度45 ℃、料液比1∶20 (w/v)、浸提时间40 min,优化后虾青素的提取量为4.42 mg/g。
法夫酵母,虾青素,二甲亚砜,正交实验,提取
虾青素(3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素)是一种广泛存在于植物、藻类、海产品中的类胡萝卜素[1],特别是在虾、蟹、鱼、羽毛中含量较高。它在抗氧化、着色、增强人体免疫能力、保护心脑血管及中枢神经等方面具有优良的生物学功能[2],因此在饲料、食品、化妆品、医药等领域有着广阔的应用前景[3-5]。
法夫酵母(Phaffiarhodozyma)是一种含有丰富虾青素的红酵母,与其它天然虾青素的来源相比较,它具有生长快、培养周期短、虾青素含量高(其含量占总类胡萝卜素的70%~95%),能利用多种碳、氮源等特点,是一种应用前景极佳的天然虾青素资源[6-7]。法夫酵母的细胞壁由甘露聚糖、葡聚糖、糖蛋白等成分组成,这不仅使其具有致密的结构,而且十分坚硬,对虾青素的开发利用造成极大的困难[8-9],因此对法夫酵母进行破壁处理是虾青素提取的重要步骤。
目前,法夫酵母的破壁方法有机械法、物理方法、化学方法及酶解法[10-11]。其中化学方法最为常用,包括酸法[12-13]、碱法[14]、二甲亚砜(DMSO)法。由于酸法破壁易导致虾青素的降解,碱法破壁会导致虾青素发生酯化反应,而且酸法和碱法破壁过程中大量污水排放对水源产生了严重的污染[15],因此酸法和碱法破壁存在一定的局限性。而二甲亚砜破壁法不仅能取得较好的破壁效果,并且虾青素的结构不会受到破坏,是法夫酵母破壁的理想方法[16-18]。
因此,本文拟采用二甲亚砜(DMSO)对法夫酵母进行破壁,选择合适的低沸点有机溶剂提取虾青素,研究提取溶剂、DMSO用量、破壁温度、料液比、浸提时间、浸提次数6个条件因子对二甲亚砜破壁法夫酵母提取虾青素的影响,优化得到法夫酵母中虾青素提取的最佳条件,为法夫酵母中虾青素的提取提供理论依据。
1 材料与方法
1.1 材料与仪器
法夫酵母菌体 厦门汇盛生物有限公司;虾青素标准品 美国Sigma公司;甲醇 色谱纯,美国Sigma公司;二甲亚砜、无水乙醇、石油醚、氯化钠、乙酸乙酯、甲醇、正丁醇、丙酮等 分析纯,国药集团。
BS124S分析天平 赛多利斯科学仪器有限公司;FA1004N电子天平 上海精科天平仪器厂;LXJ-B离心机 上海安亭科学仪器厂;旋转蒸发仪RE-52AA 上海亚荣生化仪器厂;7200可见分光光度计 厦门亿辰科技有限公司;HH-8数显恒温水浴锅 金坛市鸿科仪器厂;Agilent 1260型高压液相色谱仪 安捷伦科技(德国)股份有限公司。
1.2 实验方法
1.2.1 虾青素提取量的测定 虾青素提取量的测定方法采用分光光度法[19],并进行适当的修改,将虾青素的提取量单位改为mg/g。
虾青素标准曲线的绘制:准确称取20 mg的虾青素标准品,用丙酮溶液充分溶解,定容到100 mL,得到200 μg/mL的虾青素母液。取适量的母液,用丙酮溶液分别稀释成浓度为5、10、15、20 μg/mL的虾青素标准溶液。以丙酮溶液为空白,在474 nm下测定虾青素标准溶液的吸光度值,实验重复三次。以虾青素的浓度(μg/mL)为横坐标,吸光度(OD474)为纵坐标绘制虾青素标准曲线。
虾青素提取量的计算:以丙酮溶液为空白,测定虾青素在474 nm处的吸光值OD474,按公式(1)进行计算:
虾青素提取量(mg/g)=OD474×V×D/(a×W×103)
式(1)
式(1)中,OD474:474 nm处的吸光度值;V:提取所用有机溶剂体积;D:稀释倍数;a:虾青素浓度与OD474的换算系数(参照虾青素标准曲线计算);W:法夫酵母的质量(g)。
1.2.2 提取溶剂的选择 称取6份法夫酵母菌体,每份10 g,各加入20 mL DMSO溶液,于52 ℃破壁10 min。之后,分别加入350 mL乙醇、乙酸乙酯、丙酮、石油醚、甲醇、正丁醇作为提取溶剂,常温浸提10 min,4000 r/min离心10 min。收集上清液,稀释20倍,在474 nm下测定吸光值,实验重复3次,虾青素提取量按公式(1)计算。
1.2.3 DMSO用量的选择 称取4份法夫酵母菌体,每份10 g,按菌体∶DMSO=1∶1、1∶1.5、1∶2、1∶2.5(w/v)分别加入DMSO,52 ℃破壁10 min。之后,各加入350 mL丙酮,常温浸提10 min,4000 r/min离心10 min。收集上清液,稀释20倍,在474 nm下测定吸光值,实验重复3次,虾青素提取量按公式(1)计算。
1.2.4 破壁温度的选择 称取5份法夫酵母干菌体粉,每份10 g,各加入15 mL DMSO,分别在35、40、45、50、55 ℃下破壁10 min。之后,各加入350 mL丙酮,常温浸提10 min,4000 r/min离心10 min。收集上清液,稀释20倍,在474 nm下测定吸光值,实验重复3次,虾青素提取量按公式(1)计算。
1.2.5 料液比的选择 称取5份法夫酵母菌体,每份10 g,各加入15 mL DMSO,于50 ℃破壁10 min。之后,以菌体∶溶剂=1∶5、1∶10、1∶15、1∶20、1∶25(w/v)分别加入丙酮,常温浸提10 min,4000 r/min离心10 min。收集上清液,稀释20倍,在474 nm下测定吸光值,实验重复3次,虾青素提取量按公式(1)计算。
1.2.6 浸提时间的选择 称取5份法夫酵母菌体,每份10 g,各加入15 mL DMSO,于50 ℃破壁10 min。之后,各加入150 mL丙酮,常温下分别浸提10、20、30、40、50 min,4000 r/min离心10 min。收集上清液,稀释20倍,在474 nm下测定吸光值,实验重复3次,虾青素提取量按公式(1)计算。
1.2.7 浸提次数的选择 称取10 g法夫酵母菌体,加入15 mL DMSO,于50 ℃破壁10 min。之后,加入150 mL丙酮,常温浸提30 min,4000 r/min离心10 min,收集上清液;将菌体分别进行第二次、第三次浸提,方法同上,将每次收集的上清液分别稀释20倍,在474 nm下测定吸光值,实验重复3次,虾青素提取量按公式(1)计算。
1.2.8 正交实验方法 在单因素实验的基础上,利用正交实验,以破壁温度、料液比、浸提时间作为3个考察因素,选取3水平进行实验,按L9(34)正交表(表1)进行正交实验设计,确定法夫酵母中虾青素提取的最佳条件。
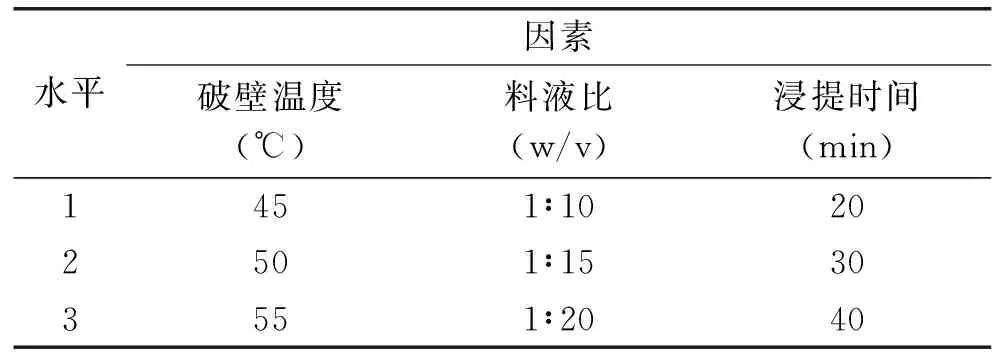
表1 法夫酵母虾青素提取正交实验因素水平表Table 1 Factors and levels for the extraction of astaxanthin from Phaffia rhodozyma by orthogonal experiment
1.2.9 提取物中虾青素纯度的测定
1.2.9.1 虾青素标准曲线的绘制 准确称取10 mg虾青素标准品,先用极少量二氯甲烷充分溶解,随后用色谱纯甲醇将其定容至100 mL,制成浓度为0.1 mg/mL的虾青素母液。取适量的母液,用色谱纯甲醇分别稀释成浓度为1、2、3、4、6、8、10 μg/mL的虾青素标准溶液。用高压液相色谱法测定虾青素标准溶液的峰面积。以虾青素标准溶液的浓度和峰面积为指标绘制标准曲线。
1.2.9.2 虾青素纯度的测定 采用高压液相色谱法测定提取物中虾青素的纯度。溶剂系统由超纯水(A泵)及甲醇(B泵)组成,使用ZORBAX SB-C18色谱柱(100 mm×2.1 mm,I.D.,3.5 μm)进行洗脱。洗脱条件如表2所示,流速0.2 mL/min,柱温35 ℃,进样量5 μL,检测波长474 nm。

表2 HPLC梯度洗脱条件Table 2 The HPLC gradient elution condition
1.2.10 数据分析 单因素实验数据采用Microsoft Excel 2007、SPSS 17.0统计软件进行统计分析并绘图。正交实验运用正交设计助手Ⅱv3.1进行实验设计、分析。
2 结果与讨论
2.1 虾青素标准曲线的绘制
以虾青素浓度(μg/mL)为横坐标,吸光度(OD474)为纵坐标绘制虾青素标准曲线,如图1所示。所得方程为y=0.066x+0.000,R2=0.999(y,吸光度(OD474);x,虾青素浓度(μg/mL)),方程线性关系良好。由此可知,虾青素提取量的计算公式(1)中a为0.066。
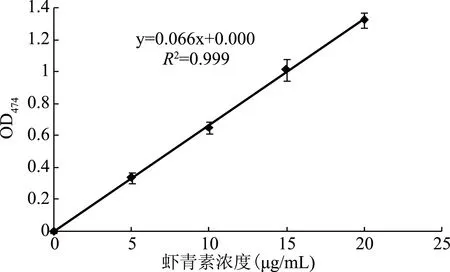
图1 虾青素标准曲线Fig.1 Astaxanthin calibration curve
2.2 提取溶剂对虾青素提取的影响
由于虾青素难溶于水,根据相似相溶原理,选取合适的有机溶剂对虾青素进行提取,结果如图2所示。
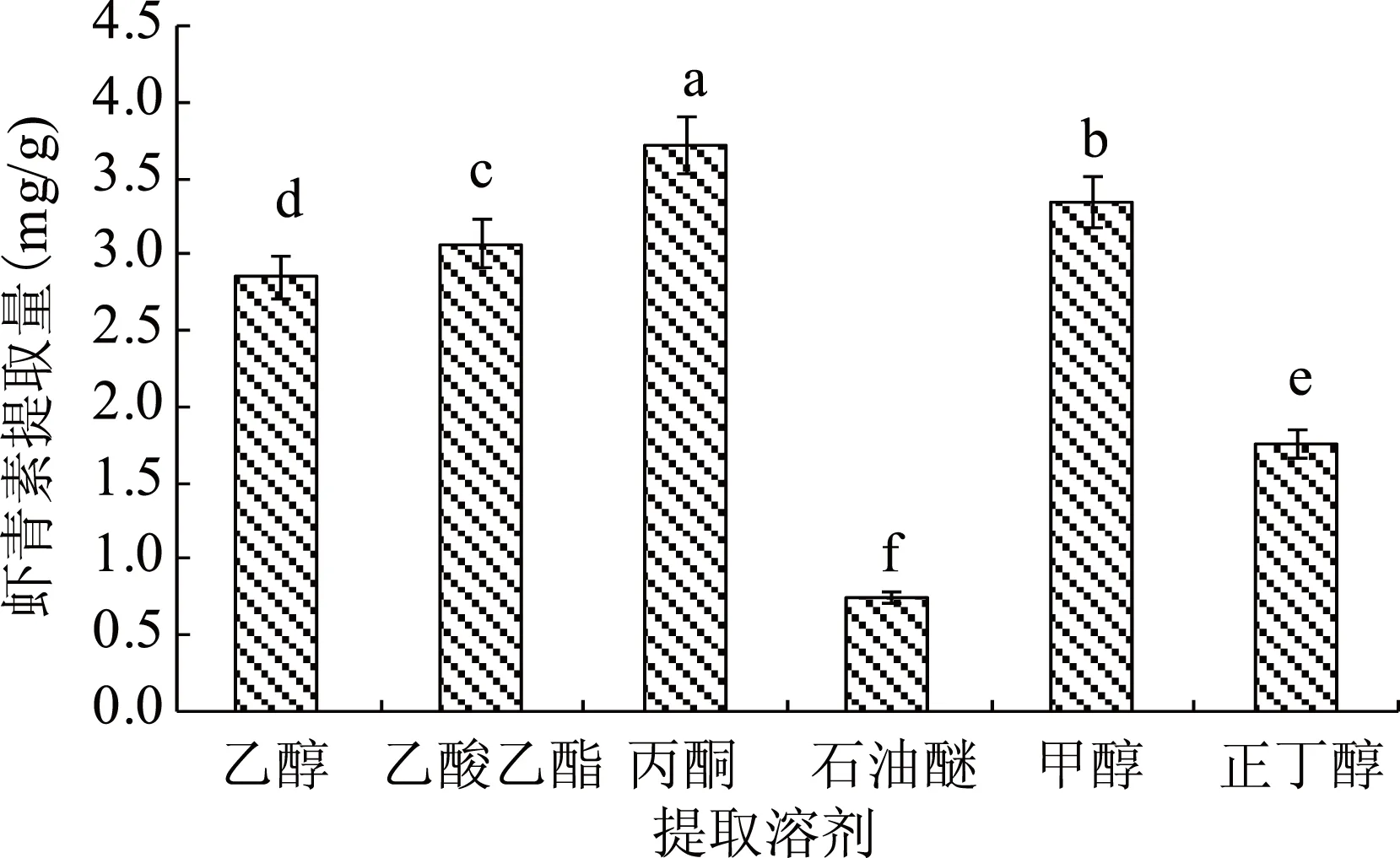
图2 不同提取溶剂对虾青素提取的影响Fig.2 Effects of different solvents on the extraction of astaxanthin注:柱子上方的小写字母表示显著性分析结果,不同字母代表具有显著性差异(p<0.05);图3~图7同。
由图2可知,提取溶剂不同,虾青素的提取量不同。提取溶剂为丙酮时,虾青素的提取量最高,为3.73 mg/g;当提取溶剂为甲醇、乙酸乙酯、乙醇和正丁醇时,虾青素的提取量依次降低;提取溶剂为石油醚时,虾青素的提取量最低,仅为0.75 mg/g。方差分析表明,丙酮与其他提取溶剂具有显著性差异(p<0.05)。倪辉等也报道采用不同溶剂从0.1 g法夫酵母菌体提取虾青素,丙酮具有较好的提取效果,其虾青素浓度可达到2.44 μg/mL[16]。另外,丙酮作为提取溶剂,还具有操作方便的特点[11],故选取丙酮作为提取溶剂进行后续的实验。
2.3 DMSO用量对虾青素提取的影响
二甲基亚砜(DMSO)是一种既溶于水又溶于有机溶剂的极性溶剂,是一种良好的渗透增强剂。据文献报道DMSO可以进入细胞使溶于其中的蛋白变性[20],由于法夫酵母的细胞壁由糖蛋白等成分组成,因而DMSO可以使法夫酵母的细胞壁结构遭到破坏,使虾青素溶解出来。此外,DMSO破壁还不会对虾青素的结构造成破坏[14-15]。因此,采用不同体积的DMSO进行法夫酵母破壁,以获得最适DMSO用量,结果如图3所示。
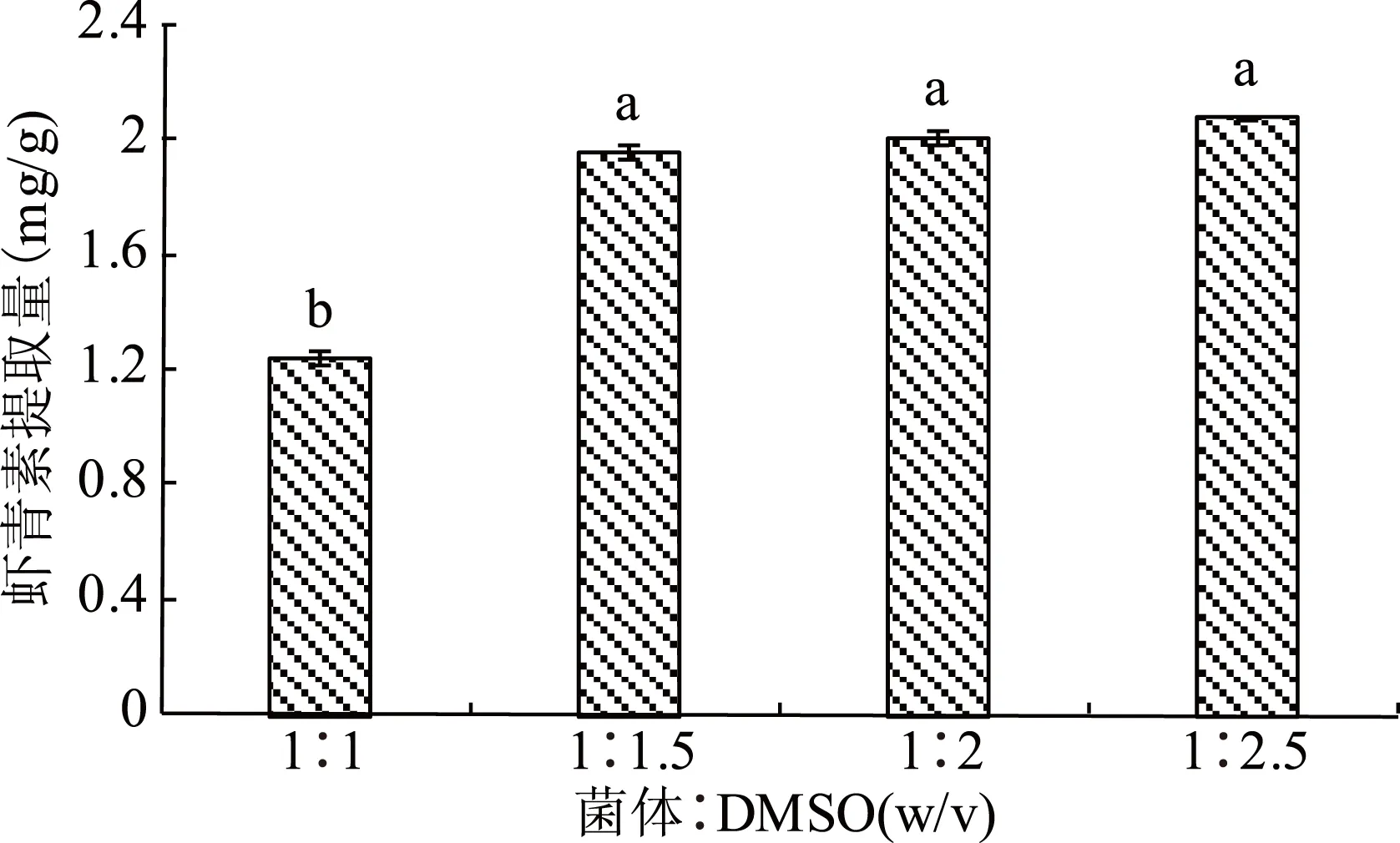
图3 DMSO用量对虾青素提取的影响Fig.3 Effects of DMSO dosage on the extraction of astaxanthin
由图3可知,当菌体∶DMSO=1∶2.5(w/v)时,虾青素提取量最高,达到2.09 mg/g;菌体∶DMSO=1∶1(w/v)时,虾青素的提取量最少,提取量为1.24 mg/g。方差分析表明,菌体∶DMSO=1∶1(w/v)与其他DMSO用量在虾青素的提取量上存在显著性差异(p<0.05),菌体∶DMSO在(1∶1.5~1∶2.5,w/v)之间时,虾青素的提取量没有明显的差异(p>0.05)。综合考虑破壁效果及后期DMSO的去除,选取菌体∶DMSO=1∶1.5(w/v)进行破壁。
2.4 破壁温度对虾青素提取的影响
不同破壁温度对虾青素提取的影响结果如图4所示。
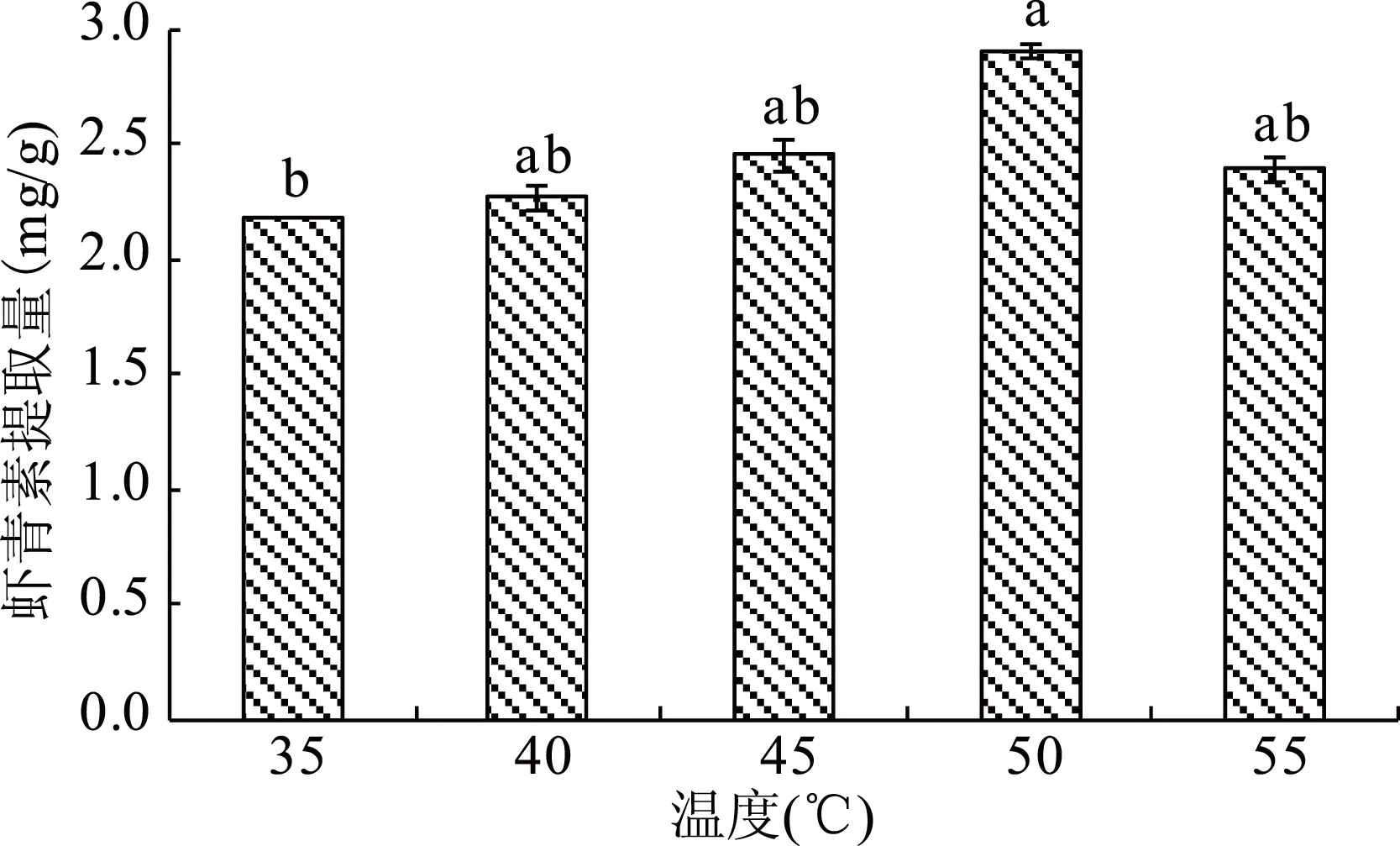
图4 破壁温度对虾青素提取的影响Fig.4 Effects of disrupting the cell wall on the extraction of astaxanthin at different temperatures
由图4可知,随着破壁温度的升高,虾青素的提取量先增加后降低。当破壁温度在35~50 ℃范围内,随着破壁温度的升高,虾青素的提取量升高,当破壁温度为50 ℃时,虾青素的提取量最高,达到2.91 mg/g;当破壁温度为55 ℃时,虾青素的提取量降低,为2.39 mg/g。温度对法夫酵母破壁后虾青素的影响由破壁效果和降解作用决定。当温度低于50 ℃时,温度对法夫酵母破壁主要具有促进作用,所以在35~50 ℃范围内,破壁效果不断增加,虾青素的提取量不断升高;当温度高于50 ℃时,温度对虾青素的影响主要是降解作用,高温破坏了虾青素的结构[11],所以虾青素的提取量又降低。方差分析表明,破壁温度50 ℃与35 ℃存在显著性差异,破壁温度40、45、50、55 ℃之间没有明显的差异(p>0.05)。因此,根据各破壁温度下虾青素的提取效果,选取50 ℃为最适破壁温度。
2.5 料液比对虾青素提取的影响
不同料液比对虾青素提取的影响结果如图5所示。
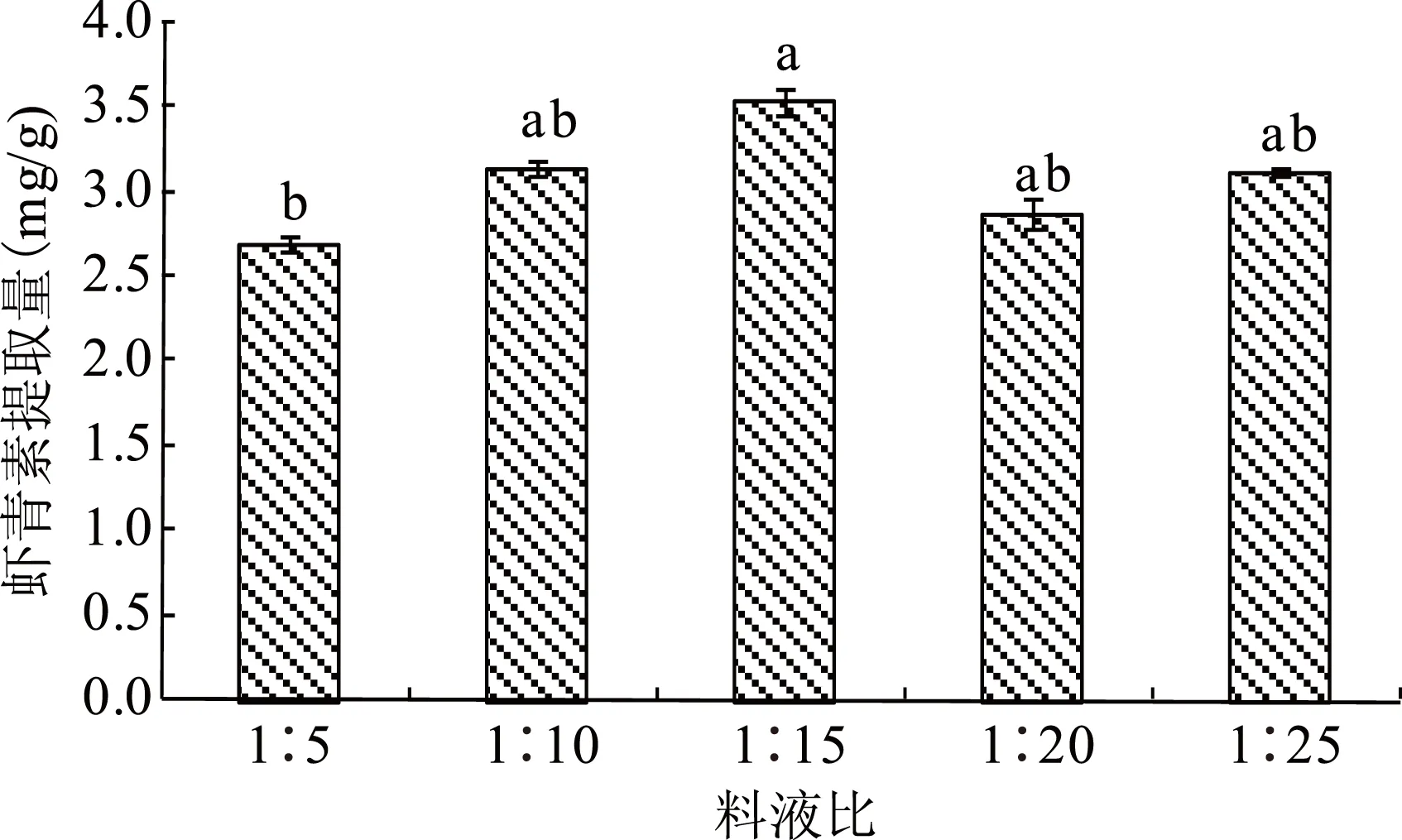
图5 料液比对虾青素提取的影响Fig.5 Effects of solid to liquid ratio on the extraction of astaxanthin
由图5可知,随着料液比的减小,虾青素的提取量先增加后降低。当料液比在1∶5~1∶15 (w/v)范围内,随着料液比的减小,虾青素的提取量升高,当料液比为1∶15 (w/v)时,虾青素的提取量最高,达到3.55 mg/g;当料液比在1∶15~1∶25 (w/v)范围内,虾青素的提取量先降后升;当料液比为1∶5 (w/v)时,虾青素的提取量最低,为2.70 mg/g。方差分析表明,料液比1∶15 (w/v)与1∶5 (w/v)存在显著性差异,料液比1∶15 (w/v)与1∶10、1∶20、1∶25 (w/v)之间没有明显的差异(p>0.05)。综合考虑溶剂使用量及提取效果选取料液比1∶15为最适料液比。
2.6 浸提时间对虾青素提取的影响
浸提时间对虾青素提取的影响结果如图6所示。
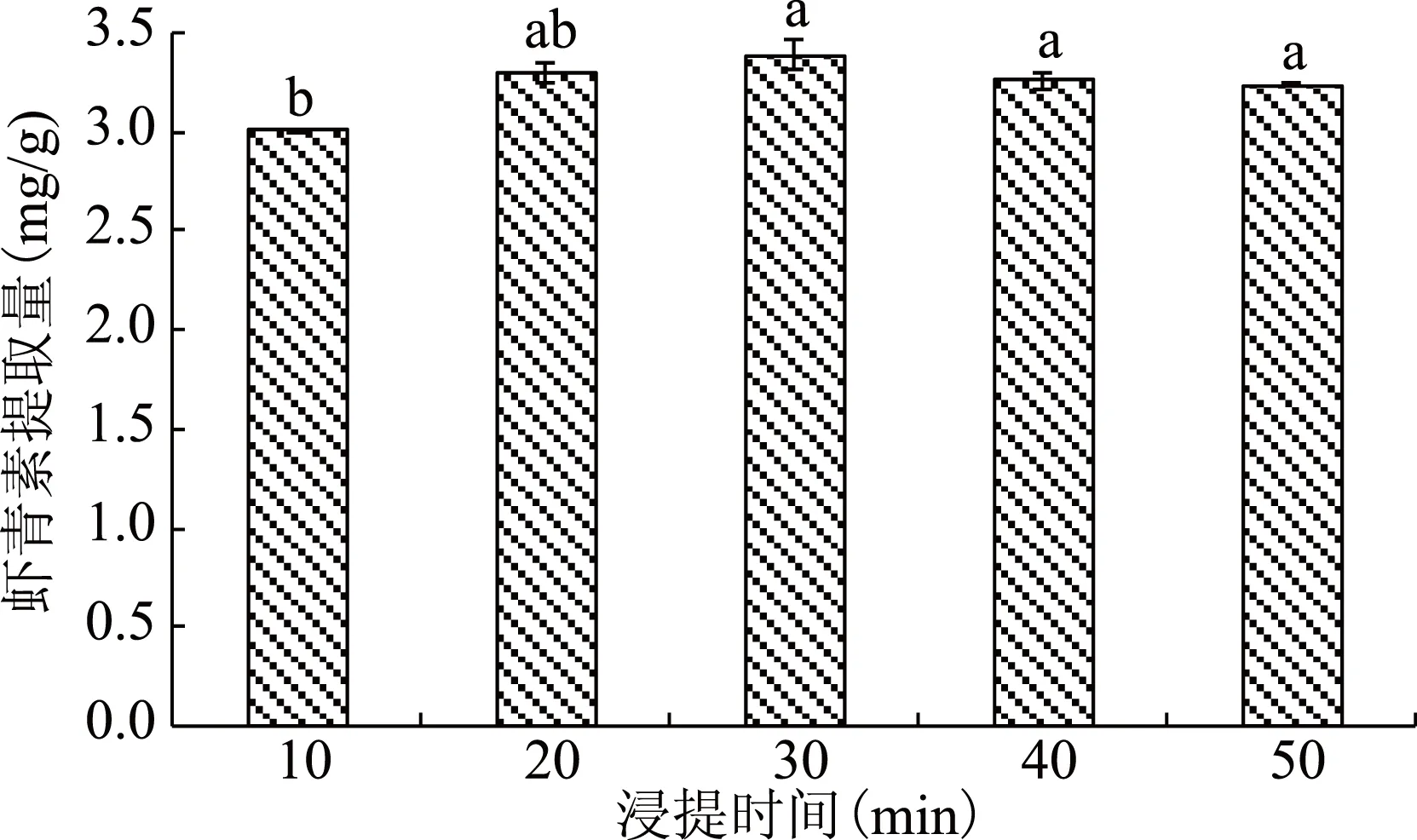
图6 浸提时间对虾青素提取的影响Fig.6 Effects of extraction time on the extraction of astaxanthin
由图6可知,随着浸提时间的增加,虾青素的提取量先增加后降低。当浸提时间在10~30 min范围内,随着浸提时间的增加,虾青素的提取量升高,当浸提时间为30 min时,虾青素的提取量最高,达到3.40 mg/g;当浸提时间大于30 min时,随着浸提时间的增加,虾青素的提取量降低,浸提时间为50 min时,虾青素的提取量为3.24 mg/g。方差分析表明,每组浸提时间之间没有显著性差异(p>0.05)。但由于浸提时间30 min时提取的虾青素含量相对较高,故选取30 min作为最佳浸提时间。
2.7 浸提次数对虾青素提取的影响
浸提次数对虾青素提取的影响结果如图7所示。

图7 浸提次数对提取效果的影响Fig.7 Effects of the number of time on the extraction of astaxanthin
由图7可知,每次浸提液中虾青素的提取量不同,第1次浸提已得到大量虾青素(4.55 mg/g);第2次浸提得到少量虾青素(1.55 mg/g);第3次浸提得到的虾青素最少(0.58 mg/g)。说明破壁后的法夫酵母经过两次浸提,就可得到大部分的虾青素。方差分析表明,各浸提次数之间存在显著性差异(p<0.05)。从经济高效的原则出发,本实验以提取两次为最佳提取次数。
2.8 正交实验优化
根据单因素实验的结果,丙酮作为提取溶剂时,虾青素的提取量最大,结合文献[14]也报道丙酮是虾青素良好的提取溶剂,确定最佳提取溶剂为丙酮;DMSO用量在菌体∶DMSO为1∶1.5~1∶2.5(w/v)时,虾青素的提取量变化不大,浸提两次已提取出大部分虾青素,从节省溶剂及后期纯化效率考虑,确定DMSO用量为菌体∶DMSO=1∶1.5(w/v),浸提次数为两次。在此实验条件下,选取破壁温度、料液比、浸提时间进行四因素三水平的正交实验设计,实验结果如表3。
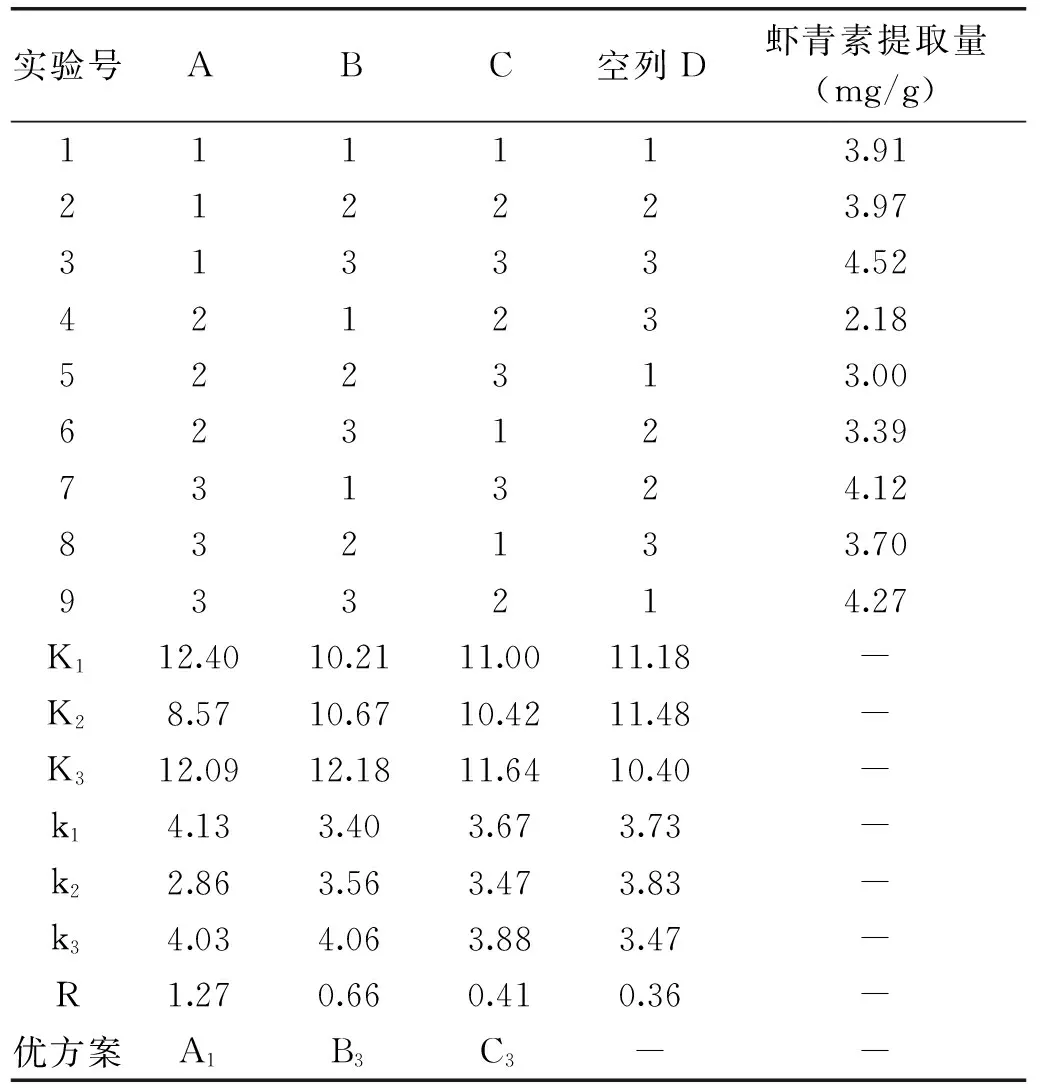
表3 法夫酵母虾青素提取的正交实验Table 3 Extraction of astaxanthin from Paffia rhodozyma by orthogonal experiment
由表3的极差分析可知,RA>RB>RC,各因素对法夫酵母虾青素提取量的影响依次为破壁温度(A)>料液比(B)>浸提时间(C)。根据极差分析得到提取法夫酵母虾青素的最佳条件为A1B3C3,即:破壁温度45 ℃,料液比1∶20,浸提时间40 min。
2.9 验证实验
采用最佳提取条件,取法夫酵母菌体进行验证实验。结果表明,在最佳提取条件下,虾青素的提取量为4.42 mg/g。
2.10 提取物中虾青素纯度的测定
根据实验方法1.2.9.1绘制出虾青素的标准曲线,如图8所示。标准曲线方程式为y=99.125x+0.3925,R2=0.9995(y,峰面积;x,虾青素浓度(μg/mL)),线性关系良好。
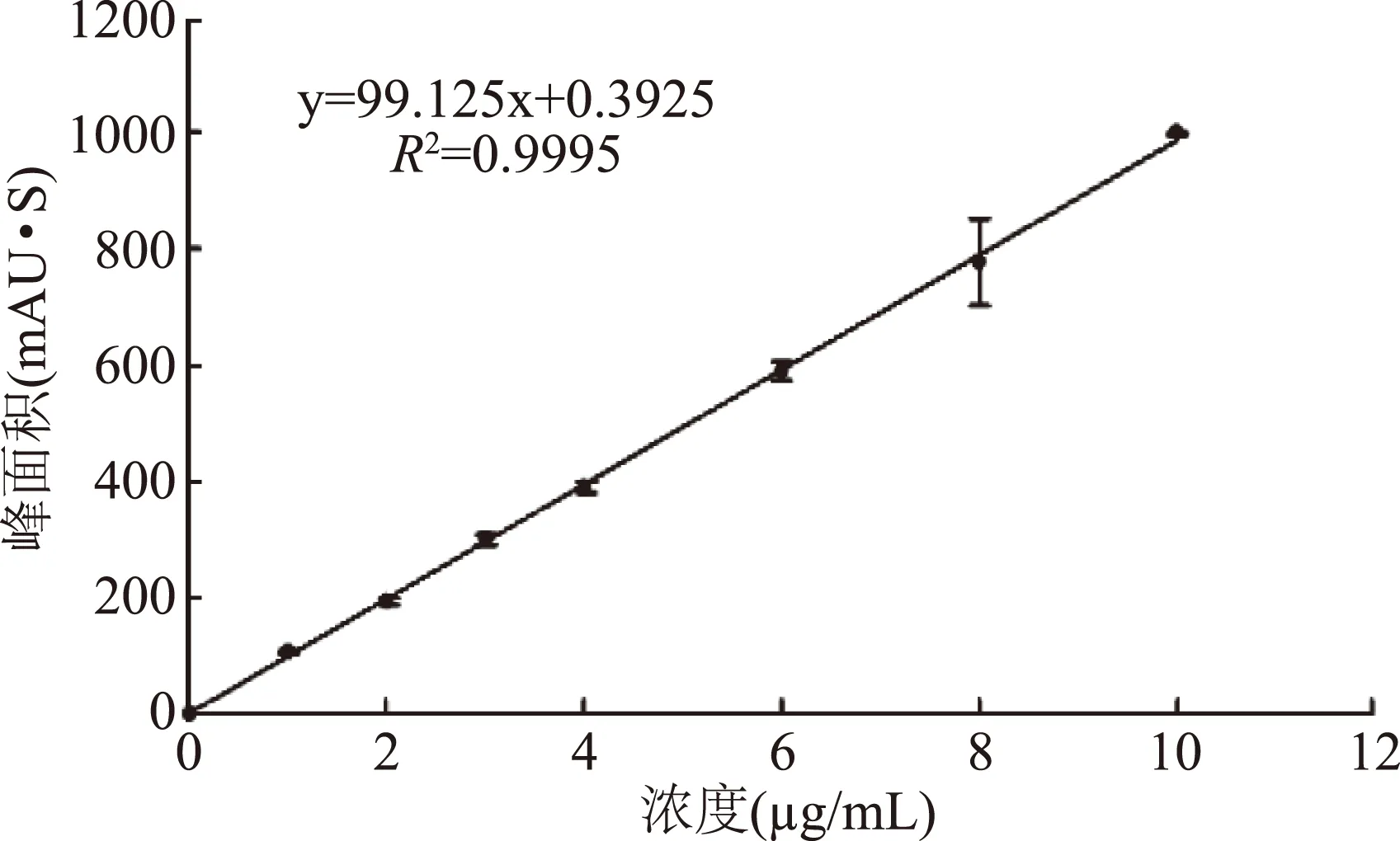
图8 虾青素的标准曲线Fig.8 The standard curve of astaxanthin
采用HPLC分析方法,对最佳提取条件下得到的提取物进一步进行虾青素纯度的测定,结果如图9所示。由图9可知,提取物的主要成分为虾青素。根据虾青素的标准曲线,得到提取物中虾青素的纯度为43.5%。
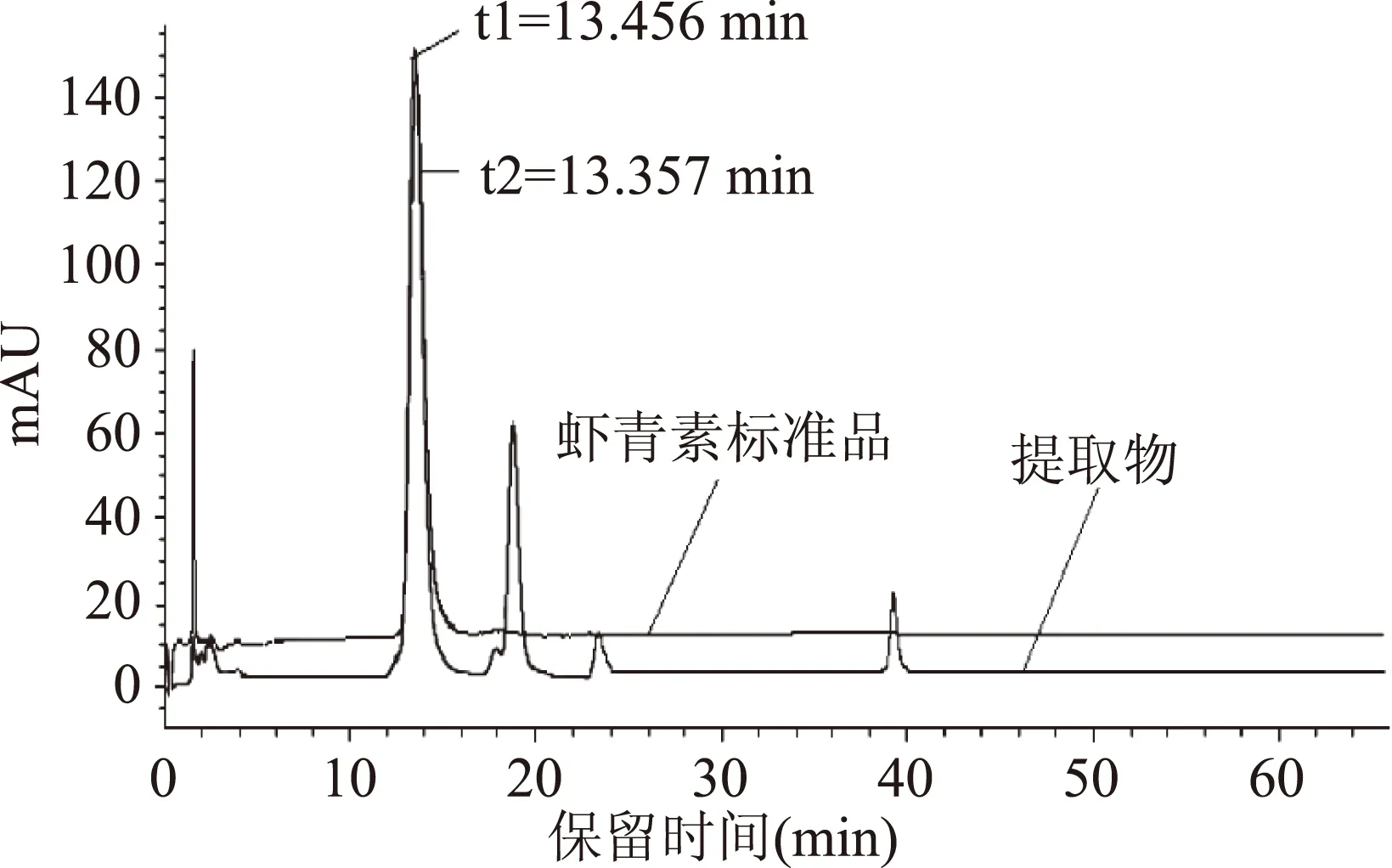
图9 虾青素标准品和提取物的高效液相色谱图Fig.9 HPLC chromatograms of astaxanthin standard and the extract
3 结论
通过单因素及正交实验,优化了法夫酵母中虾青素的提取条件,影响虾青素提取量的各主要因素排序为:破壁温度>料液比>浸提时间;最佳提取条件为:丙酮为提取溶剂、DMSO用量1∶1.5(菌体:DMSO,w/v)、浸提2次、破壁温度45 ℃、料液比1∶20、浸提时间40 min;优化后虾青素的提取量为4.42 mg/g,提取物中虾青素的纯度为43.5%。法夫酵母作为虾青素的重要来源之一,虾青素的提取条件一直备受关注。如采用乳酸破壁,酸加量为15 mL/g,用丙酮浸提虾青素,其提取量为 1.37 mg/g[21]。与之相比,本文采用DMSO破壁,不仅DMSO用量少,节约成本,减少了环境污染;而且虾青素的提取量相对较高,具有较好的开发应用前景。
[1]Nishigaki I,Rajendran R,Venugopal G,et al. Cytoprotective role of astaxanthin against glycated protein/iron chelate-induced toxicity in human umbilical vein endothelial cells[J]. Phytother Res,2010,24:54-59.
[2]姜启兴,夏文水. 龙虾壳中色素的稳定性研究[J]. 食品科学,2006,27(7):61-64.
[3]高清潭,崔志强. 虾青素的应用及其商业化生产[J]. 海湖盐与化工,2004,33(6):33-37.
[4]汪洪涛. 虾青素的性质与开发[J]. 粮食与油脂,2006(11):40-43.
[5]朱明军,宗敏华,吴振强,等. 虾青素研究进展[J].食品工业科技,2000,21(2):79-81.
[6]Johnsone A. Astaxanthin from microbial sources[J]. Critical Reviews in Biotechnology,1991,11(4):297-326.
[7]Ho L P,Tam C Y,Zhou B. Growth and carotenoid production of Phaffia rhodozyma in fed-batch culture swith different feeding methods[J]. Biotechnology Letters,1999,21:175-178.
[8]Okagbue R N,Lewis M J. Autolysis of the red yeast Phaffia rhodozyma:a potential tool to facilitate extraction of astaxanthin[J]. Biotechnology Letters,1984(6):247-250.
[9]Okagbue R N,Lewis M J. Mixed culture of Bacillus circulans WL-12 and Phaffia rhodozyma on different carbon sources:Yeast-wall lytic enzyme production and extractability of astaxanthin[J].Biotechnology Letters,1983,5:731-736.
[10]周锦珂,李金华,葛发欢,等. 酶法提取雨生红球藻中虾青素的新工艺研究[J]. 中药材,2008,31(9):1423-1425.
[11]陈喜军. 一种酶法提取雨生红球藻中虾青素的新工艺. 中国:CN104529851A[P]. 2015-4-22.
[12]Wu W,Lu M,Yu L. A New Environmentally Friendly Method for Astaxanthin Extraction from Xanthophyllomyces Dendrorhous[J]. European Food Research and Technology,2011,232(3):463-467.
[13]Ni H,Chen Q,He G,et al. Optimization of Acidic Extraction of Astaxanthinfrom Phaffia Rhodozyma[J]. Journal of Zhejiang University Science B,2008,9(1):51-59.
[14]姬聪颖. 法夫酵母JMU-MVP14类胡萝卜素的分析、制备与微胶囊化研究[D]. 厦门:集美大学,2013.
[15]武一琛,杨慧茹,方园,等. 天然虾青素提取及分离纯化研究进展[J]. 食品研究与开发,2014,35(12):117-119.
[16]倪辉,何国庆,杨远帆,等. 法夫酵母虾青素提取工艺的优化研究[J]. 农业工程学报,2004,20(2):204-208.
[17]Sedmak J J,Weerasinghe D K,JOLLY S O. Extraction and quantitation of astaxanthin from Phaffia rhodozyma[J]. Biotechnol Tech,1990,4:107-112.
[18]张琇,李娜,曹晓虹,等. 红酵母虾青素提取工艺的优化[J]. 食品科技,2011,36(1):196-199.
[19]张影霞,武利刚,罗志辉,等. 虾青素的提取及其稳定性的研究[J]. 现代食品科技,2008,24(12):1288-1291.
[20]Smondyrev A M,Berkowitz M L. Molecular dynamics simulation of DPPC bilayer in DMSO[J]. Biophysical journal,1999,76(5):2472-2478.
[21]倪辉,何国庆,吴光斌,等. 酸法破壁条件对法夫酵母虾青素效果的影响[J]. 农业工程学报,2005,21(3):176-180.
Effects of disrupting conditions on extracting astaxanthin fromPhaffiarhodozymaby DMSO method
HUANG Ying1,WANG Kai1,DONG Cong-cong1,NI Hui1,2,3,4,YANG Yuan-fan1,2,3,4, HUANG Gao-ling1,2,3,4,CAI Hui-nong1,2,3,4,DU Xi-ping1,2,3,4,*
(1.College of Food and Bioengineering,Jimei University,Xiamen 361021,China; 2.Fujian Provincial Key Laboratory of Food Microbiology and Enzyme Engineering,Xiamen 361021,China; 3.Research Center of Food Biotechnology of Xiamen City,Xiamen 361021,China; 4.Key Laboratory of Systemic Utilization and Indepth Processing of Economic Seaweed, Xiamen Southern Ocean Technology Center of China,Xiamen 361021,China)
In order to evaluate the possibility of extracting astaxanthin fromPhaffiarhodozymadisrupted cell wall by DMSO method,influences of several factors such as type of solvent,dosage of DMSO,temperature,the ratio of solid to liquid,extraction time and extracting times on recovery of astaxanthin fromPhaffiarhodozymawere studied and conditions for disrupting the yeast cell wall were optimized. Results showed that acetone was the optimal solvent for extracting astaxanthin. The effect significance of extraction temperature,the ratio of solid to liquid and extraction time were gradually decreased on recovery of astaxanthin. The optimal conditions obtained from single factor and orthogonal experiment were as follows:acetone as the extracting solvent,1∶1.5 dosage of DMSO,2 times of extraction,45 ℃ of extraction temperature,1∶20 of the ratio of solid to liquid and 40 min of extraction time. Under the optimal conditions,the astaxanthin recovery fromPhaffiarhodozymawas 4.42 mg/g.
Phaffiarhodozyma;astaxanthin;DMSO;orthogonal experiment;extraction
2017-02-21
黄莹(1992-),女,硕士研究生,主要从事天然化合物分离纯化及生物活性研究,E-mail:1970838353@qq.com。
*通讯作者:杜希萍(1978-),女,博士,副教授,主要从事天然产物化学研究,E-mail:xipingdu@jmu.edu.cn。
国家自然科学基金项目(31501448);福建省教育厅项目(JA15266);厦门市海洋渔业局(南方海洋中心)项目(14CZP035HJ09)。
TS254.1
B
1002-0306(2017)15-0212-06
10.13386/j.issn1002-0306.2017.15.040
