超滤纳滤联用优化八角茴香中莽草酸的富集工艺
2017-09-03李存玉李红阳顾佳美彭国平
李存玉,马 赟,李红阳,顾佳美,彭国平,*
(1.南京中医药大学药学院,江苏南京 210023;2.江苏省中药资源产业化过程协同创新中心,江苏南京 210023)

李存玉1,2,马 赟1,李红阳1,顾佳美1,彭国平1,2,*
(1.南京中医药大学药学院,江苏南京 210023;2.江苏省中药资源产业化过程协同创新中心,江苏南京 210023)
研究超滤-纳滤联用技术富集八角茴香中的莽草酸,通过响应面法优化工艺条件。在通过超滤预处理及单因素实验的基础上,采用响应面实验设计优化莽草酸的纳滤富集工艺,建立了该工艺的二次多项数学模型,考察截留分子量、浓度、pH三个因素及其交互作用对莽草酸截留率的影响。实验表明通过超滤预处理可去除96.88%八角茴香水提液中的总蛋白,曲面回归方程拟合性良好,其中截留分子量与浓度的交互作用极显著(p<0.000 1),在截留分子量100 Da,pH6.20,莽草酸浓度10.40 μg/mL的条件下,验证优化工艺得到莽草酸截留率为96.08%±2.02%,与预测值95.00%相近。
八角茴香,莽草酸,响应面法,纳滤,超滤
八角茴香(IlliciumverumHook. f.)为木兰科八角茴香的干燥成熟果实,是我国南方药食同源的经济树种,具有治疗寒疝腹痛、肾虚腰痛、胃寒呕吐等功效[1]。莽草酸作为其中代表性成分[2],目前被国际卫生组织推荐的惟一一个合成的抗H5N1亚型高致病性禽流感的特效药物“达菲”的关键成分[3-5]。莽草酸又称3,4,5-三羟基-1-环己烯-1-甲酸,因结构中存在不饱和双键及醇羟基而具有抗氧化作用[6-7],在提取精制过程中因加热容易氧化分解,导致得率下降,在资源产生浪费的同时,也难于进行大规模生产。
在莽草酸的精制分离工艺中,采用离子交换树脂、硅胶层析等分离技术可以实现莽草酸的富集[8-9],提升提取物中莽草酸纯度,但是也伴随酸碱及有机溶剂污染、且生产成本较高。膜分离技术具有无热效应、无污染等技术优势,在食品、制药行业中应用日趋广泛,超滤可以去除大分子杂质而对小分子目标成分影响较小,纳滤技术可以实现无热效应高效富集浓缩[10-11]。由于八角茴香提取液为多成分复杂溶液体系,采用纳滤处理易出现污染导致通量下降,基于此本文探索超滤-纳滤联用技术优化八角茴香中莽草酸的富集参数。本文旨在单因素考察的基础上,以莽草酸为指标,超滤去除水难溶性成分及大分子改善溶液的可滤性,进而开展八角茴香综合莽草酸的富集工艺研究,为含有热敏性成分的中药浓缩提供数据基础。
1 材料与方法
1.1 材料与仪器
八角茴香 安徽亳州,经南京中医药大学陈建伟教授鉴定为木兰科八角茴香的干燥成熟果实;莽草酸对照品(批号201505,质量分数≥98%) 南京泽朗医药科技有限公司;聚酰胺复合纳滤膜(截留相对分子质量100、450、800 Da) 南京拓鉒医药科技有限公司;聚醚砜超滤膜(截留相对分子质量100、50 KDa) 南京拓鉒医药科技有限公司;乙腈为色谱纯,水为纯化水,其他试剂均为分析纯。
TNZ-1纳滤分离设备 南京拓鉒医药科技有限公司;Agilent 1100高效液相色谱仪、VWD检测器 美国安捷伦公司;FL-3203型蠕动泵 四川新达集团有限公司;AL204万分之一电子天平 梅特勒-托利多(上海)仪器有限公司;KH-250B型超声波清洗器 昆山禾创超声仪器有限公司。
1.2 实验方法
1.2.1 供试品制备 八角茴香水提液:称取八角茴香适量,根据文献报道[12],采用常规水浸提,温度80 ℃,固液比1∶15 g/mL,提取时间100 min,浸提液冷却后减压过滤,记录过滤后的浸提液体积,并采用高效液相色谱法检测滤液中莽草酸的含量。
莽草酸对照品溶液:精密称取莽草酸对照品0.02804 g,置于10 mL容量瓶中,加甲醇稀释至刻度,摇匀,即得莽草酸对照品溶液(2.804 mg/mL)。
1.2.2 八角茴香中莽草酸的测定 色谱条件[14-15]:色谱柱为Hedera ODS-2色谱柱(4.6 mm×250 mm,5 μm),流动相为体积分数甲醇-1%磷酸水溶液(10∶90),检测波长214 nm,流速0.8 mL/min,柱温30 ℃,进样量20 μL。
标准曲线:精密吸取莽草酸对照品溶液 0.05、0.10、0.20、0.50、1.00、2.00 mL 分别置于20 mL的量瓶中,甲醇定容至刻度,Agilent 1100高效液相色谱仪检测,以峰面积为纵坐标(Y),对照品溶液浓度为横坐标(X),得线性回归方程:Y=16.51X-72.50,R2=0.998 7。莽草酸在7.01~280.4 μg/mL范围内,线性关系良好。
1.2.3 八角茴香水提液的超滤预处理 为提高纳滤分离效率、减轻膜组件污染,采用超滤去除八角茴香水提液中的蛋白等大分子物质。取八角茴香水提液,分别采用截留分子量100、50 kDa超滤膜过滤,以莽草酸和总蛋白含量的动态变化为指标,筛选超滤参数。
1.2.4 单因素实验
1.2.4.1 纳滤循环体积与膜吸附的相关性考察 在纳滤浓缩过程中,溶液中的溶质与纳滤膜之间存在吸附行为,影响溶质的分离行为,因此需要考察循环体积对膜吸附的影响。取莽草酸提取液,采用纯化水稀释至莽草酸浓度为0.2 mg/mL,置于纳滤系统中进行循环平衡,溶液温度20 ℃,操作压力1.0 MPa,纳滤膜截留分子量450 Da,以溶液中莽草酸峰面积的变化,分析药液平衡体积(1、2、4、6、8、16、32 L)与膜吸附的相关性。
1.2.4.2 溶液温度对莽草酸截留率的影响 研究溶液温度变量对莽草酸截留率的影响,莽草酸浓度为0.2 mg/mL、压力1.0 MPa、纳滤膜截留分子量450 Da、药液平衡体积32 L的条件下考察温度对莽草酸截留率影响规律。由于纳滤膜操作温度需低于50 ℃,考察溶液温度分别为5、10、20、30、40、50 ℃。
1.2.4.3 操作压力对莽草酸截留率的影响 研究操作压力变量对莽草酸截留率的影响,莽草酸浓度为0.2 mg/mL、溶液温度20 ℃、纳滤膜截留分子量450 Da、药液平衡体积32 L的条件下,根据纳滤操作的可行性,考察操作压力0.2、0.5、1.0、1.5、2.0 MPa对莽草酸截留率的影响规律。
1.2.4.4 浓度对莽草酸截留率的影响 八角茴香水提液中莽草酸的质量浓度为2.01 mg/mL,根据纳滤分离过程中的溶解-扩散原理中溶质浓度与纳滤分离的相关性[16-17],采用纯化水稀释至502.50、201.00、100.50、50.25、10.05、2.01 μg/mL,在溶液温度20 ℃、纳滤膜截留分子量450 Da、药液平衡体积32 L的条件下,考察莽草酸浓度变化对其截留率的影响。
1.2.4.5 pH对莽草酸稳定性的影响 结合纳滤膜材质的酸碱适用范围(pH3~10),取八角茴香水提液调节pH至3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0,检测莽草酸峰面积变化,考察pH对莽草酸稳定性的影响。
1.2.5 总蛋白检测 按BCA蛋白质浓度测定试剂盒测定待测样品中蛋白质量浓度[18]。
1.2.6 透过率和截留率计算 分别精密吸取纳滤(或超滤)分离过程中产生的平衡液、纳滤(或超滤)液,按上述相关项下的检测条件,计算待测组分的质量浓度,按式(1)计算透过率,按式(2)计算截留率。
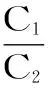
式(1)
式(2)
式(1),式(2)中,T为透过率;R为截留率;C1为纳滤(超滤)液中待测组分质量浓度;C2为平衡液中待测组分质量浓度。
1.2.7 Box-Behnken实验设计 在明确溶液循环体积、溶液温度、操作压力、莽草酸浓度、pH等因素影响的基础上,利用Design-Expert 8.05软件,选择纳滤膜截留分子量、溶液pH、莽草酸浓度作为变量,以-1、0、1代表变量水平,进行Box-Behnken设计三因素三水平实验方案,见表1。
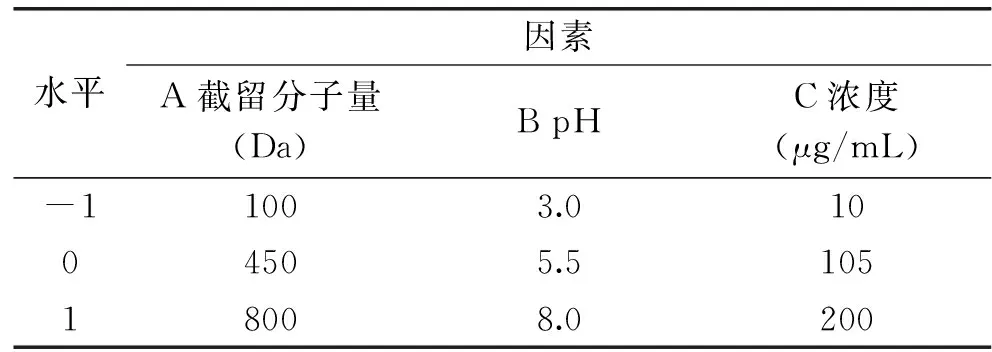
表1 纳滤浓缩因素与水平Table 1 Factors and levels used in Box-Behnken experimental design
2 结果与分析
2.1 八角茴香水提液超滤预处理
分析表2数据发现,莽草酸分子量为171.15 Da,在100、50 KDa的超滤膜中的透过率均高于99%,几乎无损失,同时50 kDa的超滤膜的蛋白的去除率高达96%以上,但随着超滤膜截留分子量的增大,其透过率逐步升高,去除效果下降。为保障后续纳滤分离效率,在去除水提液中大分子物质的保证莽草酸有效保留,选择截留分子量为50 kDa的超滤膜进行预处理。
会议认为,《条例》以习近平新时代中国特色社会主义思想为指导,既发扬我们党长期积累的党支部建设宝贵传统,又体现党的十八大以来基层创造的好做法好经验,规定明确、符合实际。制定和实施《条例》,是推动全面从严治党向基层延伸的重要举措,为新时代党支部建设提供了基本遵循,对加强党的组织体系建设,全面提升党支部组织力、强化党支部政治功能,巩固党长期执政的组织基础,意义十分重要。
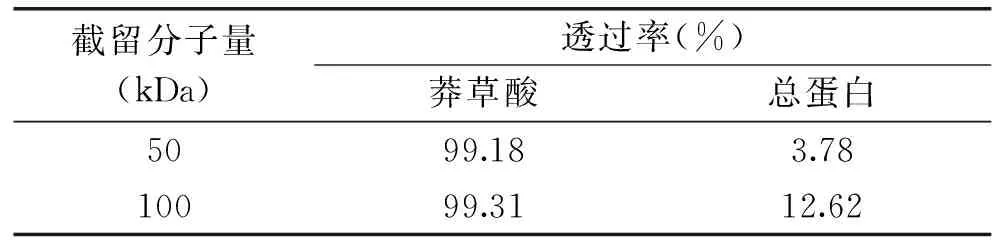
表2 不同截留分子量超滤膜对莽草酸和蛋白的分离效果Table 2 Difference membrane MWCOs on transmission of shikimic acid and protein
2.2 单因素实验结果
2.2.1 溶液循环体积对膜吸附的影响 从图1可以看出,在莽草酸溶液纳滤循环过程中,溶液中莽草酸的峰面积出现下降后有逐步升高的现象,根据Langmuir吸附定律[19],是由于在纳滤循环的初始阶段,莽草酸与纳滤膜组件接触并逐步的吸附于纳滤膜上,随着循环体积的增加,溶液中莽草酸峰面积呈现上升趋势,这主要是因为纳滤膜对莽草酸吸附逐步趋于饱和,且一部分莽草酸重新溶解于溶液中。当平衡体积达到并高于16 L时,溶液中莽草酸的峰面积呈现出平稳状态,提示此时“吸附-解吸附”达到平衡状态,在循环体积达到16 L之上时,此时莽草酸的纳滤分离行为趋于稳定。
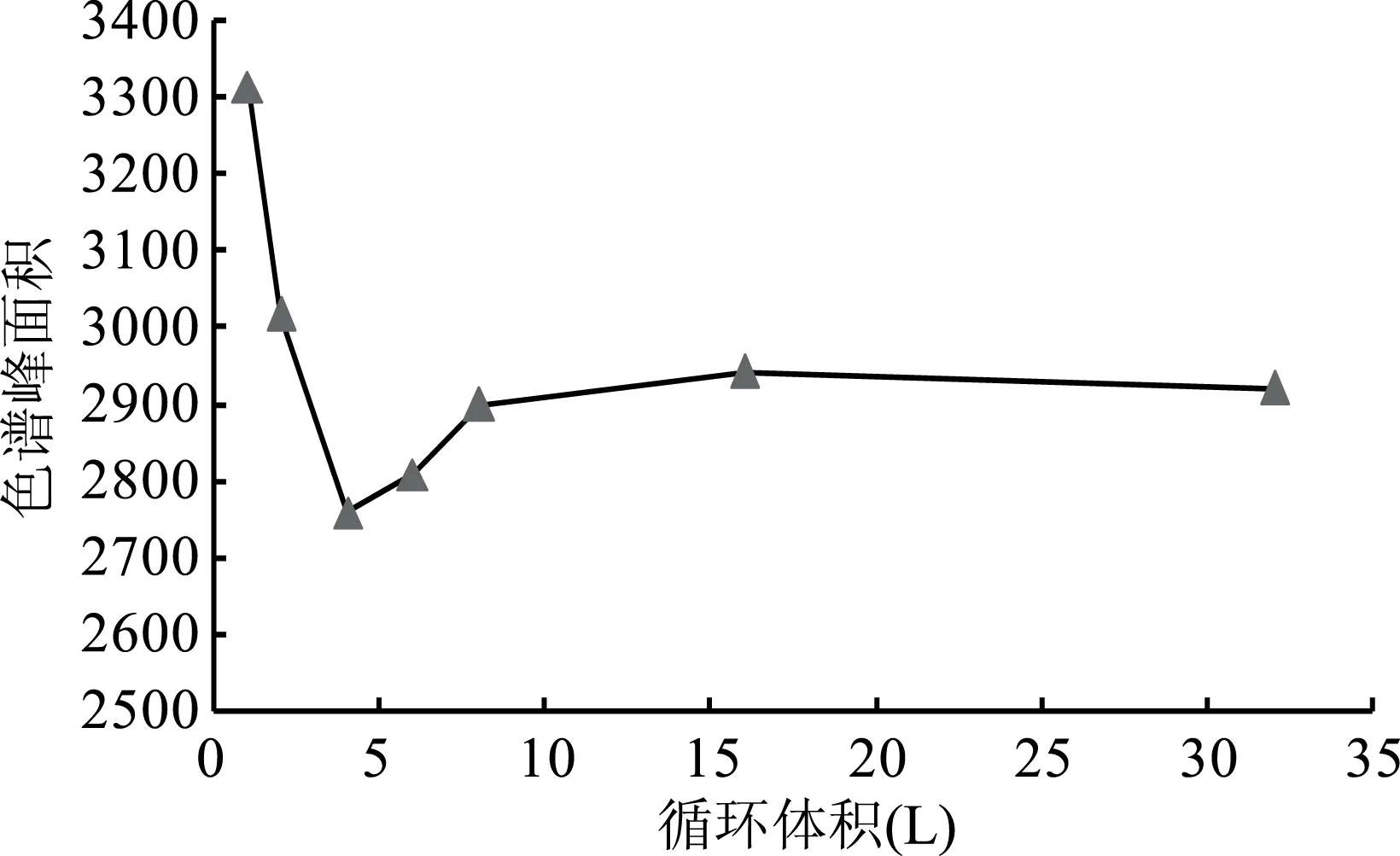
图1 循环体积对药液中莽草酸的影响Fig.1 Effect of circulating volume on the concentration of shikimic acid
2.2.2 溶液温度对莽草酸截留率的影响 从图2可以看出,在固定截留分子量纳滤膜条件下,随着操作温度的升高,莽草酸截留率均呈下降趋势。主要是随着温度升高莽草酸在纳滤膜表面的扩散系数增加,促进莽草酸透过纳滤膜,从而使得截留率下降。同时,在实验操作过程中,提高操作温度可以提升膜通量从而提高分离效率,但是结合常温操作易实现,且温度对截留率影响并不明显,故选择常温20~30 ℃范围内为纳滤操作温度。
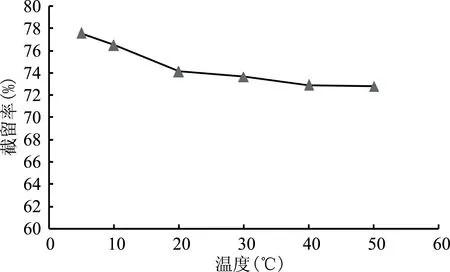
图2 温度对莽草酸截留率的影响Fig.2 Effect of temperature on the retention rate of shikimic acid
2.2.3 操作压力对莽草酸截留率的影响 从图3可以看出,随着纳滤操作压力的升高,莽草酸截留率也随之缓慢上升。操作压力从0.2 MPa提高至2.0 MPa时,莽草酸截留率从70.14%升高至76.05%。升高纳滤操作压力可以有效增加膜通量提升浓缩效率,同时也会造成溶液中大量莽草酸聚集在膜表面,由此产生的浓差极化加剧纳滤膜组件污染的影响,结合莽草酸截留率、纳滤分离效率及膜污染情况,选择1.0 MPa为纳滤操作压力。
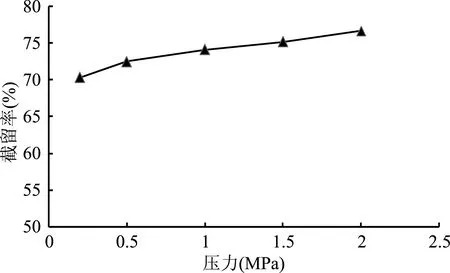
图3 压力对莽草酸截留率的影响Fig.3 Effect of pressure on the retention rate of shikimic acid
2.2.4 莽草酸浓度对莽草酸截留率的影响 从图4可以看出,八角茴香水提液中莽草酸的浓度与其截留率呈现一定的负相关,这与纳滤分离理论中的溶解-扩散原理相符合,其中在10.05~201.0 μg/mL浓度范围内截留率波动明显,随着提取液浓度的升高,其相应的纳滤通量也逐步下降,考虑到纳滤浓缩效率、实验操作的便捷性及其截留率与浓度的相关性,因此在下一步对10.0~200.0 μg/mL范围内进行优化考察。
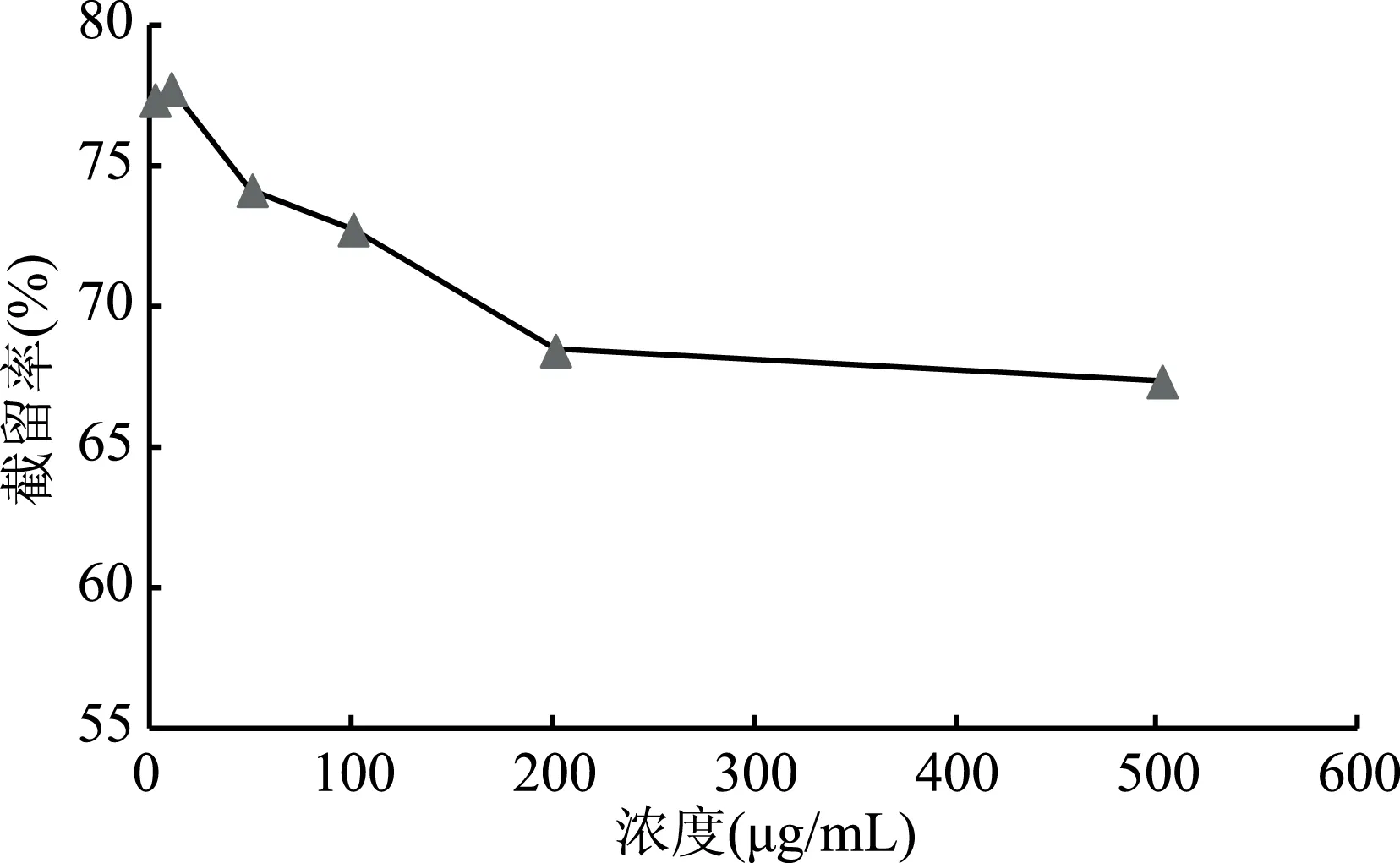
图4 浓度对莽草酸截留率的影响Fig.4 Effect of concentration on the retention rate of shikimic acid
2.2.5 pH对莽草酸稳定性的影响 通过检测pH至3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0的八角茴香水提液中莽草酸的峰面积发现,pH为8时莽草酸峰面积有所下降,随着pH上升到10,莽草酸峰面积降低约30%,因此在下一步对pH至3.0~8.0范围内进行优化考察。
2.3 响应曲面法结果
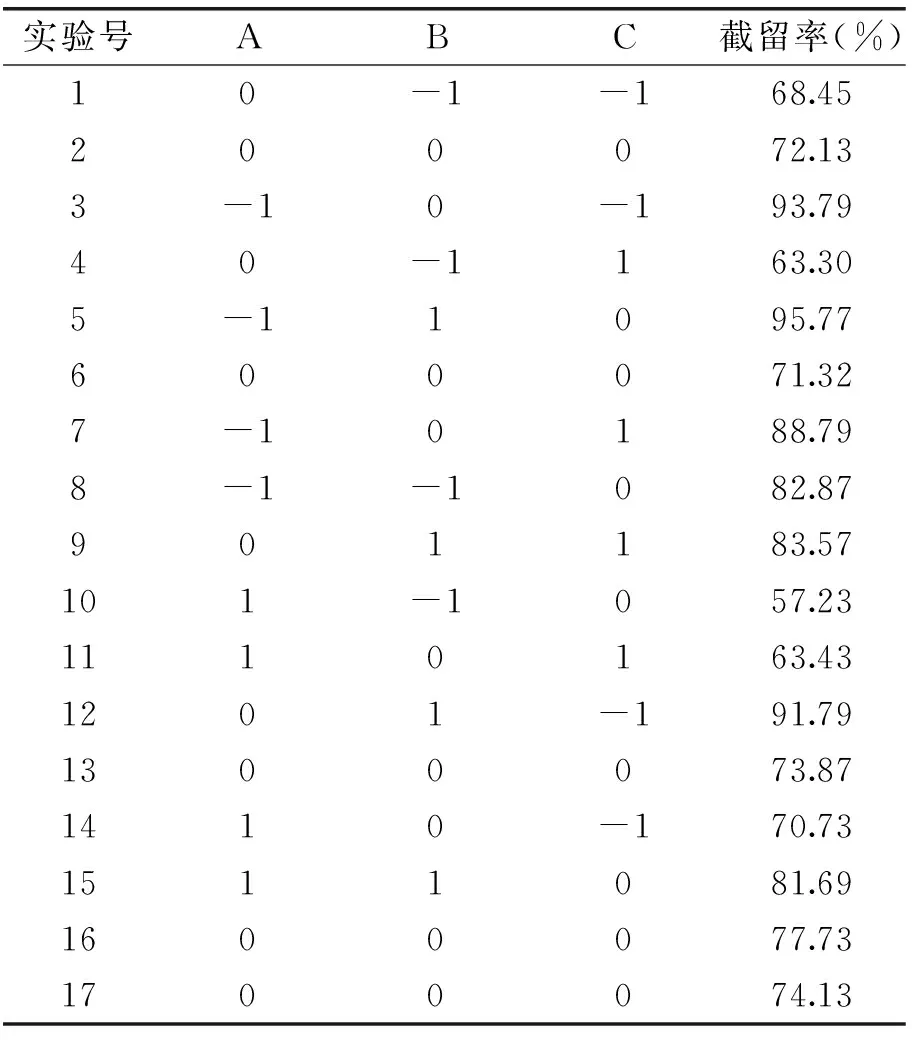
表3 莽草酸纳滤分离的响应曲面设计与结果Table 3 Response surface design and results of shikimic acid by nanofiltration
2.3.2 模型的建立及其显著性检验 利用Design-Expert 8.05软件对实验结果进行回归拟合,得到莽草酸截留率对以上3个因素的二次多项回归模型:
莽草酸截留率(%)=73.84-11.02A+10.12B-3.21C+2.89AB-0.58AC-0.77BC+3.98A2+1.57B2+1.37C2。
对该模型进行方差分析,结果见表4。回归F值为39.95,多元相关系数R2=0.9809,预测R2=0.8677,调整R2=0.9563,说明模型对实验实际情况拟合较好,实验误差小。莽草酸纳滤浓缩模型的p<0.0001,表明回归模型极显著,可用来进行响应值的预测,实验设计方案正确。
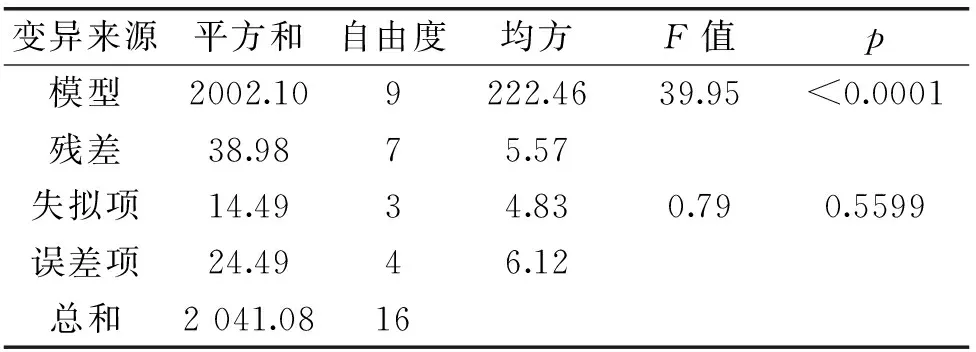
表4 回归模型的方差分析结果Table 4 Analysis of variance to the response surface quadratic model
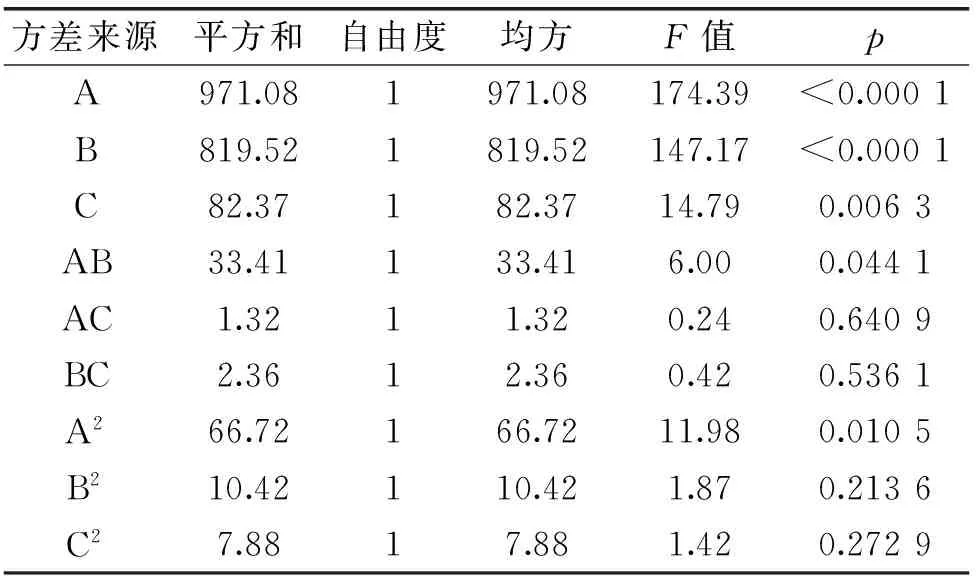
表5 莽草酸浓缩回归模型系数的显著性检验结果Table 5 Results of significance test for regression coefficients in concentrate of shikimic acid
由表5回归模型系数显著性检验结果可知,莽草酸浓缩模型的一次项(A、B)表现出极显著(p<0.0001),浓缩模型的一次项(C)、二次项(A2)及交互项(AB)均表现出显著性(p<0.01)或较显著性(p<0.05)。表明各影响因素对于八角茴香中莽草酸截留率的影响并不是简单的线性关系。
2.3.3 响应曲面分析 多元回归方程式所做的响应曲面图,见图5~图7。由此可对任何两因素交互影响莽草酸截留率进行分析与评价,以确定最佳因素水平范围。
当莽草酸溶液浓度为105 μg/mL时,由图5可知,莽草酸的截留率随着纳滤膜截留分子量减小,截留率呈升高趋势,符合膜分离的分子筛分理论。此外,随着溶液pH的逐步增加,莽草酸截留率也逐步升高,是由于莽草酸从游离态逐步向离子态转变,根据纳滤膜分离的Donnan效应[20-21],从而引起莽草酸截留率升高。等高线的形状可以反映出交互效应的强弱。从图5下方等高线可以看出,截留分子量与pH对莽草酸截留率的影响作用相似。
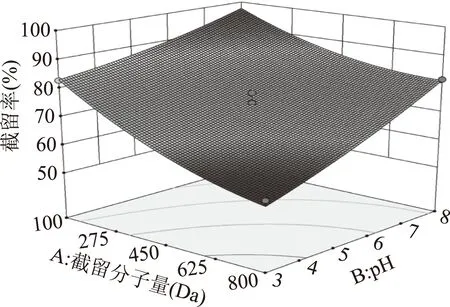
图5 截留分子量和pH对截留率交互影响的三维曲面图Fig.5 Interactions between MWCO and pH on retention rate
图6显示在pH5.5条件下,截留分子量和浓度对莽草酸截留率的交互影响。在截留分子量不变的条件下,随着浓度逐渐增加,截留率出现下降的趋势,根据纳滤分离理论中的溶解-扩散模型可知[22],溶质浓度升高相应的扩散系数也随之升高,有助于溶质分子通过纳滤膜,从而降低溶质的截留率。
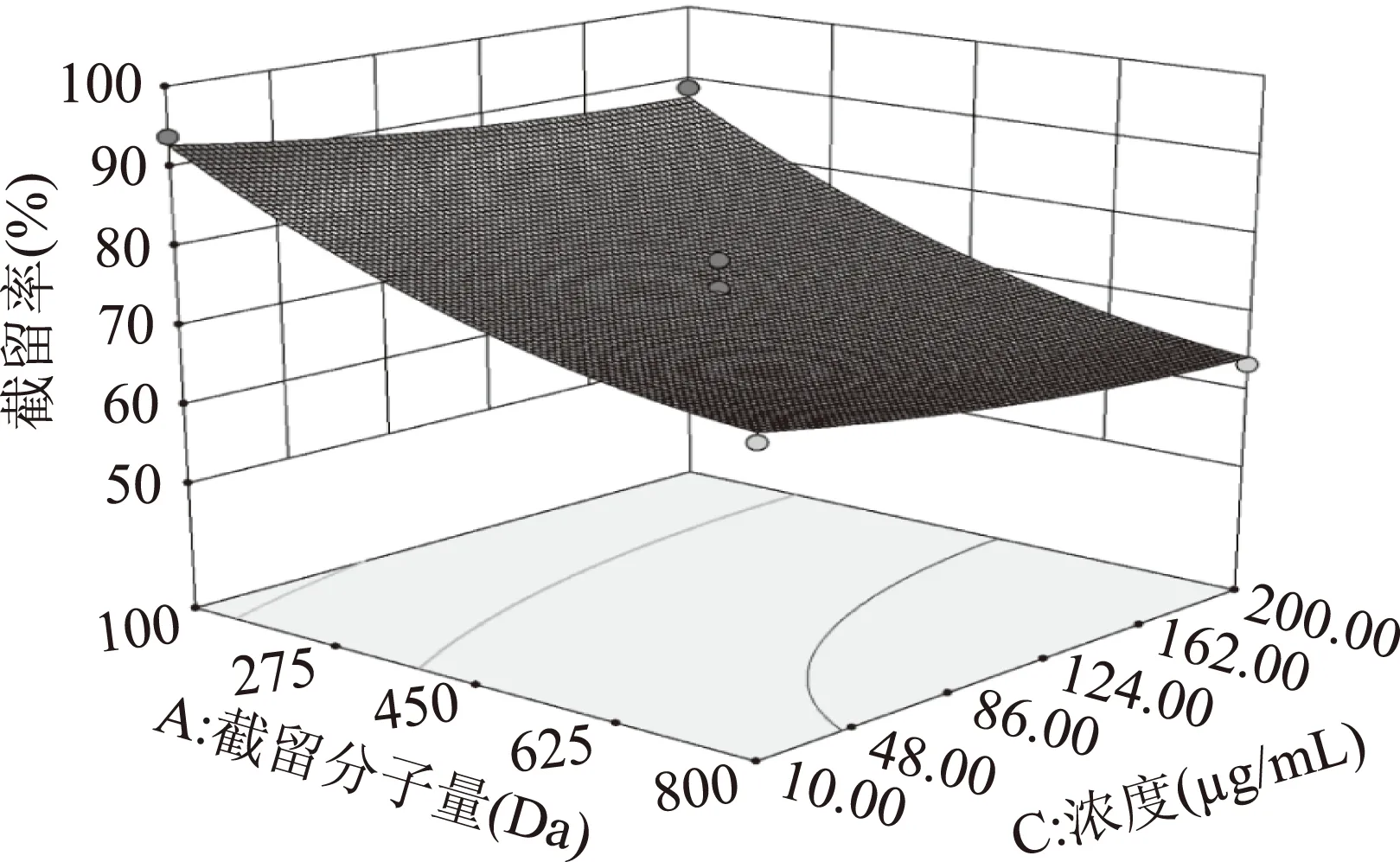
图6 截留分子量和浓度对截留率交互影响的三维曲面图Fig.6 Interactions between MWCO and concentration on retention rate
图7显示在截留分子量450 Da条件下,浓度和pH对莽草酸截留率的交互影响。浓度不变,随着pH逐渐增加,截留率明显上升的趋势,溶液中的莽草酸的存在状态中,解离成莽草酸盐的比例也随之升高,根据纳滤分离理论中的道南效应,莽草酸截留率升高。保持pH不变,随着浓度增加,截留率下降趋势不明显。从图7下方等高线可以看出,截留分子量与浓度无明显交互作用。
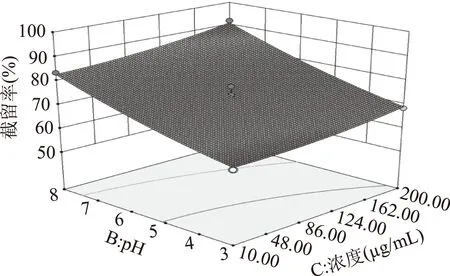
图7 浓度和pH对截留率交互影响的三维曲面图Fig.7 Interactions between concentration and pH on retention rate
比较上面的3组图可知,截留分子量和pH对莽草酸截留率的影响较为显著,表现为曲线较陡,溶液浓度影响作用不明显,表现为曲线相对较平缓,且随其数值的增加或减少,响应值的变化较小。在所考察的实验范围内,3个因素对莽草酸截留率影响的排序为A>B>C。
根据软件Design-Expert对八角茴香中莽草酸浓缩模型的优化计算,以提高截留率和分离效率为目的,得到莽草酸的最佳浓缩工艺为:截留分子量105.41 Da,pH6.23,莽草酸浓度10.42 μg/mL,在此条件下莽草酸的截留率预测值为95.00%。为检验响应面方法所得结果的可靠性,采用上述优化浓缩条件,考虑到实际操作的便利,将浓缩工艺参数修正为:截留分子量100 Da,pH6.20,莽草酸浓度10.40 μg/mL,在此条件下平行操作3次,得莽草酸截留率分别为95.97%、98.15%和94.11%,平均值为96.08%,与预测值较接近,相对误差为2.02%。因此,基于响应面所得的优化纳滤浓缩工艺参数准确可靠,具有实用价值。
3 结论
本研究在单因素实验的基础上,通过响应面法优化了八角茴香中莽草酸的纳滤浓缩富集工艺,建立了该工艺的二次多项式数学模型。该模型极显著,拟合良好,得到各因素对莽草酸截留率的影响次序为膜截留分子量>pH>浓度,其中膜截留分子量和pH对八角茴香中莽草酸截留率影响显著。综合回归模型分析和验证实验,最终确定了莽草酸纳滤富集最优参数为:截留分子量100 Da,pH6.20,莽草酸浓度10.40 μg/mL,在此条件下莽草酸的截留率为96.08%±2.02%,具有一定的实际意义。膜分离技术具有分离参数易控、分离行为重现性好、参数可线性放大等技术优势,可以有效避免树脂吸附等柱层析分离技术的化学污染问题。本文选择八角茴香中莽草酸的富集为切入点,结合超滤、纳滤的分离特点,优化了莽草酸富集工艺,为含有热敏性成分的食品原料生产提供了新思路。
[1]熊燕子,龚正礼.八角茴香的研究进展[J].中国调味品,2008,33(9):28-30.
[2]袁经权,周小雷,王硕,等.八角茴香化学成分的研究[J].中成药,2010,32(12):2123-2126.
[3]Kim H K,Park K J J. A new efficient synthesis of oseltamivir phosphate(Tamiflu)from(-)-shikimic acid [J]. Tetrahedron Letters,2012,53(13):1561-1563.
[4]王硕,司建志,龚小妹,等.八角茴香总黄酮抗氧化活性研究[J].食品工业科技,2015,36(23):75-78.
[5]Santanu Bhadra,Pulok K. Mukherjee,N. Satheesh Kumar,et al. Anticholinesterase activity of standardized extract of Illicium verum Hook. f. fruits [J]. Fitoterapia,2011,82(3):342-346.
[6]Soher E. Aly,Bassem A. Sabry,Mohamed S. Shaheen,et al. Assessment of antimycotoxigenic and antioxidant activity of star anise(Illicium verum)invitro[J]. Journal of the Saudi Society of Agricultural Sciences,2016,15(1):20-27.
[7]王强,沈华明,罗杰辉,等.八角茴香中莽草酸提取工艺及抗氧化性研究[J].广州化工,2014(20):70-75.
[8]刘东彦,石晓峰,李冲,等.雪松松针中莽草酸的分离及其纯度检查[J].中国现代应用药学,2011,28(7):637-640.
[9]杨磊,刘玉,张琳,等.离子交换树脂对白扦中莽草酸的分离纯化[J].化工进展,2009,28(1):145-149.
[10]普文英,张卫东.纳滤-新型的分离小分子有机物的膜技术[J].中国药房,2000,11(5):234-236.
[11]李存玉,钱祥,杨泽秋,等.基于纳滤技术的消癌平注射液中的钾离子去除工艺优化[J].中成药,2015,37(2):294-297.
[12]何新华,刘玲,刘兴国,等.八角茴香中莽草酸提取和纯化工艺的研究[J].天然产物研究与开发,2008,20(5):914-917.
[14]林海禄,彭雪娇,罗明标,等.微波辅助提取八角茴香中莽草酸的工艺研究[J].食品工业科技,2007,28(3):137-138.
[15]黄芳芳,苏小建.利用吸附法从八角中提取分离莽草酸的研究[J].时珍国医国药,2010,21(8):1977-1980.
[16]Yaroshchuk A,Bruening M L,Bernal E E L. Solution-Diffusion-Electro-Migration model and its uses for analysis of nanofiltration,pressure-retarded osmosis and forward osmosis in multi-ionic solutions [J]. Journal of Membrane Science,2013,447:463-467.
[17]Yan F,Chen H,Lü Y. Improving the water permeability and antifouling property of thin-film composite polyamide nanofiltration membrane by modifying the active layer with triethanolamine [J]. Journal of Membrane Science,2016,513:108-116.
[18]曹玉华. BCA法测神奇灵颗粒剂中蛋白含量[J]. 中国实用医药,2009,4(7):43-44.
[19]Wu F C,Tseng R L. Liquid-solid phase countercurrent multi-stage adsorption process for using the Langmuir equation [J]. Journal of Hazardous Materials,2008,155(3):449-458.
[20]赵彦彦,袁其朋.有机相纳滤分离过程中浓度、电荷、溶剂对溶质截留行为的影响[J].膜科学与技术,2006,26(5):31-35.
[21]Wu C,Liu S,Wang Z,et al. Nanofiltration membranes with dually charged composite layer exhibiting super-high multivalent-salt rejection [J]. Journal of Membrane Science,2016,517:64-72.
[22]Pérez L,Escudero I,Arcos-Martínez M J,et al. Application of the solution-diffusion-film model for the transfer of electrolytes and uncharged compounds in a nanofiltration membrane[J]. Journal of Industrial & Engineering Chemistry,2016,47:368-374.
Optimization concentrate process of shikimic acid fromIlliciumverumHook. F. by ultrafiltration-nanofiltration coupling technology
LI Cun-yu1,2,MA Yun1,LI Hong-yang1,GU Jia-mei1,PENG Guo-ping1,2,*
(1.College of Pharmacy,Nanjing University of Chinese Medicine,Nanjing 210023,China; 2.Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization,Nanjing 210023,China)
The concentrate process of shikimic acid fromIlliciumverumHook. f. were investigated by using ultrafiltration-nanofiltration coupling technology. Based on the single factor experimental analysis and pretreated with ultrafiltration,through the response surface methodology,concentrate condition was optimized by investigating the effect of molecular weight cut-off,concentration,pH and their interaction on the rejection of shikimic acid and the process of quadric polynomial mathematics model was established. The results showed that the rejection of the total protein was 96.88% with 50 kDa ulrafiltration membrane,the regression equation fit well with experimental data and the interaction effect of molecular weight cut-off and concentration was highly significant(p<0.000 1). The optimal concentrate conditions were as follows:molecular weight cut-off 100 Da,pH6.20,concentration 10.40 μg/mL. Under these conditions,the rejection of shikimic acid fromIlliciumverumHook. f. was(96.08±2.02)% closing to predicted rejection 95.00%.
IlliciumverumHook. f.;shikimic acid;response surface analysis;nanofiltration;ultrafiltration
2017-01-16
李存玉(1985-),男,博士,讲师,研究方向:膜分离技术的产业应用,E-mail:licunyuok@163.com。
*通讯作者:彭国平(1963-),男,博士,教授,研究方向:中药成分分离精制及制剂开发,E-mail:guopingpeng@126.com。
国家自然科学基金(81373980,81503258);江苏省自然科学基金青年基金(BK20151005);江苏省中医药局科技项目(YB2015009)。
TS202.1
B
1002-0306(2017)15-0185-06
10.13386/j.issn1002-0306.2017.15.035
