木瓜蛋白酶水解对豆乳中抗原蛋白含量和亚基构成的影响
2017-09-03赵巧丽廖振林胡会刚
赵巧丽,王 丽,廖振林,胡会刚,郑 斌,方 祥,*
(1.华南农业大学食品学院,广东广州 510642; 2.中国热带农业科学院南亚热带作物研究所/农业部热带果树生物学重点实验室,广东湛江 524091)
木瓜蛋白酶水解对豆乳中抗原蛋白含量和亚基构成的影响
赵巧丽1,2,王 丽1,廖振林1,胡会刚2,郑 斌2,方 祥1,*
(1.华南农业大学食品学院,广东广州 510642; 2.中国热带农业科学院南亚热带作物研究所/农业部热带果树生物学重点实验室,广东湛江 524091)
采用木瓜蛋白酶水解传统生浆工艺制备的豆乳,用双抗体夹心酶联免疫吸附法(ELISA)测定酶解残余物中抗原蛋白含量,用SDS-PAGE分析其蛋白分子亚基组成,并通过正交实验优化了木瓜蛋白酶的水解条件。结果表明,当保持豆乳自然pH(6.5~6.8)、酶浓度3500 U/mL、水解温度53 ℃、水解时间15 min时,β-伴球蛋白的α′、α亚基被完全水解,大豆球蛋白的酸性多肽链基本消失,碱性多肽链含量明显减少,同时产生了大量14 kDa以下组分,此时β-伴球蛋白残留率为56.6%。
豆乳,抗原蛋白,木瓜蛋白酶,水解,蛋白质亚基,抗原性
大豆蛋白质含量丰富,氨基酸组成合理,此外还含有多种矿物质和维生素,深受我国和其他亚洲国家人们的喜爱[1]。但大豆原料中含有多种抗营养因子(Antinutritional factors,ANFs),目前被广泛研究的主要有胰蛋白酶抑制剂(trypsin inhibitor,TI)、大豆凝集素(soybean lectin,SBA)、大豆抗原蛋白(soybean antigen protein,SPA)、脲酶(urease)、大豆低聚糖(soybean oligosaccharides)和植酸(phytic acid)等。这些抗营养因子不仅干扰营养物质的消化、吸收和利用[2],而且还会导致腹泻、皮肤发红等过敏反应,危害食用者的身体健康。因此,大豆的食品安全问题在国内外均受到广泛关注[3]。研究表明,7S和11S球蛋白是大豆中的主要蛋白质,其中大豆球蛋白和β-伴球蛋白具有很强的免疫原性,是引起机体过敏和腹泻的主要成分[4]。大豆球蛋白分子量为300~380 kDa,每个单体亚基由1条酸性多肽链A(34.8 kDa)和一条碱性多肽链B(19.6 kDa)通过二硫键连接,6个亚基的酸性多肽链和碱性多肽链相互交联形成稳定的六聚体结构。β-伴球蛋白是分子量为140~180 kDa的糖蛋白,由α′(77 kDa)、α(68 kDa)和β(57 kDa)3种亚基按一定方式组合成三聚体结构[5-6],研究表明,β-伴球蛋白的致敏性强于大豆球蛋白,它的3个亚基都是潜在的致敏原,其中α′、α亚基的抗原性最强[7]。
豆乳是将大豆泡水后磨制、过滤、煮沸而成的一种饮品,其营养丰富,是良好的牛乳替代源。由于豆乳中含有抗原蛋白,易引起过敏反应,因此,降低豆乳中的抗原活性是近年来营养学研究的热点。抗原蛋白较耐热,一般的加热方法很难钝化其活性,过度加热将会导致这些蛋白质变性或影响蛋白质的消化利用率[8],而酶解法[10-11]和微生物发酵法[12-14]则可降解大豆蛋白分子,破坏抗原蛋白的结构和抗原决定簇[9]。目前关于大豆蛋白酶解的报道较多,但主要以改善大豆蛋白的溶解性、生物效价和功能特性为目的,较少涉及豆乳酶解过程中大豆蛋白分子亚基组成和抗原性的变化。基于此,本研究以传统生浆工艺制备乳为原料,利用热处理钝化热敏性抗营养因子的活性,然后选用木瓜蛋白酶为酶制剂,通过SDS-PAGE和双抗体夹心酶联免疫法(ELISA)分析豆乳水解过程中大豆蛋白分子亚基组成、含量及抗原性的变化,旨在为制备低抗原性豆乳制品提供理论参考。
1 材料与方法
1.1 材料与仪器
华夏3号大豆 华南农业大学农学院提供;木瓜蛋白酶(17.2万U/g) 广州穂泽生物科技有限公司;β-伴大豆球蛋白、大豆凝集素酶联免疫分析试剂盒(ELISA) 上海羽朵生物科技有限公司;低分子量标准蛋白、苯甲酰-L-精氨酸-对硝基苯胺盐酸盐(BAPNA)、胰蛋白酶 美国sigma公司;磺基水杨酸、酪蛋白、三氯乙酸等试剂 均为分析纯 北京普博欣生物科技有限公司。
P-700打浆机 厦门惠健电子科技有限公司;UV-1100紫外-分光光度计 广州深化生物技术有限公司;HWS24电热恒温水浴锅 上海一恒科学仪器有限公司;SPH-21102C恒温培养振荡器 上海智城分析仪器制造有限公司;TGL-16G低温高速冷冻离心机 北京佳源兴业科技有限公司;DYY-7C型电泳仪 北京六一仪器厂;Mulitskan MK3酶标仪 上海始恒仪器设备有限公司;Vortex-Genie 2涡旋振荡器 美国Scientific Industries公司。
1.2 实验方法
1.2.1 传统生浆工艺乳的制备 取50 g大豆,室温浸泡10 h(豆水比1∶3),沥去水分,85 ℃热烫10 min,以1∶6豆水比打浆,纱布过滤分离到浆液,煮沸6~10 min,冷却,4 ℃冷藏备用。
1.2.2 抗营养因子活性分析 按照1.2.1的方法制备豆乳,待豆乳煮沸后保温0、2、4、6、8、10、15、20 min,分别测定胰蛋白酶抑制剂、脲酶、大豆凝聚素和β-伴球蛋白含量并计算残留率,同时测定不同保温时间下的蛋白质溶解度,衡量豆乳营养价值的高低。
残留率(%)=[煮浆前含量-煮浆后含量]/煮浆前含量×100
式(1)
1.2.3 木瓜蛋白酶水解大豆蛋白单因素实验 取100 mL豆乳,加入适量木瓜蛋白酶进行水解反应,结束后沸水浴10 min灭酶,分别探讨酶解时间、酶浓度、pH和酶解温度对β-伴球蛋白含量及大豆蛋白分子亚基组成的影响。在保持豆乳自然pH、酶解温度53 ℃、酶浓度2000 U/mL的条件下,酶解时间分别为10、20、30、40、50、60、90、120、180 min;在保持豆乳自然pH、酶解温度53 ℃、酶解时间10 min的条件下,酶浓度分别为2000、2500、3000、3500、4000、4500、5000、6000、7000、8000 U/mL;在酶解温度53 ℃、酶浓度3500 U/mL、酶解时间10 min的条件下,调节豆乳pH分别为5.5、6.0、6.5、7.0、7.5、8.0;在保持豆乳自然pH、酶浓度3500 U/mL、酶解时间10 min的条件下,酶解温度分别为45、50、53、55、60、65 ℃。
1.2.4 正交实验设计 在单因素实验的基础上,选择豆乳自然pH,对影响β-伴球蛋白(SPAg)残留率的三个因素酶浓度、酶解温度、酶解时间进行优化,每个因素选3个水平,按照L9(34)正交表进行实验,因素水平见表1。
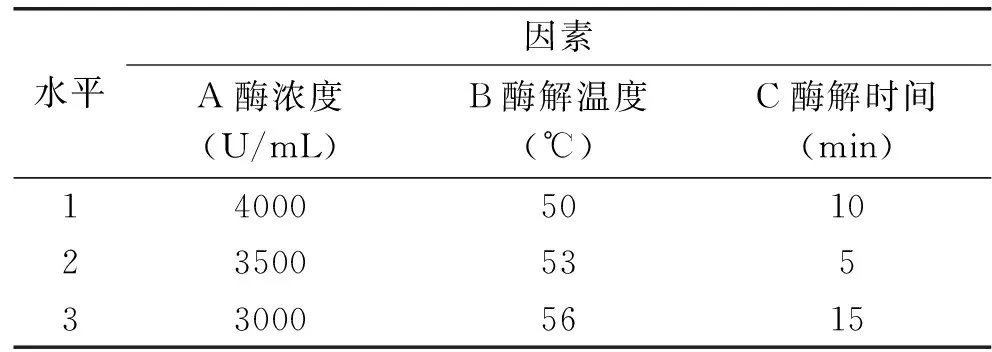
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experimental design
1.2.5 抗营养因子的活性测定
1.2.5.1 胰蛋白酶抑制剂(TI)活性的测定 参照邓慧慧等[1]的方法,改进后操作如下:取1 mL豆乳,加入50 mL Tris-CaCl2缓冲溶液(0.05 mol/L,pH8.2),于30 ℃、150 r/min振荡提取3 h,3000 r/min离心10 min,取上清液,稀释备用。酶反应试管加入1 mL样品稀释液,1 mL Tris-CaCl2缓冲液,5 mL BAPNA溶液,摇匀,37 ℃预热10 min。加入2 mL胰蛋白酶溶液,摇匀,37 ℃反应10 min;加入1 mL 30%乙酸溶液终止反应,于410 nm处比色。空白试管加入2 mL Tris-CaCl2缓冲溶液,5 mL BAPNA溶液,1 mL 30%乙酸溶液,摇匀,37 ℃预热10 min,加入2 mL胰蛋白酶液,摇匀,37 ℃反应10 min,取出冷却至室温。
活性的表示:定义为每10 mL反应体系在波长410 nm处所减少的0.01吸光度值为1个胰蛋白酶抑制剂活性单位(TIU)。
TIU=(样品OD410-空白OD410)/0.01
式(2)
胰蛋白酶抑制剂活性=TIU无抑制-TIU样品
式(3)
1.2.5.2 脲酶(UA)活性的测定 采用GB/T 8622-2006《饲料用大豆制品中尿素酶活性的测定》的方法测定。
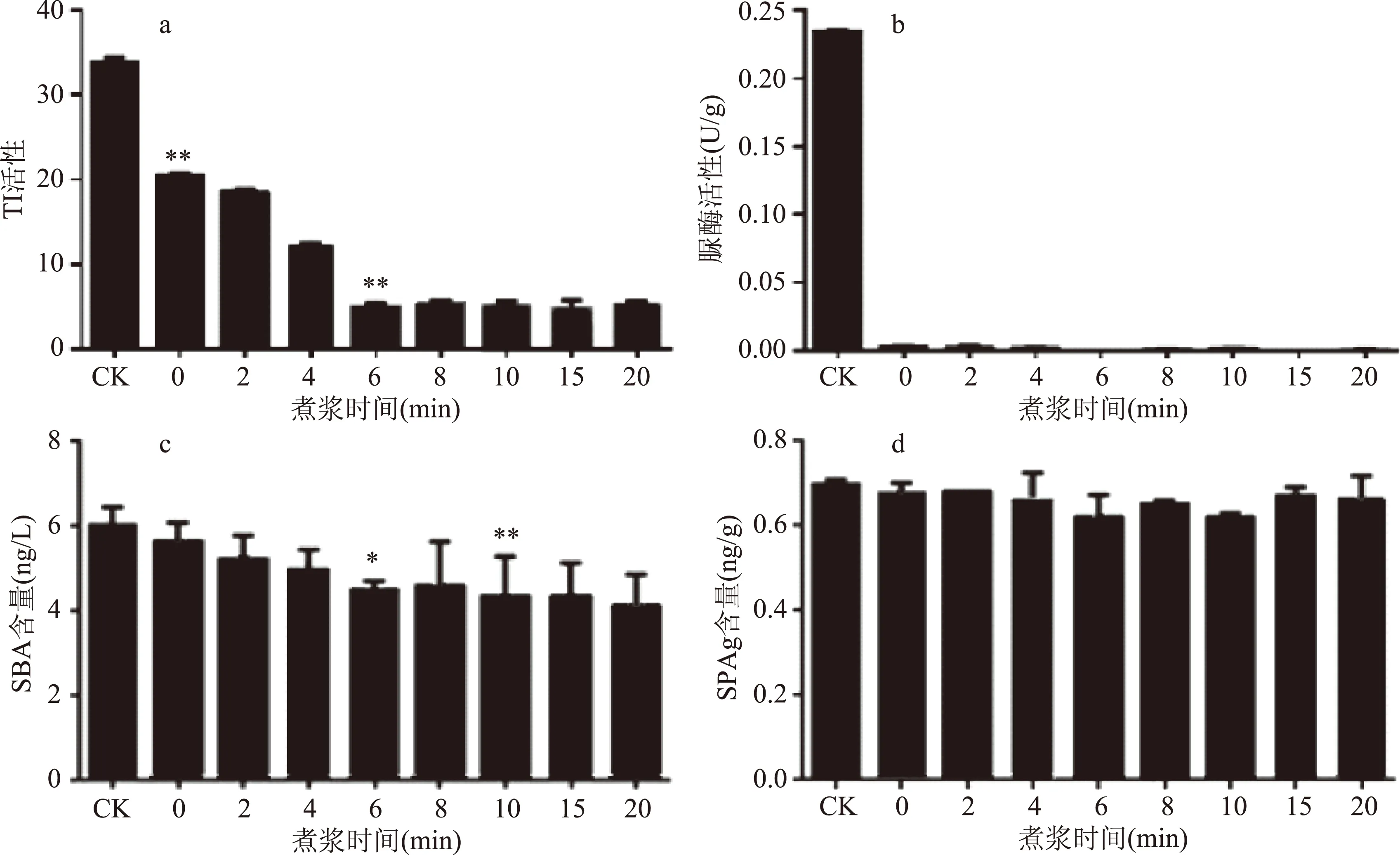
图1 煮浆时间对抗营养因子活性及含量的影响Fig.1 Effect of boiling time on the activity of antinutritional factors注:ck-生豆浆(对照);TI-胰蛋白酶抑制剂;SBA-大豆凝集素;SPAg-β-伴球蛋白;**表示与对照组相比差异极显著(p<0.01);*表示与对照组相比差异显著(p<0.05)。
1.2.5.3 大豆凝集素(SBA)含量的测定 参照徐晓峰等[16]的方法:取1 mL豆乳,加入10 mL 0.85% NaCl溶液,搅匀,于4 ℃冰箱浸泡48 h,每日搅2~3次,使充分溶出。10000 r/min离心20 min(4 ℃),收集上清液。大豆凝集素含量测定按大豆凝集素ELISA试剂盒(96孔)的方法进行。
1.2.5.4β-伴大豆球蛋白(SPAg)含量的测定 参照唐堂等[17]的方法,并稍作修改。取1 mL豆乳,加入20 mL 0.03 mol/L Tris-HCl缓冲液(pH8.0,含0.01 mol/Lβ-巯基乙醇),于28 ℃、150 r/min摇床中浸提1 h,4000 r/min离心20 min,取上清液。β-伴大豆球蛋白含量测定按照β-伴大豆球蛋白ELISA试剂盒(96孔)的方法进行。
1.2.5.5 大豆蛋白SDS-PAGE分析 参照文献[18-19]的方法,在垂直电泳槽中制胶,分离胶浓度12%,浓缩胶浓度5%,采用甘氨酸电极缓冲液。上样量为20 μL,浓缩胶段用80 V恒压,分离胶段采用120 V恒压,直至指示剂溴酚蓝移至离胶板底线0.5 cm为止。采用低分子量标准蛋白为参考,考马斯亮蓝R-250于50 ℃染色30 min,0.5 mol/L NaCl溶液在摇床上脱色过夜,直至出现清晰的电泳条带为止。
1.2.6 蛋白质溶解度的测定 采用GB/T 19541-2004《饲用大豆粕》中蛋白质溶解度的检测方法测定。
1.2.7 数据统计分析 数据处理及作图采用Excel 2010和Graph Pad Prism;方差分析采用SPSS软件处理,取95%置信区间。
2 结果与分析
2.1 抗营养因子的活性分析
2.1.1 热处理对抗营养因子活性及含量的影响 由图1可知,生豆浆煮沸后97%的脲酶已失活,胰蛋白酶抑制剂活性和大豆凝集素含量均呈下降趋势,保温6 min时残留率分别为14.5%和74.4%,此后继续延长保温时间,二者变化均不大。β-伴球蛋白较耐热,保温20 min,残留率仍高达97.1%,此时,7S伴球蛋白的3个亚基(α′、α、β),11S球蛋白的酸性和碱性亚基仍大量存在(图2),故煮浆时间以6 min为宜。
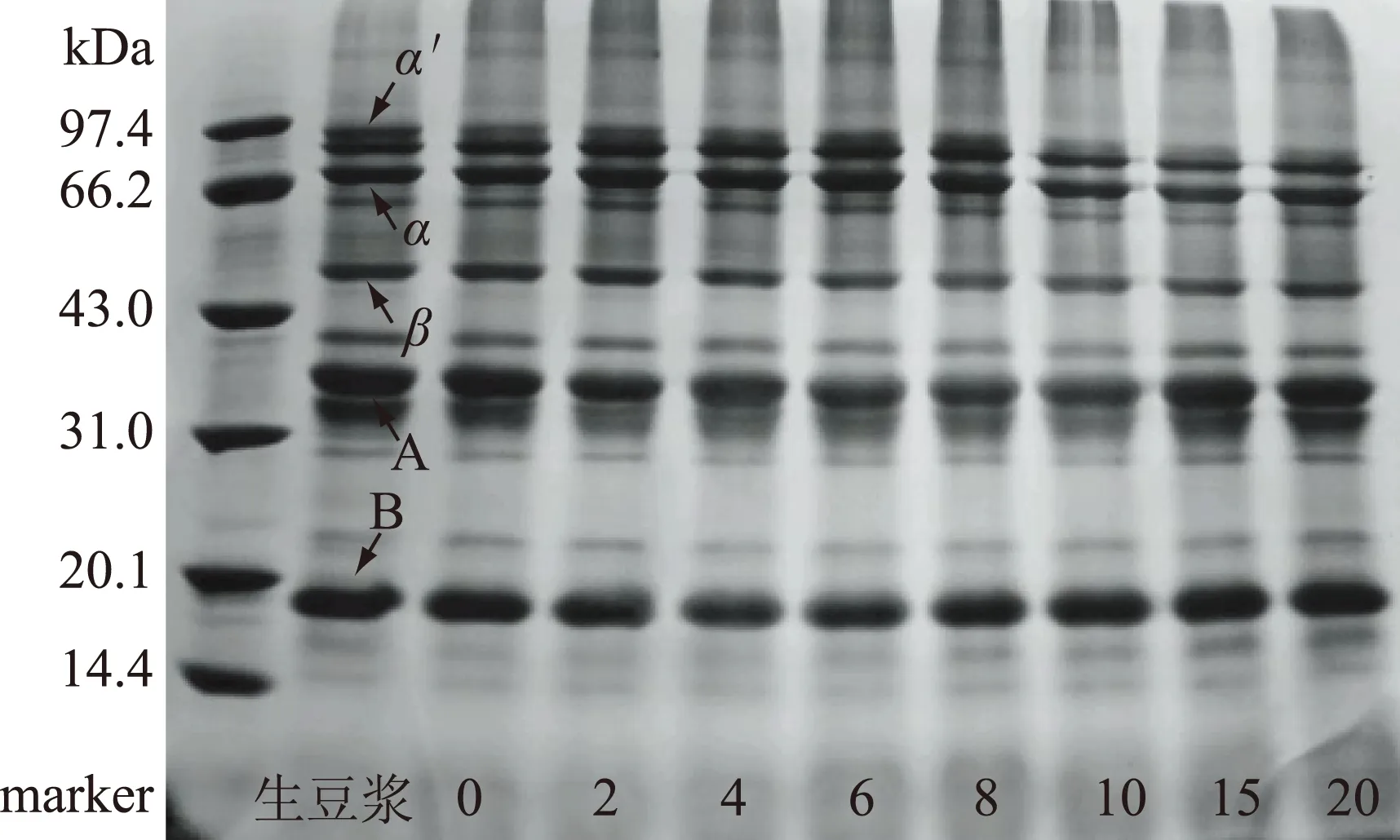
图2 大豆蛋白亚基SDS-PAGE图谱Fig.2 SDS-PAGE analysis of soybean proteins subunits注:生豆浆中电泳带α′、α、β是β-伴大豆球蛋白的三个亚基,电泳带A、B是大豆球蛋白的酸性多肽链和碱性多肽链。
2.1.2 煮浆时间对蛋白质溶解度的影响 蛋白质溶解度是衡量豆乳热处理程度的重要指标,生豆浆的蛋白质溶解度为100%,随着加热时间的延长,蛋白质溶解度逐渐降低,当其介于73%~85%时,说明热处理未过度,豆乳的营养价值较高[8]。由图3可知,蛋白质溶解度随煮浆时间的延长呈缓慢降低趋势,保温2 min,蛋白质溶解度为85.17%,保温20 min,蛋白质溶解度为82.45%,说明豆乳营养价值未被破坏。
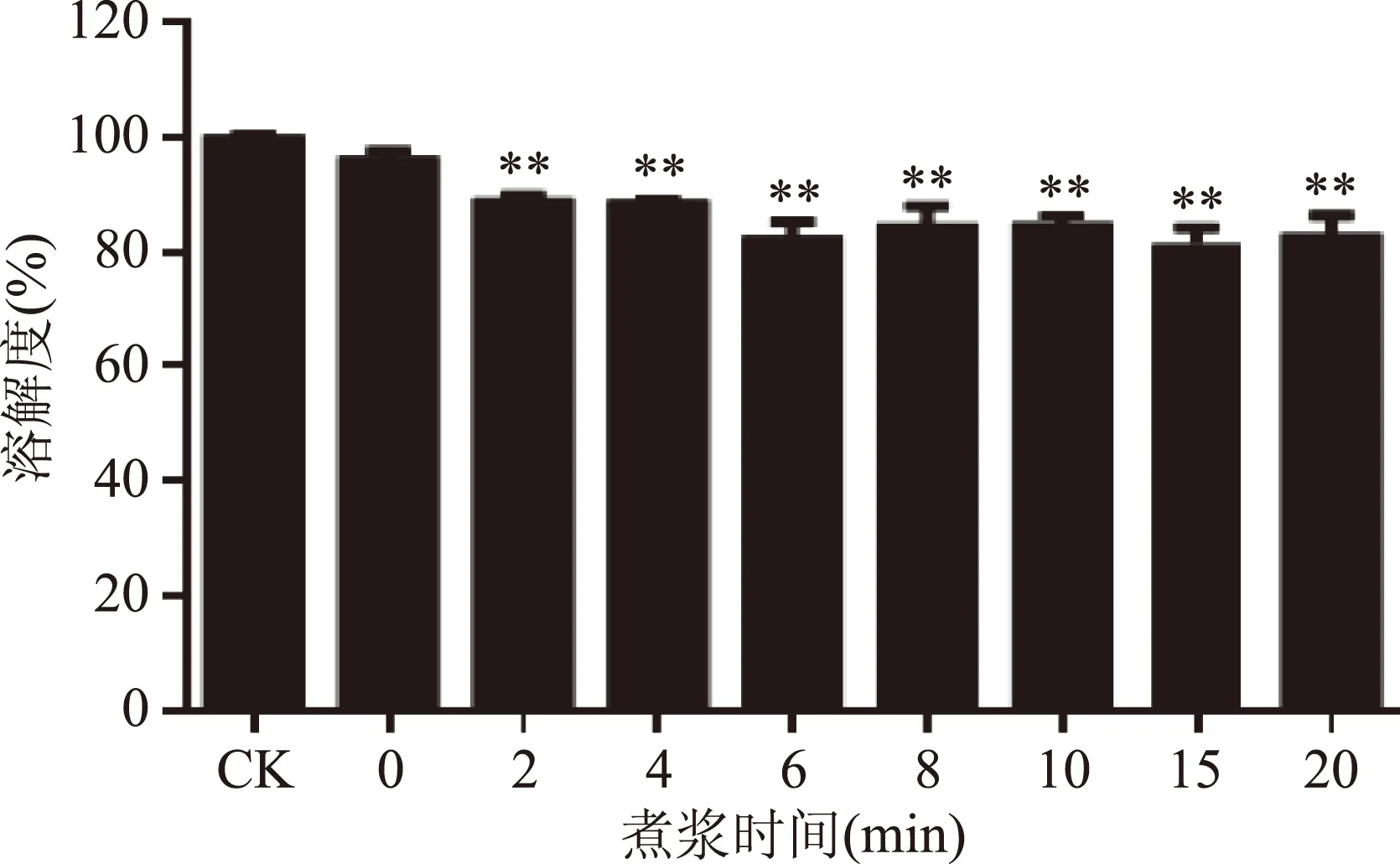
图3 煮浆时间对蛋白质溶解度的影响Fig.3 Effect of boiling time on protein solubility注:ck-生豆浆(对照);**表示与对照组相比差异极显著(p<0.01);*表示与对照组相比差异显著(p<0.05)。图4~图7同。
2.2 木瓜蛋白酶水解过程中β-伴球蛋白含量及大豆蛋白分子亚基组成的变化
2.2.1 酶解时间对β-伴球蛋白含量的影响 由图4可知,木瓜蛋白酶水解10 min时,β-伴球蛋白含量迅速降低,残留率为75.44%;此时,7S伴球蛋白的α′、α亚基条带明显变浅,β亚基基本消失;11S球蛋白的酸性亚基基本消失,碱性亚基含量明显减少,同时产生了大量分子量小于14 kDa的组分。此后继续延长酶解时间,β-伴球蛋白含量降低不明显,大豆蛋白的亚基组成和含量变化也不大。为降低产品生产成本,水解时间以10 min为宜。
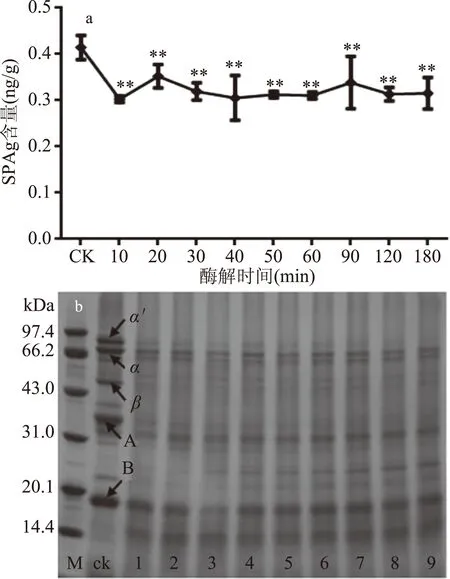
图4 酶解时间对β-伴球蛋白含量的影响及大豆蛋白亚基SDS-PAGE图谱Fig.4 Effect of enzymolysis time on the content of soybean antigen protein注:M:marker;ck:熟豆浆;1:10 min;2:20 min;3:30 min;4:40 min;5:50 min;6:60 min;7:90 min;8:120 min;9:180 min。
2.2.2 酶浓度对β-伴球蛋白含量的影响 由图5可知,β-伴球蛋白含量随着酶浓度的增大逐渐降低,当酶浓度为3500 U/mL时,β-伴球蛋白含量降至最低,残留率为63.14%。此时,7S伴球蛋白的3个亚基(α′、α、β)、11S球蛋白的酸性和碱性亚基已被水解完全。此后继续增大酶浓度对β-伴球蛋白含量降低不明显,故选择3500 U/mL的酶浓度为宜。
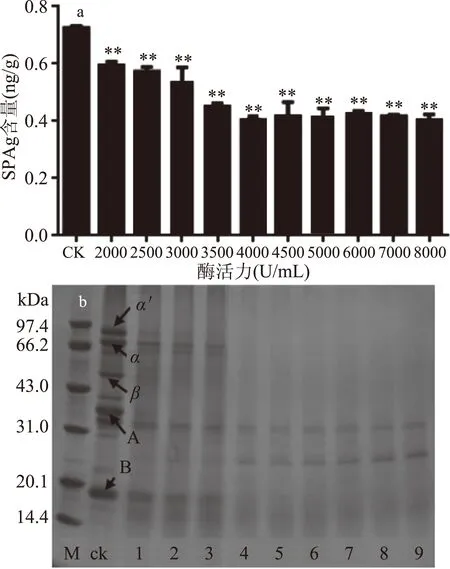
图5 酶浓度对β-伴球蛋白含量的影响及大豆蛋白亚基SDS-PAGE图谱Fig.5 Effect of enzyme concentration on the content of soybean antigen protein注:M:marker;ck:熟豆浆;1:2000 U/mL;2:2500 U/mL;3:3000 U/mL;4:3500 U/mL;5:4000 U/mL;6:4500 U/mL;7:5000 U/mL;8:6000 U/mL;9:7000 U/mL。
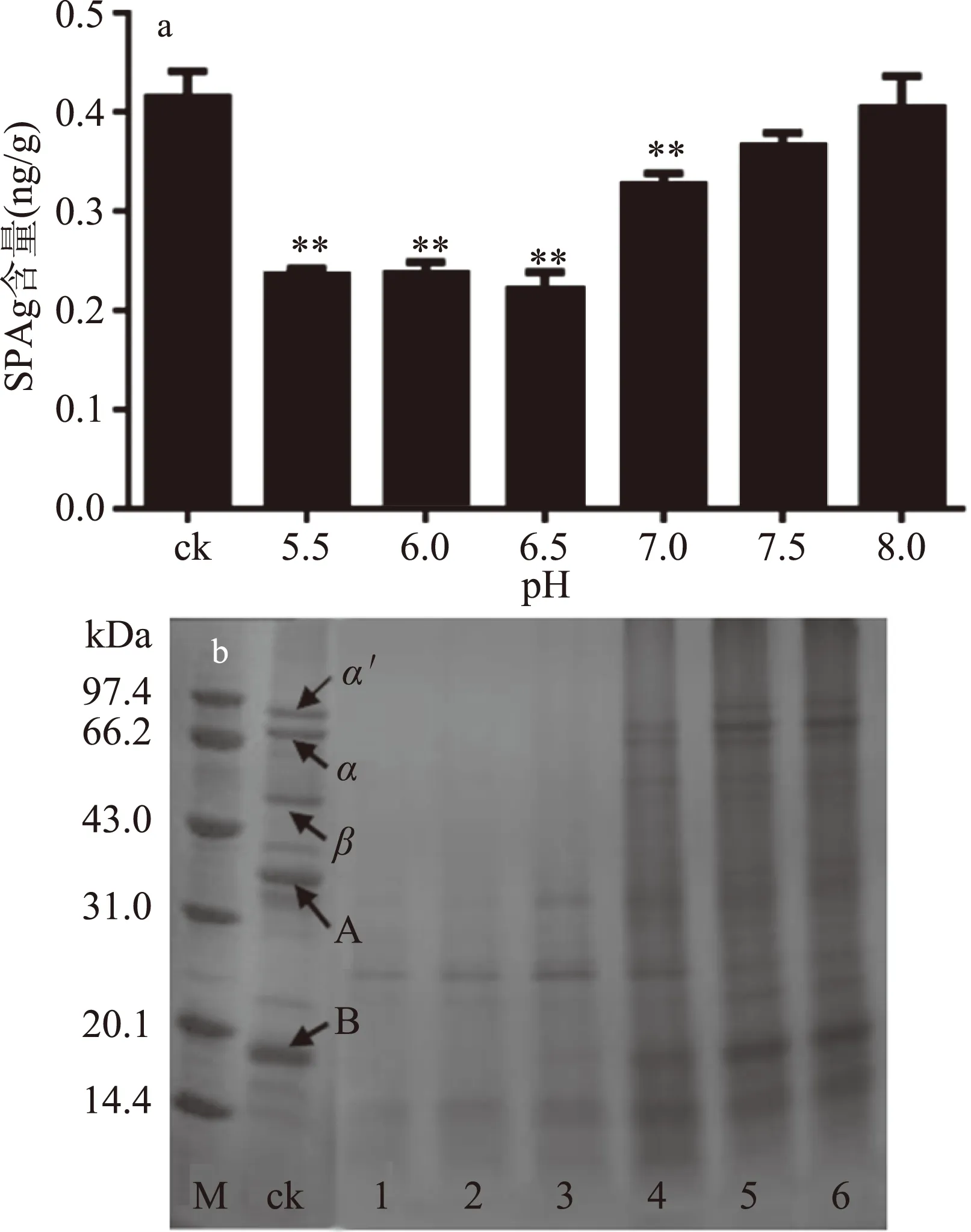
图6 pH对β-伴球蛋白含量的影响及大豆蛋白亚基SDS-PAGE图谱Fig.6 Effect of pH on the content of soybean antigen protein注:M:marker;ck:熟豆浆;1:pH5.5;2:pH6.0;3:pH6.5;4:pH7.0;5:pH7.5;6:pH8.0。
2.2.3 pH对β-伴球蛋白含量的影响 由图6可知,β-伴球蛋白含量随着豆乳pH的增加先降低后升高,当pH为6.5时,β-伴球蛋白含量降至最低,此时,7S伴球蛋白的3个亚基(α′、α、β)、11S球蛋白的酸性和碱性亚基已完全消失。当pH大于7.0后,β-伴球蛋白含量开始回升,此时,7S伴球蛋白的3个亚基、11S球蛋白的酸性和碱性亚基仍然存在。这可能是因为木瓜蛋白酶在碱性环境中不稳定,活性被钝化,在中性或稍偏酸性环境中较稳定。pH过低,豆乳出现酸凝乳现象;pH过高,豆乳呈黄色,碱味较重。为了不影响豆乳制品的风味和可食用性,本研究选取豆乳自然pH开展后续工作。
2.2.4 酶解温度对β-伴球蛋白含量的影响 由图7可知,随着酶解温度的升高,β-伴球蛋白含量呈先降低后升高趋势,当温度为53 ℃时降至最低,此时7S伴球蛋白的α′、α、β亚基和11S球蛋白的酸性亚基完全消失,11S球蛋白的碱性亚基含量明显减少。这可能是因为蛋白酶分子的肽键具有特定的空间结构,酶解反应温度过高时,引起次级键解离,蛋白酶部分丧失或全部丧失催化活性,进而导致酶活性降低,不利于抗原蛋白的降解;反之,温度过低,则会大大降低体系内分子运动的激烈程度,从而降低蛋白酶与底物的碰撞机率[10],不利于蛋白酶对抗原蛋白的水解作用,所以最佳水解温度以53 ℃为宜。
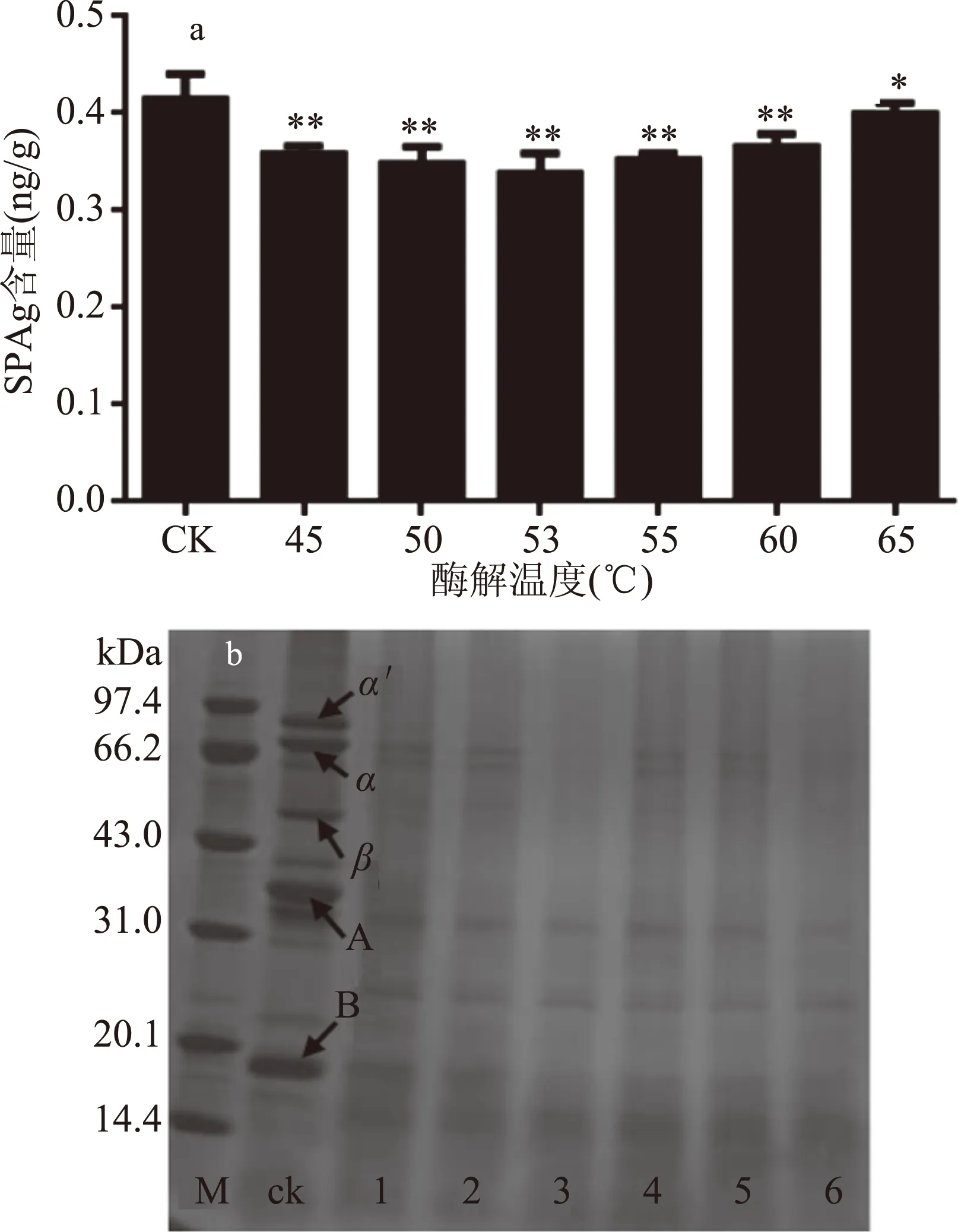
图7 酶解温度对β-伴球蛋白含量的影响及大豆蛋白亚基SDS-PAGE图谱Fig.7 Effect of enzymolysis temperature on the content of soybean antigen protein注:M:marker;ck:熟豆浆;1:45 ℃;2:50 ℃;3:53 ℃;4:55 ℃:5: 60 ℃;6: 65 ℃。
2.2.5 正交优化实验结果 通过正交实验优化木瓜蛋白酶水解豆乳最佳工艺参数,结果见表2。
由表2可知,影响β-伴球蛋白残留率的因素主次顺序依次为:酶浓度(A)>酶解温度(C)>酶解时间(D),最优水解条件为A2C3D3,即酶浓度3500 U/mL、酶解温度56 ℃、酶解时间15 min。对正交实验结果进行方差分析,由表3可知,酶浓度对β-伴球蛋白残留率的影响差异极显著(p<0.01),酶解温度的影响差异显著(p<0.05),酶解时间的影响差异不显著(p>0.05),说明酶浓度对β-伴球蛋白残留率起主要作用,这与直观分析结果一致。综上所述,木瓜蛋白酶的最佳水解条件为酶浓度3500 U/mL、酶解温度56 ℃、酶解时间15 min。为了验证上述最佳水解条件的可靠性,对采用最佳条件水解的豆乳与表2中的最优豆乳(4号)进行比较,测得β-伴球蛋白残留率为56.6%,优于4号实验组中β-伴球蛋白残留率(58.7%),说明最佳水解工艺是可行的。
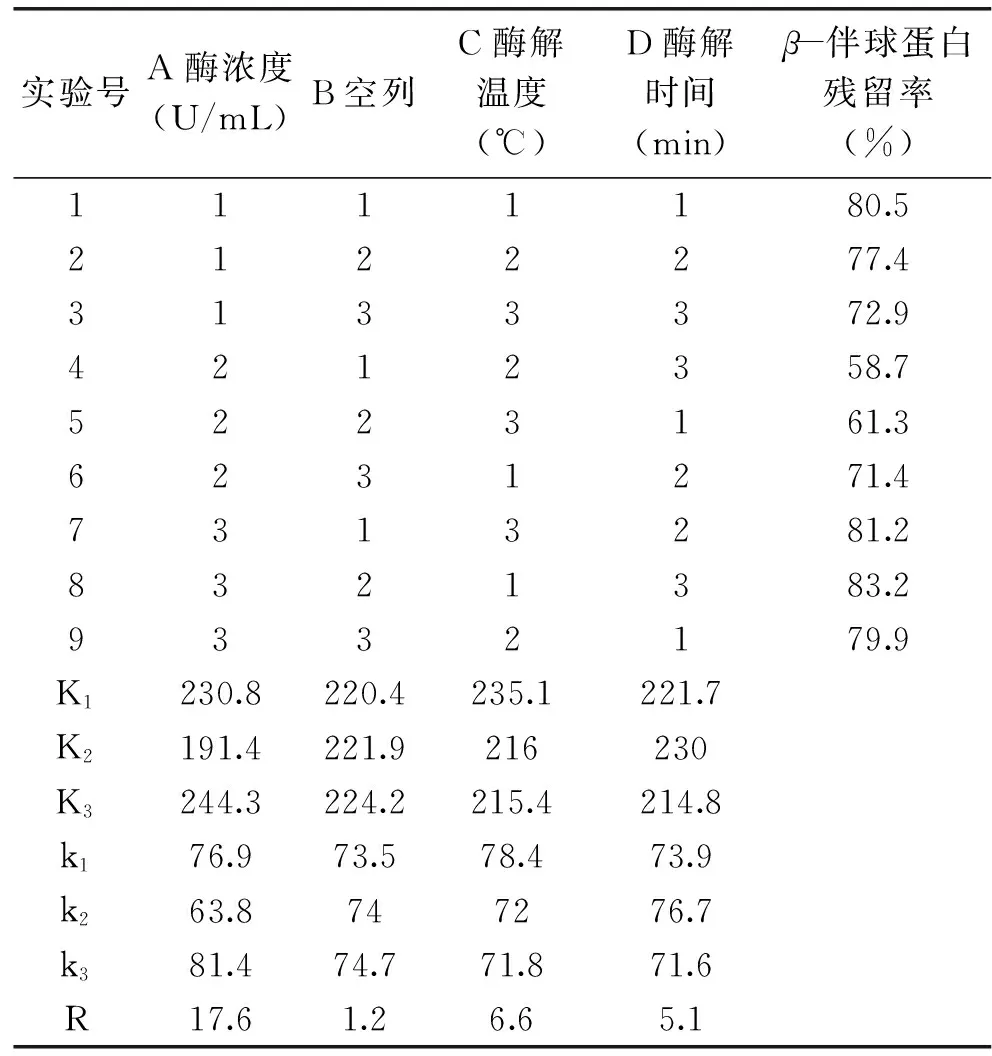
表2 正交实验结果Table 2 Experimental design and corresponding results for orthogonal test
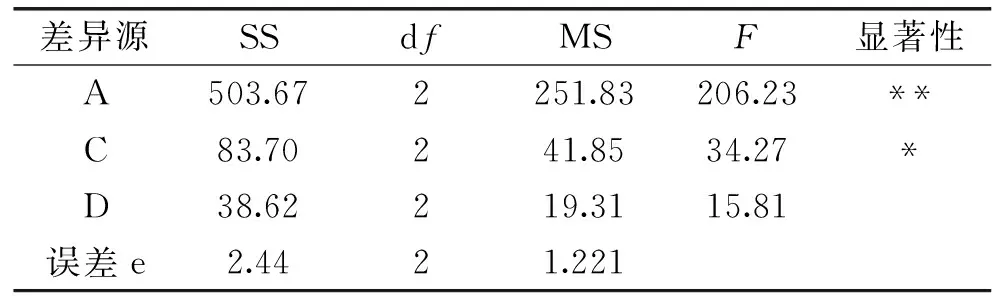
表3 方差分析Table 3 Variance analysis
注:F0.05(2,2)=19.00,F0.01(2,2)=99.00。
3 结论
常规热处理可降低传统生浆工艺制备乳中抗营养因子活性,豆乳煮沸后保温4 min,脲酶活性呈阴性;保温6 min,胰蛋白酶抑制剂、大豆凝集素和β-伴球蛋白含量分别降低85.5%、25.6%和2.9%。采用木瓜蛋白酶水解豆乳,分析酶解后β-伴球蛋白含量和大豆蛋白分子亚基组成,通过正交实验优化木瓜蛋白酶的水解条件,结果发现主要抗原蛋白的亚基已基本消失,当保持豆乳自然pH,酶浓度3500 U/mL、酶解温度56 ℃、酶解时间15 min,β-伴球蛋白残留率为56.6%。
[1]邓慧慧,王世忠,周志江,等. 豆浆中抗营养因子的去除方法[J]. 食品工业科技,2012,33(16):268-272.
[2]佟荟全,张珈榕,胡文元,等. 大豆抗营养因子研究进展[J]. 饲料博览,2015(5):10-13.
[3]王章存,李乐静,袁道强,等. 豆粕酶解过程中蛋白质分子亚基组成及其抗原性变化[J]. 食品科学,2013,34(9):267-270.
[4]张诗尧,赵元,刘丹丹,等. 日粮中大豆抗原蛋白检测方法的研究进展[J]. 大豆科学,2015,34(3):519-523.
[5]Amigobenavent M,Clemente A,Castillo M D D. Digestibility and immunoreactivity of soybeanβ-conglycinin and its deglycosylated form[J]. Food Chemistry,2011,129(4):1598-1605.
[6]Maruyama N,Katsube Tomoyuki,Wada Y,et al. The roles of the N-linked glycans and extension regions of soybeanβ-conglycinin in folding,assembly and structural features[J]. Biochem,1998,258(2):854-862.
[7]Krishnan HB,Kim WS,Jang S,et al. All three subunits of soybeanβ-conglycinin are potential food allergens[J]. Agricul Food Chem,2009,57(3):938-943.
[8]Zhang H,Takenaka M. DSC and electrophoretic studies on soymilk protein denaturation[J]. Journal of Thermal Analysis and Calorimetry,2004,75(3):719-726.
[9]王章存,李乐静,赵学伟,等. 碱性蛋白酶水解对豆粕中大豆抗原蛋白的影响[J]. 中国粮油学报,2013,28(2):6-9.
[10]吴非,霍贵成. 酶法钝化大豆胰蛋白酶抑制剂研究[J]. 粮食与油脂,2002,23(6):9-10.
[11]Lee H W,Keume H,et al. Allergenicity of proteolytic hydrolysates of the soybean 11S globulin [J]. Journal of Food Science,2007,72(3):168-172.
[12]Gao You-ling,Wang Cai-sheng,et al. Optimization of Solid-State Fermentation with Lactobacillus brevis and Aspergillus oryzae for Trypsin Inhibitor Degradation in Soybean Meal[J]. Journal of Integrative Agriculture,2013,12(5):869-876.
[13]唐巧. 酵母菌发酵大豆粉去除豆腥味的研究及其应用[D]. 长沙:湖南农业大学,2014.
[14]王乃富. 乳酸菌发酵酶解豆粉及其生物活性研究[D]. 无锡:江南大学,2007.
[15]GB/T 8622-2006 饲料用大豆制品中尿素酶活性的测定[S].北京:中国标准出版社,2010.
[16]徐晓峰,朱才.大豆凝血素的测定法[J]. 生物技术,1996,6(5):44-46.
[17]唐堂,葛向阳,彭楠.大豆11S与7S抗原蛋白的两种测定方法的研究[J]. 饲料工业,2009,30(8):52-53.
[18]Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227:680-685.
[19]黄卓烈.生物化学实验技术[M].北京:中国农业出版社,2009:178-183.
[20]GB/T 19541-2004饲用大豆粕中蛋白质溶解度的检测[S].北京:中国标准出版社,2004.
Effect of papain hydrolysis on the components of antigen proteins and subunits composition in soybean milk
ZHAO Qiao-li1,2,WANG Li1,LIAO Zhen-li1,HU Hui-gang2,ZHENG Bin2,FANG Xiang1,*
(1.College of Food Science,South China Agricultural University,Guangzhou 510642,China; 2.South Subtropical Crops Research Institute,Chinese Academy of Tropical Agricultural Sciences,Zhanjiang 524091,China)
This study was to investigate the effects of papain hydrolysis on antigenicity and molecular subunit composition of soybean proteins from traditional raw soybean milk. The contents of antigenicity proteins were measured by enzyme-linked immuno sorbent assay(ELISA),the subunits of soybean proteins were researched by SDS-PAGE,and the optimum hydrolysis conditions were studied by the orthogonal test. The results showed that when the soybean milk were hydrolysized at 53 ℃ for 10 min with natural pH(6.5~6.8),while the enzyme concentration was 3500 U/mL,theα′,αsubunits ofβ-conglycinin globulins and the acid subunits of glycinin were hydrolysized completely,the contents of basic subunits were decreased obviously. Under this condition,the residual ratio ofβ-conglycinin globulins reached to 56.6%,while abundant 14 kDa components were generated.
soybean milk;antigen protein;papain;hydrolysis;the protein subunits;antigenicity
2017-02-20
赵巧丽(1990-),女,硕士研究生,研究方向:食品工程,E-mail:zql2819557995@163.com。
*通讯作者:方祥(1971-),男,博士,教授,研究方向:食品生物技术,E-mail:fxiang@scau.edu.cn。
广东省应用型科技研发专项(2015B020230010);广东省农业技术需求研究与示范项目(2016LM3179);国家星火计划(2015GA780080)。
TS214.2
A
1002-0306(2017)15-0117-06
10.13386/j.issn1002-0306.2017.15.023
