双效型酵母细胞壁提取物及其对黄曲霉毒素B1吸附特性研究
2017-09-03钱潘攀李红波赵岩岩莫海珍胡梁斌
钱潘攀,李红波,赵岩岩,周 威,莫海珍,胡梁斌
(河南科技学院食品学院,河南新乡 453003)
双效型酵母细胞壁提取物及其对黄曲霉毒素B1吸附特性研究
钱潘攀,李红波,赵岩岩,周 威,莫海珍,胡梁斌*
(河南科技学院食品学院,河南新乡 453003)
本研究旨在利用麝香草酚裂解酵母细胞,同时以酵母膜脂为载体,与细胞壁共同组成具备抑制黄曲霉孢子萌发和吸附毒素能力的双效型细胞壁提取物。结果表明:通过流式细胞仪及荧光显微镜检测发现麝香草酚可以杀死酵母细胞;当使用500 μg/mL麝香草酚制备其酵母细胞壁提取物,采用苯酚硫酸法分析发现制备物中β-葡聚糖的含量升高51.5%,而通过SDS-PAGE研究结果表明,胞内可溶性蛋白含量降低40%。这些结果表明麝香草酚可以诱导酵母细胞发生裂解,破坏其细胞膜的完整性,导致细胞壁上肽聚糖的结构发生变化、胞内内容物释放,增强了对黄曲霉毒素B1的吸附能力。利用薄层层析(TLC)和液相色谱(HPLC)检测酵母细胞壁提取物对黄曲霉毒素的吸附情况,结果表明制备的提取物对黄曲霉毒素的吸附能力达到2.5 μg/mg,对麝香草酚的载药量达到41.5 μg/mg。本文可为粮食、饲料中控制黄曲霉毒素污染提供新的研究思路及理论依据。
麝香草酚,酵母细胞壁提取物,吸附,黄曲霉毒素B1
黄曲霉(Aspergillusflavus,AF)是一种分布极其广泛的丝状真菌,经常污染粮食作物和动物饲料,能产生毒性大、致癌性强的次级代谢产物黄曲霉毒素(aflatoxin,AFT)[1-3]。牲畜食用霉菌毒素污染的饲料会引发体重下降和免疫力降低等症状,随后通过食物链进入人体造成机体损伤和增加患癌症的风险[4-6]。目前,主要通过在饲料中添加吸附剂等方法对AFT进行吸附,使毒素不被动物所吸收,直接排出动物体外,也是公认最有效的脱毒措施[7-8]。常见的霉菌毒素吸附剂主要有水合铝硅酸盐类、酵母细胞壁提取物类、活性炭、交联聚乙烯吡咯烷酮和复合吸附剂等[9]。刘媛婷等[10]研究了酵母细胞壁培养物、水合铝硅酸钠钙盐类等对黄曲霉毒素B1的吸附效果,经过体内外实验和动物实验复合吸附剂的吸附能力最强,对猪饲料霉菌毒素吸附脱毒效果最好。而酵母细胞壁提取物具有较好的吸附AFT的能力、添加量少和不污染环境等特点,是一种非常有前景的的霉菌毒素吸附剂产品。研究表明酵母细胞壁多糖是吸附AFT有效成分,对AFT的吸附率可达92%[11-12],通常通过酸、碱或酶处理制备细胞壁提取物与生物毒素的结合效果显著[13-14],但方法繁琐且会损失磷脂等营养成分。目前亟需寻找一种高效、操作简单、成本低的方法处理酵母细胞,用于吸附饲料中的黄曲霉毒素。
麝香草酚(Thymol),别名百里香酚,是一种单萜酚,主要存在于唇形科百里香属植物中,是百里香和牛至的香精油主要成份,具有宜人香气和对病原微生物有很强的抗菌活性的作用[15-16]。研究表明麝香草酚对革兰氏阳性菌、阴性菌都有很好的抗菌活性,主要是破坏其细胞膜的完整性、抑制细胞膜麦角甾醇的生物合成和质子转运ATP酶系统[17-18]。有研究报道麝香草酚对黄曲霉的抗菌活性是通过NO(nitric oxide)和ROS(reactive oxygen species)介导使黄曲霉孢子裂解死亡[19]。麝香草酚作为一种植物源抑菌剂,安全性高,资源丰富,并且对细菌、霉菌、酵母都有较强的抑制作用[20]。
本研究以酵母细胞为原材料,通过麝香草酚处理后,冷冻干燥后制备载有麝香草酚的双效型酵母细胞壁提取物,并探究酵母细胞壁提取物对黄曲霉孢子的抑菌效果。旨在利用麝香草酚裂解酵母细胞,同时以酵母膜脂为载体,与细胞壁共同组成具备抑制黄曲霉和吸附毒素能力的双效型酵母细胞壁提取物,为其在动物饲料添加剂、饲料脱毒等方面的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
野生型酿酒酵母(Saccharomycescerevisiae) By4741 Invitrogen公司;野生型黄曲霉菌CGMCC3.2890 中国普通微生物菌种保藏管理中心;马铃薯葡萄糖琼脂(PDA)培养基 青岛高科园海博生物技术有限公司,4 ℃保存。麝香草酚(Thymol,99%) Sigma公司;二甲基亚砜(DMSO) 上海阿拉丁生化科技股份有限公司;碘化丙啶(PI)荧光染料 上海碧云天生物技术有限公司;GF254硅胶板 购于青岛海洋化工厂;氨基黑 上海索莱宝生物科技有限公司。其余试剂皆为分析纯。
1260型高效液相色谱 美国Agilent公司;Multifuge X1R型高速冷冻离心机 Thermol公司;流式细胞仪 美国Beckman公司;荧光显微镜 Zeiss Series 120Q;Alphal-2LD型冷冻干燥机 德国Christ公司;DFCNW-5LB型氮吹仪 杭州德克尔实验设备有限公司;-25 ℃低温冰箱 中科美菱低温科技有限责任公司;JY-SCZ2+型迷你双垂直电泳仪 北京君意东方设备有限公司;MSC-100型恒温混匀仪 杭州奥盛仪器有限公司;TU-1810PC型紫外可见分光光度计 北京普析通用仪器有限公司;ZWY-304型多功能脱色摇床 上海智城分析仪器制造有限公司。
1.2 实验方法
1.2.1 试剂与培养基的制备 麝香草酚:称取100 mg麝香草酚溶解于1 mL DMSO,放置于-25 ℃冰箱长期保存备用。磷酸盐缓冲液(PBS):称取NaCl 8.0 g,KCl 0.2 g,Na2HPO4·12H2O 3.58 g,KH2PO40.24 g,加蒸馏水至800 mL于磁力搅拌器上充分溶解,调pH7.4,定容至1000 mL,121 ℃高压灭菌15 min,4 ℃条件下保存备用。
YPD培养基:称取酵母提取物10.0 g,蛋白胨20.0 g,葡萄糖20.0 g,琼脂15.0 g,加水至1000 mL于磁力搅拌器上充分溶解,自然pH,分装三角瓶于121 ℃高压灭菌20 min。沙氏培养基:称取蛋白胨10.0 g,葡萄糖40.0 g,琼脂15.0 g,加水至1000 mL于磁力搅拌器上充分溶解,自然pH,分装三角瓶于121 ℃高压灭菌20 min。
1.2.2 菌株活化 将挑取野生型酿酒酵母单克隆于YPD液体培养基中,30 ℃,160 r/min 振荡培养24 h,涂板获得单克隆酵母菌株备用。
1.2.3 酵母细胞膜完整性的检测 挑取已活化的单克隆酵母于液体YPD培养基中,30 ℃、160 r/min振荡培养至OD600=2.0,分装于50 mL的EP管中,加入麝香草酚使其终浓度分别为100、200、300、400、500 μg/mL,处理4 h后5000 r/min离心5 min,用PBS重悬,加入终浓度为1 μg/mL的PI避光静置冰浴15 min,5000 r/min离心5 min,PBS重悬使酵母细胞均匀分散,300目尼龙滤网过滤,用于流式细胞仪及荧光显微镜的检测[21]。
1.2.4 蛋白质相对含量的测定 麝香草酚处理酵母细胞4 h后5000 r/min离心5 min,加入200 μL PBS重悬,加入约20 mg玻璃珠,用高速珠磨法破碎酵母细胞壁。将破碎后的样品蛋白提取液与5×上样缓冲液混匀,100 ℃煮沸5 min后,取20 μL上样,进行不连续双垂直平板电泳。将凝胶置室温摇床上55 r/min染色(0.1%氨基黑的7%醋酸溶液)1 h,在7%醋酸溶液中脱色。其中蛋白含量相对值通过光密度软件Image-Pro Plus 6.0(Media Cybernetics,Inc.)进行计算,并以柱状图表示。
1.2.5β-葡聚糖含量的测定 麝香草酚处理酵母细胞4 h,离心弃上清,用PBS洗涤两次后冷冻干燥(-50 ℃ 0.37 mbr)。取10 mg冷冻干燥后的酵母细胞裂解物溶于2 mL 50%稀硫酸中水解30 min,用苯酚硫酸法测酵母细胞壁提取物β-葡聚糖的含量,测定其在490 nm波长内的紫外吸收光谱[22]。

1.2.6 黄曲霉毒素B1含量的测定 麝香草酚处理酵母细胞4 h,离心弃上清,用PBS洗涤两次后冷冻干燥。取20 mg冷冻干燥后的酵母细胞壁提取物,加入浓度为50 μg/mL黄曲霉毒素溶液,利用微孔板恒温振荡器震荡培养(37 ℃,1 h,1000 r/min),再10000×g离心10 min,取上清液进行薄层层析实验,展开剂是丙酮∶氯仿=1∶9[23]。并配制3%氢氧化钠溶液处理4 h酵母细胞,使用上述同样的方法取上清进行薄层层析实验进行对照,并在365 nm紫外灯下观察、拍照。
把制备的酵母细胞壁提取物吸附黄曲霉毒素后的上清液加三倍体积氯仿萃取,在60 ℃条件下用氮吹仪将其吹干,然后再分别将其溶于甲醇中,过0.22 μm微孔滤膜,然后用HPLC测定黄曲霉毒素的含量[24]。色谱柱:COSMOSIL 5C18-MS-Ⅱ Packed Column(4.6 mm ID×250 mm)(上海岛泉公司);柱温:22 ℃;进样量:10 μL;紫外检测器检测波长:365 nm;流动相:乙腈∶甲醇∶水(1∶1∶2,v/v/v);流速:1 mL/min。
1.2.7 酵母细胞壁提取物对麝香草酚载药能力的测定 挑取已活化的酵母单克隆于液体YPD培养基中在30 ℃、160 r/min振荡培养至OD600=2.0,分装于50 mL的EP管中,5000 r/min离心5 min,以5 mL的PBS洗涤两次,称得质量均为650 mg。用3 mL浓度分别为300、500 μg/mL的麝香草酚处理30 s,5000 r/min离心5 min取上清,进行紫外全波长扫描观察麝香草酚特征吸收峰,并用Origin 8.5峰面积大小进行计算。
1.2.8 酵母细胞裂解物抑菌效果测定 分别称1.2 g 300 μg/mL和500 μg/mL麝香草酚处理获得的酵母细胞壁提取物加入温度为50 ℃ 12 mL沙氏固体培养基中,待培养基凝固后,取10 μL 1×105、1×104、1×103CFU/mL孢子悬浮液进行滴板,待无菌风吹干后,放入30 ℃的培养箱48 h后观察、拍照。
1.2.9 数据分析 实验数据均运用 SPSS 12.0 数据处理系统,采用Duncan’s新复极差法(DMRT)进行显著性分析。文章图表数据的结果均是三次实验数据的平均值±SD。
2 结果与分析
2.1 麝香草酚处理对酵母细胞膜完整性的影响
PI能够与双链核酸分子结合并发红色荧光,但不能穿过完整的细胞膜,因此经常被用来鉴定细胞膜的完整性[21]。本研究发现经过300、400、500 μg/mL麝香草酚处理酵母细胞后,通过荧光显微镜观察发出强烈红色荧光(图1);采用流式细胞仪分析,细胞主群峰发生了明显的向右偏移,说明麝香草酚杀死了酵母细胞(图2)。这就表明麝香草酚破坏酵母细胞膜的完整性,改变其细胞的通透性,PI进入酵母细胞并发出荧光。

图1 荧光显微镜观察的酵母细胞PI荧光强度分布Fig.1 The distribution of fluorescence intensity in the S.cerevisiae cells after PI dyeing by fluorescence microscopy
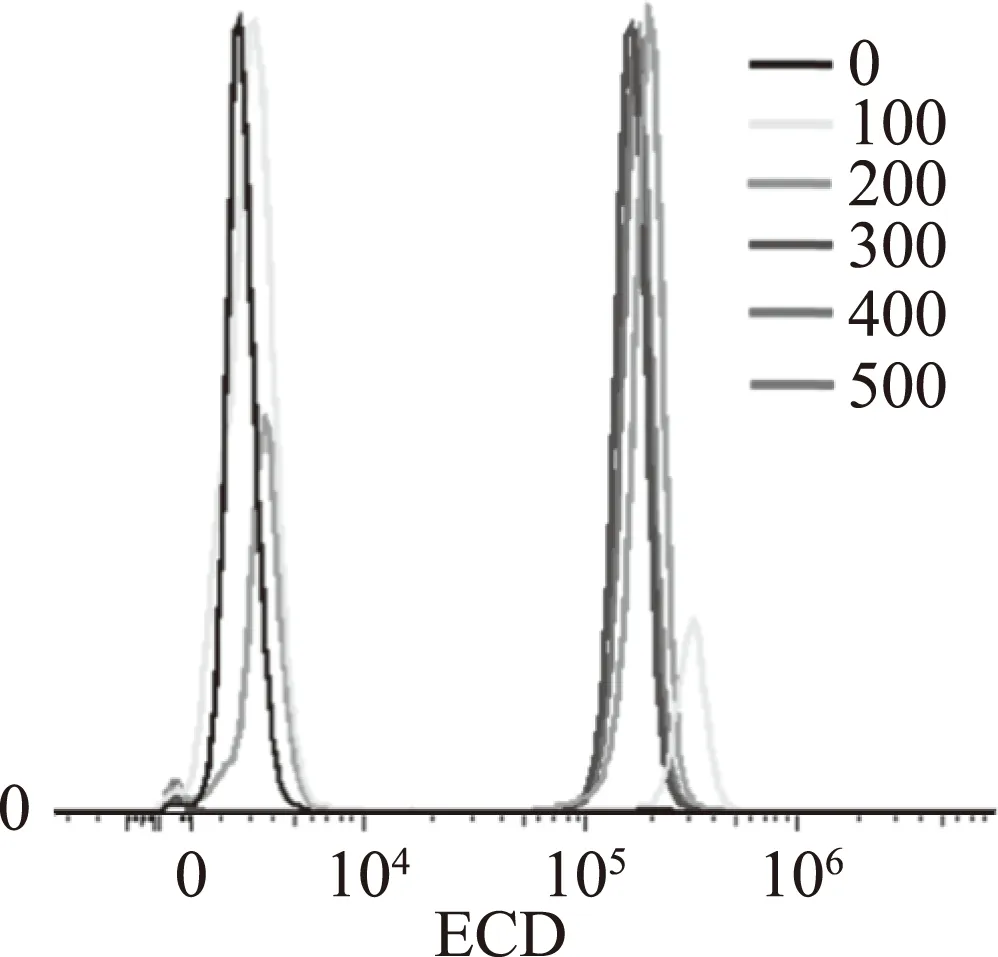
图2 流式细胞仪统计的酵母细胞PI荧光强度分布Fig.2 The distribution of fluorescence intensity in the S.cerevisiae cells after PI dyeing by flow cytometer
2.2 酵母细胞壁提取物中β-葡聚糖和蛋白质的含量变化
酵母细胞壁提取物中的成分主要由多糖和少量的蛋白质、脂肪、矿物质等,其中β-葡聚糖是吸附毒素的主要成分[25-26]。本研究发现酵母细胞经不同浓度麝香草酚处理后,其提取物可溶性蛋白含量显著降低(图3),500 μg/mL麝香草酚处理后可溶性蛋白含量仅为对照的40.0%。β-葡聚糖的百分比显著地增加(图4),500 μg/mL麝香草酚处理后β-葡聚糖的百分比与对照组比增加了51.5%。有研究报道,麝香草酚通过损伤酵母细胞膜,破坏膜的完整性从而杀死酵母细胞[27-28]。因此,β-葡聚糖百分比的增加和蛋白质含量的减少表明麝香草酚诱导酵母细胞发生裂解而导致内容物释放。
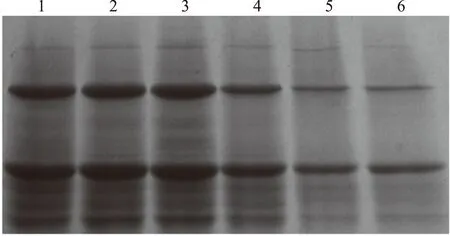
图3 酵母细胞壁提取物蛋白SDS-PAGE图Fig.3 SDS-PAGE of proteins from yeast cell-wall extract注:1:未经麝香草酚处理的酵母细胞壁提取物;2~6:分别为100、200、300、400、500 μg/mL的麝香草酚处理的酵母细胞壁提取物。
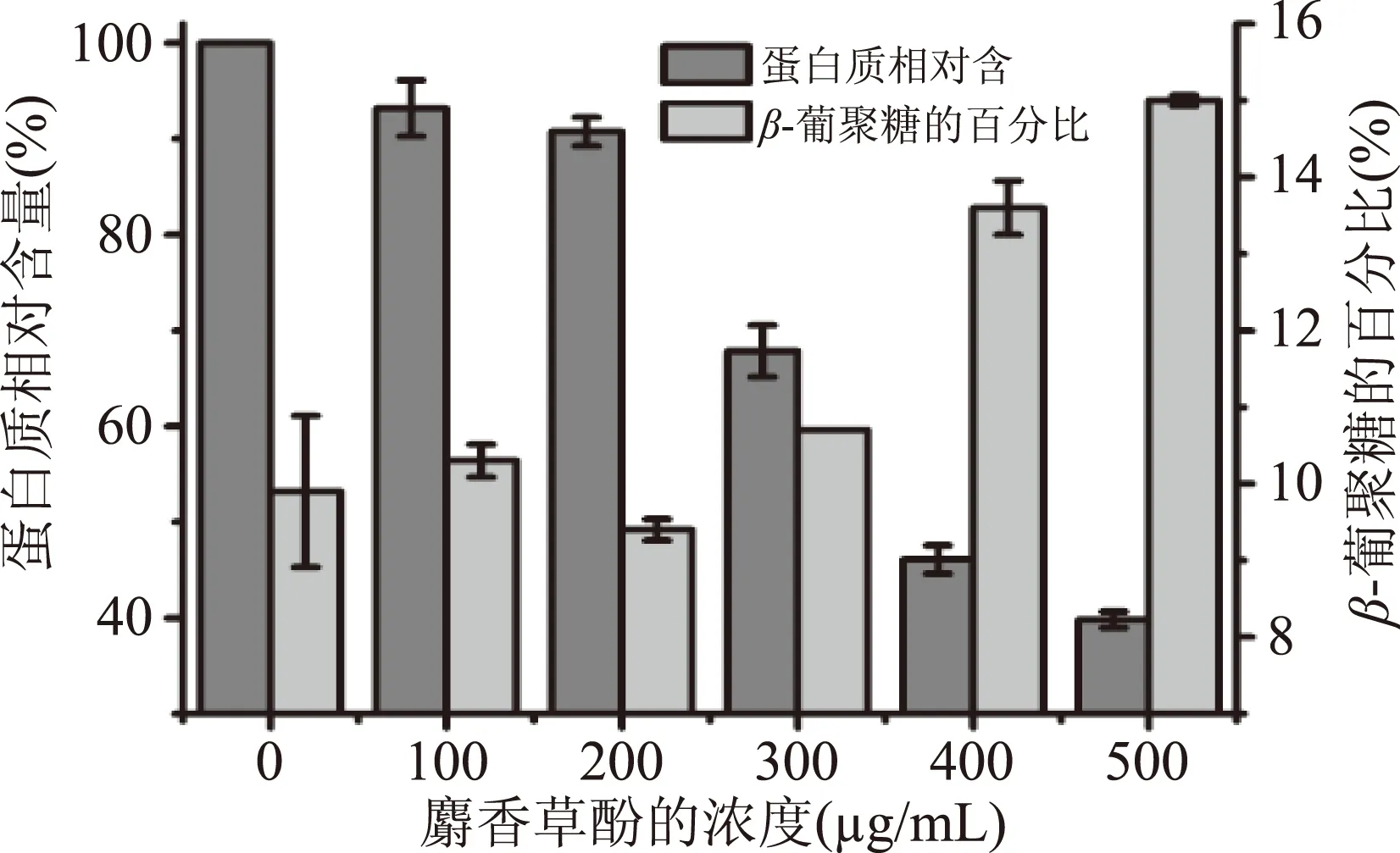
图4 酵母细胞壁提取物中可溶性蛋白与β-葡聚糖含量的变化Fig.4 The change of protein and β-glucan in yeast cell-wall extract treated with thymol
2.3 酵母细胞壁提取物对黄曲霉毒素B1的吸附作用
评价饲料AFT污染的主要指标即AFB1,也是饲料吸附剂的主要研究对象,所以实验结果均以AFB1表示其黄曲霉毒素的含量。薄层层析和液相色谱实验结果显示利用麝香草酚制备的酵母细胞壁提取物吸附黄曲霉毒素的相对含量比碱处理效果显著(图5),其中500 μg/mL麝香草酚处理酵母细胞,其制备的酵母细胞壁提取物吸附AFB1,每毫克的酵母吸附黄曲霉毒素可达2.5 μg(图6)。结果表明,酵母细胞经麝香草酚处理后,更有利于吸附黄曲霉毒素。

图5 酵母细胞壁提取物吸附黄曲霉毒素B1上清液的薄层层析Fig.5 TLC of supernatant of adsorption of AFB1 by yeast cell-wall extract注:1:未经麝香草酚处理的酵母细胞壁提取物;2~6:分别为100、200、300、400、500 μg/mL的麝香草酚处理的酵母细胞壁提取物;7:3%的氢氧化钠处理的酵母细胞壁提取物。
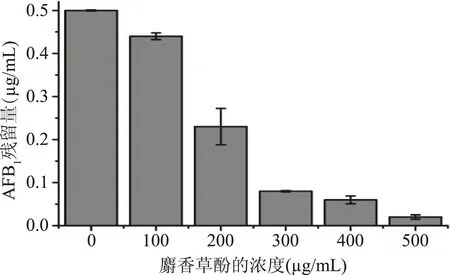
图6 酵母细胞壁提取物吸附AFB1残余量的变化Fig.6 The change of AFB1 residue in yeast cell-wall extract treated with thymol
2.4 酵母细胞壁提取物载药情况
麝香草酚在273 nm处有最大吸收峰,其峰面积随着麝香草酚处理酵母细胞的浓度增大而增大。当添加酵母细胞壁提取物后,残余的麝香草酚在273 nm处吸收峰的峰面积显著降低(图7),采用Origin 8.5软件对峰面积进行计算和处理,酵母细胞壁提取物可以吸附麝香草酚,添加酵母后的与未添加酵母峰面积之间的差值即为酵母细胞提取物对麝香草酚载药能力的大小。经计算,当麝香草酚处理酵母细胞的工作浓度为500 μg/mL时,酵母细胞壁提取物对麝香草酚的载药能力为41.5 μg/mg。
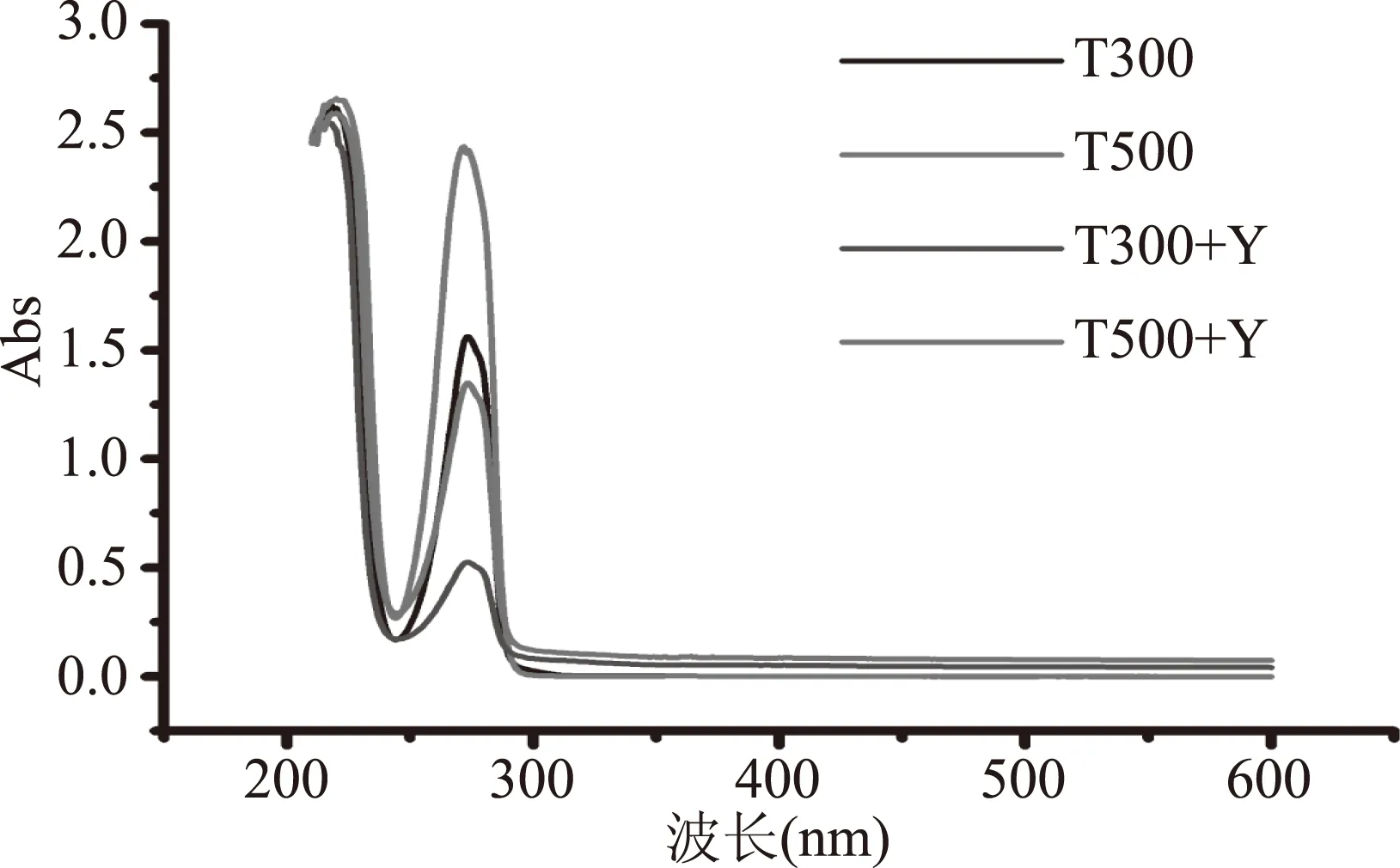
图7 麝香草酚处理酵母细胞后残余麝香草酚的特征吸收峰Fig.7 Characteristic absorption peak of residual thymol by yeast cell treated with thymol
2.5 酵母细胞壁提取物的抑菌作用
当使用工作浓度为0、300、500 μg/mL的麝香草酚处理酵母细胞获得细胞壁提取物,结果显示:其中500 μg/mL的麝香草酚处理酵母细胞得到的制备物,黄曲霉孢子在含有其制备物的沙氏平板上黄曲霉孢子的萌发和菌丝的生长受到显著的抑制作用,表明麝香草酚处理后获得的酵母细胞壁提取物有抑制黄曲霉的功效(图8)。

图8 麝香草酚处理酵母细胞后酵母细胞壁提取物的抑菌效果Fig.8 Antimicrobial effect by yeast cell-wall extract by yeast cell treated with thymol
3 结论
麝香草酚能够破坏酵母细胞膜改变细胞的通透性;麝香草酚诱导酵母细胞发生裂解而导致内容物释放,当500 μg/mL的麝香草酚处理时,细胞壁提取物中蛋白质的含量仅为对照组的40%,β-葡聚糖的含量增加了51.5%;制备的双效型酵母细胞壁提取物对黄曲霉毒素的吸附能力为2.5 μg/mg,对麝香草酚的载药量可达41.5 μg/mg,并对黄曲霉菌丝的生长有显著的抑制作用。麝香草酚作为一种植物源抑菌剂,制备这种双效型细胞壁提取物添加到粮食和饲料中,不会造成二次污染和药物残留,且这种细胞壁提取物制备方便简洁,并适合大量的工业化生产[29-30]。这一研究结果有望为我国食品和饲料中黄曲霉毒素污染问题提供理论基础。
[1]Farfan I D,Gn D L F,Murray S C,et al. Genome wide association study for drought,aflatoxin resistance,and important agronomic traits of maize hybrids in the sub-tropics[J]. Plos One,2015,10(2):e0117737.
[2]Reddy K R N,Raghavender C R,Salleh B,et al. Potential of aflatoxin B1,production byAspergillusflavus,strains on commercially important food grains[J]. International Journal of Food Science & Technology,2011,46(1):161-165.
[3]晏石娟,黄文洁,刘春明. 脂肪酸及其氧合物对曲霉属真菌菌丝生长、产孢和黄曲霉毒素合成的影响[J]. 微生物学报,2017,57(1):24-32.
[4]Morgavi D P,Riley R T. An historical overview of field disease outbreaks known or suspected to be caused by consumption of feeds contaminated withFusariumtoxins[J]. Animal Feed Science & Technology,2007,137(3):201-212.
[5]Finkgremmels J,Malekinejad H. Clinical effects and biochemical mechanisms associated with exposure to the mycoestrogenzearalenone[J]. Animal Feed Science & Technology,2007,137(3-4):326-341.
[6]Pestka J J. Deoxynivalenol:Toxicity,mechanisms and animal health risks[J]. Animal Feed Science & Technology,2007,137(3):283-298.
[7]Bailey R H,Kubena L F,Harvey R B,et al. Efficacy of various inorganic sorbents to reduce the toxicity of aflatoxin and T-2 toxin in broiler chickens[J]. Poultry science,1998,77(11):1623-1630.
[8]M.V.L.N.Raju,G.Devegowda.Influence of esterified-glucomannan on performance and organ morphology,serum biochemistry and haematology in broilers exposed to individual and combined mycotoxicosis(aflatoxin,ochratoxin and T-2 toxin)[J]. British Poultry Science,2000,41(5):640-650.
[9]卢永红,陈峰,李太翔.饲料中霉菌毒素与脱毒剂的研究进展[J]. 中国畜禽种业,2005(9):46-49.
[10]刘媛婷. 霉菌毒素吸附剂对黄曲霉毒素B1吸附特性及效果研究[D].四川农业大学,2011.
[11]Jalili M. A review on aflatoxins reduction in food[J]. Iranian Journal of Health Safety & Environment,2016,3(1):455-459.
[12]Verheecke C,Liboz T,Mathieu F. Microbial degradation of aflatoxin B1:Current status and future advances[J]. International Journal of Food Microbiology,2016,237:1-9.
[13]Wu Q,Jezkova A,Yuan Z,et al. Biological degradation of aflatoxins[J]. Drug Metabolism Reviews,2009,41(1):1-7.
[14]鄢贵龙. 黄曲霉毒素生物学去除方法的研究[J]. 食品工业科技,2005(10):181-183.
[15]王娣,谢海伟,曹珂珂,等. 麝香草酚抑菌活性及其影响因素研究[J]. 食品工业科技,2012,33(14):96-99.
[16]Gao T,Zhou H,Zhou W,et al.The Fungicidal Activity of thymol againstFusariumgraminearumvia inducing lipid peroxidation and disrupting ergosterol biosynthesis[J]. Molecules,2016,21(6):770.
[17]Ahmad A,Khan A,Akhtar F,et al. Fungicidal activity of thymol and carvacrol by disrupting ergosterol biosynthesis and membrane integrity against Candida[J]. European Journal of Clinical Microbiology & Infectious Diseases,2011,30(1):41.
[18]Ahmad A,Khan A,Yousuf S,et al. Proton translocating ATPase mediated fungicidal activity of eugenol and thymol[J]. Fitoterapia,2010,81(8):1157-1162.
[19]Shen Q,Zhou W,Li H,et al.ROS Involves the Fungicidal Actions of Thymol against Spores ofAspergillusflavusvia the Induction of Nitric Oxide[J]. Plos One,2016,11(5):e0155647.
[20]王娣,许晖,钱时权,等.麝香草酚对食品常见污染菌的抑菌作用[J].食品科学,2013,34(3):119-122.
[21]沈青山,周威,王淼焱,等. 肉桂醛诱导酿酒酵母Persisters细胞的形成[J]. 现代食品科技,2016(7):53-59.
[22]周丽明,张勇. 碱不溶性酵母胞壁多糖苯酚-硫酸测定法的研究[J]. 食品工业科技,2015,36(3):311-315.
[23]荣迪. 酵母β-D-葡聚糖及衍生物对玉米赤霉烯酮吸附效果的研究[D]. 武汉:华中农业大学,2012.
[24]Mo H Z,Zhang H,Wu Q H,et al. Inhibitory effects of tea extract on aflatoxin production byAspergillusflavus[J].Letters in Applied Microbiology,2013,56(6):462-466.
[25]赵季,任俊琦,卢彩霞,等. 酵母细胞壁多糖的研究进展[J]. 中国食品添加剂,2009(1):59-62.
[26]赵柳,陈海峰.酵母细胞壁对霉菌毒素作用的研究进展[J].饲料与畜牧:新饲料,2010(6):31-32.
[27]Malekkhahi M,Tahmasbi A M,Naserian A A,et al. Effects of essential oils,yeast culture and malate on rumen fermentation,blood metabolites,growth performance and nutrient digestibility of Baluchi lambs fed high-concentrate diets[J]. Journal of Animal Physiology & Animal Nutrition,2015,99(2):221-229.
[28]Kim J H,Chan K L,Mahoney N. Augmenting the activity of monoterpenoid phenols against fungal pathogens using 2-hydroxy-4-methoxybenzaldehyde that target cell wall integrity[J]. International Journal of Molecular Sciences,2015,16(11):26850-26870.
[29]Camiletti B X,Asensio C M,Pecci M D L P G,et al. Natural control of corn postharvest fungiAspergillusflavusandPenicilliumsp. using essential oils from plants grown in Argentina[J]. Journal of Food Science,2014,79(12):M2499.
[30]Jard G,Liboz T,Mathieu F,et al. Review of mycotoxin reduction in food and feed:from prevention in the field to detoxification by adsorption or transformation[J]. Food Additives & Contaminants Part A Chemistry Analysis Control Exposure & Risk Assessment,2011,28(11):1590-1609.
Double function yeast cell-wall extract and its capability of adsorbing aflatoxin B1
QIAN Pan-pan,LI Hong-bo,ZHAO Yan-yan,ZHOU Wei,MO Hai-zhen,HU Liang-bin*
(Department of Food Science,Henan Institute of Science and Technology,Xinxiang 453003,China)
In this study,we managed to produce a type of cell-wall extract with double functions i.e. spore inhibition and toxins adsorption by using thymol to anchor the phospholipid of yeast cells and lyse them. It was showed that thymol led to the yeast cell death with the observation by using the flow cytometry and fluorescence microscope. When yeast cell-wall extract by yeast cell was treated with 500 μg/mL thymol,the content ofβ-glucan was increased by 51.5% in the cell-wall extracts by phenol-sulfuric,and soluble protein in cells was decreased by 40% by SDS-PAGE. This indicated that thymol gave rise to the lysis of yeast cell and destroyed the integrity of the cell membrane,the structural of peptidoglycan on the cell wall changed,yeast cell released their contentand and the adsorption capacity of AFB1 increased .The capability of cell-wall extract adsorbing AFB1 was 2.5 μg/mg by thin layer chromatography(TLC)and high performance liquid chromatography(HPLC). And its thymol-loading capacity was 41.5 μg/mg. This study provided new ideas and theoretical basis for the control of aflatoxin contamination in food and feed.
thymol;yeast cell-wall extract;adsorption;aflatoxin B1
2017-01-16
钱潘攀(1992-),男,硕士研究生,研究方向:黄曲霉毒素代谢与污染控制,E-mail:qianpp292@163.com。
*通讯作者:胡梁斌(1979-),男,博士,副教授,研究方向:食源性病原物控制,E-mail:hulb973@163.com。
国家自然科学基金项目(31671952);河南省科技攻关计划项目(152102110086,162102110065)。
TS201.6
A
1002-0306(2017)15-0025-05
10.13386/j.issn1002-0306.2017.15.006
