层粘连蛋白基因家族在猪多能干细胞中的表达谱分析
2017-09-03李焕于童马洋洋王华岩
李焕,于童,马洋洋,王华岩
西北农林科技大学 动物医学院动物生物技术系 陕西省干细胞工程技术研究中心,陕西 杨凌 712100
层粘连蛋白基因家族在猪多能干细胞中的表达谱分析
李焕,于童,马洋洋,王华岩
西北农林科技大学 动物医学院动物生物技术系 陕西省干细胞工程技术研究中心,陕西 杨凌 712100
李焕, 于童, 马洋洋, 等. 层粘连蛋白基因家族在猪多能干细胞中的表达谱分析. 生物工程学报, 2017, 33(8): 1304–1314.
Li H, Yu T, Ma YY, et al. Expression of Laminin gene family in porcine pluripotent stem cells. Chin J Biotech, 2017, 33(8):1304–1314.
层粘连蛋白 (Laminin) 是细胞外基质的重要成分,对细胞生长、分化、运动、组织修复和再生等发挥重要调节作用。Laminin包括有A1-5、B1-4和C1-3共12个编码基因,以不同的表达模式发挥功能。其中Laminin A5作为可以支持多能细胞生长的重要基因,得到广泛研究。但是,在所有猪相关数据库中,均未能查到Laminin A5的信息。文中通过生物信息学分析,首次确认了猪Laminin A5的存在,并进行了克隆和测序验证。为揭示Laminin基因家族在猪诱导多能干细胞 (iPSCs) 中的表达特性,检测了Laminin在猪各组织、体细胞和iPS细胞中的不同表达模式。发现Laminin B1基因在猪多能干细胞中存在特异性可变剪接体 (LAMB1-a),且该可变剪切体的表达量与猪多能干细胞的重编程程度呈正相关。为进一步揭示和利用Laminin作为细胞外基质,用于猪多能干细胞的获取和培养优化奠定了基础。
猪多能干细胞,层粘连蛋白,LAMA5,表达模式分析
诱导多能干细胞 (Induced pluripotent stem cells,iPSCs,iPS细胞) 可以分化为体内各种成体细胞,进而形成机体各种组织和器官[1]。因此,iPS细胞的研究不仅具有重要的理论意义,而且在组织再生、修复和疾病治疗方面具有广泛的价值。细胞外基质 (Extracellular matrix,ECM)是由细胞合成和分泌的生物大分子,具有支持和连接组织结构、调节组织的发生和细胞的生理活动等功能[2-3]。有研究表明,特定 ECM 形成的微环境可以支持iPS细胞的生长,培养体系中添加这类ECM对iPS细胞的生长和多能性维持具有关键作用[4]。此外,采用无饲养层培养体系,可以避免饲养层细胞带来的外源因素的干扰[2,5]。目前,商品化的ECM包括Matrigel、层粘连蛋白、纤粘连蛋白、胶原等已经广泛应用到无饲养层培养体系中[6],部分已被验证有利于人和小鼠iPS细胞的获取和培养[7-8]。猪和人在生理和代谢上具有极高的相似性,是理想的可应用于疾病和再生医学研究的模式动物[9],因此,获得真正的猪iPS细胞将具有十分重要的意义。猪iPS细胞的获取和培养多参考人和小鼠相关体系,但获得的猪 iPS细胞无法达到原始态(Naïve state)。因此,探索并发现适宜的培养体系对于获得完全重编程的猪iPSCs有重要意义。
层粘连蛋白家族 (Laminin,LN) 是一类参与形成组织细胞基底膜的重要大分子非胶原性糖蛋白,是 ECM 的重要组成部分[10]。完整的LN蛋白由3种肽链 (α、β、γ) 形成十字架样结构的异源三聚体,其中α链有5种亚型,β链有4种亚型,γ链有3种亚型,分别由不同的基因编码,发挥不同的功能。目前,通过对小鼠和人层粘连蛋白的研究已确定存在 18种不同的LN组合[11-12]。LN蛋白可以改变细胞的表型,引导细胞向不同的方向分化[13],对于早期胚胎发生、各种组织的形成和功能的完善发挥重要作用[14-15]。其中,LAMA5作为在小鼠和人各组织中广泛表达的基因,与其他亚基的特定组合,如 Laminin-511 (由 LAMA5、LAMB1和 LAMC1组成),可以作为支持人iPS细胞生长的关键基质[16-17],并且维持其不分化状态[18-19]。因此我们推测,恰当的LN组合也可以对猪iPS细胞的分离和建系发挥作用。然而,猪LAMA5的研究仍未见报道,甚至在 NCBI和 UCSC相关基因组数据库中也没有相关序列的注释。
为明确猪iPS细胞中LN的表达情况,我们对猪组织、细胞和建系iPS细胞中的LN表达进行了检测,展示了 LN的时空表达情况。通过生物信息学分析和同源序列比对,确认了猪 LAMA5基因的存在,克隆了猪LAMA5基因部分序列,并进行了测序鉴定。此外,我们还发现猪 iPS特异表达的LAMB1基因存在可变剪接体 (LAMB1-a)。本文初步揭示了猪 LN基因表达特性,为优化猪iPS细胞培养体系和鉴定方法提供了新的依据。
1 材料与方法
1.1 菌种、载体和组织样品
大肠杆菌 Stellar感受态细胞由陕西省干细胞工程技术研究中心保存。pGEM-T Easy载体购自 Promega公司。猪各组织样品采自动物试验站饲养的八眉黑猪30日龄保育猪。
1.2 试剂和耗材
限制性内切酶、反转录试剂盒、T4 DNA连接酶、2×Taq MasterMix (Dye) 购自CWBIO公司;总RNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒、DNA marker购自天根公司 (北京);细胞培养基 (Dulbecco’s Modified Eagle Medium,DMEM)、非必需氨基酸、谷氨酰胺购自Invitrogen (美国);胎牛血清 (FBS) 购自Hyclone;PCR引物 (表1)由北京奥科鼎盛生物科技有限公司合成。
1.3 反转录 PCR检测猪组织和细胞中 Laminin的表达
引物设计利用Primer Blast在线软件进行,以已知猪Laminin的RNA参考序列为模板 (表1),进行全转录组比对后得到的目标基因特异性引物序列。为方便扩增,引物的设计尽量使 Tm值在60 ℃左右,引物序列长度设定为20 bp,最终通过试验筛选确认各基因引物。从成年猪睾丸、脑、肝、胃、心、肺组织、卵巢颗粒细胞,以及原代分离的脂肪细胞、肝脏细胞、成纤维细胞、猪iPS细胞和不同培养条件下的DOX-iPS细胞中提取总RNA,并反转录为cDNA,采用RT-PCR方法 (94 ℃ 30 s;58 ℃ 30 s;72 ℃ 1 min ;35 个循环) 检测LN的表达情况。
1.4 数据库搜索和生物信息学分析
猪iPS细胞系piPS-g和猪胎儿成纤维细胞PEF的转录组数据均来自本实验室[20],猪早期胚胎转录组数据来自韩建永课题组之前发表的文章[21]。数据使用 RPKM+1,并利用 Excel制作柱状图呈现。为了确定猪LAMA5基因,选取人、牛和羊的已知LAMA5基因组序列作为预测模板,通过分析LAMA5上下游基因的排列顺序,将猪LAMA5基因定位于RPS21与CABLES2之间的序列区域。最终,通过GeneWise基因在线预测工具 (http://www.ebi.ac.uk/Tools/psa/genewise/) 利用已知的人和牛的蛋白序列与猪 RPS21和CABLES2基因之间的DNA序列进行逆向比对,从而对猪 RPS21和 CABLES2之间是否存在LAMA5基因进行预测。
1.5 猪LAMA5和LAMB1基因的克隆和鉴定
根据预测到的两种猪LAMA5蛋白序列进行差异比对,跨差异区域进行猪LAMA5基因的引物设计,并分别命名为 pc-LAMA5-1和 pc-LAMA5-2(表1)。随后,以猪iPS细胞总RNA制备的cDNA为模板,利用引物pc-LAMA5-1、pc-LAMA5-2和pc-LAMB1进行 RT-PCR扩增。将获得的目的片段克隆到 pGME-T Easy载体并经酶切鉴定,确认酶切产物片段大小符合预期后,将质粒送往西安擎科生物技术有限公司测序。
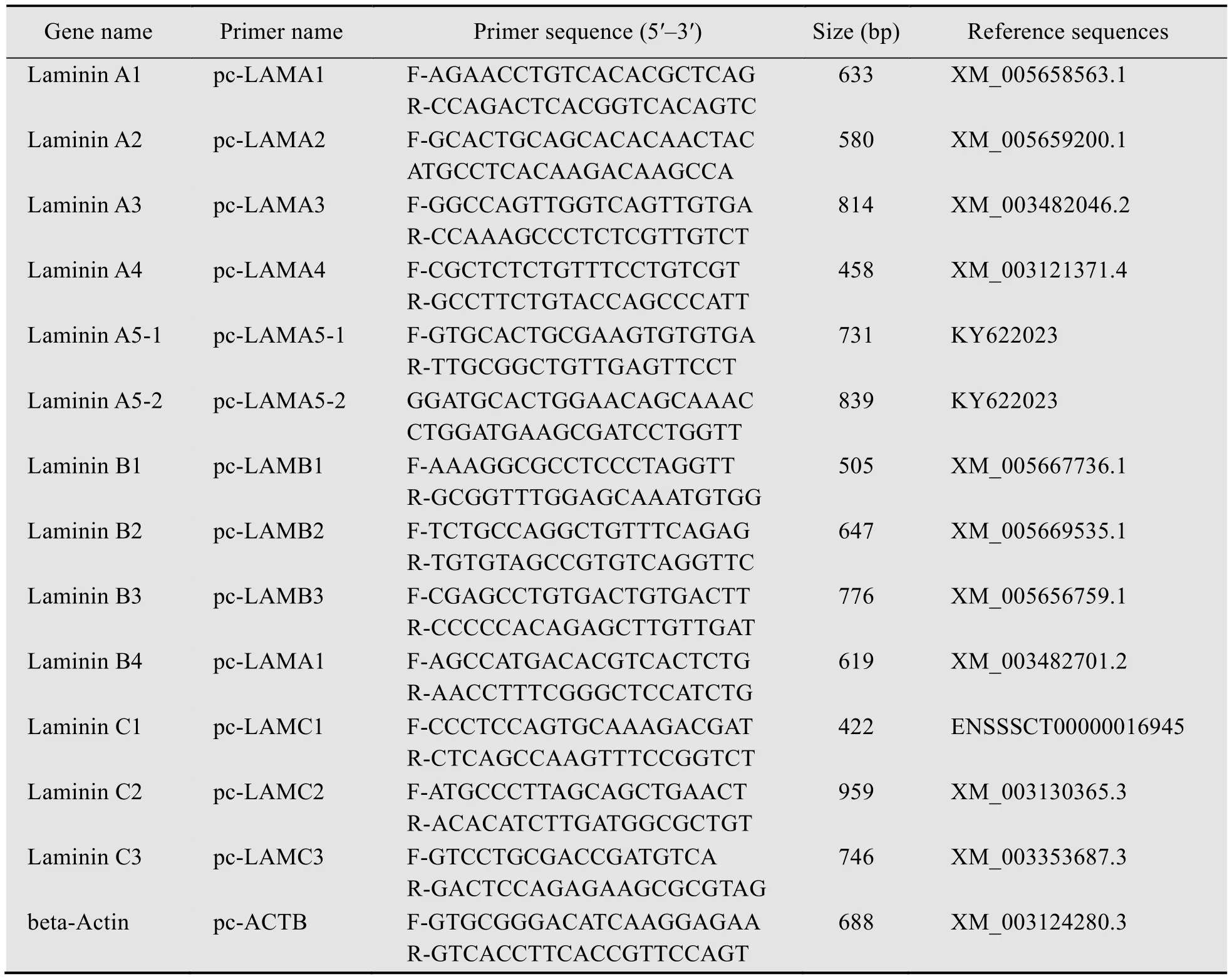
表1 本研究所用引物序列Table 1 Primers used in this study
1.6 细胞的获取和培养
猪成纤维细胞 (PEF) 来源于新生仔猪耳部组织,用高糖 DMEM培养基添加 15% FBS进行培养;猪脂肪细胞来源于仔猪皮下脂肪组织,用DME/F12培养基添加10% FBS培养;猪肝脏细胞来源于仔猪肝脏组织,用高糖DMEM培养基添加10% FBS培养。猪iPS细胞系DOX-iPS细胞由本室诱导获得[22],使用高糖DMEM添加15% FBS培养,培养基中添加10 ng/mL bFGF、10 ng/mL LIF、10 ng/mL BMP4、3 μmol 的CHIR99021、2 μmol的 SB431542、0.1 mmol/L NEAA、2 mmol/L 谷氨酰胺、0.1 mmol/L β-巯基乙醇,每天换液后以 4 μg/mL添加新鲜配制的Doxycycline,3-4 d后进行胰酶消化传代。DOX-iPS分化细胞和二代DOX-iPS细胞的获得见之前研究[22]。猪多能干细胞系piPS (PS11) 由本实验室诱导获得[23],使用 KnockOut-DMEM添加 20% FBS、10 ng/mL bFGF、10 ng/mL LIF、0.1 mmol/L NEAA、2 mmol/L谷氨酰胺、0.1 mmol/L β-巯基乙醇,每天换液,每隔2-3 d胰酶消化传代。
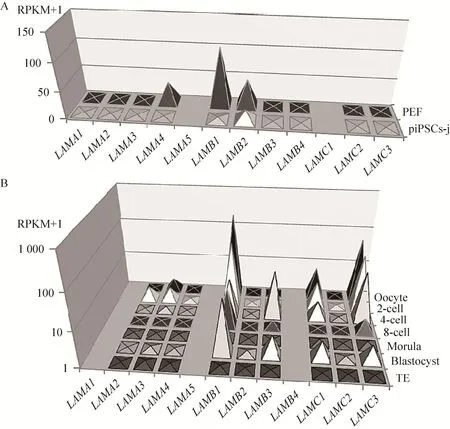
图1 猪LN基因在iPS细胞和早期胚胎的表达谱 (A:猪LN基因在PEF和iPS细胞中的表达;B:LN基因在胚胎不同时期的表达)Fig. 1 Porcine LN gene expression in the iPS cells and early embryos. (A) Porcine LN gene expression in PEF and piPS. (B) LN gene expression in different stages of embryos.
2 结果与分析
2.1 LN基因在猪iPS细胞和早期胚胎中的转录情况
通过分析猪iPS和PEF细胞的转录组数据[1],我们发现测序结果中缺少LAMA5和LAMC1的信息 (图1A)。对猪早期胚胎转录组数据的分析也发现,数据中缺少LAMA1、LAMA5和LAMB4的信息 (图1B),其原因是猪LN基因家族的注释尚不完全。对细胞转录组数据进行分析发现,成纤维细胞中转录较为活跃的LAMA4基因,在细胞重编程完成后有所下调;LAMB1和LAMB2在猪iPS细胞中也有所下调,但LAMB1在猪iPS细胞中仍占有主要地位,与人多能干细胞中LAMB1高表达的情况类似 (图 1A)。对胚胎转录组数据进行分析发现,猪LN的表达在桑葚胚期前后存在明显的界限。在卵母细胞至 8细胞时期,LAMB1、LAMC1和LAMC3呈现高表达,且随着发育过程逐渐减少,表明这 3个基因可能为母源基因,在猪胚胎阻滞期之前发挥重要的发育调控作用。在桑葚胚时期,所有LN均呈现低表达情况,说明阻滞期过后,母源RNA利用殆尽。之后的囊胚期,LAMB1、LAMB3、LAMC1和LAMC3重新上调,预示这些基因作为早期合子激活基因,对胚胎进一步分化和发育发挥重要调控作用 (图1B)。
2.2 猪 LAMA5基因序列的预测、鉴定和同源分析
LAMA5基因在大多数物种中都有报道或注释,但是,UCSC和NCBI序列数据库中没有猪LAMA5相关序列和注释。以人 (NM_005560.4)、牛 (XM_019972687.1)、羊 (XM_018057585.1) 的LAMA5基因RNA区段序列为模板,利用BLAST和BLAT对猪基因组整合序列 (Sscrofa10.2) 进行比对,也未找到相似的序列 (图2A)。我们推测,猪LAMA5基因序列无法查找可能有两个原因:1) 猪基因组数据库 (Sscrofa10.2) 的内容不够完整,而LAMA5的信息恰好位于缺失的序列当中;2) 猪在进化中发生了 LAMA5基因的丢失。因此,我们选择牛第13号染色体上LAMA5基因组上游的SS18L1/LSM14B和下游的RPS21/CANLES2两对基因为位置参照,与猪基因组序列进行了比对。结果表明,猪17号染色体上有上述基因的相邻分布,且在SS18L1和RPS21之间有一段80 kb的序列中存在序列缺口(Gap)。
2016年12月6日,最新的猪基因组数据库(Sscrofa11.1) 更新并上传至NCBI网站的Assembly数据库。在猪17号染色体SS18L1和RPS21之间的序列增加至 168 kb,且新序列中不再有序列缺口 (图2A)。利用GeneWise在线预测软件,将人 LAMA5蛋白序列 (XP_006723859.1) 与186 kb猪基因组序列进行逆向比对 (GeneWise软件提供的逆翻译算法,可将蛋白序列逆翻译为可变RNA序列,并与提供的基因组DNA序列进行比对),预测到一段 11 363 bp的同源mRNA序列,并将之命名为 P1;与牛 LAMA5蛋白序列 (XP_014333141.1) 比对预测到一段11 750 bp的同源mRNA序列,将之命名为P2。将P1和P2序列进行同源性比对,两者之间存在3个差异区段。将跨P1、P2间最大的差异区段进行引物设计 (图2B),经RT-PCR扩增并进行电泳检测,获得了731 bp的F-1和839 bp的F-2条带(图2C)。克隆F-1片段进行DNA测序,与预测序列P2相符。据此,将获得的LAMA5基因序列提交GenBank数据库 (Accession No. KY622023)。
2.3 猪LN在组织和细胞中表达情况分析
采用RT-PCR检测LN在猪各种组织 (图3A)中的表达情况发现,LN在不同组织细胞中具有不同的表达水平,其中LAMA5和LAMC1在各组织中广泛表达,LAMA1在脑、卵巢和睾丸中高表达;LAMA2在肝组织中未见表达;LAMA3在肺、脑中高表达。LAMA4在卵巢颗粒细胞组织未见表达。LAMB1在心脏未见表达。LAMC2仅在脑和卵巢颗粒细胞有表达。LAMC3在脑和睾丸中有表达。RT-PCR检测细胞中LN的表达和细胞 (图3B–C)。相较于组织,细胞LN的表达更加特异,在肝细胞中只有 LAMA5、LAMB3和LAMC1表达。脂肪细胞和 PEF中 LAMA4、LAMA5、LAMB1、LAMB2和 LAMC1高表达。检测中还发现LAMB1只在多能细胞猪iPS中出现两条特异性条带。
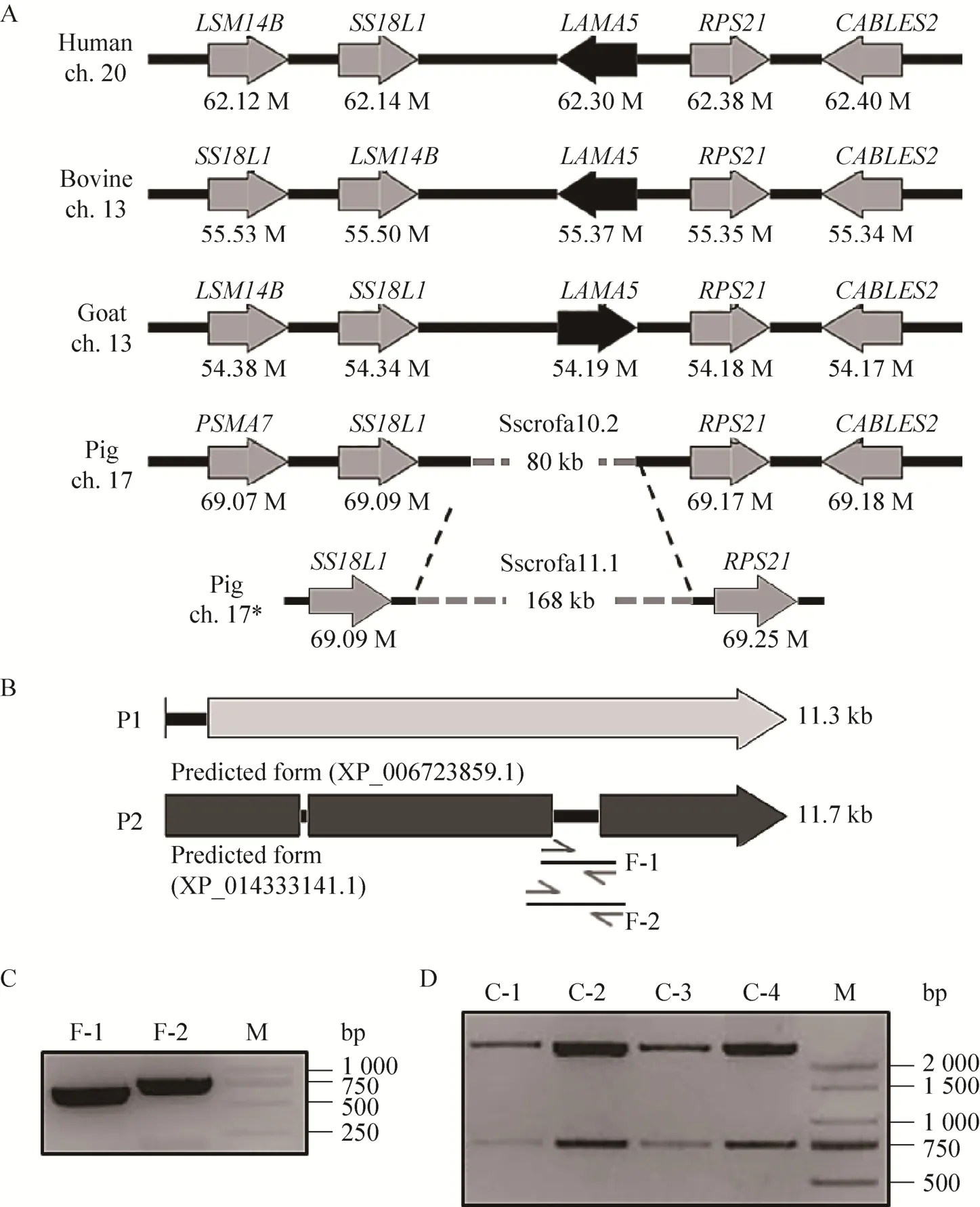
图2 猪LAMA5基因的预测和分子克隆 (A:人、牛、羊和猪LAMA5基因的定位;B:猪LAMA5基因预测;C:猪LAMA5基因RT-PCR产物F-1 (720 bp) 和F-2 (839 bp);D:猪LAMA5克隆产物EcoRⅠ酶切结果)Fig. 2 Porcine LAMA5 gene prediction and molecular cloning. (A) Alignment of LAMA5 and related gene clusters among human, cattle, goat and porcine. (B) Prediction of porcineLAMA5 gene cluster. (C) RT-PCR amplification of porcineLAMA5 F-1 (720 bp) and F-2 (839 bp). (D) Plasmid of porcineLAMA5 clone was digested byEcoR I. M:marker DL2000.
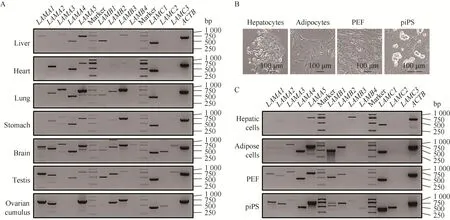
图3 猪LN的组织和细胞表达谱分析 (A:用RT-PCR检测猪不同组织中LN的表达;B:实验中所用细胞图片;C:用RT-PCR检测不同细胞中LN的表达. 内参选用β-Actin (简写为ACTB))Fig. 3 Expression profile of porcine LN. (A) RT-PCR analysis of porcine LN expression in different tissues. (B) Images of cells used in the experiment. (C) RT-PCR analysis of porcine LN expression in different cells. β-Actin: ACTB.
2.4 LAMB1-a的克隆和在多能干细胞中特异性表达
在对LAMB1的检测中,使用引物pc-LAMB1在除心、胃组织外均检测到符合预期的单一条带(图3A)。然而在猪iPS细胞中,则检测到两个条带(图3C)。分别回收两个条带,并经克隆测序和同源比对验证,505 bp条带与 GenBank数据库中的LAMB1-X1 (XM_003130269.4) 序列只有1个碱基差异。新条带为639 bp,但与GenBank数据库中的LAMB1-X1和LAMB1-X2 (XM_005667736.2)均不相同但具备较高的同源性,因此确认639 bp的产物为LAMB1一个新的可变剪切体,并将其命名为LAMB1-a (图4A)。为进一步验证LAMB1-a表达的特异性,对猪PEF、DOX-iPS细胞,以及分化 3 d (-DOX/3D)、5 d (-DOX/5D) 和二代DOX-iPS (2nd+DOX) 等细胞进行了检测 (图4B)。结果表明,PEF细胞中只表达LAMB1,而对猪iPS细胞中LAMB1的扩增则能同时检测到LAMB1和LAMB1-a (图4C)。在对分化过程中的DOX-iPS细胞进行LAMB1表达检测中,我们还发现,随着猪iPS的分化,克隆形态逐渐消失,LAMB1-a的表达也逐渐降低直至检测不到 (图4B–C)。对分化的DOX-iPS细胞恢复DOX-iPS培养条件,并添加Doxycycline进行连续传代后,DOX-iPS的克隆形态逐渐恢复,同时LAMB1-a再度表达(图4B–C)。这表明,LAMB1-a与猪iPS细胞的重编程程度存在明确的相关性。
3 讨论
在对小鼠的研究中,研究人员发现随着机体的发育,不同的组织和细胞中LN基因的表达具有不同的时空特性,从而产生不同的LN蛋白组合来行使不同的作用[24]。本研究通过检测猪组织和细胞中LN的表达情况证明,在不同组织和细胞中LN的表达均有各自的特征。这些结果表明,LN作为重要的细胞外基质存在于猪的整个生命周期和各种组织当中,并有可能参与不同的信号调控,对猪的生长发育产生不同的影响。
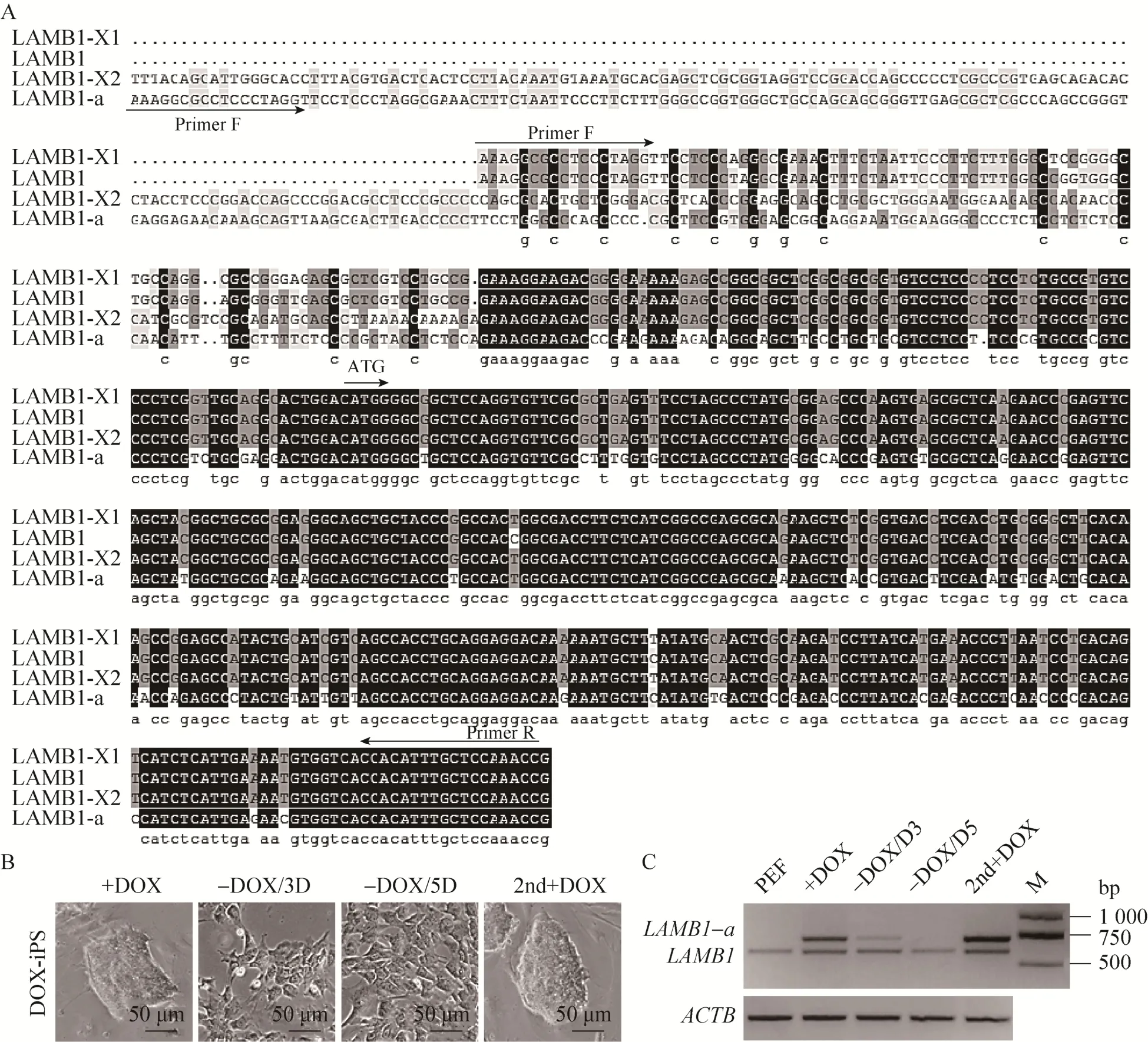
图4 猪LAMB1在多能干细胞中的特异表达分析 (A:LAMB1、LAMB1-a和已经注释的LAMB1-X1 (XM_003130269.4)和LAMB1-X2 (XM_005667736.2) 序列同源分析;B:DOX-iPS细胞图片添加DOX (+DOX, 2nd+DOX) 和撤去DOX 3 d (–DOX/3D)、5 d (–DOX/5D);C:RT-PCR检测LAMB1和LAMB1-a在PEF和猪iPS细胞中的表达)Fig. 4 Specific expression of LAMB1 in porcine pluripotent stem cells. (A) Alignment of DNA sequences of LAMB1 and LAMB1-a with published LAMB1-X1 (XM_003130269.4) and LAMB1-X2 (XM_005667736.2). (B) Images of DOX-iPSCs that were treated with (+DOX, 2nd+DOX) and without DOX in 3-day (–DOX/3D) and 5-day (–DOX/5D).(C) RT-PCR analysis of LAMB1 and LAMB1-a in PEF and piPS cells.
卵母细胞发育过程中,母源 mRNA的积累和编码的蛋白不仅可以支持卵母细胞到胚胎的发育,还在合子基因的激活中发挥重要作用,促使胚胎进一步发育[25-26]。Elis等[25]发现,LAMB1和 LAMC1在小鼠早期胚胎发育阶段就可以检测到,这与猪早期胚胎中LAMB1和LAMC1的表达谱相一致。这些基因随着胚胎的发育表达量逐渐减少,到桑葚胚期出现表达量极低的现象。这些基因表达量的下降可能与合子基因未被激活,母源mRNA的消耗、稀释和降解有关。到囊胚阶段LAMB1、LAMB3、LAMC1和LAMC3表达量再次升高,则说明其可能作为早期的合子激活基因,在随后的胚胎发育中具有重要作用。
Domogatskaya等报道,Laminin-511可以使鼠胚胎干细胞在无饲养层条件下保持不分化状态达169 d以上[27]。此外Rodin等通过将Laminin-511添加到培养基中,培养人ES和人iPS细胞,其多能性维持良好,并呈单层分布生长[16,28]。可见Laminin-511对人和小鼠多能干细胞多能性的维持具有促进作用。然而,在本文发表之前,NCBI等数据库中并没有猪LAMA5基因相关信息,本研究通过分析最新猪基因组序列数据包 (Assembly:Sscrofa11.1),确认了猪LAMA5基因的存在。同时在检测中发现,猪 iPS细胞中也高水平地表达Laminin-511组合,为后续研究猪Laminin-511是否有利于猪多能性的维持提供了基本条件。
本研究在对猪iPS细胞LN表达情况的检测过程中,还发现LAMB1基因在猪多能细胞中出现两条特异性条带,经过对测序结果的分析,认定长度为639 bp的条带是LMAB1的可变剪接体LAMB1-a形式,该剪接体的表达水平与猪iPS细胞的多能性以及重编程程度呈正相关。这一发现在小鼠、人和其他物种中均未见报道,因此,这可能是猪多能干细胞与其他物种多能干细胞的一个重要区别,为猪多能干细胞的研究提供了新的研究方向。
REFERENCES:
[1] Yamanaka S. Induction of pluripotent stem cells from mouse fibroblasts by four transcription factors. Cell Prolif, 2008, 41 Suppl 1: 51–56.
[2] Tsai ZY, Singh S, Yu SL, et al. A feeder-free culture using autogeneic conditioned medium for undifferentiated growth of human embryonic stem cells: comparative expression profiles of mRNAs,microRNAs and proteins among different feeders and conditioned media. BMC Cell Biol, 2010, 11: 76.
[3] Aryantini NPD, Kondoh D, Nishiyama K, et al.Anchorless cell surface proteins function as laminin-binding adhesins in Lactobacillus rhamnosus FSMM22. FEMS Microbiol Lett, 2017,364(6): 42–48.
[4] Wu CC, Li YS, Haga JH, et al. Directional shear flow and Rho activation prevent the endothelial cell apoptosis induced by micropatterned anisotropic geometry. Proc Natl Acad Sci USA,2007, 104(4): 1254–1259.
[5] Hansel MC, Gramignoli R, Blake W, et al. Increased reprogramming of human fetal hepatocytes compared with adult hepatocytes in feeder-free conditions. Cell Transplant, 2014, 23(1): 27–38.
[6] Hu ZX, Li TQ, Zhang XZ, et al. Hepatocyte growth factor enhances the generation of high-purity oligodendrocytes from human embryonic stem cells. Differentiation, 2009, 78(2/3): 177–184.
[7] Ingber DE. Mechanical control of tissue morphogenesis during embryological development.Int J Dev Biol, 2006, 50(2/3): 255–266.
[8] Lee M, Kim Y, Ryu JH, et al. Long-term, feederfree maintenance of human embryonic stem cells by mussel-inspired adhesive heparin and collagen type I. Acta Biomater, 2016, 32: 138–148.
[9] Okita K, Ichisaka T, Yamanaka S. Generation of germline-competent induced pluripotent stem cells.Nature, 2007, 448(7151): 313–317.
[10] Theocharis AD, Skandalis SS, Gialeli C, et al.Extracellular matrix structure. Adv Drug Deliv Rev, 2016, 97: 4–27.
[11] Aumailley M, Bruckner-Tuderman L, CarterWG,et al. A simplified laminin nomenclature. Matrix Biol, 2005, 24(5): 326–332.
[12] Zarinfard G, Tadjalli M, Razavi S, et al. Effect of laminin on neurotrophic factors expression in Schwann-like cells induced from human adiposederived stem cells in vitro. J Mol Neurosci, 2016,60(4): 465–473.
[13] Yamashita K, Hitoi A, Matsuda Y, et al. Structural studies of the carbohydrate moieties of rat kidney γ-glutamyltranspeptidase. An extremely heterogeneous pattern enriched with nonreducing terminal N-acetylglucosamine residues. J Biol Chem, 1983,258(2): 1098–1107.
[14] Vuoristo S, Virtanen I, Takkunen M, et al.Laminin isoforms in human embryonic stem cells:synthesis, receptor usage and growth support. J Cell Mol Med, 2009, 13(8B): 2622–2633.
[15] Camacho A, Núñez N, Dekomien G, et al.LAMA2-related congenital muscular dystrophy complicated by West syndrome. Eur J Paediatr Neurol, 2015, 19(2): 243–247.
[16] Rodin S, Domogatskaya A, Ström S, et al.Long-term self-renewal of human pluripotent stem cells on human recombinant laminin-511. Nat Biotechnol, 2010, 28(6): 611–615.
[17] Miyazaki T, Futaki S, Suemori H, et al. Laminin E8 fragments support efficient adhesion and expansion of dissociated human pluripotent stem cells. Nat Commun, 2012, 3: 1236.
[18] Gao J, DeRouen MC, Chen CH, et al.Laminin-511 is an epithelial message promoting dermal papilla development and function during early hair morphogenesis. Genes Dev, 2008,22(15): 2111–2124.
[19] Rajala K, Hakala H, Panula S, et al. Testing of nine different xeno-free culture media for human embryonic stem cell cultures. Hum Reprod, 2007,22(5): 1231–1238.
[20] Zhang SQ, Guo YJ, Cui Y, et al. Generation of intermediate porcine iPS cells under culture condition favorable for mesenchymal-to-epithelial transition. Stem Cell Rev, 2015, 11(1): 24–38.
[21] Cao SY, Han JY, Wu J, et al. Specific gene-regulation networks during the pre-implantation development of the pig embryo as revealed by deep sequencing. BMC Genomics, 2014, 15: 4.
[22] Duan AQ, Wang N, Yu T, et al. A porcine (Sus scrofa domesticus) somatic cell line of tetracycline operator(TetO)-inducible system for reprogramming.J Agric Biotechnol, 2014, 22(9): 1065–1073 (in Chinese).段安琴, 王宁, 于童, 等. 四环素调控基因(TetO) 诱导重编程的猪体细胞系建立. 农业生物技术学报, 2014, 22(9): 1065–1073.
[23] Cheng D, Guo YJ, Li ZZ, et al. Porcine induced pluripotent stem cells require LIF and maintain their developmental potential in early stage of embryos. PLoS ONE, 2012, 7(12): e51778.
[24] Indyk JA, Chen ZL, Tsirka SE, et al. Laminin chain expression suggests that laminin-10 is a major isoform in the mouse hippocampus and is degraded by the tissue plasminogen activator/plasmin protease cascade during excitotoxic injury.Neuroscience, 2003, 116(2): 359–371.
[25] Elis S, Batellier F, Couty I, et al. Search for the genes involved in oocyte maturation and early embryo development in the hen. BMC Genomics,2008, 9: 110.
[26] Wang H, Luo X, Leighton J. Extracellular matrix and integrins in embryonic stem cell differentiation.Biochem Insights, 2015, 8(Suppl2): 15–21.
[27] Domogatskaya A, Rodin S, Boutaud A, et al.Laminin-511 but not -332, -111, or -411 enables mouse embryonic stem cell self-renewal in vitro.Stem Cells, 2008, 26(11): 2800–2809.
[28] Okumura N, Kakutani K, Numata R, et al.Laminin-511 and -521 enable efficient in vitro expansion of human corneal endothelial cells.Invest Ophthalmol Vis Sci, 2015, 56(5): 2933–2942.
(本文责编 陈宏宇)
Expression of Laminin gene family in porcine pluripotent stem cells
Huan Li, Tong Yu, Yangyang Ma, and Huayan Wang
Shaanxi Center for Stem Cell Engineering and Technology, College of Veterinary Medicine, Northwest A&F University, Yangling 712100,Shaanxi, China
Laminin (LN) proteins are important components of extracellular matrix. These proteins regulate cell proliferation, differentiation, migration, and tissue repair. The LN family has 12 genes that encode 5 α, 4 β, and 3 γ proteins. LamininA5 (LAMA5) as an important gene can support pluripotent cell growth and have been widely studied.However, porcine LAMA5 is absent in all tested porcine genomic databases so far. In this study, we confirmed for the first time the existence of porcine LAMA5 through bioinformatics analysis, and verified this result by cDNA cloning and sequencing. To reveal the expression pattern of Laminin gene family, we detected the expression of Laminin genes in porcine tissues, somatic cells, and porcine induced pluripotent stem cells (piPSCs). The results showed that an alternative splicing variant of Laminin B1 (LAMB1-a) was found exclusively in all tested piPSCs. The expression of this alternative splicing variant is positively correlated with the pluripotent state of piPSCs. The above findings provide evidences and foundations for the father use of LN as extracellular matrix to facilitate the derivation and culture of porcine pluripotent stem cells.
porcine pluripotent stem cells, Laminin, LAMA5, expression pattern
March 12, 2017; Accepted: June 12, 2017
HuayanWang. Tel: +86-29-87080069; E-mail: hhwang101@163.com
Supported by: National Natural Science Foundation of China (Nos. 31571521, 31371505).
国家自然科学基金(Nos. 31571521, 31371505) 资助。
