猪繁殖与呼吸综合征病毒nsp4抗体制备与鉴定
2017-09-03蔡鑫娜谭敏曹胜亮黄艳孙法超商营利刘思当肖一红
蔡鑫娜,谭敏,曹胜亮,黄艳,孙法超,商营利,刘思当,肖一红
山东农业大学 动物医学院/动物科技学院,山东 泰安 271000
猪繁殖与呼吸综合征病毒nsp4抗体制备与鉴定
蔡鑫娜,谭敏,曹胜亮,黄艳,孙法超,商营利,刘思当,肖一红
山东农业大学 动物医学院/动物科技学院,山东 泰安 271000
蔡鑫娜, 谭敏, 曹胜亮, 等. 猪繁殖与呼吸综合征病毒nsp4抗体制备与鉴定. 生物工程学报, 2017, 33(8): 1276–1283.
Cai XN, Tan M, Cao SL, et al. Preparation and identification of polyclonal antibodies specific for nsp4 protein of porcine reproductive and respiratory syndrome virus. Chin J Biotech, 2017, 33(8): 1276–1283.
为了获得猪繁殖与呼吸综合征病毒 (PRRSV) nsp4的抗体,根据HP-PRRSV TA-12株 (GenBank Accession No. HQ416720) 的nsp4基因序列,设计并合成一对引物。用RT-PCR扩增后克隆到原核表达载体pET-28a(+) 中,构建重组质粒pET28a-nsp4,转化至Trasseta(DE3),经IPTG诱导重组蛋白获得了高效可溶性表达,大小约为26 kDa。经镍离子亲和柱 (Ni+-NTA) 纯化获得了高纯度重组蛋白,将纯化的nsp4蛋白免疫新西兰大白兔制备了多克隆抗体。ELISA检测抗体效价可达106,Western blotting和IFA检测结果表明所制备的多克隆抗体具有良好的免疫反应特异性,能够识别PRRSV感染宿主细胞中的nsp4蛋白。本研究成功制备了针对nsp4的多克隆抗体,为进一步研究nsp4的功能及PRRSV致病机制奠定了基础。
猪繁殖与呼吸综合症病毒,nsp4,多克隆抗体,鉴定
猪繁殖与呼吸综合征 (Porcine reproductive and respiratory syndrome,PRRS) 是由 PRRS病毒 (PRRSV) 引起的一种急性传染病。该病以母猪繁殖障碍、各年龄段猪呼吸系统障碍等为主要特征。该病1987年在美国首次报道[1],随后迅速在北美洲和欧洲蔓延[2],我国于1996年由郭宝清等首次从疑似PRRS病例中分离到PRRSV,从而证实了本病在我国的存在[3]。2006年6月我国江西等地出现了高致病性猪繁殖与呼吸综合征(Highly pathogenic PRRS,HP-PRRS)[4-6],感染猪临床特征表现为持续高热、精神萎靡、食欲废绝、呼吸困难、腹部皮肤发绀、耳朵变蓝、眼睑水肿等症状。各日龄猪表现出高发病率(50%-100%) 和高死亡率 (20%-100%)。之后我国其他多个省份也相继出现该病。造成300多万头猪发病,死亡猪只达到50多万头,严重影响我国养猪产业的经济效益[7-8]。2008年底我国农业部将HP-PRRS列为一类动物疫病[9]。
PRRSV属于动脉炎病毒科动脉炎病毒属。PRRSV基因组为单股、正链RNA,长约15 kb,共含有9个相互重叠的开放读码框 (Open reading frame,ORF)[10],即 ORF1 (ORF1a 和 ORF1b)、ORF2 (ORF2a和 ORF2b)、ORF3、ORF4、ORF5(ORF5a)、ORF6和 ORF7[11-13]。PRRSV基因组编码7个结构蛋白和14个非结构蛋白 (nsp)。其中,nsp4由ORF1a编码,是具有两种酶活性的丝氨酸蛋白酶,可以切割前体多聚蛋白 pp1a和pp1ab裂解产生多个非构蛋白 (nsp3-12),这些非结构蛋白在PRRSV病毒复制与增殖过程中起着决定性的作用[14-16]。因此,nsp4在PRRSV感染过程中起着决定性的作用,但具体作用机制尚不明确。为了研究nsp4的生物学功能及其在PRRSV感染过程中的作用机制,本研究制备了高效价的抗nsp4的抗体。
1 材料与方法
1.1 毒株、菌株与载体
HP-PRRSV TA12株 (GenBank Accession No.HQ416720)、PRRSV 疫苗株 CH-1R、非洲绿猴肾细胞Marc-145细胞、pET-28a(+) 原核表达载体均由山东农业大学临床病理实验室保存,克隆大肠杆菌DH5α感受态细胞、表达菌株Trasseta(DE3) 感受态均购于TranGen Biotech公司。
1.2 主要试剂
T4 DNA连接酶、预染蛋白分子量标准均购于Thermo公司;限制性内切酶NheⅠ和XhoⅠ、Trans2K Plus DNA 分子量标准均购自大连TaKaRa公司;高纯度质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒、抗His鼠单克隆抗体均购于康为世纪生物科技公司;卡那霉素 (Kan+)、氨苄青霉素 (Amp+) 均购自索莱宝公司;增强型HRP-DAB底物显色试剂盒购自北京Tiangen公司;Clarity Max™ Western ECL Substrate购于Bio-Rad公司;HRP标记的羊抗鼠IgG (H+L) 抗体购于Beyotime公司;Cy3标记的羊抗兔IgG抗体及 FITC标记的羊抗猪 IgG抗体购自Jackson公司;弗氏完全佐剂、弗氏不完全佐剂购自美国 Sigma公司;硝酸纤维素膜 (PVDF)购自美国Millipore公司;Ni+-NTA 镍离子亲和层析介质购自南京金斯瑞生物科技有限公司。
1.3 引物的设计与合成
根据GenBank发表的HP-PRRSV TA12株全基因组序列 (Accession No. HQ417620),设计并合成了一对用于扩增nsp4基因片段的引物。在上游引物中引入了NheⅠ酶切位点,在下游引物中引入了XhoⅠ酶切位点,上、下游引物间距离为612 bp。上游引物序列:5′-CCCGCTAGCG GTGCTTTCAGAACTCA-3′;下游引物序列:5′-CCCTCGAGTTCCAGTTCGGGTTTGGC-3′。引物由生工生物工程 (上海) 股份有限公司合成。
1.4 病毒RNA提取及RT-PCR
取出感染HP-PRRSV TA-12株的Marc-145细胞病毒液加入 TRIzol试剂,充分混匀后,按照说明书提取RNA。反转录体系为20 μL,包括:5×反转录酶缓冲液 2 μL、0.01 mol/L dNTPs 4 μL、RNA 酶抑制剂 1 μL、Oligo(dT)18 primer 1 μL、AMV 反转录酶 1 μL、RNase-free dH2O 1 μL、模板 RNA 10 μL;反应条件:42 ℃ 60 min,70 ℃5 min。PCR反应体系为 50 μL:上下游引物各1 μL,TaKaRa Premix Taq DNA 聚合酶 25 μL,cDNA 2 μL,补 ddH2O水至 50 μL。反应条件:94 ℃ 5 min ;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 45 s,共31个循环;72 ℃延伸10 min,4 ℃终止。PCR产物经胶回收试剂盒回收、纯化。
1.5 重组表达质粒的构建
将pET-28a(+) 原核表达载体与nsp4扩增片段分别利用NheⅠ和XhoⅠ进行双酶切、胶回收纯化、连接、转化至DH5α感受态细胞。用Kan+筛选重组转化子,挑取单个菌落接种于5 mL含Kan+抗性LB培养基中,37 ℃摇菌5 h,对菌液进行PCR鉴定,将菌落PCR鉴定为阳性的菌株扩大培养后提取重组质粒,并对质粒进行NheⅠ和XhoⅠ双酶切鉴定,酶切鉴定正确的质粒送至生工生物工程 (上海) 股份有限公司测序。测序成功的阳性重组质粒命名为pET28a-nsp4。
1.6 重组蛋白表达、纯化及SDS-PAGE分析
重组表达质粒 pET28a-nsp4转化至表达菌Trasseta(DE3) 感受态细胞,然后涂布于含Kan+抗性的LB平板,37 ℃培养过夜,挑取单菌落于LB培养基中活化过夜,按1%比例转接到新鲜含有 Kan+抗性的 LB培养基中培养至 OD600约为0.6时,加入终浓度为1 mmol/L的IPTG,诱导5 h。4 ℃、10 000 r/min离心5 min收集菌体,将收集的菌体经超声破碎后进行SDS-PAGE鉴定。参照金斯瑞 Ni+-NTA亲和层析介质说明书进行蛋白纯化。
1.7 Western blotting鉴定结果
将纯化的nsp4蛋白进行SDS-PAGE并转印至PVDF膜上,以1∶2 000稀释抗His标签鼠单克隆抗体为一抗,再加入1∶3 000稀释的HRP标记的羊抗鼠IgG抗体为二抗,利用Bio-Rad公司ECL发光试剂盒或DAB试剂盒进行显色。
1.8 nsp4蛋白多抗血清的制备
将纯化的nsp4蛋白按照1∶1体积比与弗氏完全佐剂混合,充分乳化后,背部皮下多点注射新西兰大白兔3 只,剂量为1 mg/只。以后每隔3周用纯化的蛋白与弗氏不完全佐剂1∶1混合、乳化进行2次加强免疫,免疫剂量均为1 mg/只。3次免疫之前新西兰大白兔均通过耳缘静脉采血,4 ℃离心分离血清,–80 ℃保存备用。
1.9 ELISA效价的测定
采用间接ELISA方法测定抗体效价,免疫前兔血清作阴性对照。用纯化的nsp4蛋白包被抗原200 ng/孔,4 ℃过夜、封闭,免疫兔血清经1∶102-1∶108稀释后按 100 μL/孔加入,37 ℃孵育1 h,再加入1∶3 000稀释的HRP标记的羊抗兔 IgG 100 μL,37 ℃孵育 1 h。利用 3 mol/L H2SO4终止反应后,使用酶标仪在OD450处读取吸光值。
1.10 多抗血清特异性检测
1.10.1 Western blotting分析
将 HP-PRRSV、经典 PRRSV 分别感染Marc-145细胞,以未接毒的细胞作为阴性对照,24 h后收集细胞裂解液经 SDS-PAGE分离后转入PVDF膜上,加入1∶200稀释的制备的兔多克隆抗体,加入1∶2 000稀释的HRP标记的羊抗兔IgG抗体为二抗,DAB显色。
1.10.2 IFA
将Marc-145细胞以 105个/cm2的密度铺 96孔板。待细胞长成单层时进行接毒,培养 24 h后用4%多聚甲醛固定,1% trixon-100透化,以1∶200、1∶600、1∶800 稀释兔多抗血清后 37 ℃孵育1 h,分别加入Cy3标记的羊抗兔、FITC标记的羊抗猪二抗避光37 ℃作用1 h,荧光显微镜和共聚焦显微镜下观察结果。
2 结果与分析
2.1 目的基因的获取
以提取的HP-PRRSV TA-12毒株总RNA为模板,反转录合成cDNA,经PCR特异性扩增得到大小约612 bp的片段,与预期目的片段大小相符 (图1)。
2.2 表达载体的构建与鉴定
构建的重组质粒经NheⅠ、XhoⅠ双酶切鉴定,1%琼脂糖电泳分析,得到两个片段分别为5 400 bp和612 bp,与预期大小相同 (图2);测序结果分析与原序列核甘酸同源性为100% (结果未展示),表明重组质粒pET28a-nsp4构建成功。

图1 HP-PRRSV TA-12株nsp4的扩增Fig. 1 Amplification of PRRSV nsp4 gene by PCR. M:DNA marker 5000; 1: PCR product of the nsp4 gene;2: negative control.

图2 重组质粒pET28a-nsp4酶切鉴定结果Fig. 2 Identification of the recombinant plasmid pET28ansp4. M: DNA marker 5000; 1: undigested pET28ansp4; 2: pET28a-nsp4 digested by NheⅠand XhoⅠ.
2.3 nsp4重组蛋白的表达
将诱导表达的细菌裂解液用12% SDS-PAGE胶分离,考马斯亮蓝染色后结果显示重组表达质粒pET28a-nsp4在Trasseta(DE3) 中获得了高效表达,得到了大小约为26 kDa的可溶性重组蛋白 (图 3)。
2.4 nsp4的纯化
将诱导后的菌体超声破碎后收集上清,按照镍离子亲和柱 (Ni+-NTA) 说明书进行蛋白纯化,得到纯度较高的可溶性重组蛋白 (图4)。
2.5 重组蛋白nsp4抗血清的ELISA效价测定
采用间接ELISA方法测定抗体效价,将纯化的nsp4蛋白包被抗原,以自制的兔血清为一抗,HRP标记的羊抗兔抗体为二抗。酶标仪读数表明第3次免疫后的兔血清效价可达到106(图5)。

图3 SDS-PAGE分析nsp4在Trasseta(DE3) 表达Fig. 3 SDS-PAGE analysis of recombinant nsp4 expressed in Trasseta (DE3). M: protein marker; 1: the whole bacteria of pET-28a(+)transformed Trasseta(DE3) before induction; 2: the whole bacterium of pET-28a(+) transformed Trasseta (DE3) after induction;3: the whole bacterium of pET28a-nsp4 transformed Trasseta (DE3) before induction; 4: the whole bacterium of pET28a-nsp4 after induction; 5: supernatant of pET28a-nsp4 after induction; 6: precipitation of pET28a-nsp4 after induction; 7: Western blotting analysis of the recombinant nsp4 protein after induction; 8: Western blotting analysis of the whole bacteria of pET-28a(+) after induction.
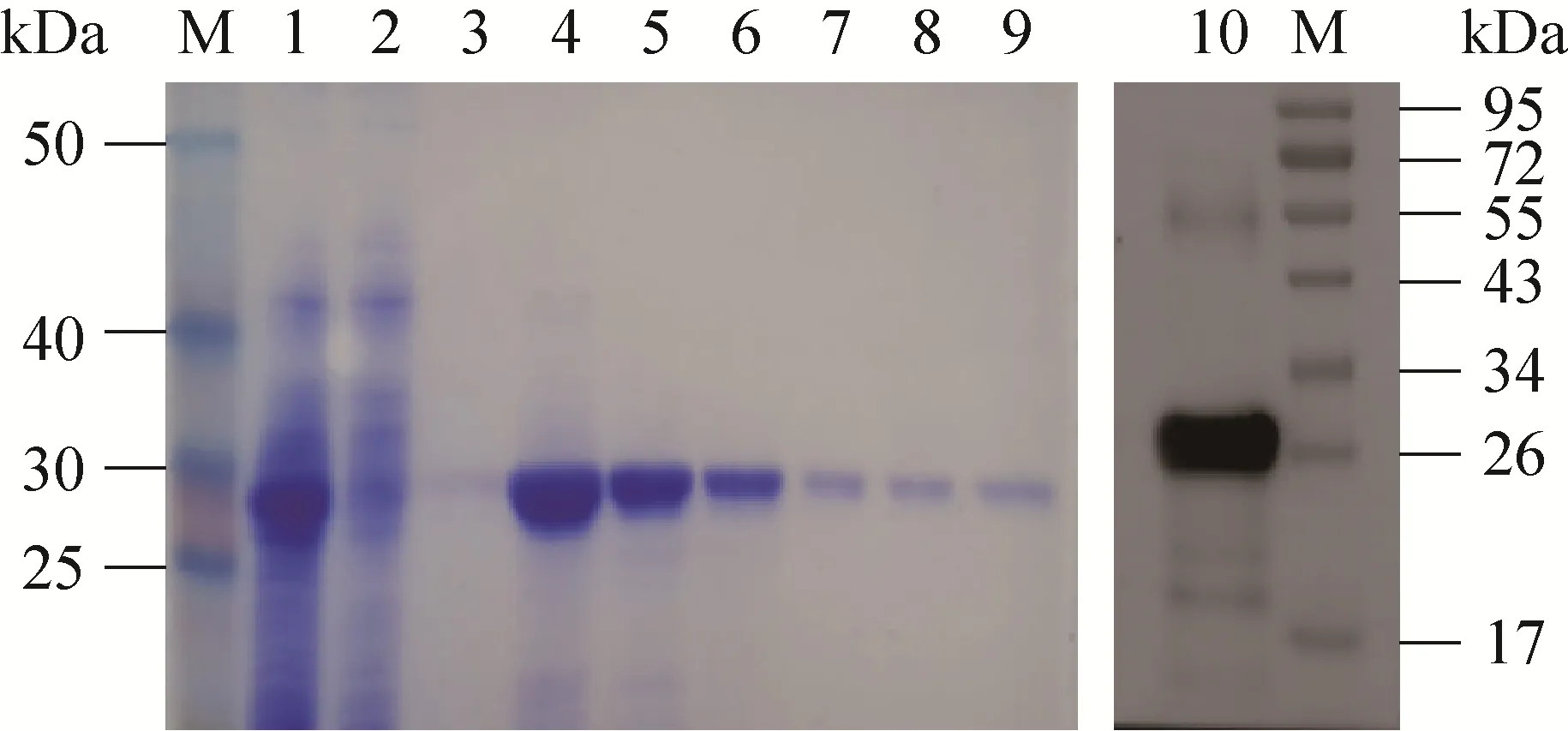
图4 nsp4纯化产物SDS-PAGE及Western blotting鉴定Fig. 4 SDS-PAGE and Western blotting analysis of the recombinant protein. M: protein marker; 1: supernatant before purification; 2: supernatant after purification;3: wash buffer; 4–9: the purified recombinant nsp4 protein 3.1 mg/mL, 2.3 mg/mL, 0.8 mg/mL, 0.5 mg/mL,0.35 mg/mL, and 0.21 mg/mL; 10: Western blotting analysis of the recombinant nsp4 protein.

图5 用间接ELISA检测兔抗nsp4抗体滴度Fig. 5 Titration of the rabbit anti-nsp4 sera by ELISA.
2.6 多抗血清特异性检测
2.6.1 Western blotting鉴定结果
用制备的 nsp4兔多克隆抗体分别与HP-PRRSV、经典PRRSV感染后的Marc-145细胞裂解物进行反应。结果显示,HP-PRRSV和经典PRRSV自身产生的nsp4蛋白均在25 kDa处出现特异性反应条带,而未感染PRRSV的细胞在相应位置没有出现条带 (图6)。
2.6.2 IFA结果
为进一步验证所制备抗体的特异性,对感染HP-PRRSV和经典PRRSV后的Marc-145细胞进行了IFA检测,荧光显微镜观察结果显示,制备的抗体在1∶800稀释时均能够检测到较强的荧光信号 (图7)。共聚焦观察结果表明,nsp4位于细胞浆中,而用PRRSV阳性血清检测的病毒成分则分布于细胞浆和细胞核 (图8)。
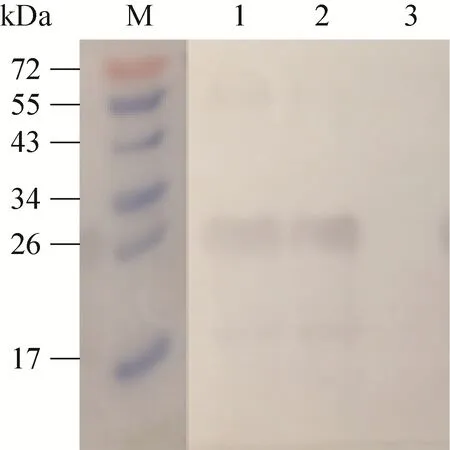
图6 用Western blotting鉴定兔抗nsp4血清特异性Fig. 6 Identification of the rabbit anti-nsp4 sera by Western blotting. M: protein marker; 1: TA-12-infected Marc-145 cell lysates; 2: CH-1R-infected Marc-145 cell;3: uninfected Marc-145 cell lysates.

图7 用IFA鉴定兔抗nsp4抗血清(200×)Fig. 7 Identification of the rabbit anti-nsp4 sera by IFA(200×).
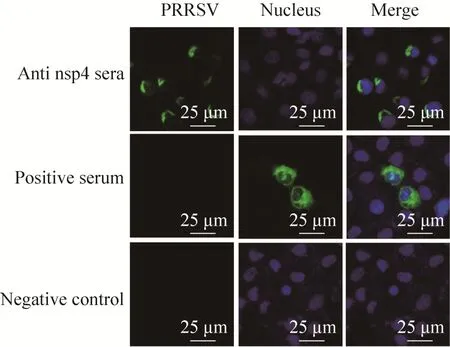
图8 用共聚焦显微镜观察nsp4的亚细胞定位(630×)Fig. 8 Localization of the nsp4 protein in the PRRSV-infected cellsby confocal microscopy(630×).
3 讨论
PRRSV感染机体后,在nsp4的作用下,可产生多个非结构蛋白,在这些非结构蛋白中,nsp1、nsp2、nsp4和nsp7包含有B细胞表位,并且能刺激机体产生抗体[17-22]。其中 nsp2和nsp7可以作为PRRSV不同分离株鉴别诊断的方法。nsp4也包含B细胞表位,在 PRRSV感染的早期也能检测到抗nsp4的抗体,说明nsp4具有较强的抗原性[23-27]。本研究中利用原核表达系统成功表达纯化了nsp4蛋白,通过对表达条件的优化,获得了可溶性表达。可溶性表达的蛋白更加接近天然构象,保留原有的线性表位和构象表位,诱导产生的抗体水平较高,特异性较强。将nsp4免疫新西兰大白兔,经3次免疫后获得的抗 nsp4抗体的效价能达到 106。并且该抗体可应用于IFA、Western blotting等常规实验,具有较高的特异性和敏感性。
通过用制备的抗 nsp4抗体对感染的 HPPRRSV的 Marc-145分析发现,nsp4位于细胞浆中,这与已报道的nsp4可在细胞核中检测到不同[28]。其原因可能为nsp4的表达方法不同,我们的研究中是PRRSV感染的细胞,而已报道的是将nsp4基因克隆入带有GFP标签的真核表达载体中进行表达,GFP可在胞浆、胞核中均能检测到,因此nsp4在胞核中检测到可能是GFP引导而导致的入核。
nsp4具有复杂和重要的生物学功能,除了包含有 B细胞表位,可刺激机体产生高效价抗体外,还可以作为蛋白酶裂解多聚蛋白产生多个非结构蛋白,以及通过干扰 NF-κB通路而抑制IFN-β产生而抑制机体的先天性免疫反应[29-30]。但对于nsp4在PRRSV感染过程中的具体作用未知。DNAStar对来自不同毒力的nsp4氨基酸序列分析发现,其同源性达到 97.5%。Western blotting和IFA结果也证明,制备的抗体与经典PRRSV的 nsp4也可以反应,扩大了其应用范围,为进一步揭示nsp4功能的研究提供了重要平台。
REFERENCES:
[1] Paton DJ, Brown IH, Edwards S, et al. ‘Blue ear’disease of pigs. Vet Rec, 1991, 128(26): 617.
[2] Wensvoort G, Terpstra C, Pol JMA, et al. Mystery swine disease in the Netherlands: the isolation of Lelystad virus. Vet Q, 1991, 13(3): 121–130.
[3] Guo BQ, Chen ZS, Liu WX, et al. Study on isolation of PRRSV from aborted fetuses suspected of PRRS.Chin J Prev Vet Med, 1996, (2): 1–5 (in Chinese).郭宝清, 陈章水, 刘文兴, 等. 从疑似PRRS流产胎儿分离 PRRSV的研究. 中国畜禽传染病,1996, (2): 1–5.
[4] Tong GZ, Zhou YJ, Hao XF, et al. Highly pathogenic porcine reproductive and respiratory syndrome,China. Emerg Infect Dis, 2007, 13(9): 1434–1436.
[5] Tian KG, Yu XL, Zhao TZ, et al. Emergence of fatal PRRSV variants: unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark. PLoS ONE, 2007, 2(6): e526.
[6] Li YF, Wang XL, Bo KT, et al. Emergence of a highly pathogenic porcine reproductive and respiratory syndrome virus in the Mid-Eastern region of China. Vet J, 2007, 174(3): 577–584.
[7] An TQ, Tian ZJ, Xiao Y, et al. Origin of highly pathogenic porcine reproductive and respiratory syndrome virus, China. Emerg Infect Dis, 2010,16(2): 365–367.
[8] Jiang YF, Zhou YJ, Tian ZJ, et al. Identification of aspecific epitope on nonstructural protein 2 of an attenuated strain of highly pathogenic porcine reproductive and respiratory syndrome virus. Chin J Anim Infect Dis, 2009, 17(3): 1–7 (in Chinese).姜一峰, 周艳君, 田志军, 等. 高致病性猪繁殖与呼吸综合征病毒 HuN4株致弱毒株特异性抗原表位的鉴定. 中国动物传染病学报, 2009, 17(3): 1–7.
[9] Hao XF, Zhou YJ, Tian ZJ, et al. Development of a RT-PCR method for differentiation of the highly pathogenic PRRSVs and the classical PRRSVs. Chin J Prev Vet Med, 2007, 29(9): 704–709 (in Chinese).郝晓芳, 周艳君, 田志军, 等. 高致病性猪繁殖与呼吸综合征病毒 RT-PCR鉴别诊断方法的建立. 中国预防兽医学报, 2007, 29(9): 704–709.
[10] Dea S, Gagnon CA, Mardassi H, et al. Antigenic variability among North American and European strains of porcine reproductive and respiratory syndrome virus as defined by monoclonal antibodies to the matrix protein. J Clin Microbiol,1996, 34(6): 1488–1493.
[11] Dea S, Gagnon CH, Pirzadeh B, et al. Current knowledge on the structural proteins of porcine reproductive and respiratory syndrome (PRRS) virus:comparison of the North American and European isolates. Arch Virol, 2000, 145(4): 659–688.
[12] Wu WH, Fang Y, Farwell R, et al. A 10-kDa structural protein of porcine reproductive and respiratory syndrome virus encoded by ORF2b.Virology, 2001, 287(1): 183–191.
[13] Allende R, Lewis TL, Lu Z, et al. North American and European porcine reproductive and respiratorysyndrome viruses differ in non-structural protein coding regions. J Gen Virol, 1999, 80(2): 307–315.
[14] Snijder EJ, Meulenberg JJ. The molecular biology of arteriviruses. J Gen Virol, 1998, 79(5): 961–979.
[15] Snijder EJ, Wassenaar AL, van Dinten LC, et al.The arterivirus nsp4 protease is the prototype of a novel group of chymotrypsin-like enzymes, the 3C-like serine proteases. J Biol Chem, 1996,271(9): 4864–4871.
[16] van Dinten LC, Rensen S, Gorbalenya AE, et al.Proteolytic processing of the open reading frame 1b-encoded part of arterivirus replicase is mediated by nsp4 serine protease and is essential for virus replication. J Virol, 1999, 73(3): 2027–2037.
[17] Wassenaar AL, Spaan WJ, Gorbalenya AE, et al.Alternative proteolytic processing of the arterivirus replicase ORF1a poly protein: evidence that NSP2 acts as a cofactor for the nsp4 serine protease. J Virol, 1997, 71(12): 9313–9322.
[18] Xu AT, Zhou YJ, Li GX, et al. Characterization of the biochemical properties and identification of amino acids forming the catalytic center of 3C-like proteinase of porcine reproductive and respiratory syndrome virus. Biotechnol Lett, 2010, 32(12):1905–1910.
[19] Snijder EJ, Wassenaar ALM, Spaan WJM.Proteolytic processing of the N-terminal region of the equine arteritis virus replicase. Adv Exp Med Biol, 1993, 342: 227–232.
[20] Snijder EJ, Wassenaar AL, Spaan WJ. Proteolytic processing of the replicase ORF1a protein of equine arteritis virus. J Virol, 1994, 68(9): 5755–5764.
[21] Van Dinten LC, Wassenaar AL, Gorbalenya AE, et al. Processing of the equine arteritis virus replicase ORF1b protein: identification of cleavage products containing the putative viral polymerase and helicase domains. J Virol, 1996, 70(10): 6625–6633.
[22] Yuan SZ, Zhang N, Xu L, et al. Induction of apoptosis by the nonstructural protein 4 and 10 of porcine reproductive and respiratory syndrome virus. PLoS ONE, 2016, 11(6): e0156518.
[23] Mardassi H, Mounir S, Dea S, et al. Structural gene analysis of a Quebec reference strain of porcine reproductive and respiratory syndrome virus(PRRSV). Adv Exp Med Biol, 1995, 380: 277–281.
[24] Dokland T. The structural biology of PRRSV. Virus Res, 2010, 154(1/2): 86–97.
[25] Ma ZT, Wang YL, Zhao HY, et al. Porcine reproductive and respiratory syndrome virus nonstructural protein 4 induces apoptosis dependent on its 3C-like serine protease activity. PLoS ONE,2013, 8(7): e69387.
[26] Huang C, Du YP, Yu ZB, et al. Highly Pathogenic porcine reproductive and respiratory syndrome virus Nsp4 cleaves VISA to impair antiviral responses mediated by RIG-I-like receptors. Sci Rep, 2016, 6: 28497.
[27] Zhang LL, Liu J, Bai J, et al. Poly (I:C) inhibits porcine reproductive and respiratory syndrome virus replication in MARC-145 cells via activation of IFIT3. Antiviral Res, 2013, 99(3): 197–206.
[28] Liu HL, Fang Y. Nuclear localization of porcine reproductive and respiratory syndrome virus nonstructural protein 4. J Nanjing Agric Univ,2011, 34(4): 89–94 (in Chinese).刘惠莉, 方莹. 猪繁殖与呼吸综合征病毒非结构蛋白 nsp4细胞核定位研究. 南京农业大学学报,2011, 34(4): 89–94.
[29] Zhang LJ, Li JN, Hu L, et al. PRRSV nsp4 inhibits type I interferon production by cleaving NF-κB essential modulator. Chin J Prev Vet Med, 2014,36(3): 169–173 (in Chinese).张利杰, 李江南, 胡亮, 等. 猪繁殖与呼吸综合征病毒NSP4切割天然免疫分子NEMO抑制I型干扰素的产生. 中国预防兽医学报, 2014, 36(3):169–173.
[30] Li CY, Wang SN, Li JN, et al. The inhibition of the interferon-β expression by porcine reproductive and respiratory syndrome virus NSP4 via cleaving IKKα. Chin J Prev Vet Med, 2016, 38(6): 425–428(in Chinese).李长尧, 王胜男, 李江南, 等. 猪繁殖与呼吸综合征病毒NSP4切割IKKα抑制β干扰素产生的研究. 中国预防兽医学报, 2016, 38(6): 425–428.
(本文责编 陈宏宇)
Preparation and identification of polyclonal antibodies specific for nsp4 protein of porcine reproductive and respiratory syndrome virus
Xinna Cai, Min Tan, Shengliang Cao, Yan Huang, Fachao Sun, Yingli Shang,Sidang Liu, and Yihong Xiao
College of Veterinary Medicine and Animal Sciences, Shandong Agricultural University, Tai’an 271000, Shandong, China
To obtain specific antibodies against nsp4 protein of porcine reproductive and respiratory syndrome virus(PRRSV), nsp4 gene was amplified by RT-PCR and cloned into pET-28a(+) vector, designated pET28a-nsp4. pET28a-nsp4was transformed into Escherichia coli Trasseta (DE3) cells and expressed after induction of IPTG. SDS-PAGE analysis showed that the recombinant protein was expressed in soluble form with the molecular weight of 26 kDa. The soluble fusion protein in the supernatant was purified using Ni+-NTA affinity chromatography. New Zealand rabbits were immunized by the purified nsp4 and anti-sera against nsp4 were obtained. The titer of polyclonal antibodies was about 106and showed good specificity and sensitivity in the immunofluorescence assay and Western blotting analysis. The polyclonal antibodies also recognized native nsp4 form PRRSV infected Marc-145 cells, providing a useful tool in PRRSV replication mechanism study.
porcine reproductive and respiratory syndrome virus, nsp4, polyclonal antibody, identification
March 25, 2017; Accepted: June 14, 2017
Yihong Xiao. Tel: +86-538-8242478; Fax: +86-538-8241419; E-mail: xiaoyihong01@163.com
Supported by: Natural Science Foundation of Shandong Province (No. ZR2014CM024), Funds of Shandong “Double Tops”.
山东省自然科学基金 (No. ZR2014CM024),山东省“双一流”奖补基金资助。
