盐碱胁迫对香樟幼苗根际土壤酶活性的影响①
2017-09-03颜路明郭祥泉
颜路明,郭祥泉
盐碱胁迫对香樟幼苗根际土壤酶活性的影响①
颜路明1,郭祥泉2
(1 闽江学院美术学院环境艺术教研室,福州 350108;2 三明市林业局,福建三明 365000)
以2年生盆栽香樟幼苗为材料,分别施用0、50、100、200 mmol/L的Na2CO3和NaHCO3(1︰1)混合溶液,研究盐碱胁迫对香樟幼苗根际土壤酶活性的影响。结果表明:随着盐碱胁迫时间的延长,各处理土壤pH不断上升,且随盐碱处理浓度越高,pH越大;对照的脲酶活性呈不断上升的趋势,盐碱胁迫处理的脲酶活性呈先升后降的趋势,盐碱处理浓度越高,土壤脲酶活性越小;过氧化氢酶活性呈不断上升的趋势,盐碱处理浓度越高,过氧化氢酶活性越大;土壤蔗糖酶活性呈先升后降的趋势,盐碱处理浓度越高,土壤蔗糖酶活性越小;轻度(0 ~ 50 mmol/L)盐碱胁迫程度促进碱性磷酸酶活性,而重度盐碱(50 ~ 200 mmol/L)胁迫抑制碱性磷酸酶活性;0 mmol/L处理的蛋白酶活性不断上升,而盐碱胁迫抑制蛋白酶活性。盐碱胁迫影响了土壤中有效养分的转化。
盐碱胁迫;香樟幼苗;土壤酶活性
香樟((L.) presl.)又名樟、芳樟,是亚热带常绿阔叶植物,世界著名的五大树种之一,在中国的主要产地为南方及西南各省区。具有固土防沙、美化环境、抗虫蛀和较强的吸烟滞尘的能力,树姿优美、形态自然,在城市绿化中可作为行道树、庭荫树和孤植树种。近年来,香樟在我国北方地区城市绿化中的应用面积越来越大,而部分地区城区土壤有机质含量低,营养缺乏,pH在8.4 ~ 9.0之间,土壤环境不利于香樟的正常生长发育[1]。盐碱胁迫降低了香樟叶片的光合色素含量和光合速率[2],影响香樟对养分离子的吸收与分配[3],影响香樟的正常生长发育[4]。香樟根系生长受到抑制,根系活力下降,对N、Fe等营养元素的吸收和利用受到影响[5]。马白菡等[6]认为土壤(母质)的pH在7.2 ~ 8.3时,香樟发生不同程度的黄化,黄化的速度随pH的升高而加快。随环境pH的升高,土壤中Zn、Fe、Mn等元素的有效性降低,植物对N的吸收下降[7]。
土壤酶主要来源于土壤微生物和根系分泌物,包括存在于活细胞中的胞内酶和存在于土壤溶液或吸附在土壤颗粒表面的胞外酶,能驱动土壤中几乎所有的生物化学反应,直接参与土壤中物质的转化、养分释放和固定过程,与土壤肥力状况密切相关[8-10],因而常作为评价土壤生物活性和土壤肥力的重要指标。土壤酶活性对植物生长发育和产量影响较大,杨槐混交林的生长与土壤脲酶、蛋白酶、转化酶和碱性磷酸酶活性呈显著或极显著正相关[11]。杨丽娟等[12]发现,菜园地的土壤中性磷酸酶、过氧化氢酶、转化酶和脲酶活性也与黄瓜产量呈显著或极显著正相关。除种植模式[13]、植物类型[14]、土壤养分[15]和土壤生物[16-17]等因素外,土壤pH与土壤酶活性之间存在着显著的相关性[18-19],它直接影响着土壤酶参与生化反应的速度,有些酶促反应只能在较窄的pH范围内进行,当pH超过其最适范围,就会对酶活性产生抑制作用[20]。王涵等[18]的研究也表明,土壤脲酶、过氧化氢酶、酸性磷酸酶、碱性磷酸酶、脱氢酶、多酚氧化酶和蛋白酶活性大致呈现酸化抑制、碱化激活的规律。毛志刚等[21]的研究表明,土壤pH的升高不利于土壤酶活性的增加。香樟作为土壤酸碱度敏感型植物,土壤酶活性对香樟根区养分的有效性非常重要,研究盐碱胁迫对香樟根际土壤酶活性的影响,能为进一步探索香樟根系对盐碱土壤环境的响应机理提供依据。
1 材料与方法
1.1 试验材料
试验材料选自园林苗木基地生长正常的二年生盆栽香樟幼苗,苗高25 ~ 30 cm。试验材料共60株,分4个处理,每处理15株,每盆种植一株,盆中栽培基质为草炭土︰田园土=3︰1,土重5.2 kg,pH 6.17,有机质38.4 g/kg。2016年3月10日移入盆中进行培养两个月,幼苗均生长正常,自2016年5月10日开始,每隔6 d,以清水(pH = 7.43) 为对照,按Na2CO3︰NaHCO3=1︰1的比例分别喷施50、100、200 mmol/L的苏打盐碱混合溶液各1000 ml,pH分别为8.55、9.38、9.56,分别代号CK、T1、T2、T3。每次施入混合溶液前,各处理随机选3盆进行土壤酶活性和pH测定,即分别于第7、14、21、28、35天检测幼苗根际土壤pH、脲酶、过氧化氢酶、蔗糖酶、碱性磷酸酶、蛋白酶活性,3次重复,以 3 次测定结果的平均值为测定值,所有数据都通过测定各自的土壤含水量换算为每克烘干土的含量。
1.2 试验方法
测定时,去除表层5 cm土层,取5 ~ 20 cm深度距根部2 cm以内的根区土壤样品,风干,去除石块和动植物残体,土样过60目筛,保存于4℃冰箱中,用于土壤pH和土壤酶活性的测定。土壤pH按土︰水= 1︰5的比例采用pH计(梅特勒FE20K)测定,土壤脲酶活性采用靛酚蓝比色法测定,结果以24 h后1 g土壤中NH3-N的mg数表示[22]。土壤碱性磷酸酶活性采用磷酸苯二钠比色法测定,结果以24 h后每g土壤的P2O5的mg数表示[22]。土壤蔗糖酶活性采用3, 5-二硝基水杨酸比色法测定,以24 h后1 g土壤葡萄糖的mg数表示[22]。土壤蛋白酶采用茚三酮比色法,结果以24 h后1 g土壤中氨基氮的mg数表示[22]。土壤过氧化氢酶活性采用紫外分光光度法测定,结果用每60 min内每g土壤分解的过氧化氢的mg数表示[23]。
1.3 数据处理与统计
采用Microsoft Excel 2016 软件对数据进行处理,用SPSS 21.0 统计软件进行方差分析、多重比较( LSD 法)。
2 结果与分析
2.1 盐碱胁迫对香樟幼苗根际土壤pH的影响
由表1可以看出,随着处理时间的延长,各处理根际土壤的pH 呈上升趋势。并且随着苏打盐碱处理浓度的增加,pH 逐渐上升,培养到第21天之前,各处理间差异明显,而培养21 d后,苏打盐碱处理的香樟幼苗根际土壤的pH 差异不明显,但均高于对照。
2.2 盐碱胁迫对香樟幼苗根际土壤脲酶活性的影响
由表2可以看出,随着处理时间的延长,对照的脲酶活性呈不断上升的趋势,最高为6.68 mg/(g·24h);不同盐碱程度处理的幼苗根际土壤脲酶活性呈先升后降的趋势,最高分别为6.50、5.44、5.08 mg/(g·24h);随着盐碱胁迫程度的递增,脲酶活性受到抑制,其中高浓度盐碱处理100 ~ 200 mmol/L的幼苗根际土壤脲酶活性均低于低浓度0 ~ 50 mmol/L处理。
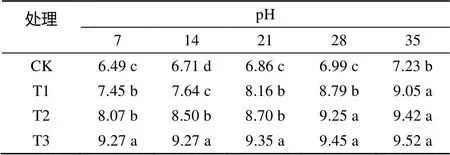
表1 盐碱胁迫对香樟幼苗根际土壤pH的影响
注:表中数据为平均值;同列数据小写字母不同表示处理间差异达到<0.05显著水平,下同。
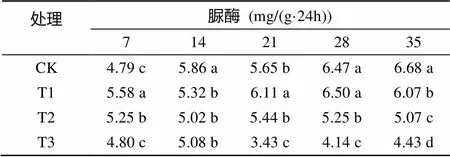
表2 盐碱胁迫对香樟幼苗根际土壤脲酶活性的影响
2.3 盐碱胁迫对香樟幼苗根际土壤过氧化氢酶活性的影响
由表3可以看出,随着处理时间的延长,不同盐碱处理的幼苗根际土壤的过氧化氢酶活性均呈不断上升的趋势,最高分别为4.52、4.81、5.18、5.46 mg/(g·h);随着盐碱胁迫程度的增加,过氧化氢酶活性也不断提高,处理后各个时期均高于对照,过氧化氢酶活性与幼苗根际土壤的pH呈正比。
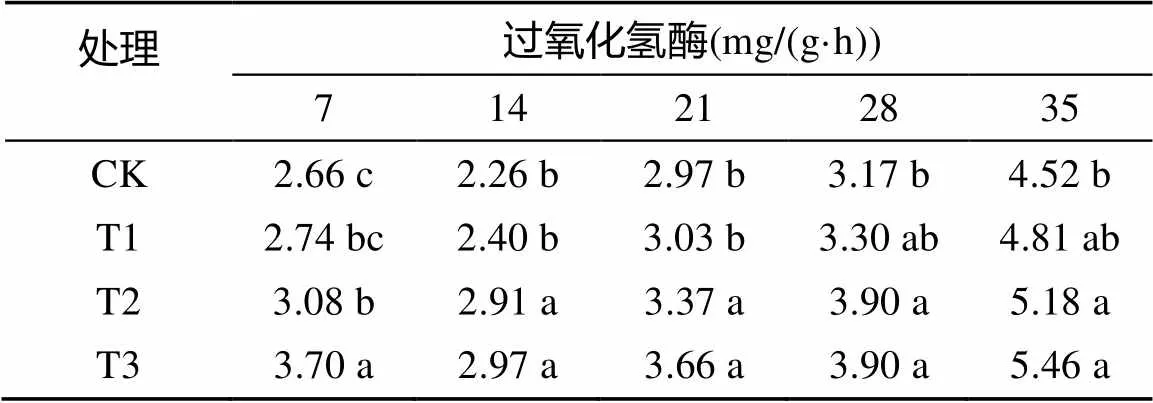
表3 盐碱胁迫对香樟幼苗根际土壤过氧化氢酶活性的影响
2.4 盐碱胁迫对香樟幼苗根际土壤蔗糖酶活性的影响
由表4可以看出,随着时间的延长,不同盐碱处理的幼苗根际土壤蔗糖酶活性呈先升后降的趋势,最高分别为1.71、1.55、1.56、1.11 mg/(g·24h);与对照相比,盐碱处理的幼苗根际土壤蔗糖酶活性受到抑制,且处理浓度越高,越明显,其中高浓度盐碱处理(100、200 mmol/L)与对照差异显著。

表4 盐碱胁迫对香樟幼苗根际土壤蔗糖酶活性的影响
2.5 盐碱胁迫对香樟幼苗根际土壤碱性磷酸酶活性的影响
由表5可以看出,随着处理时间的延长,对照和50 mmol/L处理的香樟幼苗根际土壤碱性磷酸酶活性呈上升趋势,最高值为0.13、0.18 mg/(g·24h);100 ~200 mmol/L处理的幼苗根际碱性磷酸酶呈先升后降的趋势,最高值分别为1.13、0.12 mg/(g·24h);轻度盐碱胁迫程度促进碱性磷酸酶活性,而重度盐碱胁迫抑制碱性磷酸酶活性。
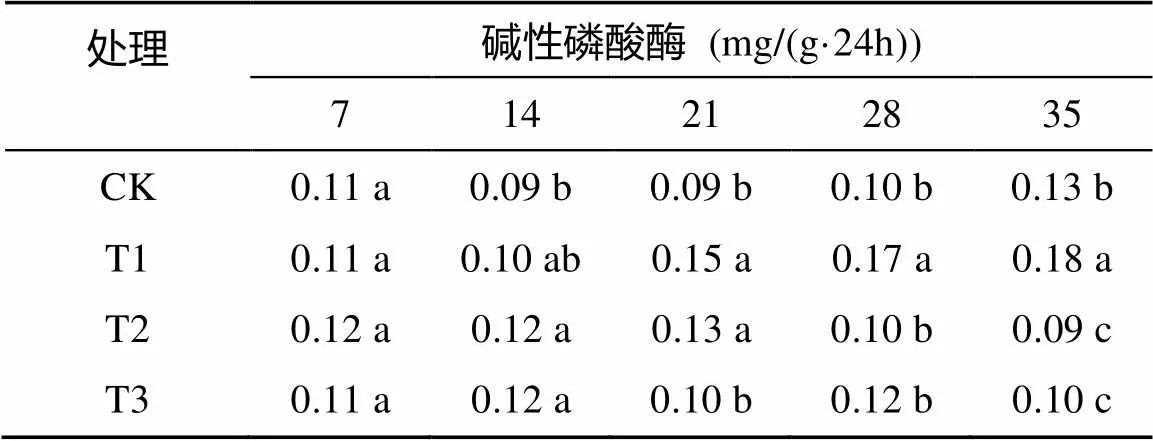
表5 盐碱胁迫对香樟幼苗根际土壤碱性磷酸酶活性的影响
2.6 盐碱胁迫对香樟幼苗根际土壤蛋白酶活性的影响
由表6可以看出,对照随植物的生长,幼苗根际土壤蛋白酶活性不断上升,最高值为1.79 mg/(g·24h);而不同程度盐碱处理的幼苗根际土壤蛋白酶活性随培养时间的延长而不断下降,最高值分别为1.99、2.02、2.20 mg/(g·24h),最小值分别为0.99、0.98、0.87 mg/(g·24h),下降幅度分别为50.47%、51.51%、60.52%,盐碱浓度越高,对蛋白酶活性的抑制效应越明显。
3 讨论
土壤酶参与土壤中各种化学反应和生物化学过程,与有机物质矿化分解、矿质营养元素循环、能量转移、环境质量等密切相关[24],其活性不仅能反映出土壤微生物活性的高低,而且能表征土壤养分转化和运移能力的强弱,是评价土壤肥力状况的重要参数之一[25]。目前关于盐碱胁迫对土壤酶的影响研究结论不尽一致,李志建等[26]研究发现,脲酶活性和过氧化氢酶活性与土壤pH均呈显著正相关。曹帮华等[27]的研究结果认为,pH与土壤脲酶和蔗糖酶活性间呈负相关关系,与过氧化氢酶活性的相关性不显著。白红霞等[28]认为,随着盐碱化程度加深,生物量显著降低,淀粉酶、脲酶活性受到抑制。根据本试验结果,随着盐碱胁迫时间的延长,各处理的香樟幼苗根际土壤pH不断上升,且随盐碱处理浓度升高而升高,其中0 mmol/L处理的pH从第7天的6.49升到第35天的7.23,这可能是试验中所用的清水pH为7.43,高于栽培基质的初始pH 6.17的原因;不同程度盐碱胁迫处理对脲酶、蔗糖酶和碱性磷酸酶活性表现先促后抑的规律,抑制了蛋白酶活性,促进过氧化氢酶活性的提高,轻度(0 ~ 50 mmol/L)盐碱胁迫处理促进碱性磷酸酶活性,而重度盐碱胁迫(50 ~ 200 mmol/L)处理抑制了碱性磷酸酶活性,与白红霞等[28]、吴丽云等[29]的研究结果一致。而与李志建等[26]、曹帮华等[27]结果不一致,土壤理化性状、林木生长年龄,土壤管理措施、林木种类及水肥管理等在一定程度上都会对土壤微生物及酶活性产生较大影响,这也可能是本试验结果与其他研究者结论不同的主要原因。
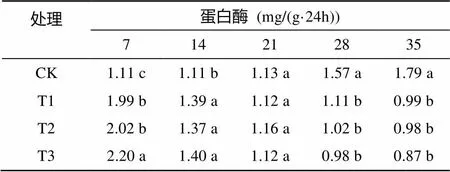
表6 盐碱胁迫对香樟幼苗根际土壤蛋白酶活性的影响
良好的生态环境是植物正常生长发育的基础,香樟正常生长过程中,对N、P等养分的需求量不断增加,根系生长发育较快,因而脲酶、蔗糖酶、碱性磷酸酶和蛋白酶的活性不断提高。土壤脲酶是一种酰胺酶[30],它专性分解土壤有机氮转化过程中形成的尿素,使其转化成矿物态的NH3,从而被树木吸收利用,其活性的提高能促进土壤有机氮向有效氮的转化[31],可以用于表示土壤的氮素供应状况。蔗糖酶主要是将碳水化合物水解产生的糖类进一步分解形成单糖,从而为微生物的繁殖提供营养,其活性高低可以反映土壤有机碳积累与分解转化的规律,能够表征土壤生物学活性强度,也可以作为评价土壤熟化程度的一个指标[32]。土壤磷酸酶活性有酸性、中性和碱性3种[33],其活性大小受pH影响较大[18],在土壤中主要参与将有机磷转化成无机磷的过程,能加速有机磷的循环速度,从而提高磷素的有效性。蛋白酶主要水解蛋白质和肽类等化合物产生氨基酸,这是含氮有机化合物氨化过程的一个环节,蛋白酶活性越强,土壤中的有效氮含量越高[34]。盐碱胁迫破坏了香樟根际土壤生态环境,土壤pH升高,盐碱胁迫程度越强,土壤pH越高。土壤pH主要通过两种方式对酶活性产生影响:①通过影响微生物种类而影响微生物释放酶的数量和种类。孙慧等[35]报道,盐碱胁迫使土壤中微生物多样性降低,微生物种类改变;②直接影响土壤酶参与生化反应的速度。H+浓度可以改变酶反应基点和土壤吸附的酶的稳定性,从而使有些酶促反应对pH变化很敏感,甚至只能在较窄的pH范围内进行[20]。盐碱胁迫也抑制了香樟根系的生长发育,降低了根系的生物量和根系活力[2-3]。随盐碱胁迫程度的增加和胁迫时间的延长,土壤脲酶、蔗糖酶、碱性磷酸酶和蛋白酶的活性受到抑制,生物体内产生并释放到土壤中的过氧化氢越多,影响微生物的活性和根系的生长发育,进而影响香樟根区养分的有效性,土壤过氧化氢酶可以分解土壤中的过氧化氢,防除过氧化氢对土壤酶的毒害作用,盐碱程度越大,形成的过氧化氢越多,对土壤环境影响越大,过氧化氢酶活性越强。
[1] 夏永久, 刘好霞. 宿迁市宿城区园林土壤养分状况初析[J].安徽农学通报, 2011, 17(23): 112–113
[2] 张丽华, 王晓立, 王梦秋, 等. 苏打盐碱胁迫对香樟幼苗光合特性的影响[J]. 北方园艺, 2012(23): 91–93
[3] 颜路明, 郭祥泉. 盐碱胁迫对香樟幼苗离子吸收与分配的影响[J]. 土壤, 2015, 47(6): 1176–1180
[4] 刘保强. Na2CO3胁迫对香樟幼苗生长的影响研究[J]. 安徽农学通报, 2015, 21(8): 102–103
[5] 华芳, 李利敏, 吴良欢, 等. 磷酸根和碳酸氢根浓度对樟树幼苗铁吸收的影响[J]. 浙江农业学报, 2009, 21(2): 173–177
[6] 马白菡, 谢宝多. 成土母质土壤(pH)对樟树黄化病的影响[J]. 中南林学院学报, 1992, 12(1): 49–56
[7] 刘梅, 郑青松, 刘兆普, 等. 盐胁迫下氮素形态对油菜和水稻幼苗离子运输和分布的影响[J]. 植物营养与肥料学报, 2015, 21(1): 181–189
[8] 陈峻, 李传涵. 杉木幼林地土壤酶活性与土壤肥力[J]. 林业科学研究, 1993, 6(3): 321–326
[9] 许景伟, 王卫东, 李成. 不同类型黑松混交林土壤微生物、酶及其与土壤养分关系研究[J]. 北京林业大学学报, 2000, 22(1): 51–55
[10] Puglisi E, Del Re A A M, Rao M A, et al. Development and validation of numerical indexes integrating enzyme activities of soils[J]. Soil Biology & Biochemistry, 2006, 38(7): 1673–1681
[11] 赵林森, 王九龄. 杨槐混交林生长及土壤酶与肥力的相互关系[J]. 北京林业大学学报, 1995, 17(4): 1–8
[12] 杨丽娟, 须晖, 邱忠祥, 等. 菜田土壤酶活性与黄瓜产量的关系[J]. 植物营养与肥料学报, 2000, 6(1): 113–116
[13] 章铁, 刘秀清, 孙晓莉. 栗茶间作模式对土壤酶活性和土壤养分的影响[J]. 中国农学通报, 2008, 24(4): 265–268
[14] 李腾懿, 孙海, 张丽娜, 等. 不同树种土壤酶活性、养分特征及其与林下参红皮病发病指数的关系[J]. 吉林农业大学学报, 2013, 35(6): 688–693, 715
[15] Kang H, Freeman C. Phosphatase and arylsulphatase activities in wetland soils: Annual variation and controlling factors[J]. Soil Biology & Biochemistry, 1999, 31: 449–454
[16] Aon M A, Colaneri A C. Temporal and spatial evolution of enzymatic activities and physico-chemical properties in an agricultural soil[J]. Appl. Soil Ecology, 2001, 18: 255–270
[17] Magnuson M, Crawford D L. Comparison of extracellular peroxidase and esterase-deficient mutants of Streptomyces viridosporus T7A[J]. Appl. Environ. Microbiol., 1992, 58: 1070–1072
[18] 王涵, 王果, 黄颖颖, 等. pH变化对酸性土壤酶活性的影响[J]. 生态环境, 2008, 17(6): 2401–2406
[19] 付慧兰, 邹永久, 杨振明, 等. 大豆连作土壤pH与土壤酶活性[J]. 大豆科学, 1996, 16(2): 156–161
[20] 万忠梅, 宋长春. 土壤酶活性对生态环境的响应研究进展[J]. 土壤通报, 2009, 40(4): 951–956
[21] 毛志刚, 谷孝鸿, 刘金娥, 等. 盐城海滨湿地盐沼植被及农作物下土壤酶活性特征[J]. 生态学报, 2010, 30(18): 5043–5049
[22] 严昶升. 土壤肥力研究方法[M]. 北京: 农业出版社, 1988: 234–286
[23] 杨兰芳, 曾巧, 李海波, 等. 紫外分光光度法测定土壤过氧化氢酶活性[J]. 土壤通报, 2011, 42(1): 207–210
[24] Yao X H, Min H, Lu Z H, et a1. Influence of acetamiprid on soil enzymatic activities and respiration[J]. European Journal of Soil Biology, 2006, 42(2): 120–126
[25] Paz Jimenez M D, Herra A M, Penzoo L, et al. Soil quality: A new index based on microbiological and biochemical parameters[J]. Biology and Fertility of Soils, 2002, 35: 302–306
[26] 李志建, 倪恒, 周爱国. 额济纳旗盆地土壤过氧化氢酶活性的垂向变化研究[J]. 干旱区自然与环境, 2004, 18(1): 86–89
[27] 曹帮华, 吴丽云. 滨海盐碱地刺槐白蜡混交林土壤酶与养分相关性研究[J]. 水土保持学报, 2008, 22(1): 128–133
[28] 白红霞, 斯琴巴特尔, 秦树辉. 草地盐碱化对灰绿碱蓬生物量及其土壤酶活性的影响[J]. 时珍国医国药, 2012, 23(12): 3129–3131
[29] 吴丽云, 曹帮华, 陆发利, 等. 盐碱地刺槐臭椿混交林土壤酶与养分相关性研究[J]. 山东林业科技, 2013(2): 10–15
[30] 董丽洁, 陆兆华, 贾琼, 等. 造纸废水灌溉对黄河三角洲盐碱地土壤酶活性的影响[J]. 生态学报, 2010, 30(24): 6821–6827
[31] 薛冬, 姚槐应, 何振立, 等. 红壤酶活性与肥力的关系[J]. 应用生态学报, 2005, 16(8): 1455–1458
[32] 耿玉清, 王冬梅. 土壤水解酶活性测定方法的研究进展[J]. 中国生态农业学报, 2010, 20(4): 387–394
[33] Frankenberger J R, Johanson J B, Nelson C O. Urease activity in sewage sludge amended soils[J]. Soil Biology & Biochemistry, 1983(15): 543– 549
[34] 弋良朋, 马健, 李彦. 荒漠盐生植物根际土壤酶活性的变化[J]. 中国生态农业学报, 2009, 17(3): 500–505
[35] 孙慧, 张建锋, 许华森, 等. 余姚滨海不同盐碱度土壤微生物群落组成及土壤酶活性的变化[J].应用生态学报, 2016, 27(10): 3361–3370
Effect of Salinity-alkalinity Stress on the Rhizosphere Soil Enzyme Activity of Camphor Seedlings
YAN Luming1, GUO Xiangquan2
(1 Department of Environmental Art, Academy of Fine Arts, Minjiang University, Fuzhou 350108, China; 2 Sanming Forestry Bureau, Sanming, Fujian 365000, China)
The potted camphor seedlings of two years were taken as the materials and were treated by the mixed solution of salinity-alkalinity (Na2CO3︰NaHCO3= 1︰1) with different concentrations (0, 50, 100 and 200 mmol/L), the enzyme activities and pH of rhizosphere soils were studied. The results showed that pH value of rhizosphere soil increased with the stress time and concentration of salinity-alkalinity; Urease activity of 0 mmol/Ltreatment showed an increasing trend, but those of salinity-alkalinity stress increased first and then degreased. Urease activity increased with the increase of salinity-alkalinity concentration. Catalase activity showed an increasing trend, and it also increased with the increase of salinity-alkalinity concentration. Invertase activity increased first and then decreased, and it decreased with the increase of salinity-alkalinity concentration. Alkaline phosphatase activity was promoted under slight salinity-alkalinity stress (0–50 mmol/L) but restrained under severe salinity-alkalinity stress (50–200 mmol/L). Proteinase activity of 0 mmol/L treatment showed an increasing trend, but inhibited under salinity-alkalinity stress. The conversion of available nutrients in soil and nutrient absorption by plants are influenced by salinity-alkalinity stress.
Salinity-alkalinity stress; Camphor seedling; Soil enzyme activity
10.13758/j.cnki.tr.2017.04.014
S156.4;S722.5
A
2014年闽江学院校级科研专项(MYZ14027)资助。
颜路明(1973—),男,福建仙游人,硕士,讲师,主要研究方向为园林生态。E-mail: 402655592@qq.com
