热诱导牛奶中乳清蛋白与酪蛋白胶束反应的机理研究
2017-09-03刘海燕顾佳升
译/刘海燕 校/顾佳升
(1 新希望乳业股份有限公司;2 上海奶业行业协会)
热诱导牛奶中乳清蛋白与酪蛋白胶束反应的机理研究
译/刘海燕1校/顾佳升2
(1 新希望乳业股份有限公司;2 上海奶业行业协会)
将牛奶加热到90 ℃,然后采用具体界定反应的最终产物的方法来研究在热诱导条件下,乳清蛋白和酪蛋白胶束之间的相互作用机理。在脱脂乳里添加了不同数量的乳清蛋白,加热后分别查验脱脂乳和依然悬浮分散在其中的酪蛋白胶束,由此获得了牛奶在热诱导条件下,“蛋白质-蛋白质”相互之间作用机制的确切信息。以α-乳白蛋白和β-乳球蛋白与κ-酪蛋白的比率,以及在酪蛋白胶束颗粒中发现的α-乳白蛋白与β-乳球蛋白的比率,作为评估牛奶中发生热诱导反应程度的指标物。结果显示,在低温(70~90 ℃)间歇式加热条件下,各种乳清蛋白相互作用,形成多类可溶性的复合物,在热诱导过程中,担任了α-乳白蛋白和β-乳球蛋白进一步与酪蛋白胶束发生反应的中间体角色。对于乳清蛋白与酪蛋白胶束之间发生的任何交联反应而言,β-乳球蛋白的存在都是必需的;此外还发现,加热后出现在酪蛋白胶束颗粒中β-乳球蛋白的数量,似乎受到酪蛋白胶束表面结合位点数量的限制,而这些结合位点的分布是离散的。
热诱导牛奶;乳清蛋白;酪蛋白;机理
在热处理过程中,牛奶发生着各种反应,包括乳清蛋白的变性和聚集,以及乳清蛋白与酪蛋白胶束和脂肪球之间多种复合物的形成。关于α-乳白蛋白(α-La)和β-乳球蛋白(β-Lg)的变性现象,目前已经通过多种模拟系统有了广泛的研究。然而,即使理解了单个蛋白质的变性机理,也只是对牛奶的热处理期间所发生的复杂系列反应的初始阶段情况有初步的了解。基于这个原因,目前需要一个不同的方法,旨在确定中间体的形成,以及环境条件的变化对它们的影响效果,即在加热过程中“蛋白质-蛋白质”是如何相互作用的。
当全脂奶被加热后,乳清蛋白不仅与酪蛋白胶束相互作用,而且与脂肪球相互作用。最近的研究已经证明,虽然乳清蛋白与乳脂肪球结合的速度很快但数量较少,如果与结合于酪蛋白胶束上的数量相比较,在乳清蛋白和酪蛋白胶束之间形成的复合物,是迄今为止热诱导反应的重要的中间产物,并且存在于β-Lg(β-乳球蛋白)天然结构中的游离巯基,似乎在相互作用过程中发挥了重要的作用。在牛奶热处理过程中形成的主要复合物是“β-Lg/κ-酪蛋白复合物”。研究发现,不仅β-Lg,α-La也参与了与酪蛋白胶束的反应。已有报道,当存在β-Lg时,α-La的变性程度会增加。也有报道指出,α-La的自身变性其实是半可逆的。
尽管对牛奶的热处理已经有了广泛的研究,但是目前关于在热诱导下,α-La和β-Lg与酪蛋白胶束之间的相互作用机制细节并不清楚。本文描述了在牛奶温度高达90℃的加热过程中,就添加乳清蛋白到脱脂乳中的效果,以及对依然悬浮分散的酪蛋白胶束的影响,探讨α-La、β-Lg和酪蛋白胶束颗粒之间的相互作用问题。
1 试验设计
从圭尔夫大学的Elora研究站收集新鲜的全脂牛奶。在加入0.2 g/L的叠氮化钠作为防腐剂后,通过低速离心(3 000 g,20 min)将牛奶脱脂。再通过离子交换层析制备单个α-La和β-Lg,用4 L 20 mmol/L的Tris pH值缓冲液(0~1 M NaCl梯度)洗脱。透析后,将分离的蛋白质冻干并在加热前以干粉形式加入到脱脂乳中。在热处理之前,将纯化的α-La和β-Lg加入到脱脂乳中,在改变了原奶蛋白质浓度的情况下,研究α-La、β-Lg和酪蛋白胶束之间的热诱导复合物的组成所产生的影响。此外,还采用超滤牛奶的方法处理悬浮的酪蛋白胶束。将未处理过的脱脂乳用60 000 g离心40 min的方法,获得净化的酪蛋白胶束。使用10 000 Da截留膜的实验室超滤装置制备超滤液。在热处理之前加入并分散了不同数量的纯化α-La和β-Lg。
将样品在温控水浴(70~90℃)的试管中加热不同时间。热处理后,样品在冰浴中快速冷却。
采用超速离心方法,从热处理过的样品中分离获得在热诱导下乳清蛋白和酪蛋白胶束之间相互作用所形成的最终复合物,采用Corredig和Dalgleish在1996年所述的SDS-PAGE电泳法进行分析,根据α-La和β-Lg与κ-酪蛋白相结合比率进行定量,将这些比率关系作为乳清蛋白和酪蛋白之间的反应指数。此外,有报道建议使用α-La/β-Lg作为一种评估脱脂乳经受热处理强度的方法,用以研究α-La / β-Lg与乳中蛋白质浓度比率的变化规律。
2 结果和讨论
当牛奶经过75~90 ℃的间歇加热处理时,乳清蛋白与酪蛋白胶束的相互作用程度随时间和温度的增加而加剧。通常与胶束颗粒相结合的乳清蛋白数量,随着加热时间的延长而增加至最大值,并且温度越高,蛋白质之间的相互作用越快。早前的研究表明,环境条件的变化强烈影响α-La和β-Lg与酪蛋白胶束的热诱导相互作用。方差分析显示,不仅加热的时间和温度,而且脱脂乳中存在的乳清蛋白数量,都将显著影响与酪蛋白胶束相结合的α-La/κ-酪蛋白和β-Lg/ κ-酪蛋白的数量。
热处理后观察到的α-La和β-Lg与酪蛋白胶束的结合情况,与Law等在1994年研究结果相一致。图1为加热温度为80 ℃,保持不同时间的脱脂乳,与酪蛋白结合的重量比率变化情况,采用4 次独立试验结果的平均值,计算黑块、左坐标为α-La/κ-酪蛋白的重量比率,黑圆、右坐标为β-Lg/κ-酪蛋白的重量比率。结果显示,在低于90 ℃的加热过程中,蛋白质不仅与胶束相互作用,而且具有非常相似的动力学行为(图1)。
温度(90 ℃)似乎在反应机制中是一个关键临界值,与表达乳清蛋白变性动力学的阿伦尼乌斯图斜率变化一致。当牛奶在低温下加热时,两种乳清蛋白质的变化情况表现相似,其在酪蛋白胶束颗粒中的数量,与它们在原奶中的浓度直接相关。图2为加热温度为80 ℃的脱脂乳,随着保持时间的增加,与酪蛋白结合的乳清蛋白/κ-酪蛋白的重量比率也在变化,黑块所示2 g/L β-Lg脱脂乳中β-Lg/κ-酪蛋白的重量比率,黑圆所示2 g/L α-La脱脂乳中α-La/κ-酪蛋白的重量比率。显示结果也证实了上述假设。
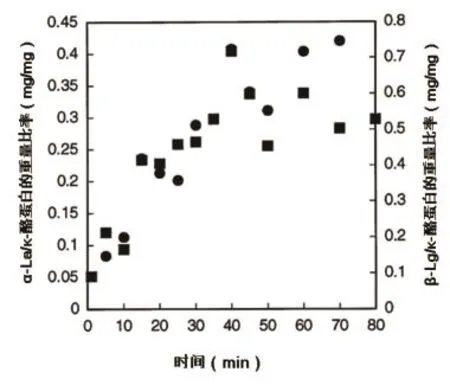
图1 加热温度为80 ℃的脱脂乳随着保持时间的变化与酪蛋白结合的重量比率变化情况
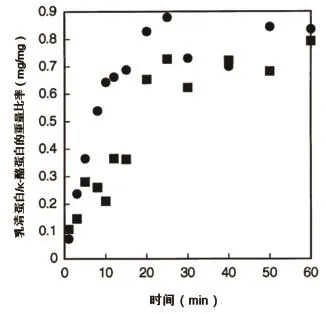
图2 加热温度为80 ℃的脱脂乳随保持时间的变化,与酪蛋白结合的乳清蛋白/κ-酪蛋白比率的变化情况
当添加2 g/L α-La中时,α-La和β-Lg的浓度相当,具有相同的相互作用动力学,处理后与胶束颗粒相结合的数量也相似。加入2 g/L β-Lg的脱脂乳在80 ℃加热(图2),几分钟后即达到β-Lg /κ-酪蛋白的最大值。而β-Lg /κ-酪蛋白所达到的高数值,与对照奶样品所达到的稳定值并没有显著的不同。该结果表明,在酪蛋白胶束颗粒的表面上只有一定数量的位点可以用于与β-乳球蛋白发生相互作用。α-La的作用行为不同于β-Lg,在相同条件下加热后,α-La即可以增加与酪蛋白胶束颗粒相结合的数量。
加热后胶束颗粒中两种乳清蛋白的存在及其在低温(直到90℃)下加热时的类似动力学行为表明,乳清蛋白内部可能形成了可溶性的聚合物,即两种乳清蛋白——α-La和β-Lg,彼此反应,形成中间体复合物,再与酪蛋白胶束发生相互作用。现已知在低温下,β-Lg需要时间改变结构,可能是α-La参与酪蛋白胶束反应的原因。在加热下依然悬浮分散的酪蛋白胶束,添加不同数量的α-La和β-Lg,结果表明尽管α-La的存在并不影响β-Lg与酪蛋白胶束的结合作用,但β-Lg与酪蛋白胶束的结合需要 α-La。
图3显示80 ℃加热后在酪蛋白胶束颗粒中α-La/β-Lg的比率,与脱脂乳中α-La和β-Lg浓度的函数关系。添加不同数量乳清蛋白的脱脂乳,在同为80 ℃但不同保持时间条件下,与酪蛋白胶束结合的α-La/β-Lg的比率,三者之间的函数关系,其中黑圆为对照样脱脂乳,黑块为添加2 g/L α-La的脱脂乳,白圆为添加2 g/L β-Lg的脱脂乳,白块为各添加1 g/L α-La和β-Lg的脱脂乳。
对没有添加蛋白质的脱脂乳进行的加热试验中,α-La/ β-Lg的比率反映了它们的原始组成。当添加2 g/L α-La时,两种乳清蛋白具有相似的浓度,与酪蛋白胶束相结合的α-La/ β-Lg的比率高于对照样品中的比率,并且达到约0.8 mg α-La/ mg β-Lg。当1 g/L α-La和1 g/ L β-Lg同时添加到脱脂乳中时,α-La/β-Lg的比率虽然与对照样品相比是明显不同的,然而向脱脂乳中加入更多的α-La时,再也没有显著的效果差异了(图3)。该结果证实了如下假设,即只存在数量有限的离散分布的结合位点可用于β-Lg与酪蛋白胶束的相互结合。此外,额外添加β-Lg到脱脂乳中,如果与对照样品比较,并不能有意义地改变与酪蛋白胶束结合的α-La和β-Lg的比率。笔者对依然呈悬浮状分散的酪蛋白胶束,再加入不同量的乳清蛋白进行了多次研究,得到了上述结论。
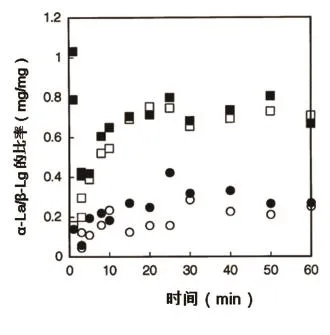
图3 不同数量乳清蛋白脱脂乳,在不同保持时间下,与酪蛋白胶束结合的α-La/β-Lg比率之间的函数关系
总之,在加热(低温间歇加热)条件下,认识到了两种主要的相互作用:一是β-Lg与酪蛋白胶束通过κ-酪蛋白结合的直接相互作用;二是α-La和β-Lg与酪蛋白胶束的结合,是通过在溶液中这两种乳清蛋白之间的反应所形成的中间体来实现的。对脱脂乳和依然呈悬浮状分散的酪蛋白胶束两种物料所进行的热处理试验,都表明了能够与酪蛋白胶束相互结合的β-Lg数量,受可用的结合位点数量的限制。能够与酪蛋白胶束颗粒相结合的α-La的数量,似乎只取决于其在奶中的浓度。C
英文原文:Corredig M,Dalgleis D G. The mechanisms of the heat-induced interaction of whey proteins with casein micelles in milk[J]. International Dairy Journal,1999,9 (3–6):233-236.
2017-06-19)
刘海燕,博士,高级工程师,从事乳制品生产管理、质量控制、乳品技术研究工作。
校者简介:
顾佳升(1948-),男,学士,高级工程师,研究方向为乳品加工及检验。
