活络效灵颗粒对自闭症患儿细胞因子IL-1、IL-17的研究
2017-09-03王春南穆亚平张琪琳
王春南 穆亚平 张琪琳
(沈阳市儿童医院康复科,辽宁 沈阳 110032)
活络效灵颗粒对自闭症患儿细胞因子IL-1、IL-17的研究
王春南 穆亚平 张琪琳
(沈阳市儿童医院康复科,辽宁 沈阳 110032)
目的观察活络效灵颗粒对自闭症患儿肠道微生态的调节作用。方法将90例自闭症患儿分为3组,试验组予活络效灵颗粒,对照组给予双歧杆菌四联活菌片,联合组给予两种药物同时治疗。观察各组治疗对胃肠道症状的影响,治疗前后血清IL-1β、IL-17的变化,临床行为学改变。结果活络效灵颗粒可有效调节小儿肠道微生态,且可提高机体免疫,并优于微生态制剂。结论活络效灵颗粒可有效调节肠道菌群,并通过上述机制治疗自闭症患儿。
活络效灵颗粒;自闭症;微生态调节
近年来自闭症患儿胃肠功能失调症状引起了学者的关注[1]。而胃肠功能的紊乱与中枢海马易损而产生孤独样表现通过IL-1β、IL-17高表达成为共识。本研究主要观察活络效灵颗粒对其临床疗效。
1 资料与方法
1.1 临床资料:2013年10月至2014年5月在沈阳市儿童医院门诊和住院的孤独症患儿90例,按就诊顺序,每组各30例。试验组:男16例,女14例,平均年龄(4.25±0.34)岁;对照组:男18例,女12例,平均年龄(4.13±0.38)岁;联合组:男13例,女17例,平均年龄(4.22± 0.53)岁。各组患儿性别、年龄相比,统计学无差异(P>0.05),具有可比性。
纳入标准:符合国际疾病分类第10版(ICD-10)孤独症的诊断标准,家长签署知情同意书。排除标准:其他广泛发育障碍;药物引起的胃肠功能失调症状。
1.2 治疗方法
1.2.1 试验组:采用郑州凯利药业有限公司的活络效灵颗粒,≤5岁患儿给予1.25 g日1次。≥5岁患儿给予1.5 g日1次,连续口服3个月。
1.2.2 对照组:给予双歧杆菌四联活菌片0.5 g日3次口服,连续3个月。
1.2.3 联合组:给予两种药物同时治疗,连续治疗3个月。
1.3 疗效观察。实验室指标:①观察便细菌培养:治疗前取新鲜便按操作规范分别进行双歧杆菌、乳酸杆菌、肠杆菌及肠球菌培养,记录其菌落数。治疗3个月后,复查并进行对比分析。②观察IL-1β、IL-17:治疗前后分别进行IL-1β和IL-17含量检测。行为指标:治疗前后ABC量表评分比较:治疗前应用ABC量表评分,治疗3个月后复评,并进行对比分析。
2 结 果
2.1 便细菌培养比较:与治疗前比较,三组双歧杆菌、乳酸杆菌及肠杆菌均增多,而肠球菌减少(P<0.05);试验组与联合组双歧杆菌、乳酸杆菌、肠杆菌的增多及肠球菌的减少更明显(P<0.05)。见表1。
表1 肠道菌群培养比较
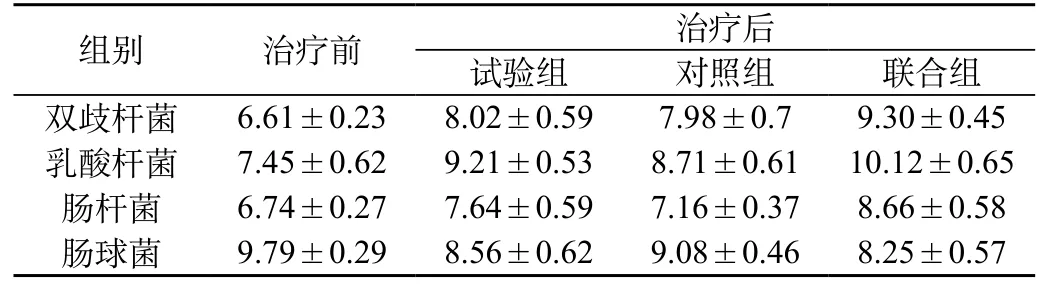
表1 肠道菌群培养比较
2.2 治疗前后IL-1β含量比较:治疗后IL-1β含量三组均有降低(P<0.05)。治疗后对照组IL-1β含量高于试验组,有统计学差异(P<0.05)。治疗后联合组IL-1β含量降低更明显,与试验组比较,有统计学差异(P<0.05)。见表2。
表2 三组患儿外周血治疗前后IL-1β含量

表2 三组患儿外周血治疗前后IL-1β含量
注:组内比较,#P<0.05;组间比较,▽P<0.05,○P<0.05
2.3 治疗前后IL-17含量比较:三组治疗后IL-17均明显降低(P<0.05),与对照组比较,另两组治疗后对照组IL-17含量降低更明显,具有统计学差异(P<0.05)。见表3。
表4 三组患儿治疗前后ABC量表各参数因子分值比较(
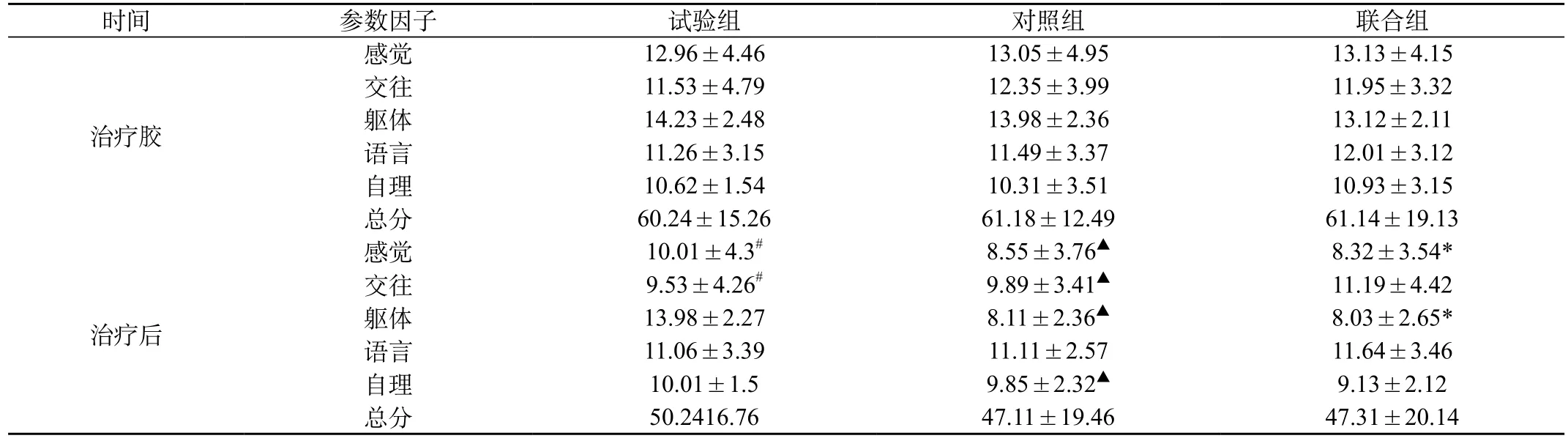
表4 三组患儿治疗前后ABC量表各参数因子分值比较(
注:与治疗前试验组比较:#P<0.05;治疗前对照组比较:▲P<0.05;与治疗前联合组比较:*P<0.05
表3 三组患儿外周血治疗前后IL-17含量

表3 三组患儿外周血治疗前后IL-17含量
注:与同组治疗前比较,#P<0.05
2.4 治疗前后ABC量表评分比较:与治疗前比较,治疗后三组总分值均低于治疗前,有统计学差异(P<0.05);治疗后试验组在感觉、交往因子分数降低,有统计学差异(P<0.05);治疗后对照组在感觉、交往、躯体、自理因子分数降低,有统计学差异(P<0.05)。治疗后联合组在感觉、躯体因子分数降低,有统计学差异(P<0.05)。见表4。
3 讨 论
现代研究发现,肠道里的神经细胞在细胞类型、数量、神经递质及感受器方面都与大脑极其相似,因此,肠道也被称为人的“肠脑”[2]。肠脑与头脑之间通过脑-肠轴进行联接[3]。自闭症可能也受脑-肠轴的影响[4-6]。肠道微生物可通过血液、内分泌和神经系统影响大脑,它们之间构成了微生物-肠道-大脑轴[7-11]。肠道菌群可通过免疫途径、神经内分泌途径影响宿主行为,并可能影响人的心理及记忆[12]。研究表明,脑内炎性因子表达增加,能引起认知功能破坏、厌食和抑郁等。特别是破坏突触可塑性和海马区依赖性记忆,这在电生理中已得到证实[13]。因而推论,自闭症也受菌-肠-脑轴的影响。研究报道,自闭症儿童肠道菌群多样性和数量的降低均与自闭症程度显著相关[14]。
中医认为,任何疾病病久皆可入络。《临证指南医案》曰“初病在经,久病入络”。活络效灵丹具有活血祛瘀、通络止痛之功效。该方引药入血络、入肠络。入血络调节络脉气血,心主血,心血充盈,则心神得养,精神振奋。入肠络而调节小肠功能,小肠化物、泌别清浊。现代研究表明,活血化瘀药能改善肠黏膜微循环,调节免疫功能和抑制炎性反应[15-16]。
本研究结果显示活络效灵颗粒可有效缩短病程,调节肠道菌群,降低IL-1β、IL-17水平。综上所述,活络效灵颗粒可有效调节肠道菌群,并通过上述机制治疗自闭症患儿。
[1] 江月斐,劳绍贤.胃肠道微生态与中医药研究进展概况[J].中国中西医结合消化杂志,2003,11(3):188.
[2] Gershon M.The second brain:a groundbreaking new nnderstanding of nervous disorders of the stomach and intestine[M].New york: Harper Collins Publishers,1999.
[3] Grenham S,Clarke G,Cryan JF,et al.Brain gut microbe communication in health and disease[J].Front Physiol,2011,2:1-15.
[4] Forsythe P,Sudo N,Dinan T,et al.Mood and gut feelings[J].Brain Behav Immun,2010,24(1):9-16.
[5] Lee YY,Chua AS.Influence of gut microbes on the brain-gut axis (Gut 2011; 60:307-317.)[J].J Neurogastroenterol Motil,2011,17(4): 427-429.
[6] Mayer EA,Padua D,Tillisch K.Altered brain-gut axis in autism: comorbidity or causative mechanisms? [J].Bio Essays,2014,36(10): 933-939.
[7] Foster JA,Mc Vey Neufeld KA.Gut-brain axis:how the microbiome influences anxiety and depression[J].Trends Neurosci,2013,36(5): 305-312.
[8] Cryan JF,O'Mahony SM.The microbiome-gut-brain axis:from bowel to behavior[J].Neurogastroenterol Motil,2011,23(3):187-192.
[9] Neufeld KM,Kang N,Bienenstock J,et al.Reduced anxiety-like behavior and central neurochemical change in germ-free mice[J]. Neurogastroenterol Motil,2011,23(3):255-264.
[10] Heijtz RD,Wang S,Anuar F,et al.Normal gut microbiota modulates brain development and behavior[J].Proc Natl Acad Sci USA,2011, 108(7):3047-3052.
[11] 梁姗,王涛,胡旭,等.微生物与行为和精神疾病[J].心理科学进展, 2012,20(1):75-97.
[12] Dinan TG,Stilling RM,Stanton C,et al.Collective unconscious:how gut microbes shape human behavior[J].J Psychiatr Res,2015,63: 1-9.
[13] Gareau MG,Wine E,Rodrigues DM, et al.Bacterial infection causes stress-induced memory dysfunction in mice[J].Gut,2011,60(3): 307-317.
[14] Furness JB,Kunze WA,Clerc N.Nutrient tasting and signaling mechanisms in the gut.II.The intestine as a sensory organ:Neural, endocrine, and immune responses[J].Am J Physiol,1999,277(5 Pt 1): G922-G928.
[15] Artis D.Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut[J].Nat Rev Immunol, 2008,8(6):411-420.
[16] Medzhitov R.Recognition of microorganisms and activation of the immune response[J].Nature,2007,449(7164):819-826.
R749.94
B
1671-8194(2017)19-0194-02
