HAI-1与子宫内膜癌侵袭转移的相关性研究
2017-09-03孙蓬明
金 琼 缪 飞 黄 勉 孙蓬明*
(1 福州市第一医院妇产科,福建 福州 350009;2 福建省妇幼保健院妇科,福建 福州 350001)
HAI-1与子宫内膜癌侵袭转移的相关性研究
金 琼1缪 飞1黄 勉1孙蓬明2*
(1 福州市第一医院妇产科,福建 福州 350009;2 福建省妇幼保健院妇科,福建 福州 350001)
目的探讨HAI-1表达水平与子宫内膜癌细胞株侵袭迁移能力的相关性。方法体外培养人子宫内膜癌细胞株,采用Real-time q PCR技术检测HEC-1A、HEC-1B和RL952三株子宫子宫内膜癌细胞中HAI-1 mRNA表达水平,应用细胞划痕实验及穿膜小室实验,观察三株子宫内膜癌细胞体外的侵袭及迁移能力。结果①HAI-1 mRNA在三株细胞中的相对表达量分别为(0.3042±0.0101)、(0.0032 ±0.0001)和(0.2580±0.0096),HAI-1蛋白在HEC-1A、HEC-1B和RL952中均呈阳性表达,但在HEC-1B中表达低于HEC-1A及RL952。②细胞划痕实验结果显示,HEC-1A、HEC-1B和RL952三组迁移距离分别为(173.30±7.33)μm、(437.00±8.72)μm和(135.30 ±6.89)μm。③侵袭实验结果显示,HEC-1A、HEC-1B和RL952三组穿膜细胞数分别为(52.67±2.73)、(117.30±3.48)和(62.00±3.06)。结论HAI-1 mRNA表达水平与子宫内膜癌细胞侵袭迁移能力呈负相关。对HAI-1抑癌机制的进一步研究,将有望使HAI-1成为今后子宫内膜癌诊断及治疗中的新靶点。
HAI-1基因;子宫内膜癌;转移;侵袭
子宫内膜癌是发生于子宫内膜的一组上皮下肿瘤,为女性生殖道三大恶性肿瘤之一,占女性全省恶性肿瘤7%,近年来发病率呈逐渐上升趋势[1]。子宫内膜癌的侵袭和转移是其作为恶性肿瘤重要的生物学特性。细胞外基质(the extracellular matrix,ECM)的降解有利于肿瘤细胞的分离、种植及远处播散,是侵袭转移的关键环节。近年研究发现,一种肝细胞生长因子活化因子抑制剂1(hepatocyte growth factor activator inhibitor-1,HAI-1)构成了一个ECM 降解系统[2-3]。肝细胞生长因子激活物抑制因子(HAI)是目前公认的肿瘤抑制因子,它分为HAI-1和HAI-2两种类型,HAI-1定位于染色体15q15,基因由11个外显子组成,长度为12 kbp,在人的HAI-1的5'端调控区包含组织损伤的早期反应转录因子(如:热休克蛋白转录因子、NFk-B、Egrs等的结合位点)可能是转录调节相关的TATA盒[4],目前国内外很少做HAI-1与子宫内膜癌侵袭转移相关性的研究。因此,本研究主要是通过检测HEC-1A、HEC-1B 和RL952三株子宫内膜癌细胞中HAI-1的mRNA表达水平,同时研究HAI-1基因表达的差异与子宫内膜癌细胞体外侵袭迁移能力的相关性。
1 材料与方法
1.1 材料来源
1.1.1 细胞系:人子宫内膜癌细胞株HEC-1A、HEC-1B和RL952细胞购自中国科学院典型培养物保藏委员会细胞库,由福建省妇幼保健院妇科肿瘤实验室保存。
1.1.2 主要试剂:DMEM高糖培养基、DMEM/F12培养基、胰蛋白酶(美国Gibco 公司),Trizol 试剂(美国Invitrogen 公司),PCR试剂(北京TIANGEN 公司),逆转录试剂盒和荧光定量PCR试剂盒(美国Promega 公司)。
1.2 方法
1.2.1 细胞培养:HEC-1A和HEC-1B细胞用含有10%灭活小牛血清、100 IU/mL青霉素、100 μg /mL链霉素的DMEM高糖培养基;RL952细胞采用含10%灭活小牛血清、100 IU/mL青霉素、100 μg/mL链霉素、NaHCO3及胰岛素的DMEM/F12培养基,置37 ℃、5%CO2饱和湿度的培养箱内培养。
1.2.2 荧光定量:PCR Trizol 法提取RNA,用紫外分光光度计测定浓度及纯度。根据说明书操作将RNA 合成cDNA 第一链。采用LightCycler SYBR Green I Master 试剂,进行荧光定量PCR。引物序列及扩增序列长度如下:HAI-1:上游5'-GGCAACAAGAACAACTTTGAGGAGGCAACAAGAACAACTTTGAGGA-3',下游5'-CAATGCAGATGACCAG GAACAC-3'(154bp);GAPDH:上游5'-GCACCGTCAAGGCTGAG AAC-3',下游5'-TGGTGAAGACGCCAGTGGA-3'(138bp)。反应参数:预变性95 ℃,5 min;之后每一步变性95 ℃,10 s;退火60 ℃,10 s;延伸72 ℃,10 s共进行45个循环。每次在延伸阶段读取吸光值。采用双标准曲线法,计算各目的基因的相对含量。
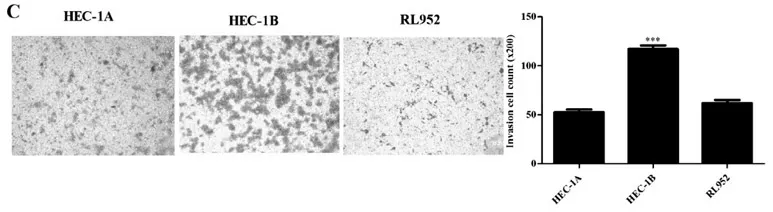
图3 子宫内膜癌细胞株HEC-1A、HEC-1B及RL952侵袭情况图
1.2.3 划痕试验:用Image J软件测量各个时间点的划痕两侧的细胞间距离(μm)变化,以0 h划痕边沿的距离减去24 h迁移边沿的距离来计算细胞的迁移距离,反映细胞的迁移能。
1.2.4 Transwell小室侵袭实验:Transwell小室直径上取5个视野,照相,计数每个视野穿过膜的细胞数,取其平均值,结果以表示。以穿膜细胞数反映肿瘤细胞的侵袭能力。
1.3 统计学处理:采用SPSS19.0统计软件。上述实验均重复3次,实验数据以表示,计量资料进行单因素方差分析,双变量相关分析采用Person分析。P<0.05为差异有统计学意义。
2 结 果
2.1 荧光定量:PCR检测HAI-1 mRNA在HEC-1A、HEC-1B、RL952细胞中表达情况,HAI-1 mRNA相对表达量分别为(0.3042±0.0101)、(0.0032±0.0001)和(0.2580±0.0096),HEC-1B组HAI-1表达情况显著低于HEC-1A组(P<0.0001)及RL952组(P<0.0001) (图1),实验重复3次。
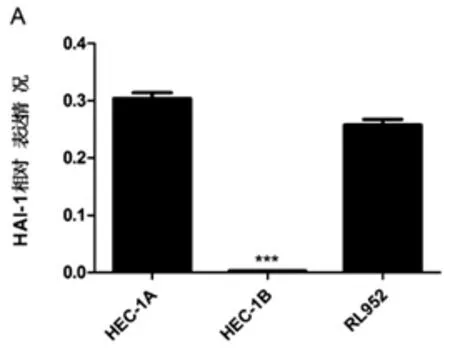
图1 子宫内膜癌细胞株HEC-1A、HEC-1B及RL952中HAI-1mRNA表达情况图
2.2 划痕实验:检测HEC-1A、HEC-1B及RL952子宫内膜癌细胞的转移情况。结果显示三株内膜癌细胞迁移距离分别为(173.30 ±7.33)μm、(437.00±8.72)μm和(135.30±6.89)μm,HBC-1B组的子宫内膜癌细胞株的转移能力显著高于HEC-1A组(P<0.0001)及RL952组(P<0.0001),HEC-1A转移能力稍高于RL952(P=0.00194)(图2),实验重复3次。
2.3 Transwell小室法:检测HEC-1A、HEC-1B及RL952子宫内膜癌细胞的侵袭情况。结果显示三株内膜癌细胞数分别为(52.67± 2.73)、(117.30±3.48)和(62.00±3.06),HEC-1B组的子宫内膜癌细胞株的侵袭能力显著高于HEC-1A组(P=0.0001)及RL952组(P=0.0003),HEC-1A与RL952无显著差异(P=0.0849)(图3),实验重复3次。
3 讨 论
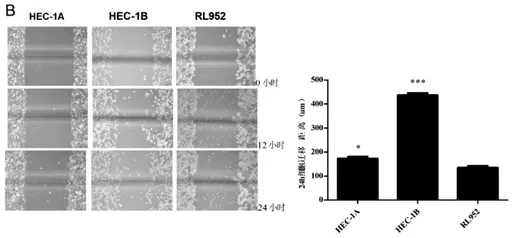
图2 子宫内膜癌细胞株HEC-1A、HEC-1B及RL952转移情况图
肝细胞生长因子激活物抑制因子1(HAI-1)是一类细胞膜相关的Kunitz型丝氨酸蛋白酶的抑制因子,它可抑制多种丝氨酸蛋白酶的活性[5]。研究证明HAI-1是一种内源性的抑制因子,HAI-1最初是作为肝细胞生长因子激活物(HGFA)的抑制剂被发现的,后续发现其可抑制matriptase、胰蛋白酶、纤溶酶(plasmin)等的活性[6-8]。相关研究发现matriptase在妇科恶性肿瘤均呈现异常表达。Nakamura K等发现HAI-1在宫颈癌中低表达,HAI-1可作为宫颈癌治疗靶点和良好预后指标[9]。进而,HAI-1在多种肿瘤中均发现起表达失调,张位星等[10]研究证实在肺癌组织中,随着恶性程度的增加,HAI-1的表达下降,其下降会增加肺癌细胞的转移可能性,使肿瘤恶性程度提高。其可能的机制是上调的HGFA(hepatocytegrowth factor activator)的激活不受抑制,进而使HGF的激活上调从而促进肿瘤细胞的增生,运动能力增强,细胞分化受影响。ST14基因最初是作为促进肿瘤转移基因研究的,HAI-1是其蛋白产物的抑制剂,可能参与促进细胞分化成熟,并且其表达降低可能促进肿瘤的转移。Zeng等[11]发现在胃癌和大肠癌组织中HAI-1的表达显著低于相应的邻近的正常组织,并且HAI-1的表达下降可能与肿瘤的侵袭和淋巴结转移有关;HAI-1对Matriptase的抑制作用在转基因小鼠模型中得到进一步证实,HAI-1的过表达可以完全抑制Matriptase诱导的皮肤癌的发展[12];在乳腺癌的研究中,Parr等[13]通过检测乳腺癌组织,研究发现HAI-1 mRNA的表达明显高于正常乳腺对照组织,HAI-1 mRNA在低分化肿瘤中的表达显著降低,而分化较好的肿瘤则表达较高,HAI-1mRNA的表达与乳腺癌的分化呈正相关,因此也说明HAI-1可能可以作为肿瘤细胞的分化指标之一。
本次研究中发现,HAI-1在子宫内膜癌细胞株HEC-1A、HEC-1B和RL952中,HEC-1B中HAI-1的表达明显低于HEC-1A和RL952,然而HEC-1B的侵袭转移能力却显著强于HEC-1A和RL952,进而说明HAI-1的表达情况与子宫内膜癌的侵袭转移关系密切,HAI-1有可能直接或者间接抑制子宫内膜癌细胞,进而调控其侵袭转移能力。Nakamura等[14]通过检测子宫内膜癌细胞株HAI-1的表达情况中发现HAI-1无表达或低表达,说明HAI-1在子宫内膜癌中充当着抑癌基因的作用,在子宫内膜癌细胞系KLE和HEC-251转染HAI-1后发现HAI-1明显抑制matriptase的表达。并且发现HAI-1在细胞增殖、侵袭和转移过程中是通过抑制matriptase和hepsin表达来实现的。这也进一步证实我们的研究结论。
综上所述,HAI-1在子宫内膜癌细胞中的表达与子宫内膜癌细胞侵袭迁移能力呈负相关,HAI-1作为子宫内膜癌的抑制基因。从而表明子宫内膜癌中HAI-1表达可能与肿瘤细胞恶性侵袭特性有关,并与患者的预后、肿瘤复发有着紧密联系,然而肿瘤的侵袭和转移是一个复杂的病理过程,但为了但全面完善评估HAI-1在子宫内膜癌侵袭转移过程中的角色,正常子宫内膜细胞的对比、组织学研究以及动物体内实验都是必不可少。总之,HAI-1与子宫内膜癌的侵袭转移过程密切相关,由此可以推断通过检测HAI-1基因和蛋白的表达水平的高低有助于判断子宫内膜癌患者发生侵袭转移的风险性,并且这将可能成为判断肿瘤肿瘤侵袭转移及预后的新指标。
[1] 谢幸,苟文丽.妇产科学[M].8版.北京:人民卫生出版社,2013.
[2] Shi YE,Torri J,Lynn Y,et al.Identification and characterization of a novel matrix-degrading protease from hormonedependent human breast Cancer cells[J].Cancer Res,1993,53(6):1409-1415.
[3] Baba T,Kawaguchi M,Fukushima T,et al.Loss of membrane-bound serine protease inhibitor HAI-1 induces oral squamous cell carcinoma cells' invasiveness[J].J Pathol,2012,228(2):181-92.
[4] Kojima K,Tsuzuki S,Fushiki T,et al.Roles of functional and structural domains of hepatocyte growth factor activator inhibitor type 1 in the inhibition of matriptase[J].J Biol Chem,2008,283(5):2478-2487.
[5] 程海霞,曹江,吴晴,等.HAI-1蛋白在人正常及肿瘤组织中的表达研究[J].中国肿瘤临床,2008,35(7):383-386.
[6] Zhao B,Yuan C,Li R,et al.Crystal structures of matriptase in complex with its inhibitor hepatocyte growth factor activator inhibitor-1[J]. J Biol Chem,2013,288(16):11155-11164.
[7] Chu LL,Xu Y,Yang JR,et al.Human cancer cells retain modest levels of enzymatically active matriptase only in extracellular milieu following induction of zymogen activation[J].PLoS One,2014, 9(3):e92244.
[8] Pendlebury D,Wang R,Henin RD,et al.Sequence and conformational specificity in substrate recognition: several human Kunitz protease inhibitordomains are specific substrates of mesotrypsin [J].J Biol Chem,2014,289(47):32783-32797.
[9] Chen YW,Xu Z,Baksh AN,et al .Antithrombin regulates matriptase activity involved in plasmin generation, syndecan shedding, and HGF activation in keratinocytes[J].PLoS One,2013,8(5):e62826.
[10] 张位星,过江.HAI-1,ST14在非小细胞肺癌中的表达及意义[J].中国现代医学杂志,2008,18(24):3606-3609.
[11] Zeng L,Zhang X.Expression of serine protease SNC19/matriptase and its inhibitor hepatocyte growth factor activator inhibitor type 1 in normal and malignant tissues of gastrointestinal tract[J].World J Gastroenterol ,2005,11(39):6202-6207.
[12] List K,Molinolo A, Sriuranpong V,et al.Deregulated matriptase causes ras-independent multistage carcinogenesis and promotes ras-mediated malignant transformation[J].Genes Dev,2005,19(16): 1934-1950.
[13] Parr C,Watkins G,Mansel RE, et al.The hepatocyte growth factor regulatory factors in human breast cancer[J].Clin Cancer Res, 2004,10(1 Pt1):202-211.
[14] Nakamura KHA, Kodama J.The role of hepatocyte growth factor activator inhibitor (HAI)-1 and HAI-2 in endometrial cancer [J]. Int J Cancer,2011,128(11):12613-12624.
The Relationship between HAI-1 and the Invasion and Migration of Endometrial Cancer Cells
JIN Qiong1, MIAO Fei1, HUANG Mian1, SUN Peng-ming2
(1 Department of Gynecology and Obstetrics, The First Hospital of Fuzhou, Fuzhou 350009, China; 2 Department of Gynecology, Fujian Province Maternal and Child Health Hospital, Fuzhou 350001, China)
ObjectiveTo explore the relationship between HAI-1 and the invasion and migration of endometrial cancer cells.MethodsDetect three endometrial cancer cells(HEC-1A, HEC-1B and RL952) mRNA expression level of HAI-1 by Q-RTPCR. Then, the ability of invasion and migration were compared between the three endometrial cancer cells using scratch assay and transwell chamber assay separately.Results①The relative expression of HAI-1 mRNA in three cells was(0.3042±0.0101), (0.0032±0.0001), (0.2580±0.0096), HAI-1 protein was positive in HEC-1A, HEC-1B and RL952, but was lower than HEC-1A and RL952 in HEC-1B. ②The scratch assay showed that the migration distance of HEC-1A, HEC-1B and RL952 were(173.30±7.33)μm, (437.00±8.72)μm and (135.30±6.89)μm. ③The millicell chamber invasion assay showed that the ability of invasion were (52.67±2.73), (117.30±3.48) and (62.00±3.06).ConclusionThe invasion and migration of endometrial cancer cells was negative related with the HAI-1 expression, Further study on the mechanism of HAI-1 tumor suppressor is expected to make HAI-1 is expected to be a new target in the diagnosis and treatment of endometrial carcinoma in the future.
HAI-1; Endometrial cancer; Invasion; Migration
R737.33
B
1671-8194(2017)19-0001-03
福州市科技计划项目(2015-S-140-4)
*通讯作者:E-mail:sunfemy@hotmail.com
