杜梨根系铁吸收关键基因生物信息学分析及缺铁胁迫对其表达的影响
2017-09-01郭献平吴中营王东升张四普牛佳佳
郭献平,吴中营,王东升,张四普,牛佳佳
(河南省农业科学院 园艺研究所,河南 郑州 450002)
杜梨根系铁吸收关键基因生物信息学分析及缺铁胁迫对其表达的影响
郭献平,吴中营,王东升*,张四普,牛佳佳
(河南省农业科学院 园艺研究所,河南 郑州 450002)
为了探究缺铁胁迫对杜梨根系铁吸收关键基因表达的影响,对杜梨根系铁吸收关键基因三价铁还原酶(PbFRO2)基因和铁转运蛋白(PbIRT1)基因的氨基酸序列进行了多重序列比对和进化树分析;采用改良的Hoagland营养液水培杜梨的方法,研究了缺铁胁迫对杜梨根系PbFRO2和PbIRT1基因相对表达量以及根系铁和锌含量的影响。结果表明,PbFRO2蛋白具有还原酶特性,PbIRT1蛋白属于二价金属离子转运蛋白家族—ZIP家族;缺铁胁迫9 d内,杜梨根系PbFRO2和PbIRT1的表达量整体上呈现出先升高后降低的趋势,胁迫3 d表达量达到最高点且与对照(加Fe-EDTA)差异显著;缺铁胁迫30 d,杜梨根系中铁含量比对照降低77.46%,而锌含量提高1 139.40%。综上可知,缺铁胁迫可诱导杜梨根系铁吸收关键基因表达量升高,进而促进二价金属离子转运蛋白的活性提高。
杜梨; 缺铁胁迫; 铁吸收; 三价铁还原酶基因; 铁转运蛋白基因
铁作为一种重要的微量营养元素,与果树的生长发育密切相关[1]。铁是植物光合作用和固氮作用2个重要的代谢途径中必要的辅助因子,其利用效率极大地影响植物的生长[2]。尽管自然界土壤中含有较多的铁,但在碱性或石灰性土壤中,铁易被氧化并以三价铁(Fe3+)形态存在,Fe3+溶解度较低,限制了铁的利用率。在这种条件下,为了维持植物的正常生长,在长期的进化中,植物从形态和生理上建立了一套适应机制。目前,对植物铁元素代谢的初期研究主要集中在根系的铁吸收机制方面。
Römheld等[3]1986年在总结前人研究的基础上,提出了高等植物在长期适应缺铁胁迫过程中所形成的2种适应性机制,双子叶植物以及非禾本科单子叶植物采用机制Ⅰ吸收铁,而单子叶禾本科植物釆用机制Ⅱ吸收铁。机制Ⅰ中,植物在进行铁吸收时,首先通过质膜上的H+-ATPase向根际分泌H+,酸化根际土壤,增加土壤中Fe3+的溶解性。在铁进入根系细胞之前,植物会先通过铁氧还原酶(FRO)将Fe3+还原为Fe2+,之后,再通过细胞膜上的铁转运蛋白IRT进入细胞。机制Ⅱ中,植物铁吸收的关键物质是麦根酸类植物铁载体MAs。这类植物发生缺铁胁迫时会分泌MAs,其对Fe3+亲和力强,能形成稳定的三价铁螯合物Fe3+-MAs,然后被运入植物体内。在番茄[4]、黄瓜[5]、豌豆[6-7]、水稻[8-9]、苹果[10]等中均发现了三价铁还原酶基因(PbFRO2)和二价铁转运蛋白基因(PbIRT1)2种关键基因。
中国梨属砧木资源丰富,华北、西北及华东的碱性土壤地区,多采用杜梨(Pyrusbetulifolia)作为砧木[11]。本试验在缺铁胁迫下对杜梨根系铁吸收关键基因PbFRO2和PbIRT1进行初步研究,为寻找提高碱性土壤中杜梨根系铁吸收效率的途径奠定理论基础。
1 材料和方法
1.1 试验材料
2016年2月底选择大小一致且饱满的杜梨种子,将种子置于无菌河沙中,在4 ℃的环境中层积催芽。2016年3月露白后播种于温室中,基质配比为V草炭∶V珍珠岩∶V蛭石=3∶1∶1。
1.2 主要试剂和仪器
试剂:RNA提取试剂盒购自天根生化科技(北京)有限公司(目录号:DP419),反转录试剂盒购自南京诺唯赞生物科技有限公司(目录号:R211-01/02)。仪器:美国应用生物系统公司生产的ABI StepOnePlus实时荧光定量PCR系统,美国Teledyne Leeman Labs公司生产的ICP-Prodigy7等离子发射光谱仪。
1.3 试验方法
1.3.1 缺铁处理 杜梨苗长出6片真叶后,进行全营养液水培,每小时通气15 min。全营养液利用改良的Hoagland溶液(表1)。全营养液培养2周后,进行缺铁处理(不加Fe-EDTA,即-Fe),以加Fe-EDTA为对照(+Fe)。

表1 改良Hoagland溶液的组成
1.3.2 杜梨根系PbFRO2和PbIRT1多重序列比对和系统进化树分析 在NCBI(美国国立生物技术信息中心)中查询到杜梨PbFRO2氨基酸序列(Accession no.AKI29081.1)和PbIRT1氨基酸序列(AMY26505.1),通过NCBI中的BLASTp(https://blast.ncbi.nlm.nih.gov/Blast.cgi)序列比对,获得拟南芥(Arabidopsisthaliana)AtFRO2(NP_171664.1)、小金海棠(Malusbaccatavar.xiaojinensis)MxFRO2(ABU54827.1)、番茄(Solanumlycopersicum)LeFRO1(AAP46144.1)、豌豆(Pisumsativum)PsFRO1(AAK95654.2)、黄瓜(Cucumissativus)CsFRO1(AAT01415.1)氨基酸序列,以及拟南芥AtIRT1(NP_567590.3)、AtIRT2(NP_001031670.1),豆梨(Pyruscalleryana)PcIRT1(AMY26506.1),小金海棠MxIRT1(AAO17059.1),番茄LeIRT1(AAD30548.1)、LeIRT2(AAD30549.1),豌豆PsRIT1(AAC17441.1),水稻(OryzasativaJaponica Group)OsIRT1 (XP_015632375.1)、OsIRT2(XP_015629246.1)氨基酸序列。
蛋白质预测和分析:利用在线工具(http://web.expasy.org/compute_pi/)预测分子量;利用CLUSTAL W(http://www.ebi.ac.uk/clustalw)和BOXSHADE (http://www.ch.embnet.org/software/BOX_form.html)进行多重序列分析;利用在线工具(http://www.ch.embnet.org/software/TMPRED_form.html)预测蛋白质跨膜结构域;利用在线工具(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽结构。利用MEGA 4.0软件以相邻连接法(Neighbour Joining,NJ)构建系统发育树。
1.3.3 杜梨根系PbFRO2和PbIRT1在缺铁胁迫不同时间的相对表达量 分别在缺铁处理0、1、2、3、6、9 d取杜梨根系,放入-80 ℃液氮保存。在NCBI中获得PbFRO2和PbIRT1 cDNA全长的基础上,利用Primer 5.0设计qPCR引物,以Actin为内参基因,PbActinQ-F:5′-TCTTCTCAACAACGACCCCA-3′,PbActinQ-R:5′-CATGAAGTCGGCAGCAAGAA-3′,PbFRO2Q-F:5′-TCAAGCCGAACCCTTCAGAC-3′,PbFRO2Q-R:5′-TCATTCCAAGCCAGAGCCAG-3′,PbIRT1Q-F:5′-TGCAGCACTGAAAACACCTC-3′,PbIRT1Q-R:5′-AGAGGTTTCGATCAGGGTGG-3′。引物合成由南京金斯瑞生物科技有限公司完成。
实时荧光定量PCR反应体系参照南京诺唯赞生物科技有限公司的SYBR Green Master Mix试剂盒,每个样品设3个重复。反应程序:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火延伸1 min,40个循环。采用2-△△CT方法进行表达量分析。
印刷行业的质量检测,与其他行业有很大的不同,而且国内外市场对于印刷质量检测的理解也有很大的差别。通常情况下,国内企业在使用国外的质量检测系统时,由于产品的要求比国外低,故导致废品率很高。凌云考虑到了这一因素,于是为研发的质量检测系统设定了一个弹性的标准,从而解决了这一问题,并可在一定程度上降低企业的成本和废品率。“质量是最关键的,我们国内的印刷企业不是做不好,而是对质量缺乏‘敬畏’。”凌云总裁姚毅强调说:“产品的质量基准设置好以后,大家都应该遵循这一标准,是成品就是成品,是废品就是废品,这样的意识正是国内印刷企业所欠缺的。”姚毅真心希望国内印刷企业能够重视产品的质量检测。
1.3.4 根系铁和锌含量的测定 在缺铁胁迫30 d,取对照和缺铁杜梨苗根系测定铁和锌含量,测定方法为酸消解-ICP法。
1.3.5 数据统计分析 采用Excel和SPSS 22.0进行方差分析,以LSD最小显著性差异法进行差异显著性分析。
2 结果与分析
2.1 PbFRO2和PbIRT1多重序列比对
杜梨PbFRO2基因 cDNA全长2 163 bp,开放阅读框编码PbFRO2蛋白具有720个氨基酸,分子质量为80.70 ku。图1显示了杜梨与拟南芥、小金海棠、番茄FRO2蛋白的氨基酸序列比对,黑色部分表示完全相同的蛋白质序列,灰色表示相似序列,其中,PbFRO2与拟南芥三价铁还原酶蛋白AtFRO2的蛋白序列同源性达58%,相似度达76%,与小金海棠、番茄FRO2蛋白序列同源性达59%、62%,相似度达77%、79%。
图1显示,PbFRO2中445—458氨基酸序列含有氧化还原酶的标识序列[12]。通过跨膜结构和信号肽预测,PbFRO2具有10个跨膜结构域,无信号肽序列。另外,在第七和第八跨膜结构域之间,存在黄素腺嘌呤二核苷酸(FAD)结合位点(氨基酸序列337—382),还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)结合位点(427—432)。
杜梨PbIRT1 cDNA全长1 188 bp,开放阅读框编码PbIRT1蛋白具有364个氨基酸,分子质量为39.10 ku。图2显示了杜梨与豆梨、小金海棠、番茄、豌豆、水稻IRT1蛋白的氨基酸序列比对,其中,PbIRT1与拟南芥铁转运蛋白AtIRT1的蛋白序列同源性达59%,相似度达73%,与豆梨、小金海棠、番茄、豌豆、水稻IRT1蛋白序列同源性达99%、98%、73%、67%、55%,相似度达99%、98%、84%、80%、72%。
图2显示,PbIRT1中227—231氨基酸序列符合ZIP家族的标识序列区域的氨基酸序列[LIVFA][GAS][LIVMD][LIVSCG][LIVFAS]H[SAN][LIVFA][LIVFMAT][LIVDE]G[LIVF][SAN][LIFVF][GS][13]。通过跨膜结构和信号肽预测,PbIRT1具有8个跨膜结构域,N端1—30为信号肽序列,在第三和第四跨膜结构域间有一可变区,可变区方框内富含组氨酸(His)。通过以上分析推理得出,PbIRT1具有ZIP家族的特征[14],为家族成员之一。
2.2 PbFRO2和PbIRT1系统发育分析
2.3 缺铁胁迫不同时间杜梨根系铁吸收关键基因表达特性分析
对杜梨进行缺铁胁迫9 d,检测不同时期杜梨根系PbFRO2和PbIRT1相对表达量(图4),采用2-△△CT方法进行表达量数据分析。结果表明,对照0 d二者相对表达量为1,缺铁胁迫1 d,PbFRO2相对表达量比对照显著降低,PbIRT1相对表达量与对照无显著差异。缺铁胁迫2 d后,PbFRO2和PbIRT1逐渐升高,在3 d达到最高(分别为25.41和13.91),之后二者的相对表达量降低,但均与对照差异显著,在9 d分别为2.85和4.07。缺铁胁迫9 d内,对照之间的相对表达量差异不显著(P>0.05)。

TM1—10表示跨膜结构域1—10;FAD-binding site表示黄素腺嘌呤二核苷酸结合位点;NADPH-binding site表示还原型烟酰胺腺嘌呤二核苷酸磷酸结合位点;Oxidoreductase signature 表示氧化还原酶的标识序列

TM1—8表示跨膜结构域1—8;Variable region表示可变区,方框内富含组氨酸残基序列;Signal peptide 表示信号肽序列;ZIP signature 表示ZIP家族的标识序列

图3 PbFRO2和PbIRT1进化树分析
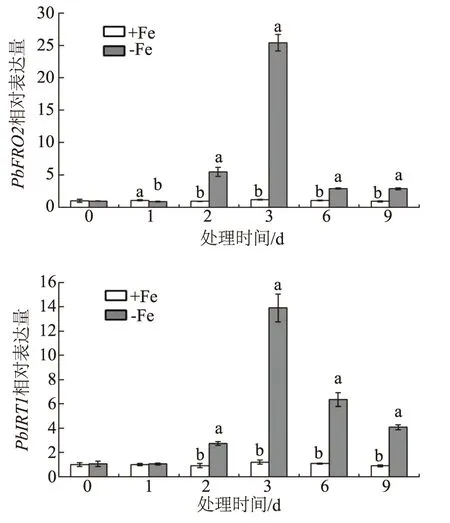
同一时间不同小写字母表示差异显著(P<0.05)
2.4 缺铁胁迫30 d对杜梨根系铁和锌含量的影响
在缺铁胁迫30 d时,对照和缺铁处理的杜梨苗已有明显的表型差异(图5),此时,缺铁胁迫的杜梨根系铁含量比对照降低77.46%,而锌含量比对照提高1 139.40%,铁和锌含量均与对照差异显著(图6)。

图5 缺铁胁迫30 d对照(左)和缺铁处理(右)杜梨表型差异
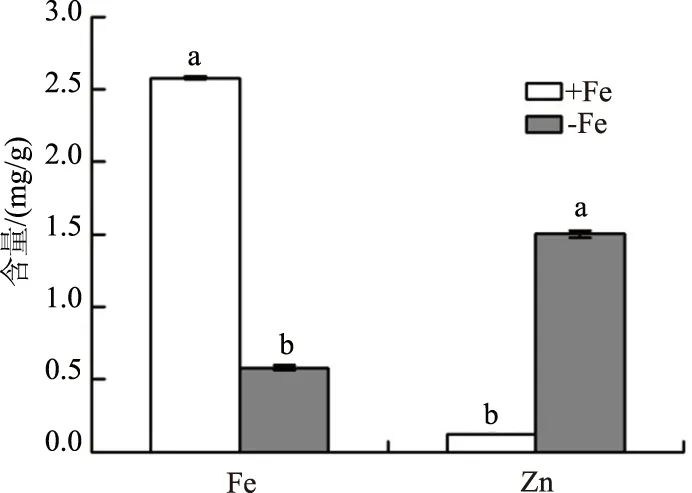
同一指标不同字母表示差异显著(P<0.05)
3 结论与讨论
本试验结果表明,杜梨根系三价铁还原酶PbFRO2具有还原酶特性,铁转运蛋白PbIRT1属于二价金属离子转运蛋白家族—ZIP家族。二价金属离子转运基因家族—ZIP基因家族由IRT1和相关的金属转运蛋白基因组成[15],拟南芥AtIRT1是ZIP基因家族的第1个成员。该基因家族编码一种长度为309~476个氨基酸残基的膜结合蛋白,具有8个疏水跨膜结构域,每个结构域都含有20多个氨基酸残基[15]。二价铁转运蛋白基因IRT表达量升高,不仅增强转运铁的效率,同时也提高了转运锌和锰等二价金属离子的能力,缺铁胁迫下,拟南芥根系中锌和锰含量均显著高于对照[16],豌豆根系中锌、锰、铜含量以及有毒的镉含量均显著高于对照[17]。ZIP基因家族在跨膜结构域3和4之间是一个与金属离子结合的可变区,这个富含His的区域对于金属离子的结合和跨膜转运是重要的,改变其内的某些氨基酸残基可以改变其对二价金属离子结合的特性。将拟南芥AtIRT1氨基酸序列103位通过点突变由谷氨酸(E)改为丙氨酸(A),在酵母二价铁转运蛋白突变体fet3fet4中相同表达量下,与对照相比,在铁的吸收效率不降低的情况下,可有效减少锌的吸收效率[18]。
本研究表明,缺铁胁迫可诱导杜梨根系铁吸收关键基因表达量升高,进而促进二价金属离子转运蛋白的活性提高。缺铁胁迫9 d内,杜梨根系PbFRO2和PbIRT1的表达量表现出先升高后降低的趋势,胁迫3 d表达量达到最高点且与对照差异显著,对照之间表达量变化差异不显著。缺铁胁迫30 d,杜梨根系中铁含量比对照降低77.46%,而锌含量提高1 139.40%。拟南芥在缺铁胁迫下AtFRO2和AtIRT1的表达量呈现先降低后增高再降低的趋势,缺铁处理6 hAtFRO2和AtIRT1表达量比对照降低,12 h后开始上升,在24 h达到最高峰,之后逐渐降低[19]。小金海棠在缺铁胁迫下2个关键基因的相对表达量也表现出与拟南芥相同的趋势,缺铁胁迫第2天表达量降低,第8天达到最高峰,之后降低[10]。有研究表明,FRO2和IRT1表达量受根际铁含量和叶片铁营养状况的双重调控,拟南芥根系周围的铁本身可诱导AtFRO2和AtIRT1表达量的升高[20]。在缺铁胁迫初期,根系周围的铁含量降低,植物根系反应为植物不再需要吸收铁,铁吸收相关基因表达量降低,随着胁迫时间延长,叶片铁含量不能满足需求,产生信号物质传达到根系促使FRO2和IRT1表达量升高,进而提高铁的吸收效率。
本研究虽然对PbFRO2和PbIRT1进行了分析,但其功能还需要通过超表达和RNA干扰进行验证。另外,进一步研究FRO2和IRT1转录前和转录后调控、铁感受信号物质等方面,对探索逆境条件下杜梨如何高效吸收铁具有重要意义。
[1] 章镇,韩振海.果树分子生物学[M].上海:上海科学技术出版社,2012:153.
[2] Ling H Q,Bauer P,Bereczky Z,etal.The tomatofergene encoding a bHLH protein controls iron-uptake responses in roots[J].Proceedings of the National Academy of Sciences,2002,99(21):13938-13943.
[3] Römheld V,Marschner H.Evidence for a specific uptake system for iron phytosiderophores in roots of grasses[J].Plant Physiology,1986,80(1):175-180.
[4] Zuchi S,Cesco S,Varanini Z,etal.Sulphur deprivation limits Fe-deficiency responses in tomato plants[J].Planta,2009,230(1):85-94.
[5] Waters B M,Lucena C,Romera F J,etal.Ethylene involvement in the regulation of the H+-ATPaseCsHA1 gene and of the new isolated ferric reductaseCsFRO1 and iron transporterCsIRT1 genes in cucumber plants[J].Plant Physiology and Biochemistry,2007,45(5):293-301.
[6] Waters B M,Blevins D G,Eide D J.Characterization of FRO1,a pea ferric-chelate reductase involved in root iron acquisition[J].Plant Physiology,2002,129(1):85-94.
[7] Cohen C K,Garvin D F,Kochian L V.Kinetic properties of a micronutrient transporter fromPisumsativumindicate a primary function in Fe uptake from the soil[J].Planta,2004,218(5):784-792.
[8] Bughio N,Yamaguchi H,Nishizawa N K,etal.Cloning an iron-regulated metal transporter from rice[J].Journal of Experimental Botany,2002,53(374):1677-1682.
[9] Ishimaru Y,Suzuki M,Tsukamoto T,etal.Rice plants take up iron as an Fe3+-phytosiderophore and as Fe2+[J].The Plant Journal,2006,45(3):335-346.
[10] Gao C,Wang Y,Xiao D S,etal.Comparison of cadmium-induced iron-deficiency responses and genuine iron-deficiency responses inMalusxiaojinensis[J].Plant Science,2011,181(3):269-274.
[11] 张绍铃.梨学[M].北京:中国农业出版社,2013:170-171.
[12] Ding H,Duan L,Wu H,etal.Regulation of AhFRO1,an Fe(III)-chelate reductase of peanut,during iron deficiency stress and intercropping with maize[J].Physiologia Plantarum,2009,136(3):274-283.
[13] Eng B H,Guerinot M L,Eide D,etal.Sequence analyses and phylogenetic characterization of the ZIP family of metal ion transport proteins[J].Journal of Membrane Biology,1998,166(1):1-7.
[14] Guerinot M L.The ZIP family of metal transporters[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,2000,1465(1):190-198.
[15] 渠慎春,章镇,乔玉山.植物ZIP基因家族铁载体蛋白基因研究进展[J].西北植物学报,2004,24(7):1348-1354.
[16] Vert G,Grotz N,Dédaldéchamp F,etal.IRT1,an Arabidopsis transporter essential for iron uptake from the soil and for plant growth[J].The Plant Cell,2002,14(6):1223-1233.
[17] Cohen C K,Fox T C,Garvin D F,etal.The role of iron-deficiency stress responses in stimulating heavy-metal transport in plants[J].Plant Physiology,1998,116(3):1063-1072.
[18] Rogers E E,Eide D J,Guerinot M L.Altered selectivity in anArabidopsismetal transporter[J].Proceedings of the National Academy of Sciences,2000,97(22):12356-12360.
[19] Wang H Y,Klatte M,Jakoby M,etal.Iron deficiency-mediated stress regulation of four subgroup IbBHLHgenes inArabidopsisthaliana[J].Planta,2007,226(4):897-908.
[20] Vert G A,Briat J F,Curie C.Dual regulation of theArabidopsishigh-affinity root iron uptake system by local and long-distance signals[J].Plant Physiology,2003,132(2):796-804.
Bioinformatics Analysis of Iron Uptake Key Gene in the Root ofPyrusbetulifoliaand the Effect of Iron Deficiency on Its Expression
GUO Xianping,WU Zhongying,WANG Dongsheng*,ZHANG Sipu,NIU Jiajia
(Institute of Horticulture,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
To explore the effect of iron deficiency on iron uptake key gene expression in the root ofPyrusbetulifolia,the amino acid sequences of ferric reduction oxidase gene(PbFRO2) and iron-regulated transporter gene(PbIRT1) ofPyrusbetulifoliawere separately compared with other plants,phylogenetic analysis was used to examine the evolutionary relationships,and the effects of iron deficiency on thePbFRO2 andPbIRT1 gene expression and Fe and zinc contents in the root ofPyrusbetulifoliawere studied by using the modified Hoagland nutrient solution for culture.The results showed that PbFRO2 protein had reductase features,and PbIRT1 protein was one of the members of the ZIP family.ThePbFRO2 andPbIRT1 gene expression showed a trend of increase first and then decrease under iron deficiency for 9 days,and the expression level reached its highest point on the 3rd day,with a significant difference from the control.Fe content in root was reduced by 77.46%,and the zinc content was increased by 1 139.40% on the 30th day under iron deficiency.In conclusion,the increase of iron uptake key gene expression in the root ofPyrusbetulifoliacan be induced under iron deficiency stress,which further promotes the activity of divalent metal ion transporters.
Pyrusbetulifolia; iron deficiency; iron uptake; ferric reduction oxidase gene; iron-regulated transporter gene
2017-02-20
河南省基础与前沿技术研究计划项目(162300410147);国家梨产业技术体系项目(CARS-29-3)
郭献平(1982-),男,河南内黄人,助理研究员,博士,主要从事梨树栽培生理与分子生物学研究。 E-mail:xianping2005@163.com
*通讯作者:王东升(1966-),男,河南武陟人,研究员,硕士,主要从事梨栽培生理研究。E-mail:wdse66@126.com
S661.2
A
1004-3268(2017)08-0096-06
