不同品种澳洲坚果花粉生活力的研究
2017-09-01罗立娜韩树全范建新王代谷吴小波
罗立娜,韩树全,范建新,王代谷,刘 荣,黄 海,吴小波
(贵州省亚热带作物研究所,贵州 兴义 562400)
不同品种澳洲坚果花粉生活力的研究
罗立娜,韩树全,范建新*,王代谷,刘 荣,黄 海,吴小波
(贵州省亚热带作物研究所,贵州 兴义 562400)
为了比较不同品种澳洲坚果花粉的生活力,筛选适合的检测方法,以6个澳洲坚果品种的新鲜花粉为材料,并用形态测定法、联苯胺染色法和蓝墨水染色法3种方法测定花粉生活力,结果表明:在显微镜下观察,澳洲坚果花粉粒均呈现三角形或近三角形,颜色呈灰色或灰褐色。其中,形态测定法是根据花粉的形状来检测生活力,准确性低;蓝墨水染色法染色后颜色不易分辨,不适合澳洲坚果花粉生活力检测;联苯胺染色法测定澳洲坚果花粉生活力效果最佳,不同品种澳洲坚果的花粉萌发率在72.50%~90.63%之间,其中以Kau的花粉生活力最高。因此,推荐联苯胺染色法是测定澳洲坚果花粉生活力的较简单、快速、准确的方法。
澳洲坚果;花粉生活力;形态测定法;联苯胺染色法;蓝墨水染色法
澳洲坚果(Macadamiaternifolia)是山龙眼科澳洲坚果属的多年生常绿果树,又名夏威夷果、昆士兰栗、澳洲胡桃,原产于澳大利亚昆士兰和新南威尔士的亚热带雨林地区。目前,主产国分布在澳大利亚、南非、美国、肯尼亚、中国等[1-4]。澳洲坚果果仁具有奶油香味、口感酥脆,脂肪酸含量高达60%~80%,含有多种微量元素、维生素等物质,具有很高的营养价值,有着“世界坚果之王”的美誉[5-9]。目前,在我国热区迅猛发展,应用前景广阔。
花粉质量的好坏、生活力的强弱是直接影响坐果率的重要因素[10],花粉生活力弱,有效授粉率低,会影响果树的产量。澳洲坚果每年开花量大,但授粉过程中存在自交不亲和性,且不同品种间的花期不一致,导致坐果率下降,产量受到影响。为了研究澳洲坚果新鲜花粉生活力的强弱,本文对6个澳洲坚果品种的花粉生活力进行了分析,以筛选澳洲坚果花粉生活力测定的最佳方法,同时研究了不同品种花粉生活力的差别,为澳洲坚果的授粉、花粉贮藏、杂交育种等提供参考。
1 材料与方法
1.1 试验材料
试验材料取自于贵州省亚热带作物研究所望谟科技示范园澳洲坚果基地,供试品种有Kau(344)、Pahaha(788)、Own Choice(O.C)、H2、桂热1号、695,园地条件一致,设施完善,植株长势健壮。在盛花期上午10:00~12:00采集即将开放的整朵花序,迅速带回实验室后,轻轻抖动使花粉从花药中散出,置于培养皿中,待花粉自然干燥后收集于塑封袋中,放于-20 ℃冰箱中保存备用。
1.2 试验药剂及方法
1.2.1 试验所用药剂及仪器 试验所用试剂:蓝墨水、联苯胺、α-萘酚、碳酸钠、过氧化氢(表1),仪器包括显微镜、培养皿、镊子等。

表1 试验药剂
1.2.2 形态测定法 形态测定法的基本原理是根据花粉大小、形状、颜色来判断花粉生活力。首先在载玻片上滴蒸馏水1~2滴,用头发丝蘸取少量花粉放入蒸馏水中,盖上盖玻片5 min后在10×显微镜下观察花粉的形状、颜色等特征。有生活力的花粉表现为大小均匀、形状规则、内含物饱满,而发育不正常的花粉则大小不齐、形状各异、遇水容易破裂。观察3个不同视野,每个视野花粉粒总数在70粒以上,计算有生活力花粉粒与花粉总数之比,计算公式如下:
花粉生活力/%=(有生活力花粉粒数/总花粉粒数)×100%
1.2.3 联苯胺染色法 联苯胺染色法又称过氧化物酶染色法,其原理是根据所用试剂与花粉中的过氧化物酶发生氧化反应而染色。第一步,称取0.1 g联苯胺溶于50 mL浓度为50%的酒精中;第二步,称取0.075 g α-萘酚溶于50 mL浓度为50%的酒精中;第三步,称取0.125 g碳酸钠溶于50 mL蒸馏水中;第四步,配置0.3%过氧化氢溶液,盛于棕色瓶放于冰箱内保存备用。
检测方法:先将联苯胺溶液、α-萘酚溶液、碳酸钠溶液按等量配制成混合液,在载玻片加1滴混合液和1滴过氧化氢溶液,用头发丝蘸取少量花粉放入混合液中,盖上盖玻片静置15 min后,在10×显微镜下观察。凡具有生活力的花粉都被染上红色,无生活力的花粉则无色;观察3个不同视野,每个视野花粉粒总数在70粒以上,计算被染上红色花粉粒与总花粉粒数之比,计算公式如下:
花粉生活力/%=(充实饱满花粉数/总花粉数)×100%
1.2.4 蓝墨水染色法 在载玻片上滴入一滴蒸馏水,再加一滴蓝墨水溶液,用镊子搅拌均匀,用头发丝蘸取少量花粉放入溶液中,盖上盖玻片5 min后置于10×显微镜下观察。花粉粒呈无色时表示具有生活力,呈蓝黑色为无生活力或发育不良的花粉。观察3个不同视野,每个视野花粉粒总数在70粒以上,求其平均值,统计花粉的生活力,计算公式如下:
花粉萌发率/%=(无色花粉粒数/总花粉粒数)×100%
1.3 数据分析
采用Excel 2003软件对试验数据进行整理和分析,SigmaPlot 10.0进行绘图,SAS 9.1.3软件进行差异显著性分析。
2 结果与分析
2.1 形态观测法澳洲坚果花粉生活力的测定
在10×和40×显微镜下观察,澳洲坚果的花粉粒均呈现三角形或近三角形,颜色呈灰色或灰褐色(图1),表1显示了形态观测法测得澳洲坚果花粉生活力的结果。不同品种的澳洲坚果的花粉活力均在80%以上,由强到弱依次为H2、344、桂热1号、788、O.C、695;其中H2的花粉生活力最高,达到87.96%;695的花粉生活力最低,为84.53%。澳洲坚果的花粉生活力显著性分析见图2,结果表明:形态观测法测澳洲坚果不同品种间花粉生活力差异不显著。
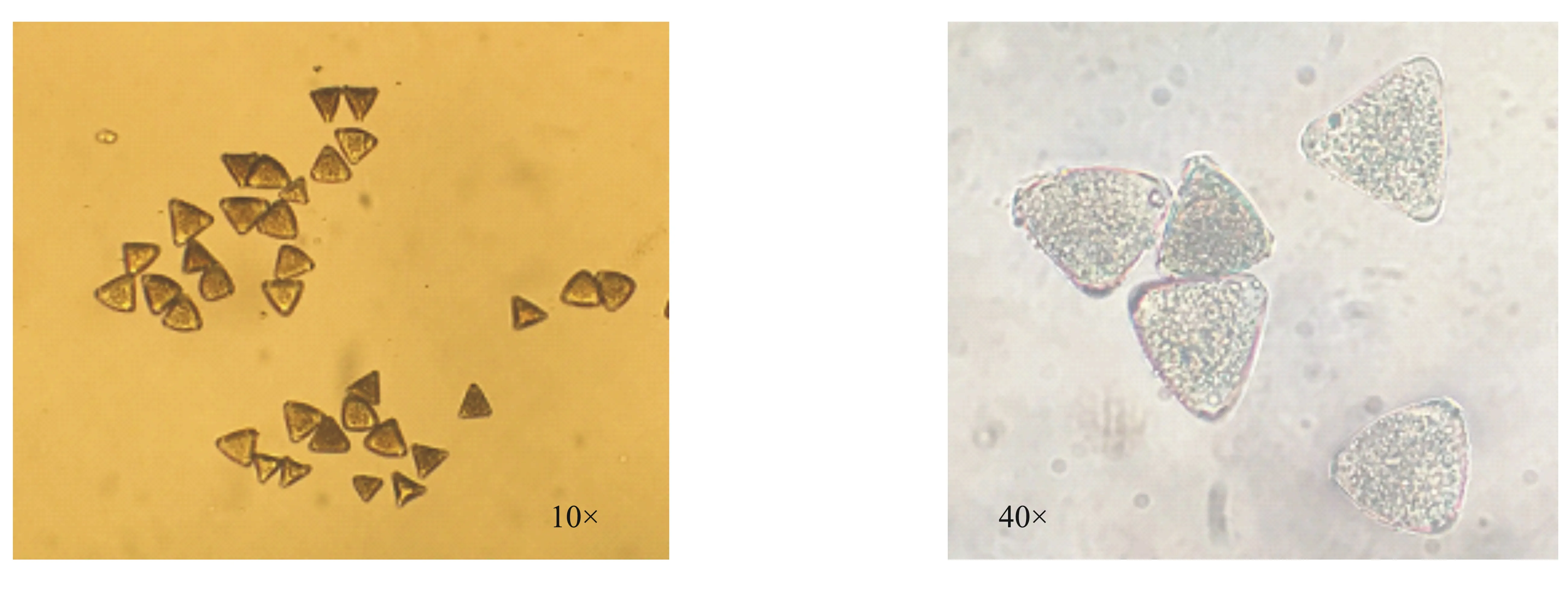
图1 10×和40×显微镜下澳洲坚果花粉的形态
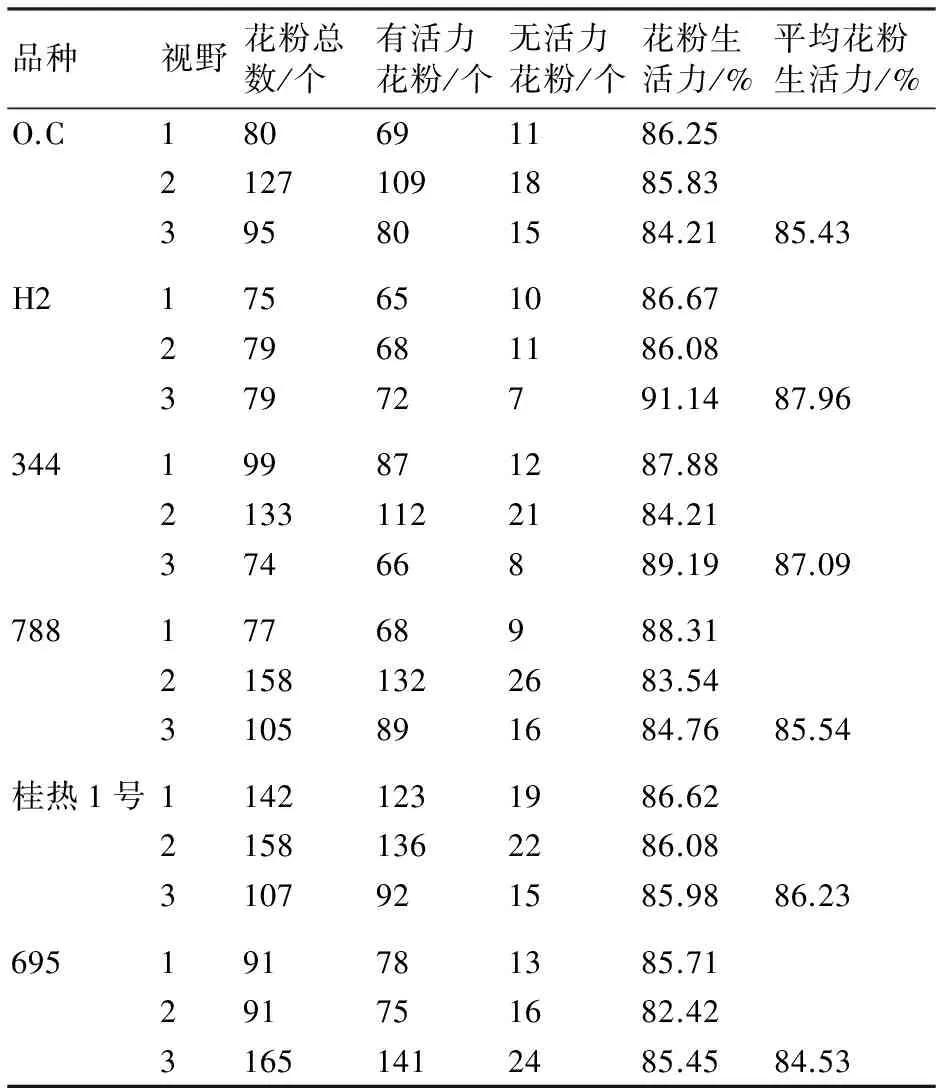
品种视野花粉总数/个有活力花粉/个无活力花粉/个花粉生活力/%平均花粉生活力/%O.C180691186.2521271091885.83395801584.2185.43H2175651086.67279681186.0837972791.1487.96344199871287.8821331122184.2137466889.1987.0978817768988.3121581322683.543105891684.7685.54桂热1号11421231986.6221581362286.083107921585.9886.23695191781385.71291751682.4231651412485.4584.53
图2 形态观测法测澳洲坚果花粉生活力的显著性分析
2.2 联苯胺染色法澳洲坚果花粉生活力的测定
由表3可以看出,在澳洲坚果不同品种中,花粉生活力变化范围在72.50%~90.63%之间,与形态观测法结果略有差异,花粉生活力最强的是344,为90.63%;其余依次为H2、桂热1号、788、695、O.C,花粉生活力分别为87.44%、85.99%、85.03%、77.46%、72.50%。由图3可以看出,花粉生活力较强的344、H2、桂热1号、788之间差异不显著,而344、H2与花粉生活力较弱的O.C、695差异显著(P<0.01)。
2.3 蓝墨水染色法澳洲坚果花粉生活力的测定
由表4可知,不同品种澳洲坚果花粉生活力在0.2%~1.5%之间,最高的是344,但花粉生活力仅1.5%。由此可知,蓝墨水染色法不适用于澳洲坚果花粉生活力的检测。
3 讨论
花粉活性检测是解决植物不同品种间的花期不遇、杂交育种困难等问题必不可少的基础性工作[11-13]。目前,国内对于澳洲坚果花粉生活力的研究较少,林玉虹等[14]以澳洲坚果O.C、788、800这3个品种为试材,研究了花粉活力和柱头可授性,结果发现:同一品种不同时间开放的小花柱头的可授性差异较大,前3 d不同品种小花的花粉活力差异极显著。王丽娜等[15]研究了水分胁迫对澳洲坚果花粉生活力和贮藏性的影响,结果表明:澳洲坚果花粉生活力测定最适合的方法是联苯胺染色法,不同品种间的贮藏性由强到弱依次为Kau>Pahala>O.C。杨帆等[16]以13年生澳洲坚果为试材研究花粉的最佳保存方式,发现以自然干燥2 h,保存5 d的花粉萌发率最大,同时采用琼脂培养基法测定花粉生活力为42.24%。
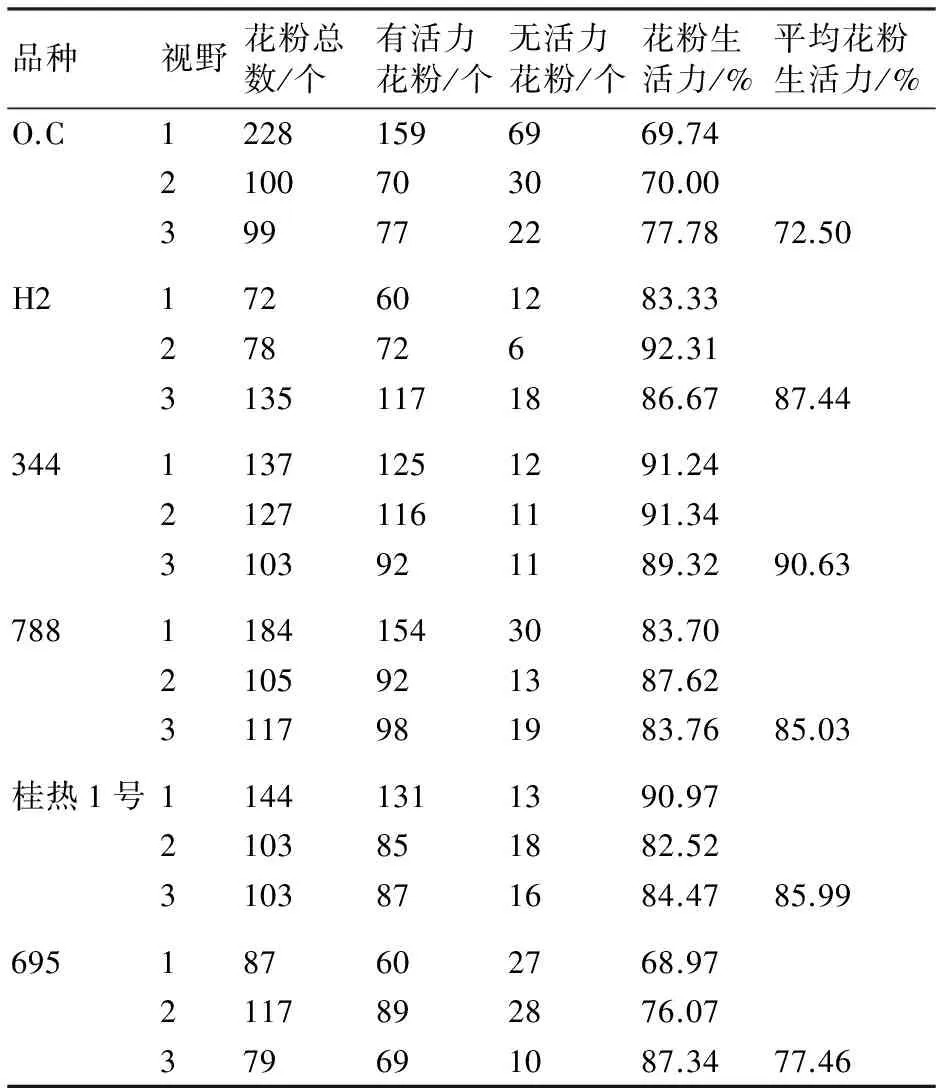
表3 联苯胺染色法测澳洲坚果花粉生活力的结果

图3 联苯胺染色法测澳洲

表4 不同澳洲坚果品种花粉生活力的比较 %
本文应用形态观测法、联苯胺染色法、蓝墨水染色法,测定了不同品种澳洲坚果的花粉生活力,结果表明:澳洲坚果花粉呈现三角形或近三角形,发育不良的花粉形状不规则,颜色灰白色。形态观测法测定澳洲坚果花粉生活力的操作方法简单,主要是通过花粉的大小、形态间的差异判断生活力的有无,结果的准确性较差。通过形态观察法观测澳洲坚果不同品种间花粉生活力变化不大,均在84.53%~87.96%之间,且差异不显著。
利用染色法测定花粉的生活力,方法简单快速,能在一定程度上反映花粉内部的代谢情况或营养含量,但方法受花粉壁的薄厚、质膜的完整性、细胞质含量及花粉内各种酶活性的强弱等因素的影响,因此,不同的染色方法并非对所有的植物花粉都适用[17-18]。联苯胺染色法测澳洲坚果花粉生活力速度快,颜色易于分辨,结果较可靠,该结果与杨帆等[16]的研究结果一致。本研究结果显示,不同品种花粉生活力值在72.50%~90.63%之间,表现出较高的生活力,但不同品种间存在明显的差异,花粉活力大小依次为344>H2>桂热1号>788>695>O.C。其中生活力较高的有344、H2,且与生活力较低的695、O.C呈显著性差异,这可能与不同种质的遗传特性或者不同树体的营养状况有关。蓝墨水染色法测澳洲坚果花粉生活力存在染色不均匀、与背景颜色难以区分等问题,结果不理想,不适用于检测澳洲坚果花粉的生活力。因此,本研究最终筛选出联苯胺染色法是测定澳洲坚果花粉生活力的较简单、快速、准确的方法。
[1] Hardner C M, Peace C P, Lowe A J, et al. Genetic resources and domestication of macadamia[J]. Horticultural reviews, 2009, 35: 1-125.
[2] Duxbur Y D. Lipid scientists shake healthy macadamia nut tree: recent studies showing protection against heart disease encourage more government-funded research[J]. Food Processing, 1995, 54(6): 83.
[3] 贺熙勇,倪书邦.世界澳洲坚果种质资源与育种概况[J].中国南方果树,2008,37(2):34-38.
[4] 陆超忠,曾辉,张汉周.澳洲坚果品种适应性研究[J].果树学报,2004,21(1):82-84.
[5] 王文林,陈海生,郑树芳,等.干旱处理对澳洲坚果光合特性的影响[J].热带农业科学,2017,37(3):63-68,73.
[6] 林文秋,杨为海,邹明宏,等.澳洲坚果果皮不同溶剂提取物的含量和抗氧化活性[J].江苏农业科学,2017,45(1):171-174.
[7] 余贵湘,段忠俊,卢靖,等.施肥和覆盖对澳洲坚果344和OC生长和产量的影响[J].经济林研究,2016,34(4):73-79.
[8] 王代谷,邹明宏,韩树全,等.澳洲坚果冻害及恢复调查[J].安徽农业科学,2016,44(35):64-66.
[9] 韩树全,范建新,王代谷,等.澳洲坚果生育期内叶片矿质营养元素含量及其变化[J].安徽农业科学,2016,44(23):8-10,52.
[10] Preston R E. The intrafloral phenology ofStreptantustortuosus(Brassicaceae)[J].American Journal of Botany, 1991, 8: 1044-1053.
[11] 林存学,刘滨.14个李品种花粉质量测定[J].中国林副特产,2016(6):21-22.
[12] 刘宝,曾杰,程伟,等.木本植物花粉采集、贮藏与活力检测的研究进展[J].广西林业科学,2008,37(2):76-79.
[13] 刘程宏,宋尚伟,张芳明.果树花粉生活力检测研究进展[J].河南农业科学,2011,40(10):13-16.
[14] 林玉虹,陈显国,周少霞,等.澳洲坚果花粉活力与柱头可授性研究[J].中国热带农业,2009(3):39-42.
[15] 王丽娜,陈李林,刘建福,等.水分胁迫对澳洲坚果花粉生活力和贮藏性的影响[J].亚热带植物科学,2005,34(2):18-20.
[16] 杨帆,陶丽,陈丽兰,等.澳洲坚果花粉保存及生活力测定[J].中国农学通报,2014,30(13):126-130.
[17] Dafni A, Firmage D. Pollen viability and longevity: practical, ecological and evolutionary implications[J]. Plant Systematics & Evolution, 2000, 222(1/4): 113-132.
[18] 赵宏波,陈发棣,房伟民.菊属植物花粉生活力检测方法的比较[J].浙江林学院学报,2006,23(4):406-409.
(责任编辑:曾小军)
Study on Pollen Viability of Different Macadamia Varieties
LUO Li-na, HAN Shu-quan, FAN Jian-xin*, WANG Dai-gu, LIU Rong, HUANG Hai, WU Xiao-bo
(Guizhou Institute of Subtropical Crops, Xingyi 562400, China)
In order to compare the pollen viability of different varieties of macadamia, and to screen out a suitable determination method, we determined the fresh pollen viability of six macadamia varieties by using morphometry method, benzidine coloration method and blue ink coloration method. The results indicated that: under a microscope, the pollen grains of macadamia were triangular or nearly triangular, and were gray or grayish brown in color. The morphometry method detected the pollen viability according to the shape of pollens, and had a low accuracy. The blue ink coloration method was not suitable for the determination of pollen viability of macadamia because it could not easily distinguish the pollen color after coloration. The benzidine coloration method had the best effect in the determination of pollen viability of macadamia. The pollen germination rate of different varieties of macadamia was 72.50%~90.63%, and the variety Kau had the highest pollen viability. Therefore, the benzidine coloration method was recommended as a simple, rapid and accurate method for measuring the pollen viability of macadamia.
Macadamia; Pollen viability; Morphometry method; Benzidine coloration method; Blue ink coloration method
2017-06-06
贵州省农业科学院项目(黔农科院院专项[2013]021号);贵州省农业科学院项目(黔农科院自主创新科研专项字[2014] 001号);贵州省科研机构服务企业行动计划(黔科合服企[2015]4002号)。
罗立娜(1991─),女,研究实习员,硕士,研究方向:植物栽培与生理。*通讯作者:范建新。
S664.9
A
1001-8581(2017)08-0034-04
