水稻品种间铝耐性差异的探究*
2017-08-31斌张慧玲朱晓芳沈仁芳
王 斌张慧玲朱晓芳沈仁芳†
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008)
(2 中国科学院大学,北京 100049)
(3 南京农业大学资源与环境科学学院,南京 210095)
水稻品种间铝耐性差异的探究*
王 斌1,2张慧玲3朱晓芳1沈仁芳1†
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008)
(2 中国科学院大学,北京 100049)
(3 南京农业大学资源与环境科学学院,南京 210095)
铝毒是酸性土壤中限制植物生长的主要因子之一,探讨植物耐铝特性与机理对提高酸性土壤植物生产力具有重要意义。通过一系列生理和分子生物学试验,主要探究了Nipponbare和Kasalath两个水稻品种的铝耐性差异。结果发现,与Kasalath相比,Nipponbare在铝胁迫下不仅拥有较长的根伸长,且根尖铝含量较少,表明Nipponbare是水稻铝耐性品种,而Kasalath为铝敏感品种。进一步研究发现,水稻根尖控制铝吸收的NRAT1基因在Kasalath中表达量更高,表明,NRAT1基因的高表达量可能是导致铝敏感品种Kasalath根尖铝含量较高的主要原因。此外,铝胁迫下,Nipponbare根系柠檬酸的分泌量显著高于Kasalath。而且,水稻中控制柠檬酸分泌的OsFRDL4基因在铝耐性品种Nipponbare中的表达量显著高于Kasalath,由此证明,柠檬酸在这两个品种水稻耐铝途径中可能起着重要的作用,并且,该品种水稻可以通过调控OsFRDL4基因的表达量来控制柠檬酸的分泌量。本研究中还分析了其他4个与铝胁迫相关的基因,但并未发现明显的相关性,值得进一步的探究。
水稻;铝胁迫;铝耐性;OsFRDL4;NRAT1
全世界约有39.5×108hm2酸性土壤,占世界可耕地土壤的40%,主要分布在热带、亚热带及温带地区、尤其是发展中国家[1]。我国酸性土壤遍及南方15个省区,广泛分布在我国东南部热带、亚热带地区,据资料统计分布面积可达14.8万~20.3万km2,约占全国陆地总面积的15.4%~21%[2-3]。Foy[4]和Kochian[1]认为铝毒害是酸性土壤上限制作物生长的主要因子之一。通常情况下,土壤中的铝是以不溶态的铝硅酸盐或者氧化铝的形式存在,对植物无毒,但当土壤pH<5.5时,铝就会从矿物态解离为离子态(其中以三价的Al3+毒性最强),从而对植物产生毒害作用[1,4]。因此,为了保障我国酸性土壤的粮食产量,不同作物耐铝机制的研究就显得格外重要。
水稻(Oryza sativa)是我国重要的粮食作物之一,广泛种植于南方各个省区,也是受铝毒影响较为普遍的作物之一。然而,不同基因型水稻品种间耐铝差异非常大,其中的原因并不完全知晓。近年来,马建锋实验室对水稻耐铝性做了一系列相关的研究,并取得了重大的研究成果:首次发现了与水稻铝耐性相关的转录因子ART1,其特异表达在水稻根部细胞核中,且不受铝的诱导。进一步研究发现,水稻ART1突变体对铝的敏感性增加,主要因为ART1能调控下游与铝耐性相关的31个基因的表达[5],并对其中多个基因进行了深入的研究,包括NRAT1、OsFRDL4、ALS1、STAR1和STAR2等[6]。其中,NRAT1基因编码的转运体主要在水稻根尖细胞的细胞膜上表达,能将外界的铝离子转运至细胞内,从而增加细胞内的铝含量[7]。ALS1编码的ABC转运体主要在植物根部细胞的液泡膜上表达,其能将植物中的铝转运至液泡中固定起来,从而减缓铝毒害[8]。STAR1编码的ABC转运体,能与同样在水稻根部细胞的细胞膜表达的STAR2联合运输二磷酸尿苷萄糖,用于修复破损的细胞壁,从缓解铝毒害[9]。OsFRDL4基因编码的蛋白质主要在水稻根尖细胞的细胞膜上表达,能够转运柠檬酸,是影响水稻耐铝性的重要基因,该基因在水稻铝耐性品种中受铝诱导的表达倍数要高于铝敏感品种,且有机酸的分泌量与该基因的表达量成正比[10]。本文试图研究这6个基因在两个不同耐铝水稻中表达量的差异,探究水稻品种的耐性差异是否与上述基因的表达量相关,为之后的水稻耐铝品种筛选提供数据支持。
1 材料与方法
1.1 供试材料
试验选取的水稻品种如下:Kasalath(A)、IR26(B)、奥优277(C)、扬稻6号(D)、亚优388(E)、杨辐籼2号(F)、南京16(G)、Koshihikari(H)和日本晴(Nipponbare)(I)。
选取各品种籽粒饱满的种子,在25℃下用蒸馏水浸泡过夜,然后将种子放置在湿润的滤纸上25℃避光催芽2~3 d,移至下含0.5 mmol L-1的CaCl2(pH 4.5)溶液的浮板上培养1 d。选取长势相近的幼苗,分别在含有0 µmol L-1、30 µmol L-1和50 µmol L-1AlCl3的CaCl2(0.5 mmol L-1,pH 4.5)溶液中培养24 h。处理前后均用直尺量取根长,计算相对根长率,每处理10个重复。
1.2 根尖铝含量测定
如上所述,水稻幼苗在0.5 mmol L-1的CaCl2(pH为4.5)溶液中培养1 d后,选取长势相近的幼苗在含50 µmol L-1AlCl3的CaCl2(0.5 mmol L-1,pH 4.5)溶液中培养24 h。切取铝处理后的根尖(0~1 cm)10个,用0.5 mmol L-1的CaCl2溶液冲洗3次后,放入1.5 ml的离心管中,加入1 ml 2 mol L-1的HCl溶液,中间间断地摇动。放置至少24 h后,吸取全部上清液转移至10 ml离心管中,定容至5 ml。用ICP-AES(IRIS-Advantage,ThermoElement,美国)测定溶液铝含量,每处理重复4次[11]。
1.3 根系分泌物的收集与测定
用木村营养液培养水稻幼苗2周,该营养液含有0.18 mmol L-1(NH4)2SO4、0.27 mmol L-1MgSO4·7H2O、0.09 mmol L-1KNO3、0.18 mmol L-1Ca(NO3)2·4H2O、0.09 mmol L-1KH2PO4、6.7 µmol L-1MnCl2·4H2O、9.4 µmol L-1H3BO3、0.01 µmol L-1(NH4)6Mo7O24·4H2O、0.15 µmol L-1ZnSO4·7H2O、0.16 µmol L-1CuSO4·5H2O 和10 µmol L-1EDTA-Fe。选取长势相近的水稻株系,放入1 L的容器中,置于pH4.5的0.5 mmol L-1CaCl2溶液中过夜,然后用含50 µmol L-1AlCl3的0.5 mmol L-1CaCl2溶液(pH4.5)处理24 h,收集其根系分泌物。
将收集溶液依次通过装有5 g阳离子交换树脂(Amberlite IR120 H+,Aldrich,美国)和装有3 g阴离子交换树脂(AG1-X8 Formate,Bio-Rad,美国)的离子吸附柱,再用15 ml的2 mol L-1HCl分3次洗脱阴离子吸附柱,洗脱液再用真空冷冻旋转蒸发仪(东京理化 1000S,日本)旋转蒸干,最后用1 ml超纯水溶解蒸馏瓶中的产物,用超快速高分离液相色谱仪(岛津 UFLC-20,日本)测定。测试条件:色谱柱(Agilent,SB-C18,250 nm × 4.6 nm,5 µm)、流动相为磷酸盐缓冲液(A,pH4.5)—甲醇(B),A(98%)—B(2%)、流速0.8 ml min-1、进样量20 µl、柱温30℃。
1.4 根尖RNA的提取
如上所述,水稻幼苗在0.5 mmol L-1的CaCl2(pH为4.5)溶液中培养1 d后,选取长势相近的幼苗,在含0 µmol L-1、50 µmol L-1AlCl3的CaCl2(0.5 m mol L-1,pH 4.5)溶液中培养24 h。切取铝处理后的根尖(0~1 cm)10~20条,用蒸馏水漂洗后放入1.5 ml的离心管中,立即放入液氮中冷冻,每个处理重复3次。冷冻完全后将样品倒入灭菌后的坩埚中碾碎,加入350 µl的裂解液(TIANGEN,中国),碾磨均匀后倒回1.5 ml的离心管中,在12 000 r min-1(ThmeroMicrocl17,德国)的条件下离心,吸取上清液用TGuige核酸自动提取仪(TIANGENM16,中国)提取RNA,最终定容至60 µl体系。
1.5 RNA反转录
吸取14 µlRNA放入PCR小管中,用反转录试剂盒(TOYOBO,日本),加入4 µl的反转录缓冲液(5×RT Buffer),1 µl的酶混合液(EnzymeMix),1 µl的引物混合液(PrimerMix),共20 µl体系。反转录程序为:37℃条件下15 min,98℃条件下5 min,4℃终止反应,得到cDNA。
1.6 实时定量PCR(RT-PCR)
RT-PCR为10 µl体系:5 µl的Tip qPCR Mix(TRANSGEN,中国),4.5 µl 的灭菌水,0.2 µl的正向引物,0.2 µl的反向引物,0.1 µl的cDNA。
仪器采用实时荧光定量PCR(Light-Cycler480II,Roch,瑞士)。运作程序为三步法,95℃下15 s,55℃下15 s,72℃下20 s,共45个循环。其中,ART1、NRAT1、OsFRDL4、ALS1四个基因用HistoneH3作为内参基因,STAR1和STAR2两个基因用Actin作为内参基因。反应的引物序列详见表1。

表1 荧光定量PCR引物序列表Table 1 Primer sequence for RT-PCR
1.7 数据处理
相对根伸长率(RRE)的计算公式如下[12]:
RRE=(RLAl,i-RLAl0)/(RLC,i-RLC0)×100%
式中,RLAl,i为铝处理24 h后的根长;RLAl0为铝处理前的根长;RLC,i为对照处理24 h后的根长;RLC0为对照处理前的根长。
本研究中,相对根伸长率测定结果为10次重复的平均值,根尖铝含量测定结果为4次重复的平均值,其余均为3次重复的平均值。所得数据采用Excel 2007和SPSS 16.0软件进行处理和统计分析。用单因素方差分析(One-way ANOVA)检验不同处理在p<0.05条件下的差异显著性。
2 结 果
2.1 不同水稻品种铝胁迫下的相对根伸长
铝胁迫下,植物的根伸长会受到显著抑制。因此,测定相同条件下植物根长便可断定该植株对铝胁迫的耐性大小,而相对伸长率也成了筛选不同耐铝植物的重要指标[11]。由图1可见,不同水稻品种在30 µmol L-1铝溶液处理下,已经受到了不同程度的抑制。尤其是Kasalath受抑制尤其明显,根伸长率为32.27%。而Nipponbare则表现得相对较耐铝,根伸长率68.17%。品种之间的耐性差值高达35%,差异显著。在50 µmol L-1铝处理下,植物的根伸长受到了进一步的抑制。图中表现为,Kasalath作为水稻敏感品种受抑制最明显,根伸长率为27.95%。而Nipponbare仍然是耐性品种,根生长率为54.60%。敏感品种与耐性品种间差异高达26%,差异显著。因此,根据本结果选取典型试验材料,Kasalath为相对铝敏感品种,Nipponbare为相对铝耐性品种。
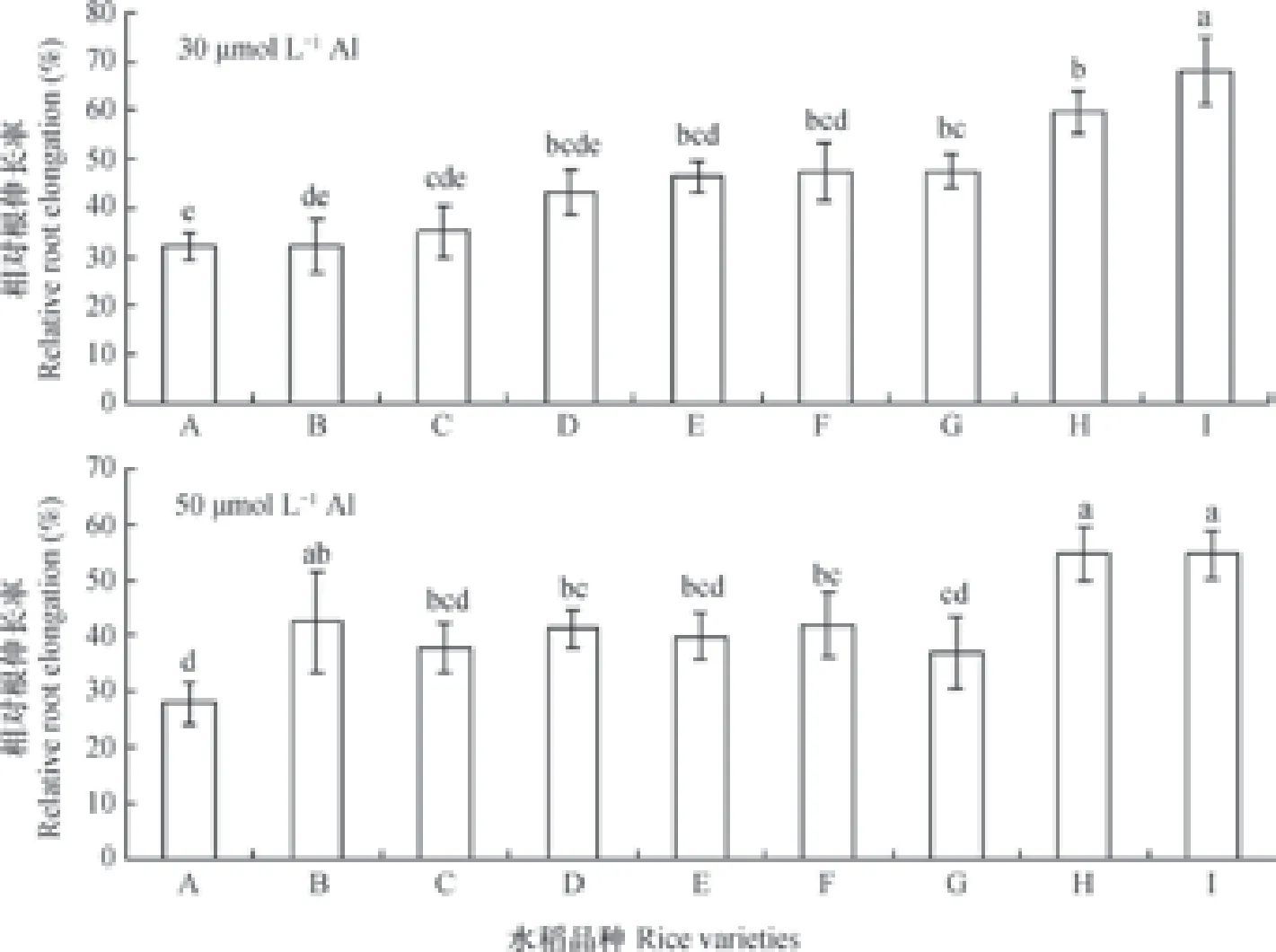
图1 30 µmol L-1和50 µmol L-1铝处理24 h水稻相对根伸长Fig. 1 Relative root elongation(RRE)of the rice plants exposed to 30 µmol L-1and 50 µmol L-1aluminum(Al)for 24 h
2.2 不同水稻品种根尖铝含量
根尖是根伸长最重要的部位,也是铝毒害最为敏感的部位[13]。水稻是一种铝排斥植物,铝耐性的强弱往往与根尖铝积累量的高低有关。从图2中可见,Kasalath的根尖铝积累量是Nipponbare的1.6倍,差异显著。由此得出,Kasalath确实为铝敏感品种,并且根尖铝含量相对较高,Nipponbare为铝耐性品种,根尖铝含量相对较低。
2.3 不同水稻品种根系分泌柠檬酸含量
在植物耐铝机制的研究中,植物根部可以通过分泌有机酸与环境中的铝螯合,从而减轻铝毒害[14]。本研究发现,Nipponbare与Kasalath在铝处理前两者柠檬酸的分泌量无差异,而铝处理后两者柠檬酸分泌量显著上升,说明柠檬酸的分泌受铝胁迫响应。同时,Nipponbare铝处理后柠檬酸分泌量显著高于Kasalath(图3),推测水稻铝耐性品种在铝胁迫下会分泌更多的柠檬酸来缓解铝毒。

图2 50 µmol L-1铝处理24 h水稻根尖铝含量Fig. 2 Al content in the root tips of the rice plants exposed to 50 µmol L-1Al for 24 h
2.4 水稻耐Al相关基因表达
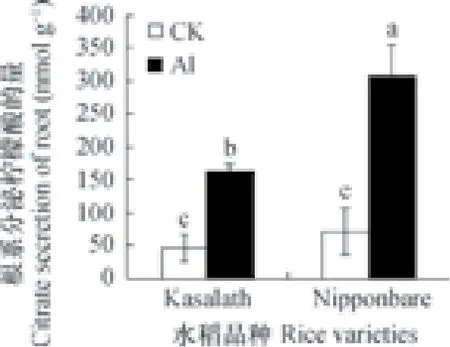
图3 50 µmol L-1铝处理24 h水稻根部柠檬酸分泌量Fig. 3 Secretion of citric acid from roots of the rice plants exposed to 50 µmol L-1Al for 24 h
由图4可见,铝处理后,ART1、ALS1和STAR2基因在不同铝耐性品种水稻中的表达量无显著差异,而STAR1虽然铝处理后两者存在显著差异,但STAR1与SRAT2在功能上共同起作用,因此,该4个基因对水稻品种间铝耐性差异是否有关,值得进一步的研究。其中,ART1基因在铝处理前后,表达水平均未发生显著变化。表明,该基因虽为水稻中众多铝耐性相关基因的调控因子,但本身并不受铝诱导而发生表达量变化,而ALS1、STAR1和STAR2则受铝诱导后表达量显著上升,表明这些基因受铝诱导表达,与前人研究结果[5,9]一致。

图4 50 µmol L-1铝处理24 h相关基因根尖相对表达量Fig. 4 Expression levels of Al tolerance related genes in root tips of the rice plants exposed to 50 µmol L-1Al for 24 h
由图5A可见,铝处理后,Kasalath与Nipponbare中NRAT1的表达量均显著上升,表明该基因受铝诱导。其中,Kasalath中NRAT1表达量上调5倍,Nipponbare中NRAT1上调4倍。Kasalath中NRAT1的基因表达量显著高于耐性品种Nipponbare。由于NRAT1能将外界的铝转运至细胞内,ALS1编码的ABC转运体又能将植物细胞内的铝转运至液泡中固定起来,因此,这两者共同控制了水稻对铝胁迫的响应[8]。本研究中,铝处理后,Kasalath与Nipponbare中ALS1的表达量并无显著差异,因此,Kasalath中NRAT1表达量的提升,可引起更多的铝积累在植物细胞内部,导致铝毒害的加深,从而抑制其根伸长。进一步测定Kasalth和Nipponbare根尖细胞壁中的铝含量发现,Kasalath根尖细胞壁中的铝含量也显著高于Nipponbare(图5B)。
由图5C可见,铝处理后水稻中的OsFRDL4基因的表达量极显著上升,上升倍数高达100倍~200倍。其中,铝敏感品种Kasalath中OsFRDL4的上调倍数显著低于铝耐性品种Nipponbare的上调倍数。由此推测,OsFRDL4基因与这两个水稻品种间的耐铝差异有关。
3 讨 论

图5 50 µmol L-1铝处理下相关基因根尖相对表达量(A,C)以及根尖细胞壁铝含量(B)Fig. 5 Relative expression level of Al tolerance related genes in root tips(A,C)and Al content in root tip cell walls(B)of the rice plants exposed to 50 µmol L-1Al for 24 h
在近几年的水稻耐铝机理研究中,控制水稻耐铝的相关基因逐步被发现,并且这些基因的功能以及缓解水稻铝毒害的途径也逐步被认知,如ART1、FRDL4、NRAT1、ALS1、STAR1和STAR2等。其中ART1是水稻铝耐性相关基因的调控因子,其调控水稻至少与铝耐性相关的31个基因的表达[6]。水稻的耐铝性是由多基因控制的,正因为如此,水稻品种间铝耐性的差异通常非常大。本研究希望通过比较不同铝耐性的水稻品种中铝耐性相关基因的表达量,探究铝耐性相关基因与水稻品种间铝耐性差异的关系,为水稻耐铝品种筛选提供数据支持。
根尖是根伸长最重要的部位,也是铝毒害最为敏感的部位,因此,在判定不同水稻品种间耐铝性差异上起着重要作用[13],其根部的铝含量与受到的铝毒害程度有明显的正相关性[17-18]。研究发现,Kasalath无论在30 µmol L-1还是50 µmol L-1铝浓度处理下,其根伸长受到的抑制作用最为明显,判断其为相对铝敏感水稻品种。Nipponbare在相同铝浓度处理下,其根伸长显著高于其他水稻品种,判断其为相对铝耐性水稻品种(图1)。并且,在相同浓度铝处理下,Kasalath的根尖铝含量显著高于Nipponbare(图2),进一步证实了Kasalath确实为铝敏感水稻品种,Nipponbare为铝耐性水稻品种。
进一步研究发现,铝处理后,ART1、ALS1和STAR2基因在Kasalath与Nipponbare中的表达量并无显著差异,STAR1在铝处理后存在显著差异。其中,ART1是水稻铝耐性相关基因的转录因子,该基因不受铝诱导,推测其表达量可能并不随着水稻铝耐性变化而变化。此外,ALS1基因的表达量在两个品种间差异并不显著,说明ALS1可能并不是这两个水稻品种铝耐性差异的主要原因。尽管STAR1在铝处理后两者存在显著差异,但STAR1与SRAT2在功能上共同起作用,因此,这2个基因与该水稻品种间铝耐性差异是否有关,值得进一步的研究(图4)。另一方面,NRAT1和OsFRDL4表达量具有显著差异。铝处理后,两个水稻品种中NRAT1的表达量均显著上升,并且Kasalath中NRAT1基因的表达量显著高于Nipponbare,其根尖细胞壁铝含量也显著高于Nipponbare(图5)。而Xia等[15]研究中,敏感水稻品种中NRAT1基因的表达量显著低于耐性水稻品种,并且在统计学上,该基因的表达量与水稻品种的耐铝性呈正相关,这与本研究结果不符,推测可能有以下两个原因:(1)与水稻品种间的差异有关;(2)水稻的耐铝性是由多基因控制的,NRAT1能将外界的铝转运至细胞内,若水稻内部铝解毒机制未协同跟上,也可能导致内部铝毒害的加深,从而抑制水稻的生长。Li等[16]的研究中发现,NRAT1过表达株系铝耐性得到一定程度的提升,但同时使得植物细胞壁以及细胞液中的铝含量上升,植物中ALS1的基因表达量也相应上升。因此,进一步测定Kasalth和Nipponbare根尖细胞壁中的铝含量发现,Kasalath根尖细胞壁中的铝含量确实显著高于Nipponbare(图5B),而Kasalath与Nipponbare中负责将铝转运至液泡中固定起来的ALS1的表达量并无显著差异,因此,Kasalath中NRAT1的高表达量可能会使更多的铝积累在Kasalath内部,导致铝毒害加深。
OsFRDL4是影响水稻铝耐性的重要基因,其编码的蛋白质与柠檬酸的转运密切相关。该基因在水稻铝耐性品种中受铝诱导的表达倍数通常高于铝敏感品种,且有机酸的分泌量与该基因的表达量成正比[10]。研究发现,铝处理后两个水稻品种中OsFRDL4的表达量显著增加,其中Nipponbare中OsFRDL4的表达量显著高于Kasalath(图5C),并且在铝处理后,Nipponbare根部柠檬酸的分泌量也显著高于Kasalath(图3)。推测这两个品种的水稻在铝胁迫下,可以通过调节FRDL4的表达量,以控制根部柠檬酸分泌来螯合环境中的铝,减少根尖细胞壁上铝的吸附,从而缓解铝毒。同时,水稻品种的耐铝性越强,该基因的表达量也越高。由此推测,FRDL4基因与这两个水稻品种间的耐铝差异有关。
4 结 论
Kasalath为相对铝敏感水稻品种,Nipponbare为相对耐铝水稻品种。Kasalath在铝处理下,根伸长受到的抑制更显著,根尖铝含量也显著高于Nipponbare,主要归因于其根尖OsFRDL4的表达量相对较低,以及NRAT1基因的表达量相对较高。相应地,其根系分泌的柠檬酸含量也相对较低,导致更多的铝吸附在根尖细胞壁上。而ALS1基因的表达量在两水稻品种间无显著差异,表明有更多的铝转运至Kasalath细胞内,并对水稻产生毒害作用。因此,Kasalath的根尖铝含量较高,其受到铝的毒害作用也较强。
[1] Kochian L V. Cellular mechanisms of aluminum toxicity and resistance in plants. Annual Review of Plant Biology & Plant Molecular Biology,1995,46(1):237—260
[2] 李智燕,邢学峰,唐华,等. 铝和酸胁迫对苜蓿根瘤菌生长和抗氧化酶系的影响. 草业学报,2013,22(3):146—153
Li Z Y,Xing X F,Tang H,et al. Effects of aluminum and acid stresses on the growth and antioxidant enzyme activities of rhizobia isolated from Medicago lupulina and M. sativa(In Chinese). Acta Prataculturae Sinica,2013,22(3):146—153
[3] 熊毅,李庆逵. 中国土壤. 北京:科学出版社,1987
Xiong Y,Li Q K. Soils of China(In Chinese). Beijing:Science Press,1987
[4] Foy C D. Plant adaptation to acid,aluminum-toxic soils. Communications in Soil Science & Plant Analysis, 1988,19(7/12):959—987
[5] Yamaji N,Huang C F,Nagao S,et al. A zinc finger transcription factor ART1 regulates multiple genes implicated in aluminum tolerance in rice. The Plant Cell,2009,21(10):3339—3349
[6] Delhaize E,Ma J F,Ryan P R. Transcriptional regulation of aluminium tolerance genes. Trends in Plant Science,2012,17(6):341—348
[7] Xia J X,Yamaji N,Kasai T,et al. Plasma membranelocalized transporter for aluminum in rice. Proceedings of the National Academy of Sciences,2010,107(43):18381—18385
[8] Huang C F,Yamaji N,Chen Z C,et al. A tonoplastlocalized half-size ABC transporter is required for internal detoxification of aluminum in rice. The Plant Journal,2012,69(5):857—867
[9] Huang C F,Yamaji N,Mitani N,et al. A bacterialtype ABC transporter is involved in aluminum tolerance in rice. The Plant Cell,2009,21(2):655—667
[10] Yokosho K,Yamaji N,Ma J F. An Al-inducible MATE gene is involved in external detoxification of Al in rice. The Plant Journal,2011,68(6):1061—1069
[11] Ahn S J,Sivaguru M,Osawa H,et al. Aluminum inhibits the H+-ATPase activity by permanently altering the plasma membrane surface potentials in squash roots. Plant Physiology,2001,126(4):1381—1390
[12] Zheng S J,Yang J L,He Y F,et al. Immobilization of aluminum with phosphorus in roots is associated with high aluminum resistance in buckwheat. Plant Physiology,2005,138(1):297—303
[13] 林咸永,章永松,罗安程. 不同小麦基因型耐铝性的差异及筛选方法的研究. 植物营养与肥料学报,2001,7(1):64—70
Lin X Y,Zhang Y S,Luo A C. Study on the differences of aluminum tolerance in different wheat genotypes and the screening methods(In Chinese). Plant Nutrition and Fertilizer Science,2001,7(1):64—70
[14] Miyasaka S C,Buta J G,Howell R K,et al. Mechanism of aluminum tolerance in snapbeans root exudation of citric acid. Plant Physiology,1991,96(3):737—743
[15] Xia J X,Yamaji N,Che J,et al. Differential expression of Nrat1 is responsible for Al-tolerance QTL on chromosome 2 in rice. Journal of Experimental Botany,2014,65(15):4297—4304
[16] Li J Y,Liu J P,Dong D K,et al. Natural variation underlies alterations in Nramp aluminum transporter(NRAT1)expression and function that play a key role in rice aluminum tolerance. Proceedings of the NationalAcademy of Sciences,2014,111(17):6503—6508[17] Wang H H,Hua J J,Bi Y R. Nitrate reductasedependent nitric oxide production is involved in aluminum tolerance in red kidney bean roots. Plant Science,2010,179(3):281—288
[18] Zhu X F,Shi Y Z,Lei G J,et al. XTH31,encoding an in vitro XEH/XET-active enzyme,regulates aluminum sensitivity by modulating in vivo XET action,cell wall xyloglucan content,and aluminum binding capacity in Arabidopsis. The Plant Cell,2012,24(11):4731—4747
[19] Ma J F,Zheng S J,Matsumoto H. Specific secretion of citric acid induced by Al stress in Cassia tora L. Plant and Cell Physiology,1997,38(9):1019—1025
[20] Kochian L V,Piñeros M A,Liu J P,et al. Plant adaptation to acid soils:The molecular basis for crop aluminum resistance. Annual Review of Plant Biology,2015,66:571—598
[21] Yokosho K,Yamaji N,Fujii-Kashino M,et al. Retrotransposon-mediated aluminum tolerance through enhanced expression of the citrate transporter OsFRDL4. Plant Physiology,2016,172(4):2327—2336
[22] 吴韶辉,蔡妙珍,刘鹏,等. 低pH和铝毒对荞麦根边缘细胞特性的交互作用研究,土壤学报,2008,45(2):336—340
Wu S H,Cai M Z,Liu P,et al. Interactions between low pH and aluminum toxicity on characteristics of root border cells of buckwheat(In Chinese). Acta Pedologica Sinica,2008,45(2):336—340
[23] Liu J,Magalhaes J V,Shaff J,et al. Aluminumactivated citrate and malate transporters from the MATE and ALMT families function independently to confer Arabidopsis aluminum tolerance. The Plant Journal,2009,57(3):389—399
[24] 张富林,张启明,赵学强,等. 磷对植物铝毒害作用研究中两种磷铝处理方法比较. 土壤学报,2010,47(2):311—318
Zhang F L,Zhang Q M,Zhao X Q,et al. Comparison between two P-Al treatment methods in studying effect of phosphorus on aluminium toxicity to plants(In Chinese). Acta Pedologica Sinica,2010,47(2):311—318
[25] 孙清斌,沈仁芳,尹春芹,等. 铝毒胁迫下植物的响应机制,土壤,2008,40(5):691—697
Sun Q B,Shen R F,Yin C Q,et al. Response mechanisms of plants against Al stresses(In Chinese). Soils,2008,40(5):691—697
[26] Ma J F,Chen Z C,Shen R F. Molecular mechanisms of Al tolerance in gramineous plants. Plant and Soil,2014,381(1/2):1—12
[27] 吴道铭,傅友强,于智卫,等. 我国南方红壤酸化和铝毒现状及防治,土壤,2013,45(4):577—584
Wu D M,Fu Y Q,Yu Z W,et al. Status of red soil acidification and aluminum toxicity in South China and prevention(In Chinese). Soils,2013,45(4):577—584
Differences in Aluminium Tolerance between Rice Varieties
WANG Bin1,2ZHANG Huiling3ZHU Xiaofang1SHEN Renfang1†
(1 State Key Laboratory of Soil and Sustainable Agriculture,Institute of Soil Science,Chinese Academy of Sciences,Nanjing 210008,China)
(2 University of Chinese Academy of Sciences,Beijing 100049,China)
(3 College of Resources and Environmental Science,Nanjing Agricultural University,Nanjing 210095,China)
【Objective】Aluminum(Al)toxicity is an important factor that inhibits growth of plants in acid soils. Different plant species are often different in Al tolerance,and so are different varieties of the same species. Through a series of hydroponic experiments,this paper was to explore difference between two varieties of rice,Nipponbare and Kasalath in Al tolerance and mechanism responsible for the variation.【Method】 Plump seeds of the two varieties of rice were selected and placed in an incubator for germination at 25℃. Then seedlings similar in growing were divided into two groups,one undergoing treatment with 0.5 mmol L-1CaCl2and pH 4.5 for 24 h(Treatment CK)and the other with 50 µmol L-1AlCl3in addition to 0.5 mmol L-1CaCl2and pH 4.5 for 24 h,too(Treatment Al). Root length was measured before and after thetreatment with a ruler. After the treatments,some roots tips(0~1 cm)of the seedling were cut down with a knife,and placed into plastic tubes containing 1 ml 2 mol L-1HCl,separately,for 24 h extraction. Then the solutions were analyzed for Al concentration with ICP. Besides,some root tips were put direct into liquid nitrogen for refrigeration at -80℃ for late-on RNA extraction. To compare the two varieties of rice in Alinduced citrate secretion from the root system,some two-week-old seedlings were treated as in Treatment Al for 24 h. Then solution from the treatment was diverted into a column containing 5 g of cation resin(Amberlite IR-120B resin)for adsorption and then into another column containing 3 g of anion resin(AG 1 × 8 resin). The anion-resin column was then eluted with 2 mol L-1HCl and the eluate condensed into solid through evaporation in a rotary evaporator. Then,1 ml of milliQ water was used to dissolve the solid adhered to the evaporator for determination of content of organic acids with HPCL.【Result】It was found that under Al stress,Nipponbare was less inhibited than Kasalath,for it had longer roots and less Al in root tips,which indicates that Nipponbare is an Al tolerant variety of rice,while Kasalath an Al sensitive variety. It was also found in further studies that the expression of NRAT1,which is responsible for controlling Al uptake,was much higher in Kasalath than in Nipponbare,and the high expression is possibly the major cause leading to the high Al concentration in the root tips of Kasalath,an Al-sensitive variety of rice. Furthermore,it was also found that under Al stress,Nipponbare secreted more citric acids than Kasalath did and the expression of OsFRDL4,a gene controlling root secretion of citric acid,was significantly higher in level in the former than in the latter,which demonstrates that citric acid may possibly play a critical role in rice tolerating Al and the variety of rice controls secretion of citric acid by regulating expression level of OsFRDL4 gene. However,tests were also done on other four genes that may be related to Al tolerance,but no direct relationship was observed. So further studies need to be done.【Conclusion】 Nipponbare and Kasalath shows different Al tolerance in the present study. Nipponbare is an Al tolerant rice variety,while Kasalath an Al sensitive one. The difference in Al tolerance between the two varieties of rice may be attributed to the differences in expressions levels of NRAT1 and OsFRDL4.
Rice;Aluminum stress;Aluminum tolerance;OsFRDL4;NRAT1
Q945
A
(责任编辑:陈荣府)
10.11766/trxb201610280440
* 国家重点基础研究发展计划(973 计划)项目(2014CB441000)资助 Supported by the National Basic Research Program of China(973 Program)(No. 2014CB441000)
† 通讯作者 Corresponding author,E-mail:rfshen@issas.ac.cn
王 斌(1991—),男,浙江杭州人,硕士研究生,主要从事植物逆境生理的研究。E-mail:binw@issas.ac.cn
2016-10-28;
2017-02-20;优先数字出版日期(www.cnki.net):2017-03-15
