低温振荡法提取甘草酸工艺优化研究
2017-08-31豆康宁王飞
豆康宁,王飞
(漯河医学高等专科学校 食品营养系,河南 漯河 462002)
低温振荡法提取甘草酸工艺优化研究
豆康宁,王飞
(漯河医学高等专科学校 食品营养系,河南 漯河 462002)
低温振荡法是提取植物生物活性物质的一种有效方法,文章研究了低温振荡法提取甘草酸的工艺条件。首先用单因素试验研究了提取时间、料液比、振荡速度对甘草酸提取率的影响,然后用正交试验设计对工艺条件进行了优化。试验结果表明:甘草酸提取率随着提取时间的延长和振荡速度的增加而增加,随着料液比的增加而降低。甘草酸提取最佳条件是:提取时间150 min、料液比0.01 (g/mL)、振荡速度140 r/min,其中提取时间因素影响显著。在该条件下,甘草酸提取率达到2.51%。低温振荡法与蒸煮法和超声波法相比,提取150 min后,甘草酸提取率相差不大。
甘草酸;低温振荡;提取工艺
甘草酸是甘草中生理活性成分之一[1],是甘草甜味的主要成分,由1分子甘草次酸和2分子葡萄醛酸组成,其甜度为蔗糖的150倍,有浓郁的甘草特殊香味,是高血压、糖尿病、肥胖症、心脏病患者食用的最理想的甜味剂,具有低热能、高甜度、安全、无毒和较强的保健功能,有解毒、护肝、消炎、增香等功效,是非常理想的纯天然甜味剂[2]。除此之外,甘草酸能使咸味很重的食品口感变得更柔和,使食品的后味更醇香,常作为酱菜、面酱、酱油中的矫味剂,可抑制盐味和苦味[3]。在果汁饮料或其他非碳酸饮料的产品中配合使用甘草酸,会让口感变得清凉可口。在凉果、蜜饯中使用,能有效突出产品风味,使其甘甜味绵长[4]。
目前,对甘草酸提取方法的研究比较多,如用水蒸煮浸提,用混合溶剂浸提,用铵性醇溶液浸提,采用微波、超声波辅助浸提等[5]。但是,这些方法普遍采用的提取温度都比较高,对甘草酸的生物活性具有一定影响;根据文献报道,对低温振荡提取法研究相对较少,对甘草酸提取工艺参数的优化研究相对较少。因此,本文采用低温振荡法提取甘草中的甘草酸,先用单因素试验研究提取时间、料液比、振荡速度对甘草酸提取率的影响,然后用正交试验对该提取工艺参数进行优化[6],最后对低温振荡法、蒸煮法和超声波法提取甘草酸进行比较。甘草酸的测定方法应用液相色谱法(HPLC)测定,所用溶剂是甲醇、醋酸铵溶液和乙酸复合物。本研究为低温振荡法提取甘草酸工艺及甘草酸的应用提供了实验依据。
1 实验材料与设备
1.1 主要试剂与材料
甘草:品种为乌拉尔甘草,生长方式为种植,产地为宁夏盐池,生长期为3年,通过市售采购;甘草酸铵标准品:色谱纯,西安汇林生物科技有限公司;甲醇:色谱纯,天津四友精细化学品有限公司;乙酸、醋酸铵:分析纯,天津市科密欧化学试剂有限公司;水:一级纯净水,实验室自制。
1.2 主要仪器与设备
LC1260型高压液相色谱仪(HPLC),100 Conc型紫外可见分光光度计 Agilent公司;YP3001N型电子天平 上海精密科学仪器有限公司;DFT-200型万能粉碎机 温岭市林大机械有限公司;RYC-111型摇床 上海福玛实验设备有限公司;X-22R型冷冻离心机 Allegra公司;202A型电热恒温干燥箱 南京莱步科技实业有限公司;VS-100UE 型恒温超声波提取机 无锡沃信仪器有限公司。
2 实验方法
2.1 流动相的制备[7]
流动相的制备方法按照GB/T 22248-2008《保健食品中甘草酸的测定》进行制备,具体方法是:先将醋酸铵配制成0.2 mol/mL,然后配制流动相,流动相的组成比例为:甲醇∶0.2 mol/mL醋酸铵溶液∶乙酸为67∶32∶1。
2.2 甘草酸铵标准曲线的建立
配制不同浓度的甘草酸铵溶液(0~400 μg/mL),采用HPLC测定不同浓度甘草酸铵溶液的吸收峰面积,建立甘草酸铵浓度和吸收峰面积之间的标准曲线,作为测定计算甘草中甘草酸含量的依据。
2.3 HPLC样品的制备
将甘草根部用万能粉碎机粉碎成20目的粉末,称量一定量的甘草样品,放入锥形瓶中,再加入50 mL流动相,放入摇床中,设置好摇床振荡速度,温度为30 ℃,然后振荡提取。提取结束后,用高速离心机分离甘草提取液,转速为10000 r/min,时间为10 min。取离心后的上清液,用0.45 μm微孔滤膜过滤后作为HPLC试样。
2.4 甘草酸铵吸收波长的确定
配制1%的甘草酸铵溶液,用紫外可见分光光度计扫描甘草酸铵的吸收峰位置,作为HPLC检测器的波长。
2.5 HPLC分析条件
色谱柱:C18柱,尺寸为4.6 mm×20 cm,柱温35 ℃;流动相组成比例:甲醇∶0.2 mol/mL醋酸铵溶液∶乙酸为67∶32∶1;UV检测波长:252 nm;进样方式:手动;进样量10 μL;流量0.8 mL/min。
2.6 甘草中水分含量的测定[8]
在计算甘草酸的提取率时,按照甘草的干重计算,便于分析比较,因此需要测定计算2.3中甘草样品的水分含量。甘草中水分含量的测定按照GB 5009.3-2010《食品中水分的测定》方法进行测定。
2.7 甘草酸提取率的计算
甘草酸提取率(%)=M甘草酸/[M甘草样品×(1-7.2%)]×100%,其中M表示质量(g),7.2%表示甘草中的水分含量。
2.8 甘草酸提取方法对比
对低温振荡法、蒸煮法、超声波法提取甘草中甘草酸的提取率进行比较,分析提取率的大小与差距。其中,低温振荡法提取参数是:提取时间150 min、料液比0.01 (g/mL)、振荡速度140 r/min;蒸煮法提取参数是: 提取时间150 min、料液比0.01 (g/mL)、温度100 ℃;超声波提取参数是:提取时间150 min、料液比0.01 (g/mL)、超声频率20 kHz、功率200 W。
3 实验结果与分析
3.1 甘草酸铵的吸收峰波长确定
将1%浓度的甘草酸铵溶液用紫外可见分光光度计进行扫描吸收光谱,结果见图1。
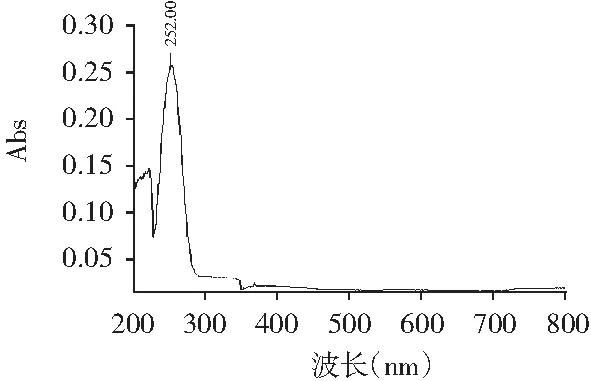
图1 甘草酸铵吸收光谱
图1中最大吸收峰位置为252.0 nm。因此,进行测定甘草样品中甘草酸含量时,HPLC检测器的波长也设置为252.0 nm。
3.2 甘草酸铵标准曲线建立
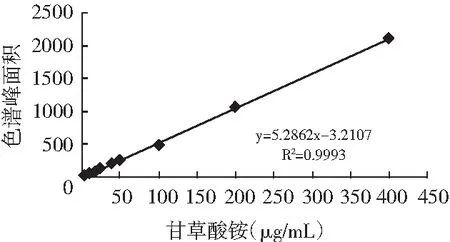
图2 甘草酸铵标准曲线图
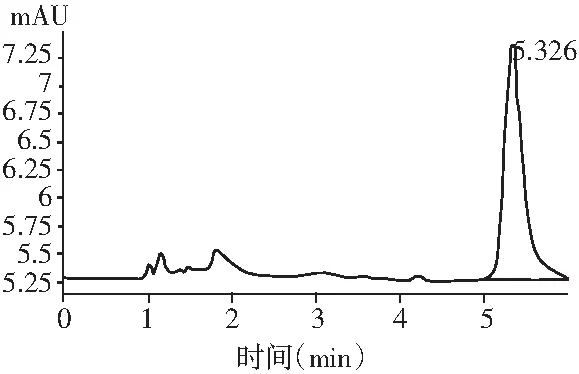
图3 甘草酸铵HPLC测定出峰图
3.3 提取时间、料液比和振荡速度对甘草酸提取率的影响
3.3.1 提取时间对甘草酸提取率的影响
在振荡速度为120 r/min、料液比为0.01 (g/mL)的条件下,分别提取0,30,60,90,120,150 min,甘草酸提取率见图4。
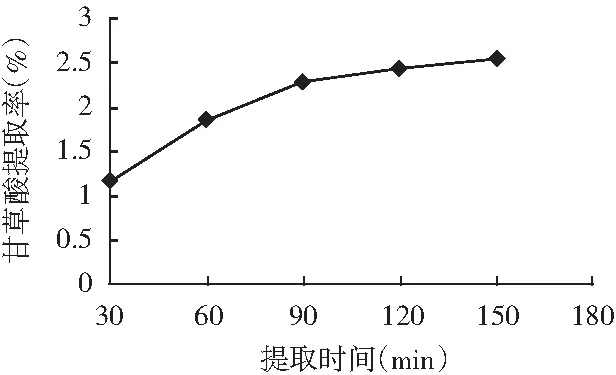
图4 提取时间对甘草酸提取率的影响
由图4可知,随着提取时间的延长,甘草酸提取率开始增加较大,90 min后提取率增加幅度变得缓慢,提取150 min与90 min相比,对甘草酸提取率增加很小。这说明开始提取时,物料中甘草酸含量高,溶剂中甘草酸浓度低,甘草酸的溶解速度较快,当大部分提取后,物料中少部分的甘草素溶解速度大大下降。因此,在正交试验因素水平设计中,选择提取时间为90,120,150 min进行优化。综合考虑提取效率与成本,下面的单因素试验中提取时间取120 min进行。
3.3.2 料液比对甘草酸提取率的影响
根据硼镁改性磷酸二氢铝的稳定性研究,当Na2B4O7·10H2O添加量超过3.0g时粘结剂稳定性变差,在固定MgSO4加入量为4g且不加入H3PO4改性聚乙烯醇的情况下,使用硼镁改性磷酸盐混砂制样,测试强度图1。
当提取时间为120 min、振荡速度为120 r/min时,料液比分别为0.01,0.02,0.03,0.04,0.05 (g/mL)的甘草酸提取率见图5。
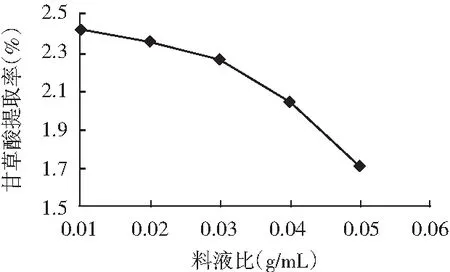
图5 料液比对甘草酸提取率的影响
由图5可知,随着料液比的增加,甘草酸提取率开始下降幅度较小,料液比超过0.03 (g/mL)之后,提取率下降幅度较大。物料浓度对甘草酸在溶剂中的浸出具有一定影响,物料浓度越大,甘草酸的浸出速度会下降,需要多次提取。因此,在正交试验因素水平设计中,选择料液比为0.01,0.02,0.03 (g/mL)进行优化。
3.3.3 振荡速度对甘草酸提取率的影响
当提取时间为120 min、料液比为0.01 (g/mL),振荡速度为60,80,100,120,140 r/min时,甘草酸的提取率见图6。
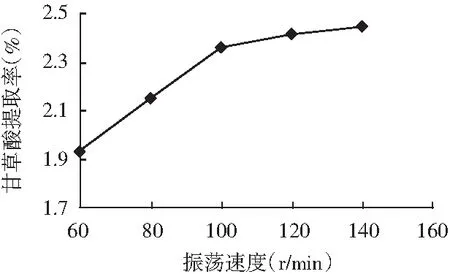
图6 振荡速度对甘草酸提取率的影响
由图6可知,随振荡速度的增加,甘草酸提取率开始增加幅度较大,振荡速度超过100 r/min之后,提取率增加幅度变小。随着振荡速度的增加,物料在溶剂中混合越充分,甘草酸的浸出率增加,但是当振荡速度达到一定值时,甘草酸提取率受其影响变得较小。因此,在正交试验因素水平设计中,选择振荡速度为100,120,140 r/min进行正交试验优化。
3.4 正交优化试验结果与讨论
3.4.1 正交试验表头设计
根据前面的单因素试验所得三因素三水平,制作成正交试验表头,见表1。
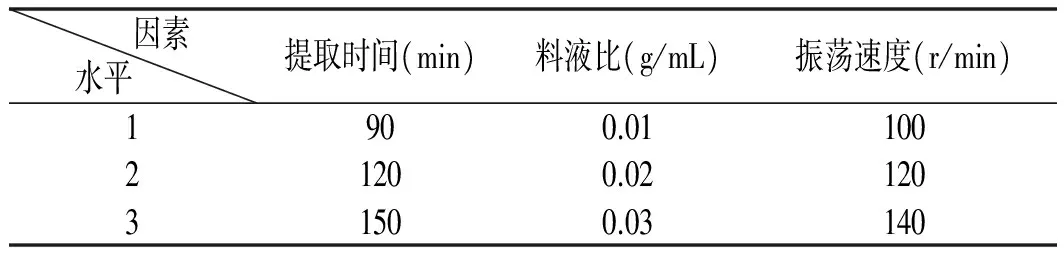
表1 正交试验表头
3.4.2 正交试验结果
采用正交设计软件助手,对表1中的数据进行三因素三水平试验,试验结果见表2。
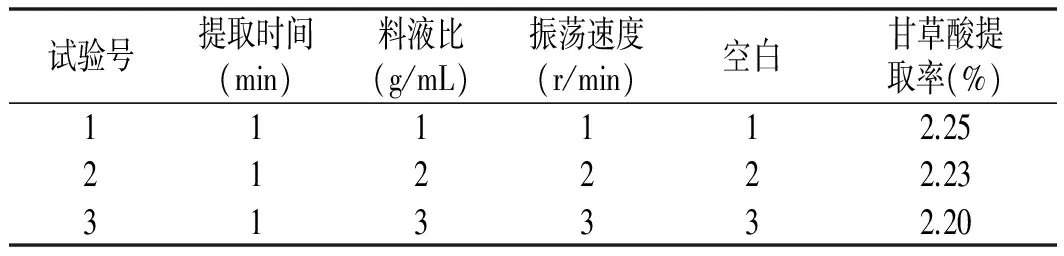
表2 正交试验结果
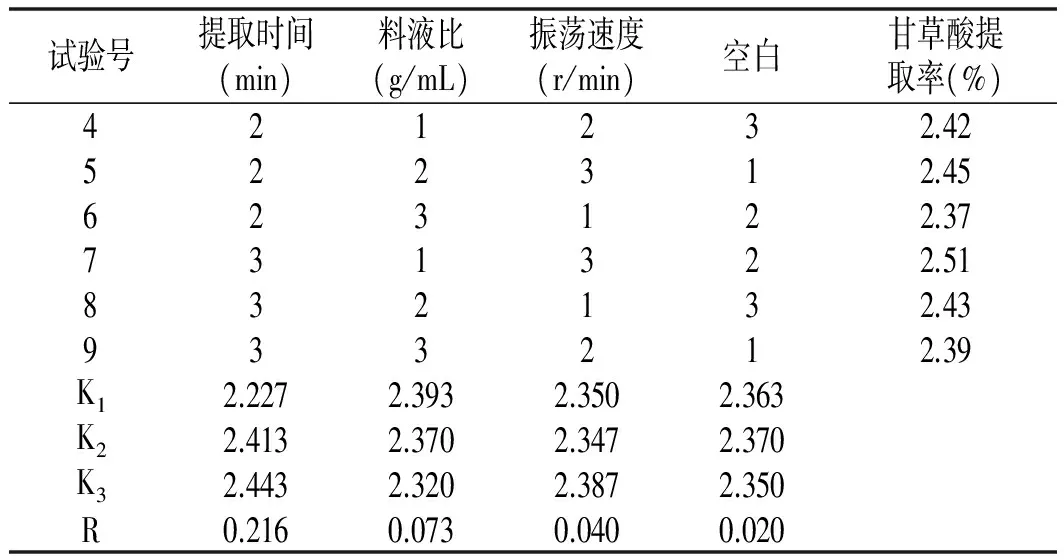
续 表
3.4.2.1 极差分析结果
由表2中正交试验统计分析结果R值可知,影响甘草酸提取率的因素大小顺序依次是提取时间、料液比、振荡速度,最佳因素组合是:提取时间150 min、料液比0.01 (g/mL),振荡速度140 r/min。经试验验证,在该条件下,甘草酸的提取率达到2.51%,与表2中试验序号6相同。
3.4.2.2 方差分析
以空白列为误差,在显著水平为0.05的基础上,对甘草酸低温振荡提取正交试验进行方差分析,其结果见表3。
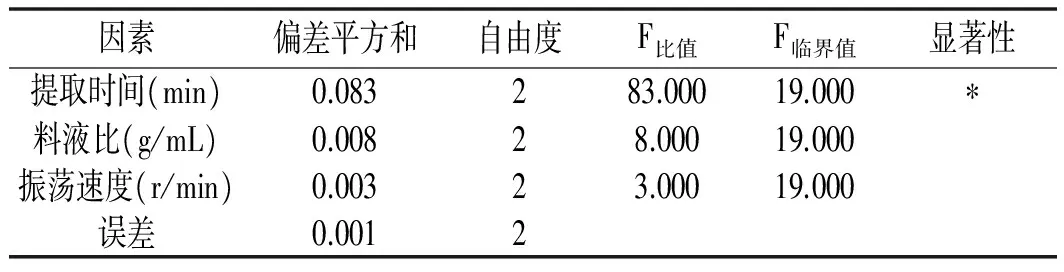
表3 方差分析结果
由表3方差分析可知,提取时间对甘草酸提取率影响显著,而料液比、振荡速度对甘草酸提取率影响不显著。这说明在正交试验的因素水平范围内,影响甘草酸提取率的因素是提取时间。但是,如果因素的水平不在该正交试验范围内,通过单因素试验发现,当料液比较大、振荡速率比较小时,对提取率的影响也比较大,因此不能忽略。
3.4.3 几种甘草酸提取方法对比
通过低温振荡法、蒸煮法、超声波法提取甘草中甘草酸,其甘草酸提取率随时间的延长见图7。
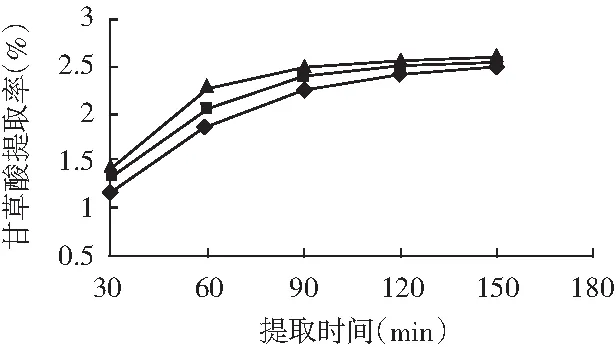
图7 提取时间对甘草酸提取率的影响
由图7可知,在低温振荡法、蒸煮法、超声波法提取甘草中甘草酸的过程中,随着提取时间的延长,甘草酸提取率增加幅度开始较快,提取一段时间之后,增加幅度变得较小。其中,在前60min内,超声波法提取效率最高,其次是蒸煮法和低温振荡提取法。但是,提取时间超过120min后,该3种提取方法的甘草酸提取率越来越接近,提取时间达到150min时,超声波法甘草酸提取率比蒸煮法高1.96%,比低温振荡法高3.58%。应用蒸煮法提取甘草酸时,提取温度比较高,在超声波提取过程中,溶剂因超声波的作用,温度也会逐渐升高[10],这对甘草酸的生物活性有一定的影响。因此,为了保证甘草酸的生物活性,将原料颗粒度粉碎到很细之后,采用低温振荡提取法,与蒸煮法和超声波法相比,其甘草酸的提取率相差不大。
4 结论
采用低温振荡法提取甘草酸时,随着提取时间的延长,甘草酸提取率先增加较快,之后增加幅度变小;随着料液比的增大,甘草酸提取率下降速度开始较小,之后下降幅度较大;随着振荡速度的增加,甘草酸提取率先增加较快,之后增加幅度变小。低温振荡法提取甘草酸的最佳因素水平组合是提取时间150 min、料液比0.01(g/mL),振荡速度120 r/min,提取率达到2.51%。与蒸煮法和超声波法相比,低温振荡法提取甘草酸的速度较慢,但是,当提取150 min时,提取率相差不大,而且能够保护甘草酸的生物活性。
[1]常雅萍,毕无邪,杨贵贞.甘草多糖抗病毒作用研究[J].中草药,1989,14(4):44-46.
[2]汲晨锋,姜薇,王晓晶.甘草多糖的化学与药理研究[J].哈尔滨商业大学学报(自然科学版),2004,20(5):515-518.
[3]隋敬达.低盐甘草保健酱油及其制造工艺[P].中国专利:98100015.0,1997.
[4]郑炯,黄明发,张甫生.甘草甜素的生理功能及其在食品工业中的应用[J].中国食品添加剂, 2007(2):165-168.
[5]程谦伟,孟陆丽,何仁,等.响应面优化超声波辅助提取百香果籽油工艺研究[J].粮油加工,2010(8):6-8.
[6]章银良.食品与生物试验设计与数据分析[M].北京:中国轻工业出版社,2010.
[7]GB/T 22248-2008,保健食品中甘草酸的测定[S].
[8]GB 5009.3-2010,食品中水分的测定[S].
[9]李炳奇,汪河滨,李学禹,等.超声法联合提取甘草黄酮和甘草酸的研究[J].山东中医杂志,2005,24(1):38-40.
[10]鲁守平,孙群,王建华,等.甘草中有效成分甘草酸的提取和测定方法研究概况[J].中国中药杂志,2006,31(5):357-360.
Research on Optimization of Glycyrrhizic Acid Extraction byLow-temperature Oscillation
DOU Kang-ning, WANG Fei
(Department of Food Nutrition, Luohe Medical College, Luohe 462002, China)
It is an effective method to extract plant biological active substances by low-temperature oscillation, in this paper, glycyrrhizic acid extracted by low-temperature oscillation is researched. Firstly, the relationship among extraction time, solid-liquid ratio and oscillation speed is researched by single factor experiments, and then the technological conditions are optimized by orthogonal test design. The experimental results show that the extraction yield of glycyrrhizic acid is increased as the extraction time extending and oscillation speed increasing, but the extraction yield of glycyrrhizic acid is decreased as the solid-liquid ratio increasing. The optimum conditions for extracting glycyrrhizic acid are determined as follows: extraction time is 150 min, solid-liquid ratio is 0.01 (g/mL), oscillation speed is 140 r/min, under these experimental conditions, the extraction yield of glycyrrhizic acid reaches 2.51%. Compared with the methods of boiling and ultrasonic wave, the extraction yield of glycyrrhizic acid is low if it is extracted for 150 min by low-temperature oscillation.
glycyrrhizic acid;low-temperature oscillation;extraction process
2017-03-10
河南省漯河市2015年度青年拔尖人才资助项目
豆康宁(1981-),男,甘肃静宁人,讲师,硕士,研究方向:食品加工与检测技术。
TS207.3
A
10.3969/j.issn.1000-9973.2017.08.030
1000-9973(2017)08-0138-04
