1例ALK阳性肺肉瘤样癌报道
2017-08-31缪晔红凌琳张秀琴黄建安
缪晔红 凌琳 张秀琴 黄建安
肺肉瘤样癌(pulmonary sarcomatoid carcinoma, PSC)是一类罕见的含有肉瘤形态细胞或肉瘤样分化的非小细胞肺癌(non-small cell lung cancer, NSCLC),在所有肺癌中所占比例为0.1%-0.4%[1]。PSC恶性程度高,预后差,平均生存期仅13.3个月,低于其他类型NSCLC[2]。PSC对放化疗不敏感,首选治疗方法为手术治疗,但多数患者发现时已处于疾病晚期,失去手术指征,且术后复发率较高,故治疗存在一定难度。有关靶向药物对PSC的治疗效果目前尚不明朗且相关报道很少。本院近期收治了1例间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)阳性PSC患者,克唑替尼联合放化疗治疗3个月后疾病获得明显缓解,现报道如下。
1 病例报告
一般资料:患者男性,31岁,因“胸闷伴咳嗽1周”入院。患者1周前无明显诱因下出现活动后胸闷胸痛,伴少许咳嗽,无咳痰,同时出现右眼视物模糊伴右面部感觉减退,遂至我院门诊就诊,行胸部计算机断层扫描(computed tomography, CT)示:左侧肺门占位;右肺下叶纤维灶;双侧少量胸腔积液(图1)。患者既往体健,否认高血压、糖尿病等慢性病史,否认粉尘及放射性毒物接触史,否认烟酒嗜好,否认传染病及家族型遗传病病史。
入院查体:神志清楚,精神尚可,右眼上睑下垂,眼裂高度0 mm,右眼视力0.15,左眼视力0.6,瞳孔圆,右眼对光反射(-),左眼对光反射(+)。左肺呼吸音低。余查体无特殊。
入院后辅助检查:血尿粪常规、生化全套无明显异常;肿瘤全套:CYFRA211 3.52 ng/mL,糖类抗原CA199 408.04 U/mL,癌胚抗原 CEA 1.73 ng/mL,糖类抗原CA125 183.1 U/mL,SCCA 2.7 ng/mL,NSE 21.47 ng/mL,CA72-4 1.02 U/mL;心超、心电图无明显异常;腹部B超:肝右叶低回声,大小约24 mm×18 mm,考虑转移;头颅核磁共振成像(magnetic resonance imaging, MRI)增强扫描:中颅窝底骨质异常,考虑转移;骨扫描:右侧锁骨中段、右侧骶髂关节反应性骨形成活跃,考虑转移。
结合病史及相关检查,考虑患者为晚期肺癌,行纤维支气管镜检查,镜下可见:左上叶开口见新生物阻塞管腔,表面有出血坏死组织附着(图2)。纤维支气管镜活检免疫病理诊断为肺肉瘤样癌,肿瘤细胞Vmentin(+),CK(+),Ki-67(+,50%),CK7(-),TTF-1(-),NapsinA(-),CK5/6(-),P63(-),P40(-),CD56(-),CgA(-),NSE(-),HMB45(-),S-100(-),CK20(-),LCA(-),Desmin(-),ALK(D5F3)(强+),对照组阴性(图3)。
治疗:患者一般情况可,体力状况(performance status, PS)评分1分,诊断肺肉瘤样癌IV期,为最大程度改善预后,经病人知情同意后,2016-11-25、2016-12-21、2017-01-17、2017-02-18行多西他赛130 mg d1+奈达铂130 mg d1化疗4次,每次化疗结束后续以克唑替尼250 mg bid口服治疗,同时行根治性放疗,具体为X-Ray 6 MV IMRT DT: 计划肿瘤靶区(planning gross tumor volume, PGTV)(海绵窦、蝶窦大体肿瘤):66 Gy/32 f,计划靶区(planning target volume, PTV)(包括PGTV及周围亚临床灶):60 Gy/32 f,同时予“希美纳1.25 g d1、d3、d5 qw”口服以增敏,截至目前已放疗25次。

图 1 胸部CT(2016-11-12):左肺门软组织影,大小约7.8 cm×8.8 cm,分叶状,密度尚均匀,周围可见肿大淋巴结影。Fig 1 Chest CT scan (2016-11-12): A lobulated soft tissue giant tumor located in the left pulmonary hilum with the size of about 7.8 cm×8.8 cm showed homogeneous density; lymphadenopathy around it can be seen. CT: computed tomography.

图 2 气管镜:左上叶开口处见新生物阻塞管腔,表面有出血坏死组织附着。Fig 2 Bronchoscopy showed that neoplasm blocked the left upper lobe bronchus openings, hemorrhage and necrosis can be seen on the surface.

图 3 病理。A:肿瘤细胞中等大小,细胞异型性明显(HE×200);B、C、D:免疫组化[B:vmentin(+);C:ck(+);D:ALK(D5F3)(+)](免疫组化采用罗氏全自动染色仪染色×200)。Fig 3 Pathology. A: Tumor cells are median size with marked atypia (HE×200); B, C, D: Immunocytochemistry [B:vmentin(+) , C:ck(+), D:ALK(D5F3)(+)](Roche automatic electrochemiluminescence immuno-assay analyzer ×200).
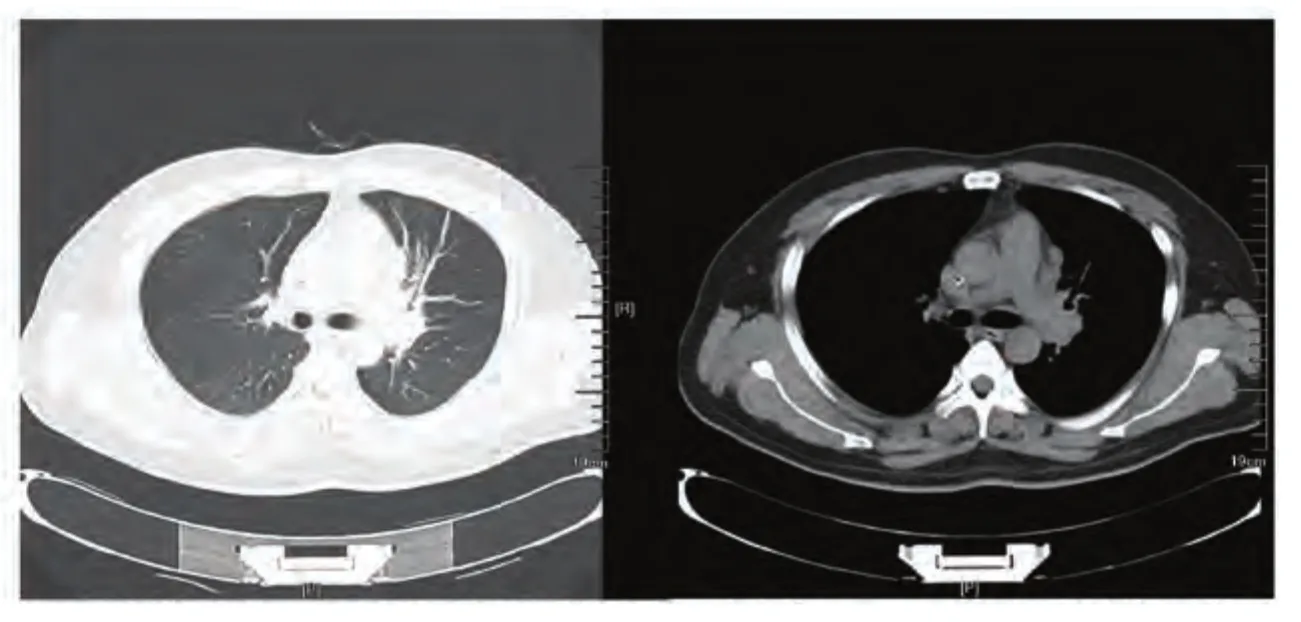
图 4 胸部CT(2016-12-14):左肺门软组织影,大小约4.4 cm×2.6 cm,分叶状,密度尚均匀,周围可见肿大淋巴结影。Fig 4 Chest CT scan (2016-11-12): A lobulated soft tissue giant tumor located in the left pulmonary hilum with the size of about 4.4 cm×2.6 cm showed homogeneous density; lymphadenopathy around it can be seen.
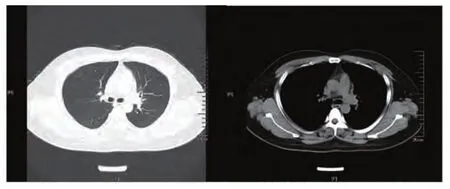
图 5 胸部CT(2017-02-17):左肺门软组织影,大小约3.2 cm×2.4 cm,分叶状,密度尚均匀,周围可见肿大淋巴结影。Fig 5 Chest CT scan (2017-02-17): A lobulated soft tissue giant tumor located in the left pulmonary hilum with the size of about 3.2 cm×2.4 cm showed homogeneous density; lymphadenopathy around it can be seen.
随访:患者定期入院,每次入院均复查3大常规、生化全套、肿瘤全套、心电图等,隔次入院复查胸部CT及头颅MRI,患者胸闷、胸痛、咳嗽等症状均较前明显好转,无明显恶心、呕吐、腹泻、便秘、视觉改变、乏力、水肿等克唑替尼不良反应,最近一次入院时间为2017-02-17,查体:Horner征改善,右眼上睑下垂较前好转,眼裂高度5.40 mm,右眼视力0.4,左眼视力0.6,瞳孔圆,右眼对光反射(+),左眼对光反射(+)。左肺呼吸音减弱较前明显好转。辅助检查:血尿粪常规、生化全套、心电图无明显异常;肿瘤全套:CYFRA211 3.52 ng/mL,CEA 4.12 ng/mL,CA125 32 U/mL,NSE 11.58 ng/mL,CA72-4 4.46 U/mL;腹部B超提示肝内病灶较前缩小,大小约18 mm×11 mm。患者近两次胸部CT(图4,图5)提示病灶每次均较前明显吸收,但头颅转移灶无明显改变。
2 讨论
PSC在2004年版世界卫生组织(World Health Organization, WHO)肺肿瘤组织学分类中首次被定义为一类分化差的NSCLC,包括5种亚型:多形性癌、梭形细胞癌、巨细胞癌、癌肉瘤、肺母细胞瘤。PSC多见于中老年吸烟男性,临床表现及影像学表现无特异性,与肿瘤发生部位相关,多数患者因咳嗽、胸痛、咯血等呼吸道症状就诊,少数患者以声音嘶哑、肩部疼痛等作为首发症状,本例患者以胸闷咳嗽等为首发表现,并出现Horner综合征等相关体征,符合晚期肺恶性肿瘤的临床表现。
PSC的诊断主要依靠电镜下细胞形态及免疫组织化学染色,既往认为支气管镜活检或痰细胞学检查很难确诊,故PSC的诊断常依靠手术获得病理。但因相当一部分患者发现时已处于肿瘤晚期,手术诊断代价较大,最新指南肯定了小活检的诊断价值[3], 本例患者通过支气管镜夹取肿瘤组织,免疫病理最终明确诊断为PSC,避免了手术带来的巨大创伤及经济负担。
PSC侵袭性强,免疫组化常提示上皮性标志物和间叶性标志物混合存在,这可能与PSC上皮间质转化(epithelial-mesenchymal transition, EMT)相关,即PSC的癌成分向肉瘤成分转化,这种表型转换使肿瘤细胞易摆脱细胞间的连接,从而向周围组织、血管、胸壁侵袭[4]。本例患者发现时已出现全身多发转移,印证了PSC的强侵袭性。而PSC的强侵袭性必然预示其治疗难度大,研究[5]支持晚期PSC患者对一线化疗不敏感,放化疗术后平均生存期仅为2.7个月[6],故积极寻求靶向治疗是改善此类肿瘤预后的较好的方法。
一项纳入33例PSC患者的临床研究[7]检测了每例患者的多个基因突变,结果显示24例(72%)患者至少存在一个基因突变,其中19例(58%)检测到TP53突变,10例(30%)检测到KRAS突变,而AKT1、JAK3、BRAF、NRAS及PIK3CA突变各被检测到1例(各3%),此外,ALK重排被检测到1例。另外一项多中心研究[8]共纳入141例PSC患者,其中ALK重排患者占3.5%。以上研究肯定了PSC患者中ALK等相关基因突变或重排的存在,而最新指南更是建议根据PSC相关的组织病理类型,对可能存在基因异常的组织进行检测,以指导医生进行个性化的治疗[3],包括小病理组织。这为PSC靶向药物的临床应用提供了依据。目前国内外已有研究肯定了表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors, EGFR-TKIs)在PSC中的治疗价值,而对于克唑替尼疗效的报道很少。
克唑替尼是ALK阳性晚期NSCLC的一线用药,是一种ATP竞争性酪氨酸激酶抑制剂。该药最初是作为肝细胞生长因子受体(c-MET)抑制剂,随后发现除了c-MET之外,其对ALK和ROS这两种蛋白激酶也有抑制作用,而随着新的致癌基因,棘皮动物微管结合样蛋白4(echinoderm microtubule-associated protein-like 4, EML4)-ALK融合基因在NSCLC中的发现,克唑替尼在NSCLC中的治疗也正式拉开了序幕。与传统化疗相比,克唑替尼疗效好,中位无进展生存期长,生存率高[9]。且最新研究[10,11]表明,存在脑转移的ALK阳性的NSCLC患者使用克唑替尼联合放疗总生存期可高达49.5个月,相比于无脑转移的患者,脑转移的患者更能从克唑替尼治疗中获益。本例患者确诊PSC,免疫组化提示ALK强阳性,考虑基因的互斥性及经费原因,未检测到EGFR、c-MET等突变,每次化疗结束后续予口服克唑替尼治疗,并行头颅立体定向放射治疗,随访至今3个月,每次复查胸部CT及腹部B超肿瘤病灶均逐渐缩小,提示克唑替尼对于治疗PSC有显著效果,但患者头颅转移灶无明显改变,这可能与肿瘤异质性、PSC对于放疗不敏感、克唑替尼作用时间过短等相关。
此外,最新研究表明,除EML4-ALK外,肝细胞生长因子及其受体(HGF /c-MET)信号通路在PSC的发生发展中有很重要的作用 ,这可能与c-MET基因14外显子跳跃缺失相关,c-MET基因14外显子跳跃缺失多发生于NSCLC,并以其中的肺肉瘤样癌和腺癌更多见,在肺肉瘤样癌中的发生率可高达22%[12]。Ou等[13]曾报道1例存在c-MET扩增而非ALK重排的NSCLC患者在使用克唑替尼后获得快速持续缓解的病例,提示克唑替尼作为一种c-MET抑制剂仍需临床的进一步研究。c-MET突变有望成为PSC治疗的新靶点,这也进一步肯定了克唑替尼在治疗PSC中的价值。
总之,PSC是一种特殊类型的NSCLC,预后差,目前治疗方法局限,靶向药物亟需更多的临床研究。本例患者ALK强阳性,口服克唑替尼联合放化疗治疗3个月后胸部CT提示原发病灶明显缩小,这让我们相信对于晚期PSC患者克唑替尼不失为一种好的选择,当然,本例临床研究因病例数较少,未检测c-MET及ROS突变,联合使用放化疗,研究时间较短,故存在一定缺陷,是否克唑替尼真的能为晚期PSC的治疗提供新的方向,这需要更多大规模的临床试验证实。
