鲤脂肪酸合成酶基因的克隆与表达分析
2017-08-27孙志鹏吕伟华匡友谊曹顶臣佟广香孙效文郑先虎
孙志鹏,吕伟华,匡友谊,曹顶臣,佟广香,孙效文,郑先虎
(中国水产科学研究院黑龙江水产研究所,淡水鱼类育种国家地方联合工程实验室,黑龙江 哈尔滨 150070)
鲤脂肪酸合成酶基因的克隆与表达分析
孙志鹏,吕伟华,匡友谊,曹顶臣,佟广香,孙效文,郑先虎
(中国水产科学研究院黑龙江水产研究所,淡水鱼类育种国家地方联合工程实验室,黑龙江 哈尔滨 150070)
脂肪酸合成酶(FASN)是动物体内脂肪酸合成的关键酶。本研究利用逆转录PCR和RACE技术获得鲤Cyprinus carpio FASN全长cDNA序列为8 927bp,开放阅读框7 533bp,编码2 511个氨基酸。FASN蛋白质相对分子量274 145.67D,理论等电点(PI)为6.10。氨基酸同源性分析结果显示:鲤FASN基因与其他鱼类同源性为75.13%~95.34%,与人同源性为61.81%。系统进化树结果显示:鲤FASN氨基酸序列与金线鲃Sinocyclocheilus grahamia聚为一支,同源性最高。实时荧光定量PCR(RT-qPCR)检测结果表明:FASN基因鲤脑组织中表达量最高,肝脏次之,血液中最低。鲤FASN基因的获得为进一步深入研究鲤脂肪酸的合成途径及脂肪发育分子调控机制奠定了基础。
鲤;脂肪酸合成酶;序列分析
脂肪酸合成酶(Fatty acid synthase,FASN)可催化乙酰CoA和丙二酸单酰CoA合成软脂酸[1]。1957年Wakil等[2]在动物肝脏匀浆中提纯出脂肪酸合成酶系从而提出了这一概念。随着脂肪沉积的营养调控逐渐成为营养学研究的重点领域[3],动物脂肪酸合成酶的表达调控引起了各国研究者的关注,逐渐成为研究热点。
近年来,大量研究初步阐明了脂肪酸合成规律,在此基础上从分子生物学水平探索了脂肪酸合成酶的结构及功能与基因表达与调控究[4]。但大多数研究工作主要集中在哺乳动物和家禽中。单体中等[5]发现,猪从1日龄到28周龄,FASN基因在腹脂mRNA水平呈逐渐升高的趋势且存在显著差异(P<0.05)。潘辉等[6]用RT-PCR扩增并获得了卡拉库尔羊FASN基因的cDNA序列。研究表明,FASN基因表达与动物体脂水平呈正相关,可作为脂质代谢的候选基因[7,8]。张磊等[9]认为,FASN 基因可以作为鹅肥肝性状的候选分子标记。对水产动物的FASN基因研究较少。朱大世等[10]发现,在饲料中添加鱼油和豆油极显著抑制了草鱼Ctenopharyngodon idella FASN基因的表达(P<0.01)。牛波等[11]发现,随着齐口裂腹鱼Schizothorax prenanti Tchang体质量的增长,肝脏及肌肉中的FASN mRNA先增加后降低,肌肉粗脂肪含量与FASNmRNA表达量呈一定正相关。施培松等[12]比较发现,FASN基因mRNA在匙吻鲟Polyodon spathula肝脏中的表达量最高,腹部脂肪次之,在胃中表达最低;在鳙Aristichthys noblis咽上器官中表达最高,肠次之,在鳃中表达最低。王爱民等[13]克隆了罗非鱼Oreochromis niloticusFASN基因部分cDNA序列片段557bp,利用3组不同脂肪含量的等氮饲料喂养罗非鱼,饲料脂肪水平对肝脏中FASN活性无显著影响(P>0.05),饥饿再次投喂后6~48h,肝脏中FASN mRNA表达丰度显著下降。韩光明等[14]发现,饲料脂肪水平在1.73%~3.71%范围内,罗非鱼肝脏中FASN的活性下降幅度较小;当饲料脂肪水平等于或大于9.64%时,FASN活性大幅下降,表明饲料中脂肪水平充足时,FASN基因的表达丰度降低,以减少脂肪酸的生物合成。覃川杰等[15]克隆了瓦氏黄颡鱼Pelteobagrus vachelli脂肪酸合成酶部分cDNA序列片段674bp,发现FASN在肝脏、肠道、腹腔脂肪、心脏组织的表达水平显著高于肌肉组织。
中国重要的淡水经济鱼类鲤Cyprinus carpio L.的FASN基因的核酸序列和作用机制尚不清楚,相关的报道较少。Buchtová等[16]研究证明,不同遗传群体鲤间的脂肪酸组成不同。刘艳等[17]证明津新鲤Cyprinus carpio var.Jian饥饿后再投喂后,肝胰脏中FASNmRNA表达丰度先下降后上升,6h最低,随后开始上升,趋于稳定,达到禁食水平。奥斯卡等[18]发现,日粮对鲤FASN基因mRNA表达没有显著影响(P>0.05)。本研究通过克隆鲤FASN基因全长cDNA序列,分析其在不同组织的表达,为进一步研究鲤脂肪酸发生及对脂肪沉积作用机制提供参考。
1 材料与方法
1.1 材料
自黑龙江水产研究所呼兰试验基地选取5尾体质量80~118g的1龄鲤。实验器材(手术刀,手术剪,镊子)用75%乙醇消毒,取麻醉鱼血液、脑、背部肌肉、肠、肝胰脏、肾、心、脾、腹部肌肉和腹部脂肪,做好标记后迅速投入液氮冷冻备用。
1.2 方法
1.2.1 总RNA的提取
使用R Neasy Min Elute Clean up Kit(QIAGEN)试剂盒提取总RNA。取肝脏组织约30μg,加入500μL Buffer RLT,匀浆后,13 000r/min 离心 3min。上清转至新的离心管中,加入1倍体积70%乙醇,用移液器吹打混匀,转至离心柱中,8 500r/min离心15s,弃收集管液体。加 500μL Buffer RPE,8 500 r/min离心15s,弃收集管液体。加500μL Buffer RPE,8 500r/min离心2min,弃收集管及液体,将离心柱转至新的收集管内,8 500r/min离心1min。将离心柱移至1.5mL离心管中,加入30~50μLRNase-Free water,室温放置 3min,8500r/min 离心 1min。
1.2.2 基因克隆
使用Prime ScriptTMRT reagent Kit试剂盒合成cDNA第一链。根据NCBI的斑马鱼等硬骨鱼类FASN基因的cDNA序列,选择保守区域在鲤转录组文库进行序列比对,获得鲤FASN基因的部分cDNA序列。设计同源简并引物(FAS1F1/R1表1),以反转录产物cDNA为模板,扩增目的基因核心片段。PCR产物经琼脂糖凝胶回收试剂盒(康为世纪)纯化,连接到 PMD18-T(TaKaRa)载体,转入 DH5α感受态细胞,选择阳性克隆进行测序,获得FASN基因核心片段序列。根据核心片段设计RACE扩增引物(表 1),GSP1与 NGSP1为 3'端 RACE第一次PCR和巢式 PCR引物;GSP2与 NGSP2为 5'端RACE第一次PCR和巢式PCR引物。利用SMARTerRRACE 5'/3'Kit试剂盒进行RACE反应。RACE产物经胶回收试剂盒纯化,连接到载体,转化至感受态细胞,选择阳性克隆进行测序,获得FASN基因3'端及5'端片段序列。将测序结果经BLAST比对、DNAMAN分析和 Staden(1.7)拼接,最终获得FASN基因的全长cDNA序列。
1.2.3 系统进化分析

表1 鲤FASN基因克隆及组织表达引物Tab.1 Primers for cDNA cloning of FASN determining the mRNA level in tissues of common carp Cyprinus carpio
查找并下载GenBank中鱼类、人与小鼠(外源)FASN氨基酸序列,用Clusta W软件比对多种鱼类FASN氨基酸序列,由Modeltes选择最适模型,用MEGA 6.0软件构建系统进化树,Bootsrap值1 000次。
1.2.4 荧光定量PCR检测
根据测序获得的FASN基因全长cDNA序列,设计荧光定量引物FASN-F/R。以β-actin和18S为内参基因,以反转录产物cDNA为模板,用One Step SYBRRPrime ScriptTMRT-PCR Kit II(TaKaRa)试剂盒,ABI 7500 Real-time PCR定量仪,测定不同组织FASN基因的相对表达量,每个样品3个重复。基因表达量用相对定量方法(2-△△Ct)计算。实时荧光定量结果采用SPSS17.0中单因素方差分析(one-wayANOVA),差异显著进行Duncan’s多重比较,差异显著水平为0.05,差异极显著水平为0.01。
2 结果与分析
2.1 基因片段cDNA的序列分析
以鲤RNA为模板扩增获得的cDNA全长8 927bp(KY378913),其中开放阅读框 7 533bp编码2 511 个氨基酸,5’非编码区(5’-UTR)为 202bp,3’-UTR为 1 192bp,加尾信号(ATTAA)以及 Poly-A尾(图1)。通过Expasy的Protparam工具分析,FASN蛋白质相对分子量274 145.67,理论PI值为6.10,亮氨酸Leu(L)的含量最高,为11.2%,不含氨基酸Pyl(O)和Sec(U)。带负电荷的残基总数(Asp+Glu)为270个,而正电荷的残基总数(Arg+Lys)为236个;理论分子式为C12114H19227N3397O3649S103,总原子数为38 490个。其不稳定系数为41.14,说明该蛋白不稳定。脂肪系数为91.91,亲水性平均系数为-0.129(图 2)。

图1 FASN基因cDNA全序列及推测的氨基酸序列Fig.1 The nucleotide and predicted amino acid sequence of FASN in common carp Cyprinus carpio
2.2 氨基酸同源性分析
用Clusta W软件对多种鱼类FASN氨基酸序列的比对表明,序列差异主要集中在C-端的多肽序列上,中部区域同源性较高。由表2可知,鲤FASN与金线鲃FASN的同源性最高为95.34%,与鳙、团头鲂、罗非鱼的同源性分别为93.39%、93.15%和75.13%。

图2 鲤FASN的蛋白质二级结构图Fig.2 The secondary structure of FASN protein in common carp Cyprinus carpio

表2 鱼类和人、小鼠FASN氨基酸序列比对表Tab.2 Alignment matrix showing the results of pair-wise comparison on the identities and divergence of the amino acids sequences of FASN in fish,mouse and human
2.3 系统进化树分析
基于13种鱼类包括金线鲃、鳙、团头鲂、罗非鱼、虹鳟 Oncorhynchus mykiss、斑马鱼 Danio rerio、斑点叉尾鮰Ctalurus punctatus、鲈Lates calcarifer、雀鳝 Lepisosteus oculatus、青鳉 Oryzias latipes、大西洋鲑Salmo salar、绿河豚Tetraodon nigroviridis和人及大鼠(外群)FASN的氨基酸序列,使用MEGA 6.0软件构建系统进化树(图3)。图3可知,鲤与金线鲃脂肪酸合成酶的进化关系最近,这与其氨基酸同源性的分析结果相符合。

图3 FASN氨基酸序列的系统进化树Fig.3 Phylogenetic tree based on FASN amino acid sequences
2.4 FASN基因在鲤各组织中的表达
实时荧光定量结果显示(图4),鲤FASN基因在所有检测组织中均有表达,在脑中表达量最高,其次是心、脾、肾、肝、脂肪组织(脂肪)、背部肌肉(背肌)、肠、腹部肌肉(腹肌)、血液。脑中的表达量极显著高于其他9种组织(P<0.01),血液中表达最低。背肌和腹肌中表达量差异不显著(P>0.05)。
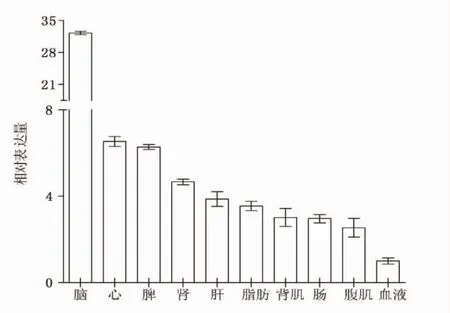
图4 FASN基因在鲤不同组织中的相对表达Fig.4 Relative expression of FASN gene in different tissues of common carp Cyprinus carpio
3 讨论
本研究中,鲤FASN基因cDNA全长8 927bp,编码2 511个氨基酸与鳙(编码2 514个氨基酸)、金线鲃(编码2 514个氨基酸)、罗非鱼(编码2 510个氨基酸)基本一致,可判断其cDNA的完整性。经预测,FASN蛋白属于亲水性蛋白,相对分子量274 145.67D,理论PI值为6.10,与陈斯钰等[19]研究的赤点石斑鱼Epinephelus akaara FASN蛋白分子量为274.03KD、理论PI值为5.8的结论相一致。经氨基酸序列比对发现,鲤与鳙、金线鲃等鱼类同源性很高,表明FASN基因相对保守,可用于生物进化研究。系统进化分析结果显示,杂食性淡水鱼与草食性鱼类进化关系较近,海水鱼与肉食性鱼类进化关系较近,与吴景等[20]分析脂肪酸延长酶进化所得到的结果一致。由此可见,脂肪酸合成酶的系统进化与鱼类的生活环境和食性密切相关。
本文中实时荧光定量检测得出FASN基因在脑组织中表达量最高,肝胰脏和背部肌肉中表达量无显著性差异。而韩光明等[14]发现,吉富罗非鱼各组织中FASNmRNA在肝脏中表达量最高,覃川杰等[15]发现瓦氏黄颡各组织中FASNmRNA在肠中表达量最高,肝脏中表达量明显高于肌肉(P<0.05)。这可能是因为鲤与吉富罗非鱼和黄颡鱼脂肪蓄积模式不同,也可能与食性有关。奥斯卡等[18]在研究日粮对鲤脂肪酸合成酶的影响,得出FASNmRNA在不同组织中表达量高低依次为肝组织、脑组织、肌肉。刘艳等[17]发现,津新鲤FASN mRNA在肝胰脏及肾脏表达丰度明显高于脑中,与本研究结果有差异,这可能是实验技术与方法间存在一定的误差造成。本研究主要集中在FASN基因的克隆和表达模式,对其功能研究还不够深入,其表达调控机制还不清楚。
大多数鱼类在饥饿状态下优先动用脂肪作为能量来源[21,22]。鱼类对脂肪的利用过程主要包括:脂肪的合成、分解与转运。脂肪酸合成酶的作用是合成脂肪酸以储存能量,是脂肪合成的关键酶。FASN基因的表达直接影响脂肪酸合成酶的多寡,FASN酶活力高时,丙二醛CoA源源不断地被催化成脂肪酸,鱼体内多余的脂肪酸能够通过酯化作用形成脂肪[23]。这与Semenkovich[24]发现机体组织中FASN表达水平的升高会显著增加甘油三酯在体内的沉积的结果相一致。脂蛋白酯酶(lipoprotein lipase,LPL)是脂肪分解与转运的关键酶。它通常以同源二聚体的形式发挥甘油三酯水解酶和在受体介导的脂蛋白摄入时作为配体或桥接因子的双重功能[25]。夏晓杰等[26]发现,齐口裂腹鱼FASN mRNA与LPL mRNA表达水平呈一定正相关,初步推断脂肪酸合成酶和脂蛋白酯酶基因表达共同影响肌间脂肪的沉积。然而脂肪性状是一个由多个基因控制的形状,单纯孤立研究某一个或两个基因是远远不够的,要研究鱼类的脂肪性状,需要更多地发掘鱼类的脂质代谢相关基因表达的差异,要从整体上把握这些基因在控制鱼类脂肪性状上的相关性,清楚地了解鱼类脂肪性状的控制机制。研究这些脂肪性状相关基因的功能及调控网络迫在眉睫。
[1]Chirala S S and Wakil S J.Structure and function of animal fattyacid synthase[J].Lipids,2004,39(11):1045-1053.
[2]WakilSJ,PorterJWand Gibson DM.Studies on the mechanism of fatty acid synthesis.I.Preparation and purification ofan enzymes systemfor reconstruction offattyacid synthesis[J].BiochimBiophysActa,1957,24(3):453-461.
[3]张力莉,徐晓锋.动物脂肪酸合成酶基因表达调控的研究进展[J].畜牧与兽医,2012,44(4):101-103.
[4]卢辰,羊惠君,史恺.脂肪酸合成酶基因表达调控[J].四川解剖学杂志,2009,17(2):31-35.
[5]单体中,汪以真,刘建新,等.不同日龄猪腹脂中脂肪酸合成酶(FAS)基因表达规律的研究[J].畜牧兽医学报,2006,37(7):662-666.
[6]潘辉,贺艳艳,李连瑞.新疆卡拉库尔羊FAS基因的克隆及核苷酸序列分析[J].塔里木大学学报,2011,23(2):14-18.
[7] Zheng Jialang,Luo Zhi,Zhu Qingling,et al.Molecular cloningand expression pattern of11 genes involved in lipid metabolism in yellow catfish Pelteobagrus fulvidraco[J].Gene,2013,531(1):53-63.
[8]Tian Juan,Wen Hua,Zeng Lingbing,et al.Changes in the activities and mRNA expression levels of lipopro-tein lipase (LPL),hormone-sensitive lipase (HSL)and fatty acid synthetase(FAS)ofNile tilapia(Oreochromis niloticus)during fasting and re-feeding[J].Aquaculture,2013,400:29-35.
[9]张磊.鹅脂肪酸合成酶(FAS)基因SNP与肥肝性能的关联研究[D].长春:吉林农业大学,2008.
[10]朱大世.饥饿和不同脂肪源对草鱼体脂含量及脂肪合成酶的影响[D].武汉:华中农业大学,2005.
[11]牛波.齐口裂腹鱼肌肉品质、血脂和FAS及LPL基因表达研究[D].雅安:四川农业大学,2104.
[12]施培松.匙吻鲟和鳙的生长、肌肉品质比较及FAS基因克隆表达[D].武汉:华中农业大学,2013.
[13]王爱民.饲料脂肪水平对吉富罗非鱼生长与脂肪代谢调节研究[D].南京:南京农业大学,2010.
[14]韩光明.饲料脂肪对吉富罗非鱼生长、体脂沉积、脂肪酸组成及脂肪酸合成酶的影响[D].南京:南京农业大学,2009.
[15]覃川杰.瓦氏黄颡鱼(Pelteobagrus vachelli)脂肪代谢相关基因cDNA的克隆及表达分析[D].上海:华东师范大学,2010.
[16] Buchtová H,Svobodová Z,Kocour M,et al.Chemical composition of fillets of mirror crossbreds common carp(Cyprinus carpio L)[J].Acta Vet Brno,2010,79(4):551-557.
[17]刘艳,方珍珍,曲木,等.不同脂肪源对津新鲤(Cyprinus carpio var.Jian)生长及脂类代谢的影响[J].水产养殖,2016,37(8):20-26.
[18]奥斯卡.日粮脂肪对鲤鱼脂蛋白脂酶和脂肪酸合成酶基因表达的影响[D].重庆:西南大学,2012.
[19]陈斯钰,张芮,杨云霞.赤点石斑鱼FAS基因的克隆及序列分析[J].安徽农业科学,2016.44(25):109-111.
[20]吴景,郑先虎,匡友谊,等.镜鲤脂肪酸延长酶5基因的克隆和表达分析[J].中国水产科学,2015,22(1):9-16
[21] Palou M,Sanchez J,Priego T,et al.Regional differences in the expression of genes involved in lipid metabolism in adipose tissuein response to short-and medium-term fasting and refeeding[J].J Nutr Biochem,2010,21(1):23-33.
[22] Field F J,Born E and Mathur S N.Fatty acid flux suppresses fatty acid synthesis in hamster intestine independently of SREBP-1 expression[J].J Lipid Res,2003,44(6):1199-1208.
[23]Smith S,Witkowski Aand Joshi A K.Structural and functional organization of the animal fatty acid synthase[J].Progress in Lipid Research,2003,42(4):289-317.
[24]Semenkovich CF.Regulation offattyacid synthase(FAS)[J].Progressin Lipid Research,1997,36(1):43-53.
[25]王刚,曾勇庆,武英,等.猪肌肉组织LPL基因表达的发育性变化及其与肌内脂肪沉积关系的研究[J].畜牧兽医学报,2007,38(3):253-257.
[26]夏晓杰,邬应,龙冯姣,等.齐口裂腹鱼生长、肌肉品质和脂蛋白脂酶及脂肪酸合成酶基因表达的研究[J].食品科学,2015,36(1):164-1690.
Cloning and Expression of Fatty Acid Synthase Gene in Common Carp Cyprinus carpio
SUN Zhi-peng,LV Wei-hua,KUANG You-yi,CAO Ding-chen,TONG Guang-xiang,SUN Xiao-wen,ZHENG Xian-hu
(National Local Joint Engineering Laboratory for Freshwater Fish Breeding,Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
Fatty acid synthase(FASN)as an important enzyme catalyzes the synthesis of fatty acids and the content and activity of FASN have impact on synthesis of fatty acids,fat deposition,and muscle quality.The full-length cDNA of FASN gene was sequenced from common carp Cyprinus carpio by RT-PCR and RACE methods.Full length of the FASN cDNA was found to be 8 927 bp,and open reading frame(ORF)of 7 533 bp encoding 247 amino acids,and the FASN protein had relative molecular weight of 274 145.67 D,and theoretical PI value of 6.10,with fat coefficient of 91.91.The protein shares 75.13%~95.34%sequence identity with other fish,and 61.81%identity with human Homo sapiens.The phylogenetic tree revealed that it clustered closely with herbivorous and omnivorous freshwater fish,most similar to fish Sinocyclocheilus grahamia.The real-time quantitative PCR revealed that FASN gene was expressed maximally in brain,followed by liver and the minimal in blood.These findings will assist in further understanding of the biosynthesis of FASN in common carp,and enable the methods to be developed for enhancing its production.
Cyprinus carpio;fatty acid synthase;sequence analysis
S917
A
1005-3832(2017)04-0001-06
2017-02-26
中国水产科学研究院基本科研业务费(2015C04XK01);国家自然科学基金(31302174).
孙志鹏(1991-)男,研习员,从事鱼类遗传育种与繁殖研究.E-mail:jiayousunzhipeng@126.com
郑先虎(1982-),副研究员.E-mail:zhengxianhu@hrfri.ac.cn
